α-苯基-N-叔丁基硝酮对MPP+/MPTP诱发帕金森病模型的神经保护作用
2018-07-04付永莉李鸿杰
文 婷,付永莉,罗 婷,周 坤,李鸿杰
(华中科技大学同济医学院附属武汉精神卫生中心药学部,湖北 武汉 430022)
帕金森病(Parkinson’s disease,PD)是仅次于阿尔茨海默病的第2大神经退行性疾病, 60岁以上老年人中,约有1%~2%人群深受PD困扰[1]。PD的病理特征主要是大脑黑质致密部多巴胺能神经元的进行性损伤,导致多巴胺能神经元大量减少,形成以α-突触核蛋白(α-synuclein)为主要成分的Lewy小体,最终引起动作迟缓、肌肉僵直、静止性震颤等行为功能障碍[2]。尽管目前多巴胺能神经元损伤的具体机制仍不明确,但是越来越多的研究证实,大脑内活性氧自由基(reactive oxidative species,ROS)和活性氮自由基(reactive nitrogen species,RNS)增加导致的氧化损伤,在多巴胺能神经元的进行性退化病变中起着重要的作用[3]。能够抑制神经元自由基生成或者快速清除细胞内自由基的抗氧化剂,在多种PD模型中都表现出良好的治疗效果[2,4]。
α-苯基-N-叔丁基硝酮(phenyl N-tert-butylnitrone,PBN)是第1个被报道的神经保护剂[5],其分子结构中含有1个硝酮基团,能够与多种自由基反应,具有较强的抗氧化能力,在体外模型中能够有效地清除多种自由基[5-6]。体内实验也已经证明,PBN通过捕获自由基,降低氧化损伤,在脑中风、痴呆等多种神经系统疾病中有着良好的作用[7]。同时,一些已报道的含有硝酮基团的化合物,在多种体内和体外模型中,均能有效地保护多巴胺神经元,提高多巴胺(dopamine,DA)含量,明显改善PD症状[2,8]。基于此,我们认为自由基清除剂PBN也能够通过有效清除自由基,从而保护多巴胺能神经元,改善PD症状,起到治疗PD的作用。本研究通过神经毒素1-甲基-4-苯基吡啶/1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenylpyridinium/1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPP+/MPTP)诱导建立的PD体外和体内模型,评价了PBN对PD的治疗作用。
1 材料
1.1细胞与试剂人神经母细胞瘤(SH-SY5Y)来源于ATCC。N, N-二甲基-4-亚硝基苯胺(p-NDA)、5-氨基-3-(4-吗啉基)-1, 2, 3-恶二唑鎓盐酸盐(SIN-1)、鲁米诺,均购自Alfa Aesar公司;MPP+iodide、1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)、2′, 7′-二氯荧光素二乙酸酯(DCFH-DA)、羟苯基荧光素[3'-(p-hydroxyphenyl) fluorescein,HPF]、二氢罗丹明123(DHR 123)、4-氨基-5-甲氨基-2’, 7’-二氟荧光素二酯(DAF-FM),均购自Sigma Aldrich;兔抗酪氨酸羟化酶(tyrosine hydroxlase, TH)抗体(货号sc-25269)、抗Nrf2抗体(货号sc-365949)、抗血红素氧化酶1(heme oxygenase 1,HO-1)抗体(货号sc-136960),均购自Santa Cruz公司; GTVisionTMⅢ抗鼠/兔通用型免疫组化检测试剂盒,购自基因科技(上海)有限公司;PBN、司来吉兰(Selegiline)购自Orion corporation;多聚甲醛、二甲苯、无水乙醇等试剂购自上海碧云天生物技术有限公司;其他试剂均为市售分析纯。
1.2仪器电子天平(梅特勒-托利多仪器上海有限公司);离心机(德国Eppendorf公司);倒置荧光显微镜(日本Olmpus公司);高效液相库仑阵列电化学检测系统(美国ESA公司);高效液相色谱仪(美国Agilent公司);凝胶成像仪(加拿大Carestream Health公司);电泳仪(美国Bio-Rad公司);冰冻切片机(德国Leica公司)等。
1.3实验动物SPF级♂C57BL/6小鼠30只,10周龄,体质量(23±2)g,由华中科技大学同济医学院附属同济医院提供,许可证号:SYXK(鄂)2014-0049。
2 方法
2.1PBN对非细胞体系自由基的清除作用
2.1.1Fenton法检测·OH清除能力 在Corning®48孔标准平底透明板中,依次加入50 μL浓度为1.0 mmol·L-1的p-NDA、300 μL H2O(空白对照组)或者300 μL不同浓度的PBN样品液,在BioTek®SynergyTM4全波长多功能酶标仪上分别加入125 μL浓度为1.0 mmol·L-1的H2O2,以及125 μL浓度为2.0 mmol·L-1的FeSO4溶液,在Gen 5软件界面上振板均匀后,于440 nm波长下测量吸光度。测定反应体系在100 s内吸光度的变化值,清除率以下列公式计算:清除率=[1-(A0-At)/A0]×100%,刚开始时A0及第100 s A100分别为扣除本底吸收后,在第0 s和第100 s时的吸光度值。
2.1.2化学发光法比较ONOO-清除能力 在光度计量管中使用微量移液器加入300 μL的PBS(pH=7.4),然后加入100 μL各浓度的PBN样品溶液(样品组)或者0.1 mol·L-1PBS(pH=7.4)(对照组),最后加入50 μL浓度为1.0 mmol·L-1的鲁米诺溶液及50 μL SIN-1盐酸溶液(3 g·L-1)激发反应。37℃条件下,以动力学模式总时间10 min,时间间隔为100 s,记录发光值,重复3次后统计计算平均值。清除率=(A对照液-A样品液)/A对照液×100%。
2.2细胞培养SH-SY5Y细胞培养于含10% FBS和2 mmol·L-1L-谷氨酰胺的高糖DMEM培养液中,置于5% CO2培养箱中培养,每2~3 d传代1次。细胞按照1×108·L-1接种于96孔板中,24 h后进行实验。
2.3细胞存活率的检测SH-SY5Y细胞接种24 h后吸掉原培养基,对照组和模型组用正常培养液替换,给药组分别加入含不同浓度PBN(0.1、1、10 μmol·L-1)的培养基预保护2 h。除正常组外,其他组加入MPP+(终浓度为1 mmol·L-1)诱导24 h。MTT试剂盒检测细胞存活率。
2.4细胞内自由基的检测SH-SY5Y细胞接种于96孔板(黑色边,底部透明,货号3603,Corning Corporation, USA)中,每孔接种1×104个/100 μL,24 h后吸走培养基,加药组分别加入不同浓度PBN(0.1、1、10 μmol·L-1),对照组和模型组只加入培养基,孵育2 h后,分别加入10 μmol·L-1DCFH-DA、5 μmol·L-1HPF、5 μmol·L-1DHR 123或10 μmol·L-1DAF-FM探针预处理30 min,随后加入终浓度为1 mmol·L-1MPP+诱导6 h。用Hanks缓冲液洗涤3次,加入100 μL Hanks缓冲液,多功能酶标仪检测荧光值,检测完成后,加入10 μL MTT(5 g·L-1),4 h后于570 nm检测OD值。检测的荧光值与OD值的比值为每孔的相对荧光强度。
2.5动物分组及模型建立随机将C57BL/6小鼠分为5组,每组6只,分别为对照组、MPTP组、PBN低剂量组(50 mg·kg-1)、PBN高剂量组(100 mg·kg-1,PBN剂量按文献[9]设定)和司来吉兰组(10 mg·kg-1)。称量记录动物体质量,MPTP组、PBN低、高剂量组和司来吉兰组动物按照10 mL·kg-1剂量腹腔注射MPTP·HCl(溶解于生理盐水,MPTP·HCl 35.1 mg·kg-1,含MPTP量为30 mg·kg-1),对照组腹腔注射等量的生理盐水。连续注射5 d,每天1次,然后正常条件下饲养3 d,使MPTP完全代谢为其活性分子MPP+,即此阶段为诱导动物模型,未给予药物预防。根据分组情况分别给予不同药物处理7 d,对照组与MPTP组小鼠给予等量生理盐水,PBN组和司来吉兰组分别给予对应剂量药物。在d 7麻醉并处死小鼠,快速分离并提取纹状体和黑质。
2.6黑质多巴胺神经元的检测脑组织切片以及免疫组化按文献报道方法[2]。组织切片置于60℃烘箱1 h后,切片放入3% H2O2避光封闭10 min,去除脑组织切片中的过氧化物酶,然后在0.05 mol·L-1柠檬酸缓冲液(pH=6.0)中进行微波抗原修复,高火5 min,中火10 min。待自然冷却至室温后,加入含有1%的Trion X-100室温通透30 min,然后10% FBS封闭1 h,直接加入TH(1 ∶1 000)一抗,4℃孵育过夜。切片轻轻放入PBS溶液中洗2次,每次5 min,加入FITC标记的二抗(1 ∶1 000),室温避光孵育1 h,甲苯透明化处理2次,每次5 min,擦去切片上残留液体,滴加荧光抗猝灭剂,盖上盖玻片,封片。倒置荧光显微镜显微拍照,统计黑质多巴胺神经元的数量。
2.7纹状体内DA、高香草酸(HVA)及3,4-二羟苯乙酸(DOPAC)含量的检测小鼠双侧纹状体称重后,按10 mL·g-1加入0.1 mol·L-1高氯酸提取液,冰浴匀浆后12 000 r·min-1离心15 min,取上清液备用。采用Agilent C18反相色谱柱(150 mm×3 mm,4.6 μm),流动相:甲醇/水=10/90,水相中含有0.05 mol·L-1NaH2PO4、0.027 mmol·L-1EDTA、0.74 mmol·L-1辛烷磺酸钠、2 mmol·L-1KCl,流速1 mL·min-1,柱温33℃,检测电压0.52 V,流动相pH调节为3.5,精确吸取20 μL注入色谱仪分析,以各标准品的浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归。
2.8抗氧化蛋白Nrf2和HO-1的检测小鼠中脑黑质部位称重,按照10 mL·g-1加入含1 mg·L-1PMSF的RIPA裂解液,冰浴匀浆3 min,然后于4℃、12 000r·min-1离心15 min,取出上清液,BCA蛋白定量,上清液中加入5×SDS上样缓冲液,100℃煮沸5 min进行变性。按30 μg蛋白上样,用SDS-PAGE分离。电泳后,半干式转膜仪恒压20 V转膜1 h,经5%的脱脂奶粉室温封闭2 h,加入抗Nrf2和抗HO-1一抗(1 ∶1 000),置于4℃过夜。室温下孵育辣根过氧化物酶标记的二抗2 h后,采用化学发光显影,凝胶成像仪显示蛋白条带,并分析目标条带灰度。

3 结果
3.1PBN能有效清除非细胞体系自由基利用化学方法模拟机体内自由基生成体系,对PBN的自由基清除活性进行了评价。如Fig 1所示,PBN对非细胞体系的·OH和ONOO-自由基均具有较强的清除能力,且呈浓度依赖性增加。当PBN浓度达到10 μmol·L-1时,对·OH和ONOO-自由基的清除率依次为83%和79%。
3.2PBN保护MPP+诱导的SH-SY5Y细胞损伤线粒体复合物Ⅰ的抑制剂MPP+能引起阻断线粒体呼吸链,造成氧化损伤,导致神经元死亡,从而被广泛应用于抗帕金森病药物体外神经保护活性的筛选。通过MPP+诱导SH-SY5Y细胞损伤模型,我们对PBN的神经保护活性进行了初步评价。如Fig 2所示,1 mmol·L-1MPP+诱导24 h后,细胞存活率约42%,与正常对照组比较差异有显著性(P<0.01); PBN(0.1、1、10 μmol·L-1)预保护2 h,与模型组比较,细胞存活率明显提高(P<0.05),当PBN浓度为10 μmol·L-1时,其保护作用最强,细胞存活率到达了60%。

Fig 1 Free radical scavenging activity of PBN in cell free

Fig 2 Effects of PBN on MPP+-induced cell viability in SH-SY5Y )
Cells were pretreated with different concentrations of PBN (0.1 to 10 μmol·L-1) for 2 h, and then exposed to 1 mmol·L-1MPP+for 24 h. Cell viability was examined by MTT assay and the data were from three independent experiments.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPP+treated group.
3.3PBN抑制MPP+诱导的SH-SY5Y细胞内自由基生成线粒体功能紊乱导致的氧化应激是细胞发生死亡的重要因素。考虑到PBN在体外非细胞体系中表现出良好的自由基清除活性,我们推测PBN同样能够清除神经元内自由基,降低氧化损伤,保护神经元。通过各种细胞内自由基荧光探针,我们对MPP+诱导的细胞内自由基水平进行了检测。如Fig 3所示,加入 1 mmol·L-1MPP+诱导6 h 后,与正常对照组比较,细胞内H2O2(DCF)、·OH(HPF)、NO(DFA)、ONOO-(DHR123)水平分别升高了约1.7倍、1.6倍、1.9倍、1.4倍(P<0.01)。PBN(0.1、1、10 μmol·L-1)预保护2 h后,细胞内H2O2、·OH、NO、ONOO-呈现浓度依赖性下降,当PBN浓度为10 μmol·L-1时,分别降低到1.2、1.1、1.3、1.1倍,与模型组比较差异具有显著性(P<0.01)。表明PBN能够明显抑制MPP+诱导的神经元内自由基的生成。
3.4PBN降低MPTP诱导的黑质部TH阳性神经元损伤对TH进行特异性荧光染色表明(Fig 4A),模型组给予MPTP后,黑质中的TH阳性神经元数目明显减少,明显低于生理盐水组。给予PBN(50、100 mg·kg-1)治疗后,TH阳性神经元数目较MPTP组明显增加(Fig 4B),在PBN高剂量组(100 mg·kg-1),其作用甚至强于阳性药司来吉兰。结果表明,PBN能明显降低MPTP对黑质中多巴胺神经元的损伤,提高黑质多巴胺神经元数目。
3.5PBN提高纹状体中DA及其代谢产物的含量通过HPLC-ECD对小鼠纹状体内DA及其代谢产物含量进行了测定。Fig 5结果表明,模型组小鼠纹状体中DA及其代谢产物的含量较正常对照组明显降低,PBN给药1周后,给药组的纹状体内DA、多巴烯(DOPAC)、高香草酸(HVA)较模型组明显升高,说明PBN能够逆转MPTP诱导的DA损伤,增加PD小鼠脑内DA及其代谢产物DOPAC、HVA的含量。检测DA、DOPAC、HVA标准品的回归方程及相关系数(R2)如下,DA:Y=3.721 6X+0.831 4(R2=0.999 9);DOPAC:Y=6.821 3X+1.342 1(R2=1);HVA:Y=1.206 8X+13.584(R2=0.999 9)。
3.6PBN提高MPTP诱导的PD模型黑质区Nrf2和HO-1蛋白的表达Nrf2-ARE通路在抗氧化应激方面发挥重要作用,为进一步明确PBN保护黑质区TH神经元的作用机制,Western blot检测了黑质区Nrf2和HO-1蛋白的表达。如Fig 6所示,MPTP明显降低了小鼠中脑黑质组织Nrf2和HO-1蛋白表达;PBN(50、100 mg·kg-1)能够明显提高Nrf2和HO-1蛋白表达,抑制MPTP的下调作用。该结果表明,PBN的神经保护作用至少部分依赖于激活Nrf2-ARE通路,提高下游HO-1蛋白表达实现。
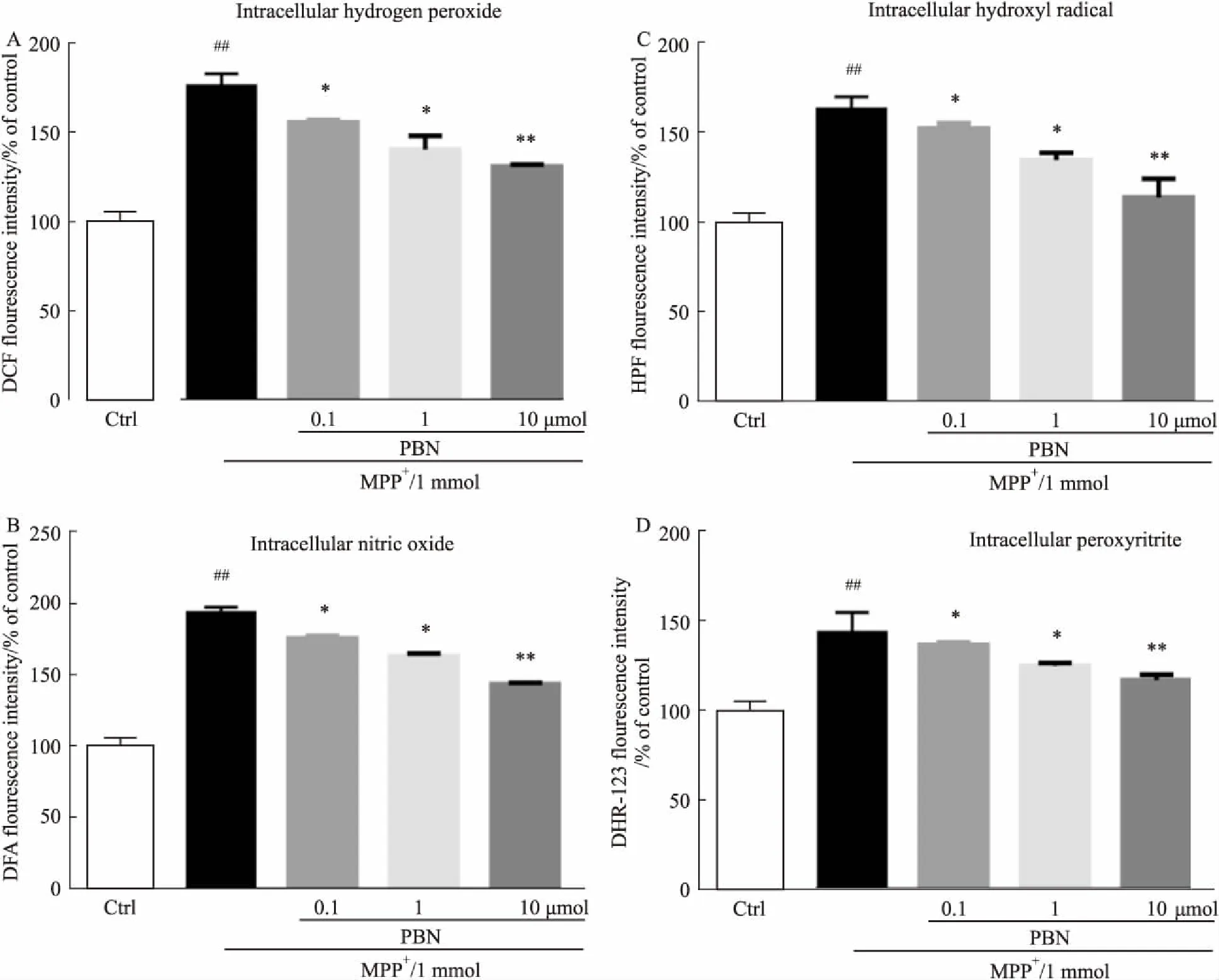
Fig 3 PBN attenuated MPP+-induced oxidative )
SH-SY5Y cells were pretreated with different concentrations of PBN (0.1 to 10 μmol·L-1) for 2 h, and then exposed to 1 mmol·L-1MPP+for 6 h supplement contained with fluorescent probes for 0.5 h. Fluorescence was examined using Fluorescence Microplate Reader.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPP+treated group.

Fig 4 PBN attenuated loss of dopaminergic neurons in MPTP-lesioned
A:Representative microphotographs of dopaminergic(TH-positive) neurons; B: The number of TH-positive neurons.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPTP group.

Fig 5 Effects of PBN on levels of DA and its metabolites DOPAC and HVA in striatum of MPTP-treat )
DOPAC: 3, 4-dihydroxyphenylacetic acid; HVA: Homovanillic acid.##P<0.01vscontrol group;*P<0.05,**P<0.01vsMPTP group.
4 讨论
ROS生成过多导致的氧化应激是PD的主要病因之一,ROS异常生成和累积的最终结果是导致大脑黑质部位多巴胺能神经元的损伤和死亡[10]。因此,抑制自由基生成、清除自由基是治疗PD的重要靶点之一。PBN同时具有亲脂性与亲水性,能够轻易的穿透组织屏障,到达包括脑组织在内的机体组织,并通过其碳-氮键与自由基结合后生成无毒的氮氧化合物被代谢和排泄,从而降低氧化损伤[7]。在所有的自由基中,对组织损伤最厉害的是·OH和ONOO-[2]。文献报道[11],PBN能够快速有效的清除·NO、·OH、O2·-等,但是对于ONOO-的清除能力则没有直接的报道。本研究结果表明,PBN不仅在非细胞体系中对化学诱导的ONOO-有较强的清除能力(在10 μmol·L-1时,清除率达到80%左右),在MPP+诱导的SH-SY5Y细胞氧化损伤模型中,PBN也能明显降低细胞内ONOO-的水平。同时,PBN还能明显抑制MPP+诱导的细胞内·NO、·OH、O2·-自由基水平升高,提高细胞存活率。考虑到MPP+主要通过阻断细胞线粒体呼吸链引起氧化损伤产生毒性,我们可以肯定,PBN的神经保护活性与其清除自由基,降低氧化损伤的能力相关。
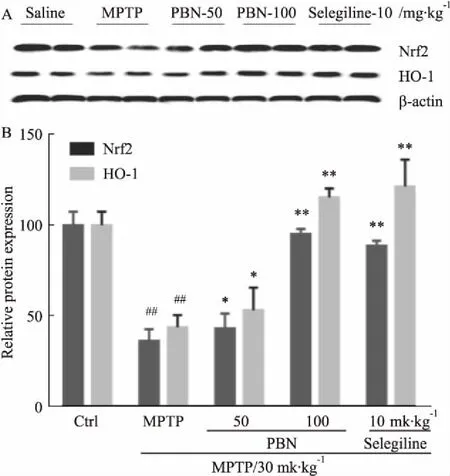
Fig 6 Effect of PBN on protein expression of Nrf2 and HO-1 in SNpc of MPTP-treated
A: Representative blots of Nrf2 and HO-1 protein expression; B: Densitometric analysis of blots.
MPTP诱导的PD模型是目前常用的PD动物模型之一,它在脑内通过单胺氧化酶的氧化生成MPP+,结合到神经元线粒体呼吸链,从而产生毒性作用[12]。脑内多巴胺能神经元的进行性退化、死亡造成脑内DA含量降低是PD最重要的致病机制之一,通过对大脑黑质致密部多巴胺能神经元的计数和黑质-纹状体区域多巴胺含量的检测,可以直观地判断化合物对PD的治疗作用。TH催化氨基酸 L-酪氨酸形成多巴,是DA合成的限速酶[13]。本研究表明MPTP造模后,小鼠大脑黑质区域TH阳性神经元数目明显降低,而与此对应的是,黑质-纹状体区域的DA及其代谢产物含量明显下降,经PBN治疗后,TH阳性神经元数目有所回升,而DA及其代谢产物含量也有明显提高。表明PBN降低了MPTP诱导的氧化损伤,对多巴胺能神经元起到了保护作用。
氧化失衡一方面包括氧化系统的过度活化导致自由基生成过量,另一方面包括还原体系的弱化,使自由基不能及时清除而堆积。转录因子Nrf2调控着II相解毒酶和抗氧化酶的活性,同时调控着线粒体呼吸链的正常功能[14],Nrf2含量降低能进一步提高氧化损伤,降低多巴胺能神经元对神经毒素的抵抗能力。研究已经证实,Nrf2过表达可以减轻6-OH DA对多巴胺神经元损伤[15]。越来越多的研究表明,HO-1是Nrf-2下游调控的重要的抗氧化蛋白之一。HO-1过表达可以保护细胞对过氧化氢引起的氧化性损伤,还可以保护黑质多巴胺神经元,减轻MPP+的毒性损伤[16]。在本研究中,模型组小鼠给予MPTP后,Nrf2与HO-1表达与正常组比较均有明显降低,而不同剂量的PBN治疗后,Nrf2与HO-1的含量均有明显增加,表明PBN在MPTP诱导的PD模型中的神经保护作用至少部分依赖于其能够刺激Nrf2/HO-1信号通路。
综上所述,PBN一方面通过抑制细胞内ROS的产生,降低氧化损伤,另一方面通过激活细胞内Nrf2/HO-1信号通路,增强细胞内抗氧化系统活性,从而起到神经保护作用。
[1] Schapira A H, Olanow C W, Greenamyre J T, et al. Slowing of neurodegeneration in Parkinson’s disease and Huntington’s disease: future therapeutic perspectives[J].Lancet(London,England), 2014,384(9942):545-55.
[2] Guo B, Xu D, Duan H, et al. Therapeutic effects of multifunctional tetramethylpyrazine nitrone on models of Parkinson’s diseaseinvitroandinvivo[J].BiolPharmBull, 2014,37(2):274-85.
[3] Crotty G F, Ascherio A, Schwarzschild M A. Targeting urate to reduce oxidative stress in Parkinson disease[J].ExpNeurol, 2017,298:210-24. doi:10.1016/j.expneurol.2017.06.017.
[4] Song L, Song W, Schipper H M. Astroglia overexpressing heme oxygenase-1 predispose co-cultured PC12 cells to oxidative injury[J].JNeurosciRes, 2007,85(10):2186-95.
[5] Williams H E, Claybourn M, Green A R. Investigating the free radical trapping ability of NXY-059, S-PBN and PBN[J].FreeRadicalRes, 2007,41(9):1047-52.
[6] Hassan W N, Cantuti-castelevetri I, Denisova N A, et al. The nitrone spin trap PBN alters the cellular response to H2O2: activation of the EGF receptor/ERK pathway[J].FreeRadicBiolMed, 2002,32(6):551-61.
[7] Sack C A, Socci D J, Crandall B M, et al. Antioxidant treatment with phenyl-alpha-tert-butyl nitrone (PBN) improves the cognitive performance and survival of aging rats[J].NeurosciLett, 1996,205(3):181-4.
[8] Chavarria C, Perez D I, Perez C, et al. Microwave-assisted synthesis of hydroxyphenyl nitrones with protective action against oxidative stress[J].EurJMedChem, 2012,58:44-9.doi:10.1016/j.ejmech.2012.09.044.
[9] Ferger B, Teismann P, Earl C D, et al. The protective effects of PBN against MPTP toxicity are independent of hydroxyl radical trapping[J].PharmacolBiochemBe, 2000,65(3):425-31.
[10] Lin M T, Beal M F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature, 2006,443(7113):787-95.
[11] Durand G, Choteau F, Pucci B, et al. Reactivity of superoxide radical anion and hydroperoxyl radical with alpha-phenyl-N-tert-butylnitrone (PBN) derivatives[J].JPhysChemA, 2008,112(48):12498-509.
[12] Zhang Z, Lai D, Wang L, et al. Neuroprotective effects of the andrographolide analogue AL-1 in the MPP+/MPTP-induced Parkinson's disease modelinvitroand in mice[J].PharmacolBiochemBe, 2014,122:191-202.
[13] Fujiyama F, Unzai T, Nakamura K, et al. Difference in organization of corticostriatal and thalamostriatal synapses between patch and matrix compartments of rat neostriatum[J].EurJNeurosci, 2006,24(10):2813-24.
[14] Kumar H, Koppula S, Kim I S, et al. Nuclear factor erythroid 2-related factor 2 signaling in Parkinson disease: a promising multi therapeutic target against oxidative stress, neuroinflammation and cell death[J].CNSNeurolDisord-Dr, 2012,11(8):1015-29.
[15] Jakel R J, Townsend J A, Kraft A D, et al. Nrf2-mediated protection against 6-hydroxydopamine[J].BrainRes, 2007,1144:192-201.
[16] Kim J W, Li M H, Jang J H, et al. 15-Deoxy-Delta(12,14)-prostaglandin J(2) rescues PC12 cells from H2O2-induced apoptosis through Nrf2-mediated upregulation of heme oxygenase-1: potential roles of Akt and ERK1/2[J].BiochemPharmacol, 2008,76(11):1577-89.
