天麻素在KK-Ay小鼠中抗糖尿病作用的实验研究
2018-07-04武燕彬孔维佳
张 勇,武燕彬,孔维佳
(中国医学科学院北京协和医学院医药生物技术研究所病毒室,北京 100050)
Ⅱ型糖尿病以高血糖、胰岛功能相对不足和胰岛素抵抗为特点,会引起糖尿病肾病等严重并发症,并使心、脑血管疾病和肿瘤患者的发生率明显增加[1]。随着我国经济的不断发展,Ⅱ型糖尿病患者的数量逐年增加,严重影响着人们的健康和生活质量,研发新型的降糖药物仍是当务之急。
天麻素(gastrodin,GSTD)是从中药天麻的根茎中提取出来的一种小分子天然产物,目前在临床上主要用于癫痫、头痛等的治疗。GSTD具有多种药理学活性,如抗炎、抗氧化、降血脂、改善脂肪肝和肝纤维化等[2-3]。有报道,GSTD有降血糖的活性,在链脲佐菌素(streptozotocin, STZ)诱导的糖尿病小鼠中能明显降低空腹血糖[4],但其改善糖代谢的具体作用和对糖尿病并发症的影响尚未有深入研究。本文以GSTD治疗KK-Ay Ⅱ型糖尿病小鼠,结果发现其能明显促进糖代谢、减轻胰岛素抵抗,并改善糖尿病肾病。
1 材料与方法
1.1药品与试剂GSTD购自浙江诚意药业有限公司,批号20120509;二甲双胍(metformin, Met)购自中美上海施贵宝制药有限公司;ACCU-CHEK血糖仪和血糖试纸购自罗氏诊断产品(上海)有限公司;糖化血红蛋白(glycosylated hemoglobin, GHb)和葡萄糖(氧化酶法)检测试剂盒购自英国Randox公司;大鼠/小鼠胰岛素酶联免疫吸附测定(enzyme-linked immuno sorbent assay, ELISA)试剂盒购自德国Merck KGaA公司;血清肌酐(serum creatinine, Scr)、血尿素氮(blood urea nitrogen, BUN)、丙氨酸转氨酶(alanine aminotransferase, ALT)、天门冬氨酸转氨酶(aspartate aminotransferase, AST)、尿总蛋白和微量白蛋白(microalbumin, mAlb)检测试剂盒购自北京九强生物技术股份有限公司;晚期糖基化终末产物(advanced glycation end product, AGE)竞争性ELISA试剂盒购自美国Cell Biolabs公司;组织甘油三酯(triglyceride, TG)测定试剂盒购自北京普利莱基因技术有限公司;二喹啉甲酸(bicinchoninic acid, BCA)法蛋白浓度测定试剂盒购自赛默飞世尔科技(中国)有限公司;D-(+)-葡萄糖购自美国Sigma公司;重组人胰岛素注射液Humulin®购自美国礼来公司。
1.2实验动物SPF级10周龄♂C57BL/6J小鼠10只,体质量(23.5±1.30) g和10周龄♂KK-Ay糖尿病小鼠50只,体质量(35.2±2.39)g,购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2014-0004。C57BL/6J小鼠投喂常规饲料,KK-Ay小鼠投喂高脂高糖饲料(蛋白质16.5% kcal、脂肪45.6% kcal、碳水化合物37.9% kcal)。动物均饲养于本所动物房屏障环境内,自由摄食和饮水,室温(20~24) ℃,湿度40%~60%,12 h明暗循环。
1.3方法
1.3.1动物实验 所有动物适应性饲养1周后进行分组实验。以C57BL/6J小鼠为正常对照,KK-Ay小鼠按空腹血糖(fasting blood glucose, FBG)水平,以随机区组法分为5组,分别为未治疗组、GSTD 10 mg·kg-1组(GSTD-L)、GSTD 20 mg·kg-1组(GSTD-M)、GSTD 50 mg·kg-1组(GSTD-H)、Met 200 mg·kg-1组(Met),每组10只。GSTD和Met均溶于生理盐水,并于每日上午10时灌胃给药,疗程8周。每周2次测量体质量,每周1次禁食12 h后断尾采血,以血糖仪和试纸测量FBG。
1.3.2口服葡萄糖耐量实验(oral glucose tolerance test, OGTT)和胰岛素耐量实验(insulin tolerance test, ITT) 给药第7周分别进行OGTT和ITT,其中间隔3 d。进行OGTT时,所有动物禁食12 h,测量FBG作为0时间点的值。精确称取4.00 g葡萄糖并溶于20 mL水中,配成20%葡萄糖溶液,所有动物灌胃给予该溶液,葡萄糖摄入量为2 g·kg-1。在葡萄糖摄入后30、60、120、180 min分别测量血糖值,以时间点绘制曲线。对于ITT, 所有动物禁食6 h,测量血糖值作为0时间点的值,然后按体质量腹腔注射重组人胰岛素注射液,剂量为0.5 IU·kg-1。分别在胰岛素注射后15、30、60、120 min测量血糖,以时间点绘制曲线。以GraphPad Prism 6软件计算OGTT和ITT的曲线下面积(area under curve, AUC)。
1.3.3标本收集和测定 实验结束前1 d使用代谢笼收集所有动物的24 h尿标本,测量体积,于-20 ℃冷冻保存,以试剂盒测定尿糖、尿总蛋白和mAlb的浓度,根据尿量,计算24 h尿总蛋白量和mAlb量。
实验结束前所有动物禁食12 h,断尾采血测定FBG,并收集血样(约50 μL)于EDTA-K2抗凝离心管内,以试剂盒测定GHb含量。所有动物摘除眼球取血(约1 mL),置于1.5 mL离心管内,室温放置2 h后,以3 000 r·min-1离心10 min,分离血清,分装后置-20 ℃冷冻保存。测量前,血清标本快速解冻后,以日立7100型全自动生化分析仪和相应试剂盒测定Scr、BUN、ALT、AST。以ELISA方法测定血清胰岛素浓度,以公式FBG (mmol·L-1) × 胰岛素 (mIU·L-1)/22.5,计算稳态模型的胰岛素抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR)。
1.3.4组织病理学检测 所有小鼠以颈椎脱位法处死,解剖并收集肝脏、肾脏和胰腺。取左肾,并在相同部位切取胰腺,以10%甲醛固定,常规石蜡包埋切片(5 μm)后,以苏木精-伊红(HE)法染色并照像。肾组织病理学改变依据肾小球硬化程度进行评分(0~5),评分标准为:无病变(0分),肾小球轻度基底膜增厚(1分),肾小球轻度系膜增生(2分),肾小球重度系膜增生(3分),肾小球结节性硬化(4分),晚期糖尿病肾小球硬化(5分)。胰腺病理学改变依据组织破坏和病变严重程度进行评分(0~4),评分标准为:无病变(0分),<25%胰腺组织发生病变(1分),25%~50%发生病变(2分),50%~75%发生病变(3分),>75%发生病变(4分)。另取部分肝脏组织,在4 ℃预冷的卡诺液(北京雷根生物技术有限公司)中固定8 h,经乙醇脱水、二甲苯处理和石蜡包埋后切片(厚5 μm)。脱蜡后,进行过碘酸雪夫(periodic acid-Schiff, PAS)染色,镜下观察拍照,并定量分析阳性染色面积所占百分比。剩余组织立即于液氮中冷冻保存。肾组织匀浆后,以试剂盒测定其中AGE和TG的含量,结果以蛋白含量进行校正。

2 结果
2.1GSTD改善KK-Ay小鼠糖代谢并减轻胰岛素抵抗KK-Ay糖尿病小鼠的FBG和尿糖值较C57BL/6J小鼠明显升高(P<0.01),各组KK-Ay小鼠的FBG值在给药前差异无显著性(Tab 1、Tab 2)。GSTD治疗8周后,KK-Ay小鼠的FBG呈剂量依赖性降低,其中10 mg·kg-1的GSTD可使KK-Ay小鼠的FBG较未治疗组平均降低23.5%(P<0.05),而50 mg·kg-1GSTD组的FBG平均降低约36.1%(P<0.01)。相应的,KK-Ay糖尿病小鼠血液中的GHb含量(Tab 1)和尿糖水平(Tab 2)经GSTD治疗后也出现明显下降(P<0.05或P<0.01)。
与C57BL/6J小鼠相比,KK-Ay小鼠出现明显的高胰岛素血症(P<0.01)和胰岛素抵抗状态,表现为HOMA-IR明显增加(P<0.01),见Tab 1。10、20、50 mg·kg-1的GSTD治疗8周能剂量依赖地减轻KK-Ay小鼠的高胰岛素血症,并改善胰岛素抵抗(P<0.05或P<0.01)。GSTD治疗后,KK-Ay小鼠的体质量较未治疗组有下降趋势,但差异无统计学意义。而计算实验终点动物体质量增加时发现,KK-Ay小鼠的体质量增加值明显高于C57BL/6J小鼠(P<0.01),GSTD则可明显抑制KK-Ay小鼠体质量的过度增加(P<0.05或P<0.01)。结果还显示,50 mg·kg-1的GSTD降低FBG、GHb、尿糖、血清胰岛素,以及改善胰岛素抵抗、抑制体质量增加的效果与阳性药物Met(200 mg·kg-1)相当(Tab 1、2)。
为了进一步评价GSTD在糖尿病动物中对糖代谢和胰岛素敏感性的影响,我们分别进行了OGTT和ITT检测。OGTT结果如Fig 1A所示,所有小鼠在灌胃葡萄糖溶液30 min后血糖达到峰值,其后逐渐下降。与C57BL/6J小鼠相比,未治疗组KK-Ay小鼠OGTT的AUC值明显增加(P<0.01),说明其糖耐量明显下降;GSTD治疗6周后即能明显改善KK-Ay小鼠的葡萄糖耐受性,使OGTT的AUC值剂量依赖性降低(P<0.05或P<0.01)。ITT的结果如Fig 1B所示,C57BL/6J小鼠在腹腔注射胰岛素后血糖逐渐降低,并于注射后60 min达到最低值。而未治疗组KK-Ay小鼠在注射胰岛素后血糖基本没有变化,说明其对胰岛素的反应性明显降低,出现了胰岛素抵抗,其ITT的AUC值也较C57BL/6J小鼠明显增加(P<0.01)。各GSTD治疗组小鼠在腹腔注射胰岛素后血糖均出现下降,并于60 min达到最低值,说明GSTD可恢复小鼠的胰岛素敏感性。另外,GSTD组小鼠ITT的AUC值较未治疗组KK-Ay小鼠剂量依赖性减少(P<0.05或P<0.01)。50 mg·kg-1的GSTD改善糖耐量和胰岛素耐量的效果与200 mg·kg-1的Met相当(Fig 1)。
2.2GSTD改善KK-Ay小鼠肝脏、肾脏和胰腺的病理学改变并减轻糖尿病肾病由于KK-Ay小鼠投喂高脂高糖饲料,其血清肝功能指标,如ALT和AST在未治疗组中明显升高(与C57BL/6J小鼠比P<0.05或P<0.01),提示肝功能受损(Tab 1)。与我们实验室之前的报道相符合[5],GSTD各剂量均明显降低血清ALT水平(P<0.05或P<0.01),而血清AST水平在50 mg·kg-1GSTD组动物中明显下降(P<0.05)。200 mg·kg-1的Met改善KK-Ay小鼠肝功能(Tab 1)的效果与50 mg·kg-1的GSTD相当。我们还通过PAS染色观察各组动物肝糖原的含量。如Fig 2所示,C57BL/6J小鼠肝组织切片中PAS阳性染色的平均面积超过45%,而未治疗组KK-Ay小鼠阳性染色的面积平均仅为12.8%(与C57BL/6J小鼠比P<0.01),提示糖尿病小鼠肝脏中糖原含量明显减少。与未治疗组比,GSTD各剂量组动物肝脏PAS阳性染色的面积百分比呈剂量依赖性增加(P<0.05或P<0.01),说明GSTD治疗后能明显增加肝糖原含量。
C57BL/6J小鼠肾组织切片和HE染色显示其结构清晰,形态正常(Fig 3)。与之相比,未治疗组KK-Ay小鼠出现了严重的肾小球硬化(P<0.01);10、20、50 mg·kg-1的GSTD治疗8周使KK-Ay小鼠的肾脏形态学得到明显改善,肾小球病理学评分明显下降(P<0.05或P<0.01)。与病理学检测相一致,未治疗组KK-Ay小鼠的Scr水平较C57BL/6J小鼠明显升高(P<0.01,Tab 1),24 h尿量平均增加约3.14倍,24 h尿总蛋白和mAlb分别平均增加约5.94和10.2倍,并且肾组织中AGE和TG的含量均明显增加(与C57BL/6J小鼠比P<0.01,Tab 2),提示糖尿病小鼠出现了严重的肾功能损害。各剂量GSTD在改善肾脏病理变化的同时,使KK-Ay小鼠的肾功能得到明显恢复,表现为Scr水平明显下降,24 h尿量、尿总蛋白和mAlb明显减少,并且肾组织中AGE和TG的含量也明显减少(P<0.05或P<0.01),见Tab 1、2。200 mg·kg-1的Met改善KK-Ay小鼠肾脏病理学变化(Fig 3)和肾功能(Tab 1、2)的效果与50 mg·kg-1的GSTD相当。
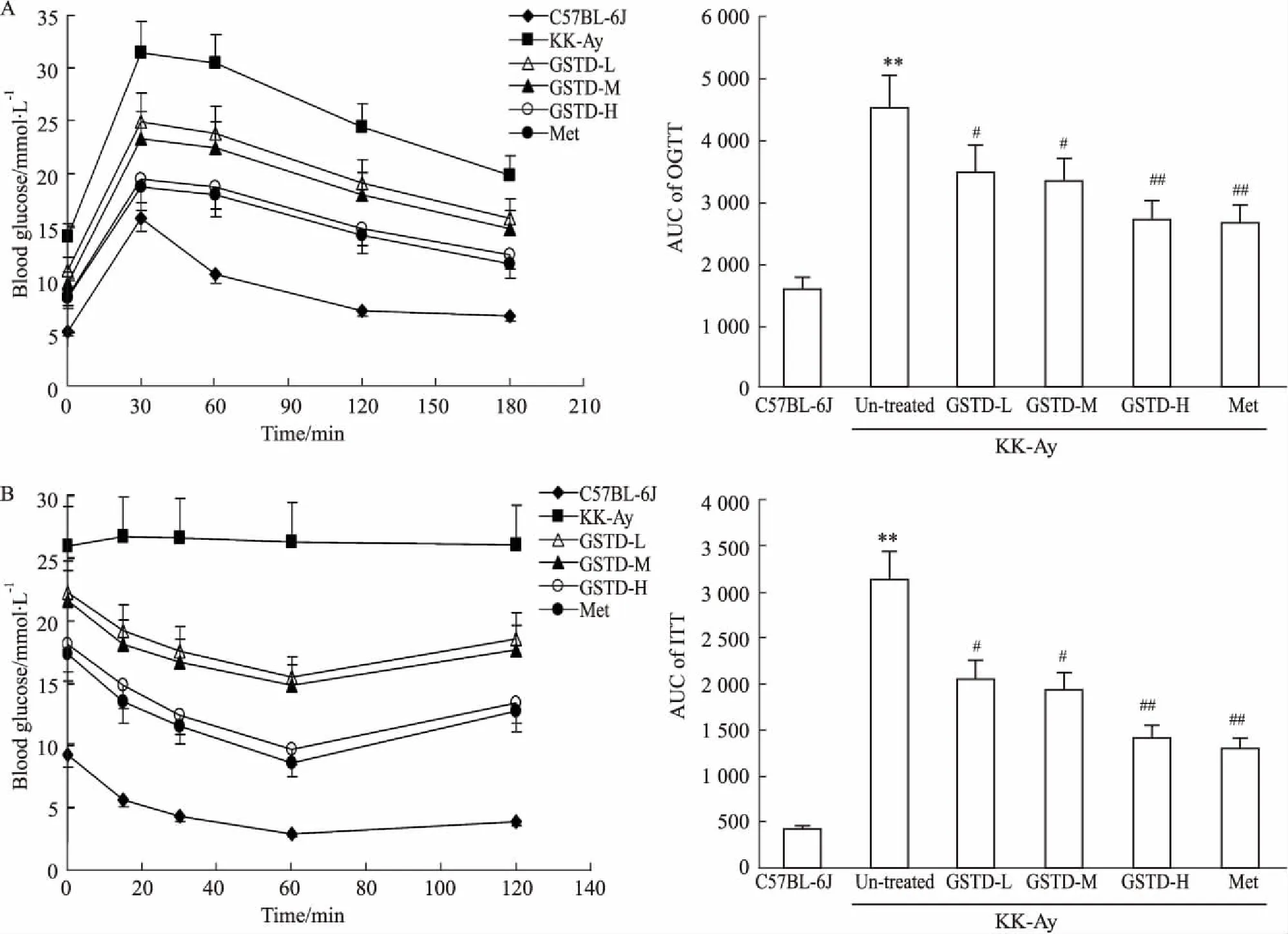
Fig 1 Effects of GSTD and Met on OGTT (A) and ITT (B) in KK-Ay diabetic mice n=10)
**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice
HE染色显示,C57BL/6J小鼠胰腺组织结构清晰,胰岛成球团状,与周围腺体界限清楚,形态规则,胰岛内细胞排列整齐,呈团索状(Fig 4)。而未治疗组KK-Ay小鼠胰岛体积明显增加,胰岛内细胞排列紊乱,可见散在空泡样变性细胞,有些部位细胞缺失、塌陷。胰岛细胞形态不规则,部分细胞出现胞质深染和核固缩等凋亡特征,其病理学评分较C57BL/6J小鼠明显增加(P<0.01)。各剂量GSTD治疗8周后,均能明显减轻KK-Ay小鼠胰岛的病理学改变,使胰岛体积减少,形态学得到恢复,病理学评分明显下降(P<0.05或P<0.01)。并且50 mg·kg-1的GSTD改善胰岛病理学改变的疗效与200 mg·kg-1的Met相当。
3 讨论
本文深入研究了天然药物GSTD在KK-Ay小鼠中的抗糖尿病作用,并首次报道了GSTD对糖尿病肾病具有明显的改善作用。KK-Ay小鼠是一种由Ay基因突变引起的自发性Ⅱ型糖尿病的模型动物,被广泛应用于糖尿病药物研究[6]。文献报道,其具有高血糖、肥胖、胰岛功能不足、胰岛素抵抗和肾功能损害等病理生理学特征[6-7],本文的结果与之相一致。我们的研究显示,GSTD灌胃给药能明显降低KK-Ay小鼠的FBG、尿糖、GHb水平,并改善糖耐量,证实了GSTD的降血糖作用。另外,GSTD的降血糖作用在另一种模型——STZ诱导的小鼠糖尿病模型中也得到证实,而且该报道中GSTD的使用剂量(12.5、25、50 mg·kg-1)与本文基本一致[4]。在该研究中,25、50 mg·kg-1的GSTD作用14 d后能使FBG水平明显下降,而12.5 mg·kg-1GSTD组小鼠的FBG虽然有下降趋势,但与模型组比较差异无统计学意义[4]。本文中10 mg·kg-1的GSTD即能使KK-Ay糖尿病小鼠的FBG、GHb、尿糖等指标明显下降,二者的差异可能是疗程不同所致。
Tab 1 Effects of GSTD and Met on body weight, blood and serum biochemical indexes in KK-Ay mice n=10)
*P<0.05,**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice
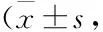
Tab 2 Effects of GSTD and Met on kidney and urine-related parameters in KK-Ay mice n=10)
**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice
GSTD调控糖代谢的具体机制尚不清楚。本研究结果显示,GSTD治疗后能明显增加KK-Ay小鼠肝糖原的合成,这可能是其降血糖的途径之一。我们实验室之前的报道还发现,GSTD对AMP依赖的蛋白激酶(AMP-activated protein kinase, AMPK)有激活作用,与其改善脂肪肝和减肥的作用有关[5]。由于AMPK与糖代谢的密切关系,其激活可能也是GSTD的降糖机制之一;但GSTD对糖代谢的其他各个环节如无氧酵解、有氧氧化、糖异生和葡萄糖跨膜转运等的影响均不明确,需深入研究。
本文的结果显示,GSTD能明显减轻KK-Ay小鼠的高胰岛素血症和胰岛素抵抗,恢复对胰岛素的反应性。这些血液指标的变化与GSTD治疗后动物胰岛形态学的改善相符合,因为GSTD能明显减少胰岛体积,并减轻胰岛细胞的病理学变化。在糖尿病的发生和发展过程中,氧化应激对胰岛损伤和胰岛素抵抗的产生起关键作用[8]。有报道,在体外培养的大鼠胰岛素瘤INS-1细胞中,GSTD能明显减轻STZ诱导的氧化应激和细胞损伤,并使其受损的胰岛素分泌功能得到恢复[9]。这些发现提示在治疗糖尿病的过程中,GSTD可通过抗氧化作用改善胰岛功能。
GSTD增加胰岛素敏感性的具体分子机制尚不明确。有研究发现,在高脂高糖饲料诱导的SD大鼠胰岛素抵抗模型中,GSTD腹腔注射后能通过增加肝脏胱硫醚合成酶(cystathionine β-synthase, CBS)的表达,降低同型半胱氨酸的含量,从而达到减少胰岛素抵抗的作用[10]。但GSTD对胰岛素信号通路中关键分子,如胰岛素受体(insulin receptor, InsR)和胰岛素受体底物-1(insulin receptor substrate-1, IRS-1)的表达和信号转导的影响尚不清楚,需要进一步研究。此外,糖尿病引起的慢性炎症状态对胰岛素抵抗的发生起关键作用[8],而GSTD具有明确的抗炎作用[5],其抗炎活性是否也参与了胰岛素增敏作用值得进行深入研究。

Fig 2 Effects of GSTD and Met on liver PAS staining (A, ×200) and quantification (B) in KK-Ay diabetic mice n=10)
**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice

Fig 3 Effects of GSTD and Met on kidney HE staining (A, ×200) and pathological scores (B) in
**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice
本研究还发现,GSTD用于治疗KK-Ay小鼠在降血糖的同时,能明显减轻糖尿病肾病,使肾脏病理学变化明显改善,并使受损的肾功能得到明显恢复。国内外大量研究证实,AMPK是治疗糖尿病肾病的重要分子靶点,AMPK的激活能有效缓解糖尿病肾病[11]。而GSTD缓解糖尿病肾病的作用是否也与肾组织中AMPK的激活有关尚需进一步研究。本研究还发现,50 mg·kg-1的GSTD抗糖尿病的效果与200 mg·kg-1的Met相当。GSTD较强的抗糖尿病药效可能得益于其良好的药代动力学参数。GSTD口服吸收迅速、完全,有报道,男性健康志愿者口服GSTD胶囊,其相对生物利用度为100%[12]。此外,除了直接降糖作用,得益于其对神经系统的药理学活性,GSTD对糖尿病周围神经病变[13]和视网膜神经细胞病变[14]也有一定改善作用。这些特点将有助于GSTD和天麻制剂将来的进一步研发。
Fig 4 Effects of GSTD and Met on pancreas HE staining (A, ×200) and pathological scores (B) in KK-Ay diabetic mice n=10)
**P<0.01vsC57BL/6J mice;#P<0.05,##P<0.01vsuntreated KK-Ay mice
综上所述,GSTD对KK-Ay糖尿病小鼠具有明显的降血糖、改善糖耐量和胰岛素抵抗、以及减轻糖尿病肾病和恢复肾功能的效果,但其调控糖代谢和胰岛素增敏的分子机制尚需深入研究。
(致谢:本研究在中国医学科学院医药生物技术研究所病毒室和动物实验室完成,对在实验过程中给予帮助的老师和同学致以诚挚的感谢!)
[1] Tahrani A A, Bailey C J, Del Prato S, et al. Management of type 2 diabetes: new and future developments in treatment [J].Lancet, 2012,125(10): 182-97.
[2] Zhan H D, Zhou H Y, Sui Y P, et al. The rhizome of Gastrodia elata Blume-an ethnopharmacological review [J].JEthnopharmacol, 2016,189: 361-85.
[3] 王 灿, 于 滨, 孔维佳. 天麻和天麻素改善糖脂代谢紊乱的药理学研究进展[J]. 中国医药导报, 2016,13(27): 51-4.
[3] Wang C, Yu B, Kong W J. Research progresses of the pharmacology of Gastrodia elata Bl. and gastrodin in improving glucose and lipid metabolism disorders [J].ChinaMedHer, 2016,13(27): 51-4.
[4] 韩 磊, 乔爱敏, 刘 青. 天麻素的抗糖尿病作用实验[J]. 华侨大学学报(自然科学版), 2013,34(6): 682-6.
[4] Han L, Qiao A M, Liu Q. Research on anti-diabetic efficacy of gastrodin [J].JHuaqiaoUniv(NatSci), 2013,34(6): 682-6.
[5] Qu L L, Yu B, Li Z, et al. Gastrodin ameliorates oxidative stress and proinflammatory response in nonalcoholic fatty liver disease through the AMPK/Nrf2 pathway [J].PhytotherRes, 2016,30(3): 402-11.
[6] 李 娜, 张 周. 两种自发性2 型糖尿病小鼠生物学特性比较[J]. 中国比较医学杂志, 2011,21(1): 16-22.
[6] Li N, Zhang Z. Two spontaneous type 2 diabetic mice and their difference of phenotype [J].ChinJCompMed, 2011,21(1): 16-22.
[7] 张 哲, 王 超. KLF4在糖尿病小鼠心肌组织的表达及通心络胶囊干预作用研究[J]. 中国药理学通报, 2015,31(6): 876-81.
[7] Zhang Z, Wang C. Expression of KLF4 in diabetic mouse myocardium and the interventional effect of Tongxinluo capsule on diabetic cardiomyopathy [J].ChinPharmacolBull, 2015,31(6): 876-81.
[8] Li Z, Geng Y N, Jiang J D, et al. Antioxidant and anti-inflammatory activities of berberine in the treatment of diabetes mellitus [J].EvidBasedComplementAlternatMed, 2014,2014: 289264.
[9] 张 磊, 陈红梅, 李 汛, 等. 天麻素对STZ损伤INS-1细胞的保护和修复作用[J]. 中华内分泌外科杂志, 2011,5(4): 222-4.
[9] Zhang L, Chen H M, Li X, et al. Protection of INS-l cells from STZ injury by gastrodine [J].ChinJEndocrSurg, 2011,5(4): 222-4.
[10] 白 永, 范晓明, 郭家智, 等. 天麻素对胰岛素抵抗模型中CBS 表达的影响[J]. 昆明医科大学学报, 2014,35(4): 6-9.
[10] Bai Y, Fan X M, Guo J Z, et al. Effect of gastrodin on the expression of CBS in insulin resistance model [J].JKunmingMedUniv, 2014,35(4): 6-9.
[11] Kim Y, Park C W. Adenosine monophosphate-activated protein kinase in diabetic nephropathy [J].KidneyResClinPract, 2016,35(2): 69-77.
[12] 孙成春, 董玉波, 孙 军, 等. 高效液相色谱法测定天麻素人体相对生物利用度[J]. 中国医院药学杂志, 2008,28(20): 1804-6.
[12] Sun C C, Dong Y B, Sun J, et al. Measurement of relative bioavailability of gastrodin in humans by HPLC [J].ChinHospPharmJ, 2008,28(20): 1804-6.
[13] 季志平, 谢小菊, 钱卿云. 阿魏酸钠与天麻素治疗糖尿病神经病变180例[J]. 中国药师, 2009,12(5): 627-8.
[13] Ji Z P, Xie X J, Qian Q Y. Effect of sodium ferulate combined with gastrodin on 180 patients with painful diabetic neuropathy [J].ChinPharmacist, 2009,12(5): 627-8.
[14] 杨晓春, 许建彪, 梅 妍, 等. 天麻素及乙酰天麻素对糖尿病视网膜神经节细胞的保护作用[J]. 眼科新进展, 2015,35(1): 25-7.
[14] Yang X C, Xu J B, Mei Y, et al. Protective effects of acetagastrodin and gastrodin on retinal ganglion cells in diabetic rats [J].RecAdvOphthalmol, 2015,35(1): 25-7.
