鉴别鲍曼不动杆菌定植与感染的临床指标研究
2018-07-04黄升海
宋 骏,黄升海,钟 民
鲍曼不动杆菌是一种非发酵性的革兰阴性杆菌,广泛存在于自然环境中,可定植于人体皮肤、与外界相通的腔道中。文献[1]报道,在入院48 h内,约40%的普通患者可出现鲍曼不动杆菌定植,而重症患者可高达75%。鲍曼不动杆菌定植是引起医院院内感染的高危因素,也是住院患者呼吸系统获得性感染的重要来源。由于其对多数常用的抗菌药物耐药,发生感染后的及时治疗非常关键,因此鉴别定植或感染,对于避免抗菌药物的滥用和及时的抗菌治疗具有重要意义。但是,针对住院患者痰等标本培养出来的鲍曼不动杆菌,目前国内外尚无统一标准来判断分离的是定植还是感染。研究[2-3]表明,鲍曼不动杆菌感染可引起细胞免疫功能的改变,并导致多种细胞因子的表达水平发生显著变化。因此,该研究通过检测鲍曼不动杆菌定植、感染患者的T淋巴细胞亚群、血清细胞因子水平,探讨上述指标在鉴别鲍曼不动杆菌下呼吸道定植与感染中的临床意义。
1 材料与方法
1.1病例资料收集2016年1月~11月在皖南医学院第一附属医院住院治疗,且连续痰培养2次以上为鲍曼不动杆菌优势生长的患者。根据中华医学会呼吸病学分会医院获得性肺炎的诊断标准,分为定植组(观察期间未出现医院获得性肺炎)和感染组(发生医院获得性肺炎)。排除标准如下:① 下呼吸道分泌物培养出现其他病原菌或在其他部位有感染的患者;② 使用激素类及免疫抑制类药物治疗期内的患者;③ 病程小于2周患者。收集来源于同一医院健康管理中心的体检正常者50例作为对照。
1.2方法
1.2.1痰培养 取患者合格痰标本进行培养,采用VITEK-2自动微生物分析仪(法国生物梅里埃),按照《全国临床检验操作规程》中华人民共和国卫生部医政司(第3版)的检验程序进行细菌鉴定。
1.2.2标本采集 清晨采用EDTA-K2抗凝的真空采血管和普通真空采血管,分别抽取空腹的住院患者与体检者肘部静脉血2、3 ml。
1.2.3T淋巴细胞亚群检测 取5只流式管,编号为1、2、3、4、5,分别将100 μl抗凝全血或Immunotrol质控血加入1~5号试管后,依次各加入20 μl的IgG1-FITC/IgG1-PE/IgG1-PC5于试管1;CD4-FITC于试管2;CD8-PE于试管3;CD3-PC5于试管4;CD4FITC/CD8PE/CD3PC5三种抗体混合加于试管5。振荡混匀后,室温避光反应20 min;取出试管,每管加入500 μl Optilyse C,即刻震荡混匀后,室温避光反应10~15 min,管内液体透亮;每管加500 μl的PBS,震荡混匀后,室温避光反应10 min后,即可上机检测(若不能及时上机,4 ℃冰箱保存,24 h内上机检测)。采用流式细胞仪(FC-500,贝克曼,美国)分析和检测。
1.2.4细胞因子检测 按照试剂盒(Abnova公司)说明书操作,分别测定血清肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)、白细胞介素2(IL-2)、白细胞介素4(IL-4)和白细胞介素17(IL-17)水平。

2 结果
2.1对照组、鲍曼不动杆菌定植组和感染组各项指标的比较计量资料三组间两两比较结果显示,感染组、定植组和对照组在年龄、性别上差异无统计学意义(P>0.05)。感染组CD3+、CD4+水平均低于定植组和对照组(P<0.05),而定植组和对照组间差异无统计学意义(P>0.05);感染组CD4+/CD8+比值低于定植组和对照组(P<0.05);感染组TNF-α、IFN-γ和IL-17水平均高于定植组和对照组(P<0.05),且定植组也高于对照组(P>0.05);感染组和定植组IL-2、IL-4水平均高于对照组(P<0.05),而感染组和定植组间差异无显著性。见表1。
2.2鲍曼不动杆菌感染与T淋巴细胞亚群、血清细胞因子水平的相关性Spearson相关分析表明,鲍曼不动杆菌感染与TNF-α (rs=0.241,P=0.012)、IFN-γ (rs=0.235,P=0.014)、IL-2(rs=0.249,P=0.009)、IL-4 (rs=0.268,P=0.005)、IL-17 (rs=0.538,P=0.000)呈正相关性,与CD3+(rs=-0.193,P=0.045)、CD4+/CD8+(rs=-0.302,P=0.001))呈负相关性。
2.3鲍曼不动杆菌感染的多因素Logistic回归分析单因素Logistic回归分析显示,CD3+、CD4+、CD4+/CD8+、TNF-α、IFN-γ和IL-17是鲍曼不动杆菌的感染的因素(P<0.05),而IL-2和IL-4对鲍曼不动杆菌的感染无影响(P>0.05)。根据纳入(α=0.05)与排除(β=0.10)标准,CD3+、CD4+、CD4+/CD8+、TNF-α、IFN-γ和IL-17 6个因素进入多因素Logistic回归分析(逐步回归法)显示,IL-17(OR=1.511)和IFN-γ(OR=1.420)是鲍曼不动杆菌的感染的危险因素(P<0.05);CD4+/CD8+(OR=0.025)、CD4+(OR=0.854)和CD3+(OR=0.885)是鲍曼不动杆菌的感染的保护因素(P<0.05)。见表2。
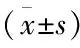
表1 对照组、鲍曼不动杆菌定植组和感染组多项指标的比较
与对照组比较:*P<0.05;与定植组比较:*P<0.05
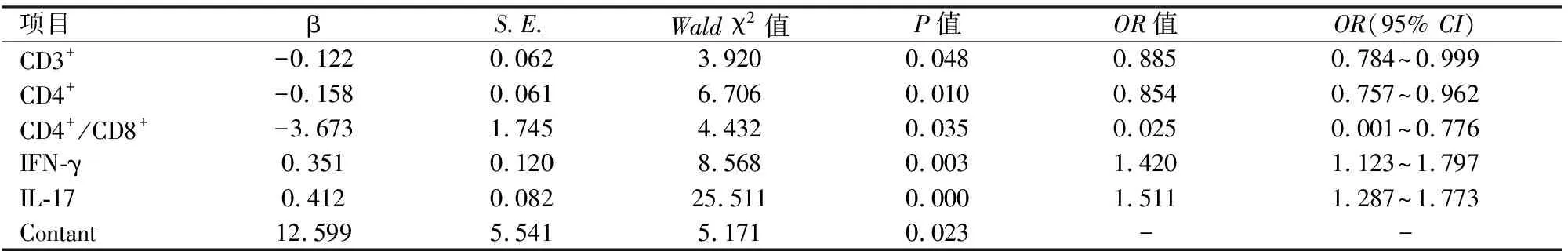
表2 鲍曼不动杆菌感染的多因素Logistic回归分析
3 讨论
鲍曼不动杆菌在各种环境中均易于生存和繁殖。随着各类抗菌药物的广泛使用,多重耐药鲍曼不动杆菌的感染发生率也出现显著增加[4]。尤其在免疫力低下的患者中,由于缺乏有效的药物治疗,其安全和医疗质量受到极大的影响[5-6]。细菌定植是发生医院院内感染的先兆,及时发现鲍曼不动杆菌的定植并采取相应措施控制其感染意义重大,但根据患者的初期临床表现或者细菌培养结果无法确定为感染菌或定植菌[7-8]。本研究期望从免疫水平方向寻找一些有力的证据。
研究[9]表明鲍曼不动杆菌的感染往往可引起患者局部和全身的免疫应答,导致免疫细胞和细胞因子水平的改变。在机体免疫系统中,T淋巴细胞具有重要功能的一个细胞群,依据其细胞表面抗原可分为不同的亚群。当机体免疫功能异常,例如细菌感染时,T淋巴细胞亚群可发生数量的改变[10]。CD3+代表的是成熟的活性T淋巴细胞,是细胞免疫中主要的活性细胞,CD3+细胞又可进一步被分为辅助性T淋巴细胞(CD3+CD4+)和细胞毒性T淋巴细胞(CD3+CD8+)。研究[10]表明CD4+/CD8+的比值是评估机体内免疫平衡的敏感指标,该比值的下降往往提示机体免疫功能的降低。Jeong et al[11]发现,在机会致病菌(包括鲍曼不动杆菌)引起院内感染的高龄患者中,死亡患者的CD4+T淋巴细胞的数量及CD4+/CD8+的比值均呈现显著下降。本研究的结果显示,鲍曼不动杆菌感染患者的CD4+T淋巴细胞数量及CD4+/CD8+比值显著低于鲍曼不动杆菌定植患者和正常对照,并且鲍曼不动杆菌感染与CD4+/CD8+比值存在负相关。
在小鼠模型中,经气管接种鲍曼不动杆菌后,小鼠肺部可出现多种病理改变,并刺激产生多种细胞因子,例如TNF-α、IL-1、IL-6、IL-12、IL-23等[12]。正常情况下CD4+T淋巴细胞通常处于前体状态,在特异性抗原的刺激和不同细胞因子作用下可进一步分化为Th1、Th2细胞。Th1型免疫反应可增强机体对微生物感染的免疫能力和防御功能,而Th2型免疫反应主要与感染的进展、持续化和慢性化有关[13]。有研究[14]表明在鲍曼不动杆菌感染可通过激活树突状细胞,刺激CD4+T淋巴细胞向Th1分化,引起Th1/Th2比值的升高。TNF-α、IFN-γ、主要由Th1细胞分泌产生,本研究观察到鲍曼不动杆菌感染组患者的血清TNF-α、IFN-γ水平显著高于定植组以及对照组。IL-2、IL-4主要由Th2细胞分泌产生,所以在鲍曼不动杆菌感染组和定植组之间,本研究未发现血清IL-2和IL-4水平存在显著性差异。Spearson相关分析证实鲍曼不动杆菌感染与血清TNF-α(rs= 0.241,P=0.012)、IFN-γ(rs= 0.235,P=0.014)水平存在正相关,与上述报道结果相一致。多因素Logistic回归分析筛选出血清IFN-γ水平升高是鲍曼不动杆菌感染的危险因素。
Breslow et al[2]在鲍曼不动杆菌肺部感染的小鼠模型中,可观察到肺部组织中性粒细胞的大量募集,并且证实中性粒细胞是免疫应答过程中主要的免疫细胞。鲍曼不动杆菌感染后,IL-17通过诱导趋化因子的大量产生在中性粒细胞募集并最终清除细菌的过程中发挥关键作用[15]。本研究显示鲍曼不动杆菌感染组患者血清IL-17(rs=0.538,P=0.000)水平显著升高,并且与鲍曼不动杆菌的感染存在正相关。多因素Logistic回归分析筛选出血清IL-17水平升高是鲍曼不动杆菌感染的危险因素。
本研究还存在一定的不足。首先,在严格控制入选标准下纳入的样本量较小;其次,来源于不同报道的血清细胞因子测定值差异较大,血清细胞因子的临床检测还有待进一步的标准化;再次,由于鲍曼不动杆菌定植与感染的判断需要回顾性分析,目前尚无法进行前瞻性随访研究。因此,T淋巴细胞亚群、血清细胞因子对鉴别鲍曼不动杆菌定植与感染的临床价值有待大样本、多中心研究的进一步证实。
综上所述,鲍曼不动杆菌感染导致患者免疫系统功能发生明显变化,与定植患者存在显著差异,表现为CD4+/CD8+比值降低、血清TNF-α、IFN-γ及 IL-17显著升高。血清IFN-γ、IL-17可作为鉴别鲍曼不动杆菌感染与定植的指标,并且可为抗菌药物的合理使用以及医院感染的预防、控制提供依据。
[1] Apisarnthanarak A, Pinitchai U, Thongphubeth K, et al. A multifaceted intervention to reduce pandrug-resistantAcinetobacterbaumanniicolonization and infection in 3 intensive care units in a Thai tertiary care center: a 3-year study[J]. Clin Infect Dis, 2008,47(6):760-7.
[2] Breslow J M, Meissler J J Jr, Hartzell R R, et al. Innate immune responses to systemicAcinetobacterbaumanniiinfection in mice: neutrophils, but not interleukin-17, mediate host resistance[J]. Infect Immun, 2011,79(8):3317-27.
[3] Jun S H, Lee J H, Kim B R, et al.Acinetobacterbaumanniiouter membrane vesicles elicit a potent innate immune responseviamembrane proteins[J]. PLoS One, 2013,8(8):e71751.
[4] 胡 伟, 张 婷, 孙 成, 等. 某三甲医院2012-2015年抗菌药物使用强度与鲍曼不动杆菌耐药性的相关性分析[J]. 安徽医药, 2017, 21(7):653-5.
[5] 宋晓萍, 陈佳红, 翟军清, 等. 青岛地区重症监护病房分离的鲍曼不动杆菌耐药特征及碳青霉烯酶基因型的研究[J]. 中华检验医学杂志, 2017, 40(3):216-20.
[6] 赵洪峰, 任淑华, 蔡艺飞. ICU患者鲍氏不动杆菌定植感染的调查分析[J]. 中华医院感染学杂志, 2012, 22(4):693-5.
[7] 白国强, 董 磊, 李 昂, 等. 鲍曼不动杆菌定植与感染鉴定方法的对照研究[J]. 临床和实验医学杂志, 2013, 12(21):1705-8.
[8] 韩忠学, 刘 静, 巩 静. 降钙素原在鲍曼不动杆菌定植与感染鉴别中的应用[J]. 国际检验医学杂志, 2017, 38(3):407-8.
[9] 陈 淼, 邹志玲, 陈雪梅. 鲍曼不动杆菌感染和IL-17介导的免疫过程[J]. 国际检验医学杂志, 2017, 38(4):514-6.
[10] 陈少艳, 刘基铎, 肖明锋, 等. 淋巴细胞亚群检测在感染性疾病中的应用[J].国际检验医学杂志, 2017, 38(2):206-8.
[11] Jeong S J, Yoon S S, Han S H, et al.Evaluation of humoral immune response to nosocomial pathogen and functional status in elderly patients with sepsis[J]. Arch Gerontol Geriatr, 2014,58(1):10-4.
[12] 张瑞凌,冼 盈,张扣兴. 鲍曼不动杆菌感染与免疫研究进展[J].中国感染与化疗杂志,2017, 17(2):224-8.
[13] de Breij A, Dijkshoorn L, Lagendijk E, et al.Do biofilm formation and interactions with human cells explain the clinical success ofAcinetobacterbaumannii[J], PLoS One, 2010,5(5):e10732.
[14] Lee J S, Lee J C, Lee C M, et al. Outer membrane protein A ofAcinetobacterbaumanniiinduces differentiation of CD4+T cells toward a Th1 polarizing phenotype through the activation of dendritic cells[J]. Biochem Pharmacol, 2007,74(1):86-97.
[15] Yan Z, Yang J, Hu R, et al.Acinetobacterbaumanniiinfection and IL-17 mediated immunity[J]. Mediators Inflamm,2016,2016:9834020.
