过表达miR-218增强食管鳞状细胞癌对顺铂敏感性
2018-07-04黄云龙张仁泉方炎鑫吴开明
黄云龙,张仁泉,方炎鑫,姚 龙,吴开明
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是东亚发展中国家较为常见的恶性肿瘤[1],尽管各种治疗策略已经明显改善并提高患者的预后及生存率,但ESCC仍然是最具侵袭性和预后较差的恶性肿瘤之一,其5年总生存率低于15%。以铂类为基础的化疗仍是食管癌患者姑息性治疗的常见治疗方案,而部分患者对铂类药物的敏感性较差。因此,迫切需要一种新的治疗靶点,可以应用于判定抗癌药物敏感性高的细胞或机体,也可以用于提高存在药物抵抗性个体对药物的敏感性。微小RNAs(micro ribonucleic acids,miRNAs or miRs)是一类内生的、长度约为20~24个核苷酸的单非编码小分子RNA,可通过调节基因的表达影响肿瘤发生发展。最近,越来越多的研究[2]表明miRNAs药物抵抗中发挥重要作用,已有研究[3-5]证实在有铂类药物抵抗的细胞中miR-218呈低表达,而恢复miR-218的表达可以增加铂类化疗药的敏感性。因此揭示miR-218在铂类耐药的食管鳞癌细胞中的生物学特性和miR-218异常表达在调控食管鳞癌细胞对铂类耐药的分子机制显得尤为重要。
1 材料与方法
1.1材料与试剂食管鳞癌细胞Eca109购自上海生物科学院细胞库;顺铂购自美国Sigma公司;RPMI-1640及胎牛血清购自美国Gibco公司;CCK8 试剂盒购自上海碧云天公司;AnnexinV-FITC/PI 细胞凋亡检测试剂盒购自美国BD公司;RNA提取试剂TRIzol购自美国Invitrogen公司;实时荧光定量试剂盒购自南京Vazyme公司;相关蛋白抗体购自英国Abcam公司。本实验中涉及的基因及引物序列见表1。
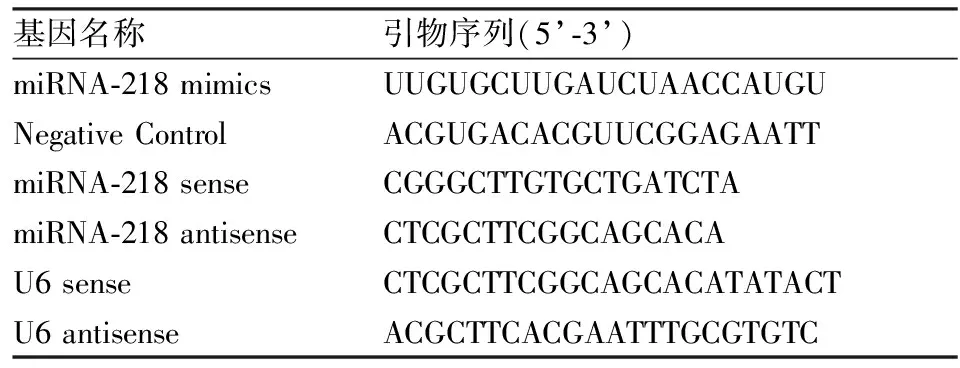
表1 基因和引物序列
1.2方法
1.2.1细胞系及培养 食管鳞癌细胞Eca109采用含10%胎牛血清,1%青链霉素的RPMI1640完全培养基,耐药细胞Eca109/CisR用含10%胎牛血清和1%青链霉素的DMEM完全培养基, 在37 ℃恒温,含5% CO2培养箱中培养,取对数期状态良好的细胞用于实验。
1.2.2耐药株构建 采用递增药物浓度、间歇冲击作用的方法构建耐药细胞株[6]。取状态良好并处于对数生长期的Eca109 细胞,从浓度为0.5 μmol/L 的 Cisplatin 开始培养,24 h后更换为新鲜的完全培养基,观察到细胞恢复正常生长,再次用初始浓度的 Cisplatin 培养基培养 Eca109 细胞,发现有细胞死亡后换为新鲜的完全培养基,细胞稳定生长并传代3次,测定半抑制浓度(half maximal inhibitory concentration,IC50)。随后提高 Eca109浓度反复作用直至细胞能在10 μmol/L Cisplatin 的培养基中维持培养并连续传代3次,最后测 Eca109 的 Cisplatin 耐药细胞株 IC50为(18.68±0.94) μmol/L,命名为 ECA109/CisR。
1.2.3RNA提取 定量即时聚合酶链锁反应(quantitative real time polymerase chain reaction ,qRT-PCR) 采用TRIzol方法提取细胞总RNA,并使用微量分光光度计测浓度及纯度(一般要求OD260/OD280为1.8~2.2之间)。按照Vazyme实时荧光定量试剂盒说明书具体步骤,进行反转录、扩增,同时以U6作为内参进行扩增,miR-218的表达量为其与该样本中内参U6的相对表达量,由公式Folds=2-ΔΔCt检测ECA109/ECA109-CisR、miRNA-218 mimics/ Negative Control miR-218的差异性表达。
1.2.4细胞转染 取对数生长期的细胞进行试验,6孔板细胞数:3×105/孔;96孔板细胞数3×103个/孔分别均为种于每孔,培养12 h至细胞密度达80%,应用转染试剂siRNA-Mate(上海吉玛公司)进行瞬时转染法并参照产品说明书,将miRNA-218 mimics、Negative Control(NC)(终浓度50 nmol/L)与 Si-Mate按比例加入每孔。转染miRNA-218 mimics作为实验组,Negative Control(NC)作为对照组。
1.2.5CCK8法检测细胞增殖 将实验分为两组:miRNA-218 mimics转染组,NC对照组。每组在转染后不同时间点0、24、48、72 h分别取3个重复孔进行实验。弃原培养基后加入含有10% CCK-8的完全培养基,置于37 ℃恒温培养箱中继续培养1 h,酶标仪检测各孔450 nm波长处的吸光度(optical density,OD)值。同样的方法作瞬时转染,24 h后,给予两组细胞不同终浓度顺铂处理,每个浓度梯度分别设置3个重复孔,置于37 ℃恒温培养箱培养48 h后,同样方法检测各孔450 nm波长的OD值。以上每组实验操作重复3次,并取重复孔平均值。细胞抑制率=(0 h药物浓度OD值-任意h药物浓度OD值)/(0 h药物浓度OD值)×100%,IC50值是指导致细胞抑制率为50%时的药物浓度。
1.2.6流式细胞仪检测细胞凋亡 取6孔板作Eca109/CisR细胞瞬时转染,miRNA-218 mimics为转染组,NC为对照组,48 h后,参照AnnexinV-FITC/PI 细胞凋亡检测试剂盒说明书,收集细胞(注意保留培养基),500 r/min低速离心5 min后,用预制冷的1×PBS洗涤两遍,加入300 μl 的1×Binding Buffer 制成细胞悬液;加入5 μl的Annexin V-FITC混匀后,避光,室温孵育15 min,上机前5 min再加入5 μl的PI染色并补加200 μl的1×Binding Buffer混匀,上机检测凋亡比率。同样的方法做细胞转染,48 h后,两组加入含有终浓度5 μmol/L顺铂的完全培养基,置于培养箱48 h,上机检测凋亡比率。
1.2.7Western blot检测细胞中蛋白的表达 收集经不同方法处理的Eca109/CisR细胞,分为四组:NC组,miRNA-218 mimic组,NC+ Cisplatin组, miRNA-218 mimics+ Cisplatin组。用RIPA/PMSF(100 ∶1)冰上裂解30 min,14 000 r/min 离心15 min,收集上清液用 BCA法测定总蛋白浓度。根据蛋白浓度计算上样体积,30 μg蛋白样品在10% SDS-PAGE 凝胶中电泳分离、转膜,5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,TBST 10 min/次摇床洗膜3次,加入辣根过氧化物酶标记的二抗,室温摇床孵育1 h,TBST 10 min/次摇床洗膜3 次后显色。
1.3统计学处理采用 SPSS 18.0 软件进行分析,组间比较采用t检验分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1Eca109/CisR耐药株及耐药测定CCK8法检测结果证实,Eca109、Eca109/CisR细胞在不同Cisplatin浓度处理后,与食管鳞癌细胞Eca109比较,Eca109/CisR细胞增殖受明显抑制;根据公式测算两组细胞IC50值分别为(4.9±1.04) μmol/L和(18.88±0.94) μmol/L,差异具有统计学意义(P<0.05)(图1)。
2.2miRNA-218在细胞株Eca109和Eca109/CisR细胞中表达实时荧光定量PCR法检测结果显示:与Eca109细胞比较,Eca109/CisR细胞中miRNA-218表达下调;与NC组比较,miR-218 mimics组Eca109/CisR细胞中miRNA-218表达明显上调,差异有统计学意义(P<0.05)(图2)。
2.3CCK8检测不同方式处理后耐药细胞Eca109/CisR增殖活性转染miRNA-218 mimics,CCK8法检测两组不同时段(0、24、48和72 h)Eca109/CisR细胞增殖能力,miRNA-218抑制Eca109/CisR细胞增殖能力;转染miRNA-218 mimics 24 h后, 用不同终浓度的Cisplatin(0、2.5、5、10、20和40 μmol/L)处理,与NC组相比,miRNA-218 mimics组Eca109/CisR 的OD值明显下降,差异具有统计学意义(P<0.05)(图3)。
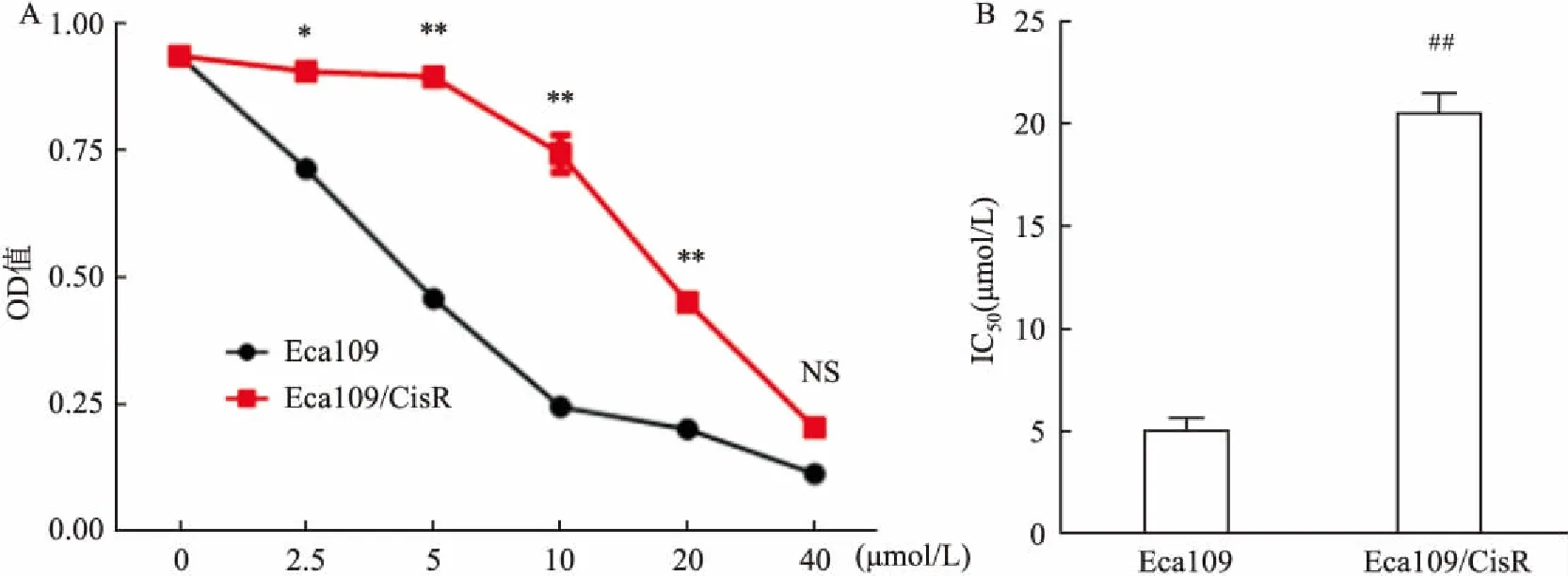
图1 CCK8法检测Cisplatin对Eca109和Eca109/CisR细胞的增殖抑制效应
A:CCK8测两组细胞增殖能力;B:两组细胞IC50值;与食管鳞癌细胞Eca109/CisR比较:*P<0.05,**P<0.01;与食管鳞癌细胞Eca109比较:##P<0.01
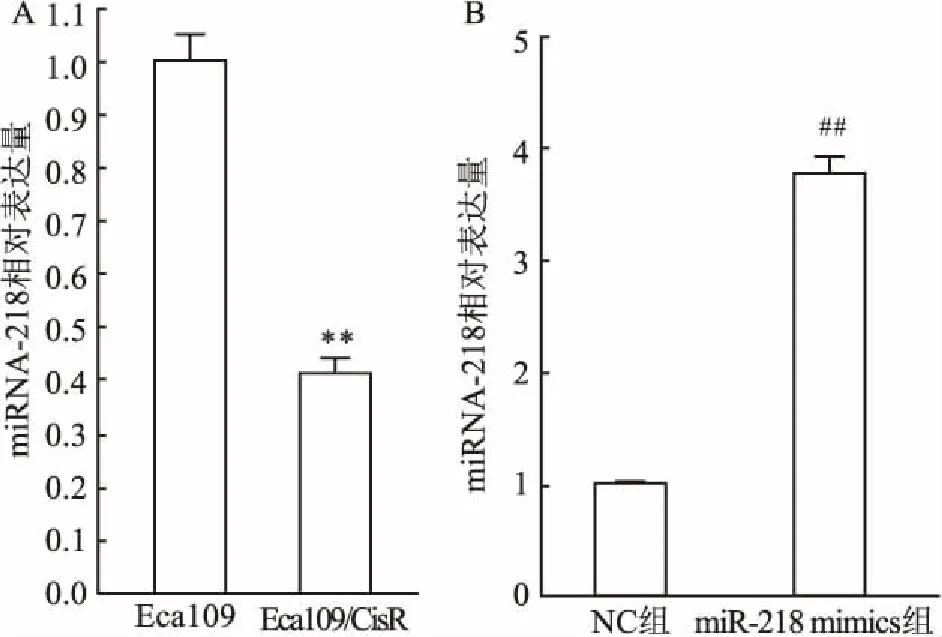
图2 实时荧光定量PCR检测miRNA-218的表达量
A:Eca109细胞与Eca109/CisR细胞中miRNA-218的表达;B:NC组与miR-218 mimics组Eca109/CisR细胞中miRNA-218表达;与 Eca109细胞比较:**P<0.01;与NC组比较:##P<0.01
2.4流式细胞术法检测过表达miRNA-218对Eca109/CisR细胞凋亡的影响流式细胞仪检测结果表明, 转染miRNA-218 mimics组和NC组Eca109/CisR 细胞凋亡率分别为5.33%和2.05%;转染miRNA-218 mimics组和NC组Eca109/CisR 细胞后给予浓度5 μmol/L的Cisplatin处理 ,细胞凋亡率分别为28.8%和7.42%(图4)。
2.5转染miRNA-218mimics和Cisplatin处理后Eca109/CisR细胞中抗凋亡蛋白Survivin、Mcl-1和Bcl-2的表达Western blot 法结果显示,与NC组细胞比较,miR-218 mimics 组和miRNA-218 mimics+Cisplatin组Eca109/CisR细胞中抗凋亡蛋白Survivin、Mcl-1和Bcl-2表达下调,差异有统计学意义(P<0.05)(图5)。

图3 miRNA-218 mimics 和Cisplatin对Eca109/CisR细胞增殖抑制效应
A:miR-218 mimics抑制Eca109/CisR细胞增殖;B:miR-218 mimics增加Eca109/CisR细胞对Cisplatin的敏感性;与NC组比较:**P<0.01;与NC+Cisplatin组比较:#P<0.05

图4 流式细胞术检测对Eca109/CisR细胞凋亡率的影响
A:NC组;B:miRNA-218 mimics组;C:NC+Cisplatin组;D:miRNA-218 mimics+Cisplatin组
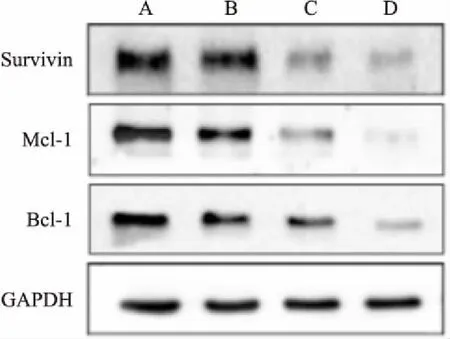
图5 抗凋亡蛋白Survivin、Mcl-1和Bcl-2表达量的变化
A:NC组;B:miRNA-218 mimics组;C:NC+Cisplatin组;D:miRNA-218 mimics+Cisplatin组
3 讨论
以药物顺铂为基础的化疗药物耐药性仍然是食管鳞状细胞癌治疗的主要难题,大量的microRNAs被证实参与食管鳞癌细胞顺铂耐药性调控机制[7],而miR-218也被证实在多种癌症的耐药性的形成起到重要作用[8],甚至部分学者认为通过检测miRNA的表达,预测肿瘤患者对药物治疗的敏感性[9]。miR-218增加口腔癌对顺铂的耐药性[7],异于本研究中证实的miR-218与顺铂耐药性之间的关系,本研究证实miR-218在顺铂耐药的食管鳞癌细胞中呈低表达,而过表达miR-218可以促进耐药细胞药物敏感性,进而可以认为miR-218调控食管鳞癌细胞对顺铂的敏感性。
Survivin基因是一个细胞凋亡抑制基因,具有强大的凋亡抑制功能,同时也参与部分肿瘤耐药性的调节[10]。而在乳腺癌细胞中[11],miR-218抑制survivin基因表达以调节起对化疗的耐药性,与此同时,学者Lin et al[12]也提出相似观点,miR-218通过作用于survivin基因的表达促进食管癌细胞对顺铂药物的敏感性。抗凋亡基因Bcl2家族参与调控基因介导的细胞的多要耐药性MDR,诸如上调 miR-15b 和表达可以增加 SGC7901/VCR 细胞由长春新碱诱导凋亡的敏感性,这种改变就是通过作用于靶基因Bcl-2 来实现的[13]。本研究中miR-218介导的Bcl2蛋白实现食管癌耐药性降低的原因,可能是基于miR-218抑制Wnt/β-catenin信号通路[14],抑制Bcl-2的表达。同时Wnt/β-catenin信号通路的下游靶基因中包括有细胞周期相关基因Cyclin, 原癌基因C-myc、Survivin、Mcl-1,血管内皮生长因子(vascular endothelial growth factor, VEGF)基因等,Survivin、Mcl-1是凋亡抑制因子,二者表达水平下降,会启动主要依赖于Caspase 途径的凋亡程序, 导致细胞线粒体膜电位下降和Caspase-3的活化。同样miR-218也可以抑制PI3K/AKT/mTOR信号通路[4],而PI3K/AKT/mTOR信号通路可以通过抑制Bcl-2的表达[15],促进细胞凋亡,进而间接增加食管癌细胞对顺铂的敏感性。Mcl-1是 Bcl-2家族的一个重要成员,在凋亡的调控中起着重要作用。已有研究[5]证实,在肺癌细胞中,miR-205/miR-218促进对卡铂耐药的肺癌细胞的凋亡,通过抑制Mcl-1的表达得以实现。因此,在本研究中,通过过表达miR-218实现食管癌对顺铂敏感性的增加,其中具体分子机制可能是通过调节抗凋亡基因survuvin、mcl-1、bcl-2表达,促进耐药细胞的凋亡,而是否存在分子信号通路如Wnt/β-catenin、PI3K/AKT/mTOR的参与来影响药物敏感性,有待进一步研究证实。
本研究证实,miRNA-218在食管鳞状细胞癌对顺铂药物的敏感性和耐药性方面具有潜在的调控作用, 而这些调控机制可能涉及直接或间接作用于凋亡基因的表达。鉴于未做临床病例血清学和(或)者组织学miRNA-218表达的差异性对比,miRNA-218是否可以作为有用的生物标记物,用来预测患者对化疗的敏感度及生存预后,尚待进一步研究佐证。总的来说,上调miRNA-218表达可以提高耐药的食管鳞状细胞癌细胞对顺铂药物的敏感性,miRNA-218可作为设计靶向药的分子靶点,应用于对顺铂耐药的食管鳞状细胞癌患者的临床靶向治疗。
[1] Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010,127(12):2893-917.
[2] Donzelli S, Mori F, Biagioni F, et al. MicroRNAs: short non-coding players in cancer chemoresistance[J]. Mol Cell Ther, 2014,2(1):1-12.
[3] Xie J, Yu F, Li D, et al. MicroRNA-218 regulates cisplatin (DPP) chemosensitivity in non-small cell lung cancer by targeting RUNX2[J]. Tumour Biol, 2016,37(1):1197-204.
[4] Tian H, Hou L, Xiong Y M, et al. miR-218 suppresses tumor growth and enhances the chemosensitivity of esophageal squamous cell carcinoma to cisplatin[J]. Oncol Rep, 2015, 33(2):981-9.
[5] Zarogoulidis P, Petanidis S, Kioseoglou E, et al. MiR-205 and miR-218 expression is associated with carboplatin chemoresistance and regulation of apoptosisviaMcl-1 and Survivin in lung cancer cells[J]. Cell Signal, 2015, 27(8):1576-88.
[6] 李 敏, 王志举, 李文涛,等. 人食管癌顺铂耐药细胞系Ec9706/cDDP的建立及其生物学特征[J]. 世界华人消化杂志, 2006, 14(34):3257-60.
[7] Sugimura K, Miyata H, Tanaka K, et al. Let-7 expression is a significant determinant of response to chemotherapy through the regulation of IL-6/STAT3 pathway in esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2012, 18(18):5144-53.
[8] Zhuang Z, Hu F, Hu J, et al. MicroRNA-218 promotes cisplatin resistance in oral cancerviathe PPP2R5A/Wnt signaling pathway[J]. Oncol Rep, 2017, 38(4):2051.
[9] Yang N, Kaur S, Volinia S, et al. MicroRNA microarray identifies Let-7i as a novel biomarker and therapeutic target in human epithelial ovarian cancer[J]. Cancer Res, 2008, 68(24):10307-14.
[10] Wang S, Wang A, Shao M, et al. Schisandrin B reverses doxorubicin resistance through inhibiting P-glycoprotein and promoting proteasome-mediated degradation of survivin[J]. Sci Rep,2017,7(1):8419.
[11] Hu Y, Xu K, Yagüe E. miR-218 targets survivin and regulates resistance to chemotherapeutics in breast cancer[J]. Breast Cancer Res Treat, 2015, 151(2):269-80.
[12] Lin J, Wang W, Xu Q, et al. MiR-218 increases sensitivity to cisplatin in esophageal cancer cellsviatargeting survivin expression[J]. Open Med, 2016, 11(1):31-5.
[13] Zheng T, Wang J, Chen X, et al. Role of microRNA in anticancer drug resistance[J]. Int J Cancer, 2010, 126(1):2-10.
[14] Huang Y, Liang S H, Xiang L B, et al. miR-218 Promoted the Apoptosis of Human Ovarian Carcinoma CellsviaSuppression of the WNT/β-Catenin Signaling Pathway [J]. Mol Biol, 2017, 51(4):629-36.
[15] Huang C, Sheng S, Li R, et al. Lactate promotes resistance to glucose starvationviaupregulation of Bcl-2 mediated by mTOR activation[J]. Oncol Rep, 2015, 33(2):875-84.
