一株非酿酒酵母分离鉴定及多菌种混菌发酵对葡萄酒香气的影响研究
2018-07-02李艺凡薛逸轩肖世娣张惠玲
李艺凡,薛逸轩,赵 璐,王 菁,肖世娣,张 博,张惠玲
(宁夏大学农学院,宁夏微生物制造应用技术与安全控制重点实验室,宁夏银川 750021)
葡萄酒香气是评价葡萄酒品质的客观指标之一,也是构成葡萄酒灵魂的重要部分[1]。而葡萄酒的香气来源有三方面,原料香、酿造香和陈酿香[2]。酿造香主要来自菌种及其发酵条件,不同的酵母代谢产物不同,酿造的酒风格不同。长期使用商业酿酒酵母酿造,导致葡萄酒日益同质化,致使葡萄酒缺乏鲜明的特征[3]。红茶菌又称“海宝”、“胃宝”,是酵母菌、乳酸菌和醋酸菌的共生物[4]。而红茶菌中的酵母多为非酿酒酵母[5],唐欣昀[6]从红茶菌种分离筛选了酿酒酵母,非酿酒酵母的分离还未见报道。
葡萄汁和红茶菌发酵液均富含碳水化合物、蛋白质、有机酸、酚类物质及各种矿物质元素[7-9],两者具有相似的物质环境,红茶菌中的微生物能在葡萄汁中生长,并有可能对葡萄酒的香气有贡献。本研究以宁夏贺兰山东麓的赤霞珠葡萄为原料,将从红茶菌种分离获得1株产香性能较好的非酿酒酵母,并与现有实验室保藏的两株非酿酒酵母全美梅氏酵母(Mestchnikowiapulcherrima)、葡萄有孢汉生酵母(Hanscniasporauvaruin)等比例混合,与葡萄酒酿酒活性干酵母顺序接种发酵,分析理化指标并测定挥发性物质及含量,与葡萄酒酿酒活性干酵母单菌种发酵进行比较分析。通过文献所知,王晓昌[10]经研究发现全美梅氏酵母和葡萄汁有孢汉生酵母对葡萄酒酿造具有香气贡献的潜力,与王星晨[11]、汪立平[12]的研究结果相一致,因此,本实验采用三株非酿酒酵母(从红茶菌中分离得到性能优良的一株非酿酒酵母及实验室保藏的两株非酿酒酵母)与葡萄酒活性干酵母混合发酵赤霞珠红葡萄酒,以期增加发酵菌种的多样性,增强葡萄酒的香气。
1 材料与方法
1.1 材料与仪器
赤霞珠葡萄样品 宁夏贺兰山东麓留世酒庄;葡萄酒酿酒活性干酵母(RX) 法国Lamothe-Abiet公司;果胶酶(7500 U/g) 丹麦Novozymes公司;全美梅氏酵母(Mestchnikowiapulcherrima)、葡萄有孢汉生酵母(Hanscniasporauvaruin)宁夏大学生物工程实验室保藏(实验室分离纯化得到,并已进行菌种26sRDNA鉴定);YPD培养基、WL营养培养基[13]、赖氨酸培养基[14-15]、氢氧化钠、无水乙醇、乙醇、葡萄糖、浓硫酸、重铬酸钾 天津基准化学试剂有限公司,国产分析纯;柠檬酸、酒石酸钾钠、次甲基蓝、磷酸氢二钠、无水硫酸铜 天津市百世化工有限公司,国产分析纯;酒石酸、30%过氧化氢 北京化工厂,国产分析纯;磷酸、酚酞 天津市大茂化学试剂厂,国产分析纯;化学药品均用于葡萄酒理化指标的测定;白砂糖、红茶茶叶、红茶菌 市售,用于从中分离微生物。
PL203电子天平 瑞士梅特勒天平有限公司;UV2000 紫外分光光度计 上海尤尼柯仪器有限公司;SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;DSX-280型手提式压力蒸汽灭菌器 上海申安医疗器械厂;GC-MS-QP气相色谱-质谱联用仪 日本岛津公司;手持糖度计 杭州联测自动化技术有限公司;固相微萃取装置 美国Supelco公司。
1.2 实验方法
1.2.1 非酿酒酵母分离
1.2.1.1 初筛 红茶菌液的制备:参考文献[16]方法培养红茶菌。
样品处理:无菌操作下在100 mL三角瓶中加入45 mL无菌水,并加入成熟红茶菌液5 mL振荡摇匀后,稀释为10-2、10-3、10-4、10-5梯度,从各个稀释梯度分别取1 mL加入9 mL 液体YPD培养基中,28 ℃培养2 d。
增殖培养:取1 mL培养液涂布固体YPD培养基上进行增殖培养[17]。
分离纯化:挑选能够固体YPD增殖培养基上生长的菌落,初步为酵母菌[18]。采用YPD固体培养基涂布划线培养,进一步分离纯化酵母菌,在28 ℃环境下培养3 d。待培养基表面长出菌落,通过观察菌落的形态和颜色,进行酵母菌株的初步筛选并编号。
1.2.1.2 复筛 对以上初步筛选得到的酵母菌,进行WL培养基培养复筛,观察形态及颜色,同时利用非酿酒酵母可利用赖氨酸作为氮源的特性再进行筛选,能在赖氨酸平板培养基生长的鉴定为非酿酒酵母[19]。
1.2.2 性能测定 对以上非酿酒酵母菌进行葡萄糖、SO2、酒精耐受性能测定。调整培养基在不同糖浓度[20]、不同SO2浓度[21]、不同酒精浓度[22]下,利用紫外分光光度计测定OD660,考察菌的耐受性。选择优良耐受菌进行发酵,测定菌株发酵酒挥发香气成分,选出一株产香优者作为待试菌,并绘制该菌以及实验室保藏菌种全美梅氏酵母、葡萄有孢汉生酵母的生长曲线,以期获得其发酵周期。
1.2.3 待试菌葡萄酒发酵实验 扩大培养:将分离获得的优良待试菌斜面试管,用无菌的接种针挑取一环于10 mL YPDA培养基中28 ℃条件下培养24 h进行活化作为种子液。将活化好的种子液进行扩大培养,使菌密度达到107~108CFU/g。
葡萄汁预处理:选择新鲜无霉变的赤霞珠葡萄进行破碎,加入100 mg/L SO2,40 mg/L的果胶酶,调整pH为3.3~3.5。取扩大培养好的待试菌5%,接种到赤霞珠红葡萄汁中发酵,定期测定比重,当比重不再下降时发酵结束,取样测定挥发香气成分,并进行感官品评。
1.2.4 葡萄酒发酵比较实验 实验分两组进行比较实验。第一组为酿酒活性干酵母单菌种发酵。第二组为非酿酒酵母与酿酒酵母顺序接种发酵。非酿酒酵母由三种酵母按照1∶1∶1混合培养混合组成(克鲁斯假丝酵母H8、全美梅氏酵母、葡萄有孢汉生酵母),顺序接种次序为:先接种混合非酿酒酵母培养液5%[23-24],发酵46 h,再接种活化好的酿酒酵母(RX)2%,发酵温度为25 ℃,待糖全部发酵完比重不再下降为止。进行皮渣分离,分别取样测定理化指标和挥发性香气成分。
1.3 测定方法
1.3.1 理化指标检测 pH测定:pH计法;残糖含量测定、挥发酸测定、酒精度测定、游离二氧化硫测定:参照GB/T 15038-2006方法[25]。
1.3.2 香气成分检测 香气成分提取:顶空固相微萃取提取,参考文献[26]。顶空固相微萃取提取:取10 mL发酵液,8000 r/min离心10 min后取5 mL上清液,注入萃取瓶中,加入磁力转子和1 g NaCl,快速盖紧盖子,置于恒温磁力搅拌加热台上,将活化的萃取头插入样品瓶的顶空部分,萃取头距离液面1 cm,40 ℃条件下吸附30 min,将吸附后的萃取头插入气相色谱进样口,于250 ℃热解析5 min。
挥发性物质测定:GC-MS条件参考文献[27]。采用Agilent 5975c/7890a测定挥发性物质,气相色谱柱为DB-5 ms(30 m×250 μm,0.5 μm);载气为高纯氦气,流速为1 mL/min。采用不分流模式手动进样,进样口温度250 ℃,热解析5 min。柱温箱升温程序:40 ℃保持4 min,然后以3 ℃/min的速率升温到230 ℃,保持2 min。质谱接口温度为250 ℃,离子源温度:230 ℃,电离方式为EI,离子能量70 eV,质量扫描范围:20.0~500.0。
定性定量分析:通过质谱全离子扫描图谱,根据已有标样的色谱保留时间和质谱信息、NIST05标准谱库比对结果定性分析葡萄酒中的香气物质。采用气相色谱峰面积归一化确定各组分的相对含量[28]。利用Origin软件制作总离子流图。
1.3.3 感官品评 由15人组成感官品评小组,根据GB/T 15038-2006[25]的要求对感官评定小组成员进行培训,培训合格后待测酒样进行感官品评,评分标准:去掉一个最高分与一个最低分后计算平均分。品评表如表1。

表1 感官评分表Table 1 Sensory scoreTable
1.4 数据统计分析方法
酵母菌性能测定过程中所有指标均平行测定三次,数据采用SPSS 21.0进行差异分析,结果以平均值±标准差表示[31]。
2 结果与分析
2.1 初筛结果
从成熟红茶菌液中共分离得到具有菌落大而厚,表面光滑而湿润,质地柔软而粘稠,且易挑起,菌落质地均匀,正反面和边缘、中央部位的颜色均一等典型酵母菌落特征的菌株共53 株。对菌株进行编号,依次为H1-H53。
2.2 复筛结果
通过复筛,能够在WL鉴定培养基[32]中显示出具有非酿酒酵母明显特征的有9株酵母菌,并将其接种到赖氨酸培养基后,均能利用赖氨酸作为氮源生长。徐亚男[33]、刘景[34]、Yamagishi H[35]等分别对各自筛选的酵母进行了WL 培养基鉴定与26srDNA鉴定,发现两者的鉴定具有高度一致性,以此为依据判断这9株酵母为非酿酒酵母,根据形态判断H33、H45为中间型酒香酵母,H8、H15为克鲁斯假丝酵母,H7、H22、H36为拜耳接合酵母,H38、H49为东方伊萨酵母,结果见表2。

表2 酵母菌在WL培养基上的分类结果Table 2 Classification of yeast on WL medium
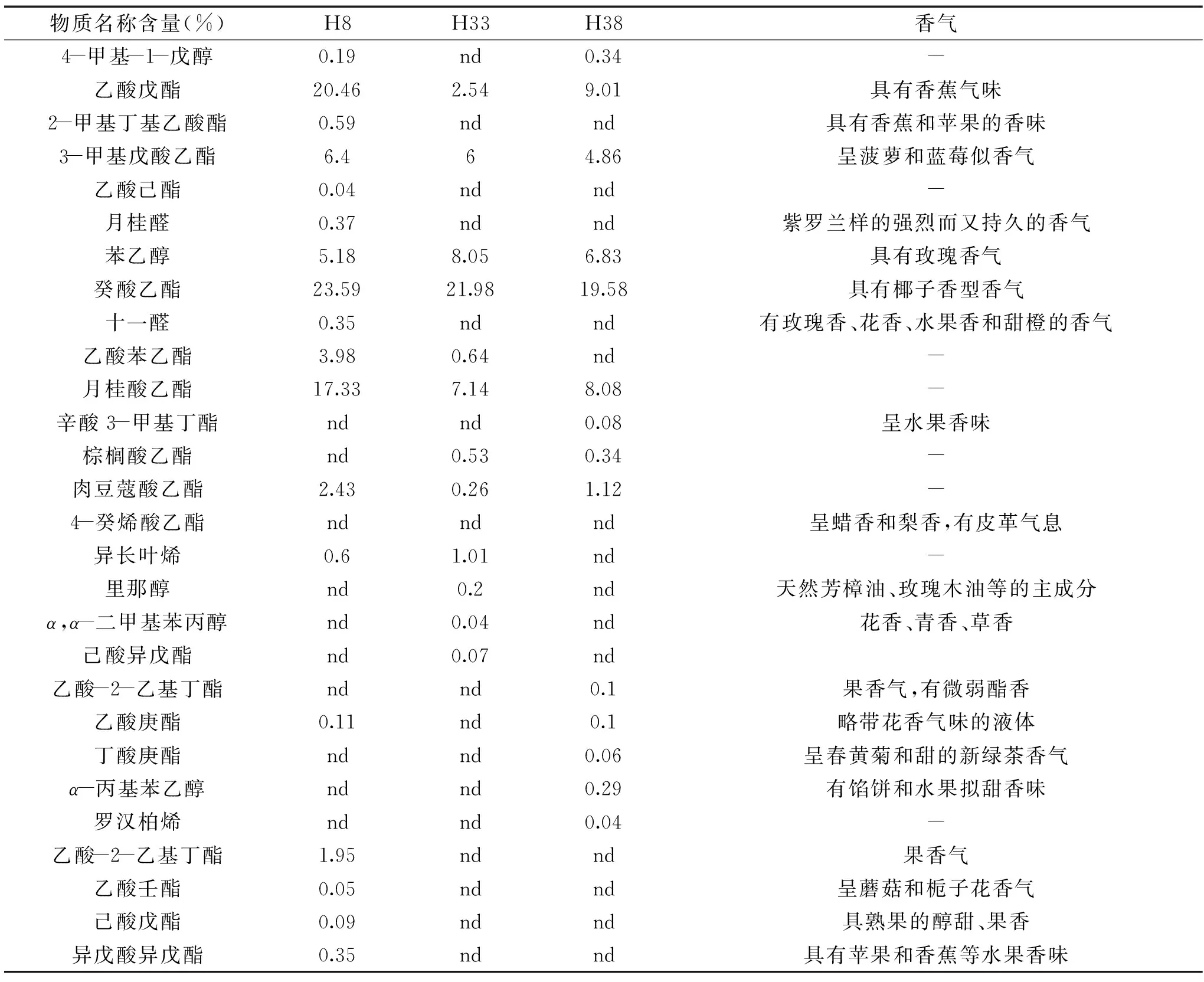
表2 3株非酿酒酵母发酵酒样挥发性物质组成Table 2 3 non-Saccharomyces cerevisiae fermentation of volatile substances in wine composition
2.3 性能测定结果
对以上9株非酿酒酵母进一步进行性能测定实验,结果如下:
2.3.1 葡萄糖耐受性结果 据图1可知,在葡萄糖浓度低于180 g/L时,多数酵母的生长繁殖不受糖的限制而持续生长,但当葡萄糖浓度高于180 g/L时,酵母的生长不同程度的受到限制,其中当糖浓度达到220 g/L时,菌株H49表现出明显的被抑制,菌株H8、H33、H38在300 g/L浓度中生长仍不受限,显示耐受性较好。

图1 非酿酒酵母的耐糖性能Fig.1 Sugar tolerance of non-Saccharomyces cerevisiae
2.3.2 SO2耐受性能测定结果 据图2可知,随着SO2浓度的增加,酵母生长繁殖会受到不同程度的抑制,H8、H38、H45、H49能够耐受300 mg/L的二氧化硫,而H15、H22、H33在二氧化硫浓度为180 mg/L时生长受到明显抑制。葡萄酒发酵工艺常常需要用添加二氧化硫的方法抑制其他杂菌,选择耐受性好的菌种,有利于在接种到葡萄酒汁中发酵时不受其影响。

图2 非酿酒酵母的耐二氧化硫性能Fig.2 Sulfur dioxide resistance of non-Saccharomyces cerevisiae
2.3.3 酒精耐受性能测定结果 据图3可知,在酒精度达到6%以后,酵母生长明显迟缓。H7、H38、H49的酒精耐受能力比较低,在酒精浓度为4%时生长抑制极为显著,H8、H22、H33对酒精的耐受能力最强,在8%的酒精浓度下仍可生长,对于混菌酿造葡萄酒意味着非酿酒酵母可以更长久的发挥作用。

图3 非酿酒酵母的耐酒精性能Fig.3 Alcohol resistance of non-Saccharomyces cerevisiae yeast
由图1~图3结果可以看出,H8、H33、H38在耐受性方面表现良好,但对其发酵性能还不甚了解,因此,进一步对三株菌进行发酵性能测定以及感官品评。
2.3.4 发酵性能测定结果 挥发香气成分比较。
根据表2、表3可知,3株非酿酒酵母的发酵液中挥发性物质中大部分为酯类,同时还有较少的醇、醛、烯、酮类物质。各发酵液中均含有的物质为乙酸戊酯、3-甲基戊酸乙酯、苯乙醇、癸酸乙酯、月桂酸乙酯五种,含量差异明显。挥发性物质总含量最高的为H8,含量为82.93%,共有18种物质,种类丰富,香气突出,含量颇高,其中十一醛含量为0.35%,具有玫瑰香、花香、水果香和甜橙的香气,月桂醛含量为0.37%,具有紫罗兰样的强烈而又持久的香气,对葡萄酒的香气均有积极贡献。
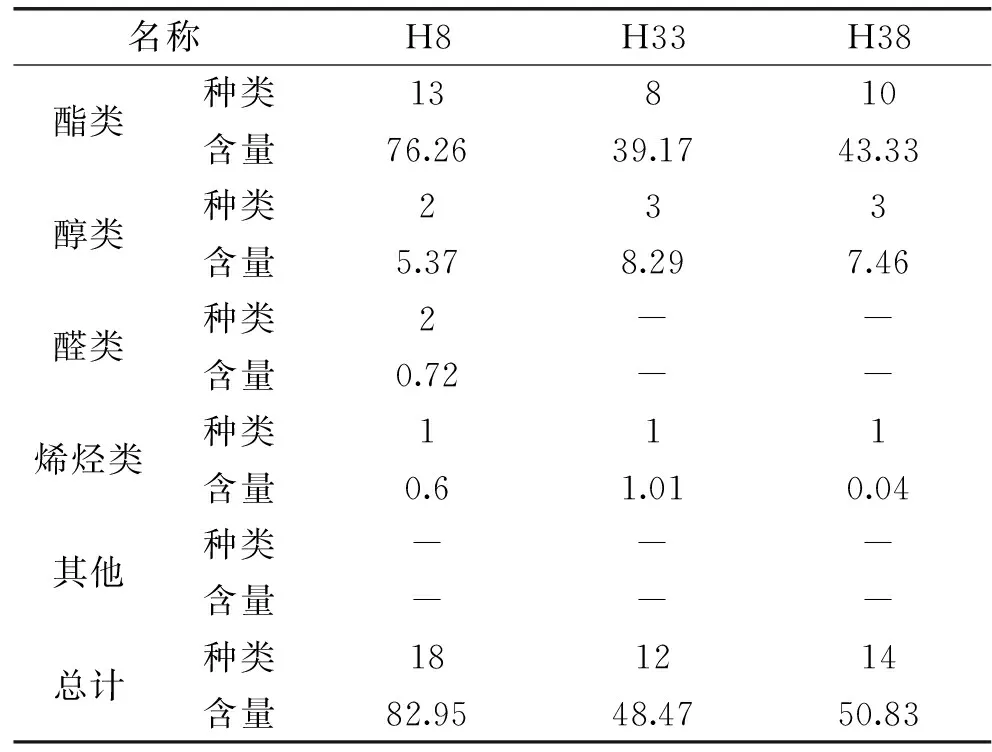
表3 3种非酿酒酵母发酵液挥发性物质含量(%)Table 3 Volatile matter content of 3 non-Saccharomyces cerevisiae fermentation broth
3株非酿酒酵母发酵液感官品评结果见表4。

表4 3株非酿酒酵母发酵液感官品评结果Table 4 3 non-Saccharomyces cerevisiae fermentation broth sensory evaluation results
根据3株菌株的挥发香气成分比较以及感官品评结果发现,H8具有较好的发酵性能,且发酵液的感官品评良好,外观呈宝石红,香气怡人且口感协调。
为了进一步增强葡萄酒发酵香气,等比例添加已知发酵性能的全美梅氏酵母、葡萄有孢汉生酵母与法国酿酒活酵母(RX)顺序发酵进行实验。
2.4 混合发酵葡萄酒实验结果
2.4.1 H8、全美梅氏酵母、葡萄有孢汉生酵母的生长曲线 由图4可知,H8和葡萄有孢汉生酵母在6 h时达到对数生长期,在10~16 h进入平稳期,而全美梅氏酵母则在8 h进入对数生长期,在10~18 h进入平稳期。三种酵母分别在44、42、46 h后进入衰亡期,菌体数量可能由于自溶开始减少。由此可知,当非酿酒酵母发酵46 h时,可以进入到酿酒酵母接种发酵阶段,即顺序接种酿酒酵母的时间。

图4 三种非酿酒酵母生长曲线Fig.4 Three non-brewer’s yeast growth curves
2.4.2 单菌种发酵与多菌种发酵比较
2.4.2.1 理化指标比较 混菌发酵的葡萄酒由于非酿酒酵母代谢了一部分的糖来产生香气物质而使得混菌发酵比RX单菌发酵的赤霞珠葡萄酒的酒精度低,这一结果与韩姗姗[36]的研究结果一致,且混菌发酵的赤霞珠葡萄酒的pH、残糖、挥发酸均稍高于葡萄酒酿酒活性干酵母的酒样,而游离SO2稍低,结果见表5。

表5 葡萄酒理化指标比较Table 5 Cabernet Sauvignon wine physical and chemical indicators test results
2.4.2.2 葡萄酒挥发性物质比较 通过表6可以看出混菌发酵的酒样中共有挥发性物质29种,而RX单菌发酵的酒样中拥有23种挥发性物质。

表6 挥发性物质种类及其含量Table 6 Types of volatile substances and their contents

续表
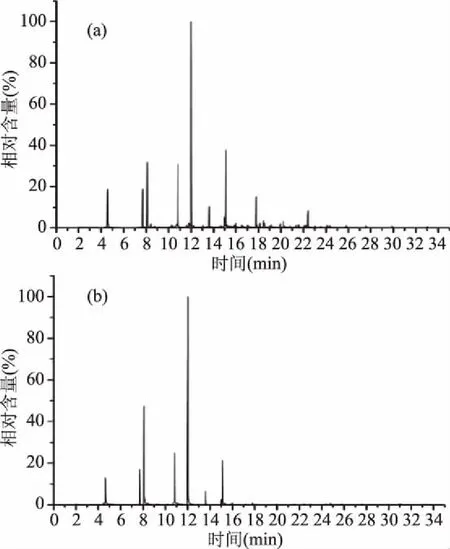
图5 挥发性物质GC-MS总离子流图Fig.5 Volatile substances GC-MS total ion flow chart注:(a)混菌发酵;(b)RX单菌发酵。
混菌发酵酯类物质18种。包括月桂酸乙酯25.75%,癸酸乙酯10.87%,3-甲基戊酸乙酯8.81%,乙酸戊酯6.6%,棕榈酸乙酯6.58%,珠光脂酸乙酯2.54%,肉豆蔻酸乙酯1.88%,4-癸烯酸乙酯1.57%,3-甲基辛酸丁酯1.15%;醇类物质3种,其中苯乙醇1.66%,薄荷醇2.04%,己基癸醇0.19%,苯乙醇具有玫瑰香气,增加酒体香气的复杂性;酸类物质3种,棕榈酸0.55%,辛酸0.64%,肉豆蔻酸0.38%;烯烃类2种,其中含量为0.18%的柠檬烯具有鲜花的清淡香气,异长叶烯0.53%;酮类物质为4-甲基苯戊酮,含量0.04%;具有2,4-二叔丁基苯酚0.17%,肉豆蔻醛0.07%,十一醛0.26%等。
RX单菌发酵酯类物质16种,包括月桂酸乙酯37.85%,丁酸异丁酯20.82%,乙酸戊酯4.26%,癸酸乙酯3.14%;醇类3种,正丁醇1.00%,2-戊醇0.03%,4-正癸醇0.31%;酸类物质2种,正戊酸0.05%,异香兰酸0.07%;烯烃类1种,异长叶烯0.68%;酮类物质为3-甲基-4-庚酮,含量0.1%。
由上可以看出,混菌发酵中含量较多且单菌种没有的物质如薄荷醇、柠檬烯、十一醛、肉豆蔻醛等均具有丰富复杂的特征香气,对酒的香气具有积极作用。
2.4.2.3 感官评分结果 由图6可知,混菌发酵与RX单菌发酵酒样之间香气的评分差异较大,混菌发酵的葡萄酒香气浓郁,酸甜协调,酒体丰满,而RX单菌发酵的葡萄酒果香中等,口感纯正,酸甜较协调。

图6 混菌发酵与RX单菌发酵感官评价结果Fig.6 Mixed fermentation and RX single bacteria fermentation sensory evaluation results
综上研究,混菌发酵的葡萄酒相比于RX单菌发酵酒的理化指标差异不明显,挥发性物质的含量和种类均高于单菌种发酵酒,且感官评价优良。因此,混菌发酵对于葡萄酒产香有积极作用,是一种增加葡萄酒复杂香气的手段。
3 结论
本研究从红茶菌成熟培养液中分离得到一株优良非酿酒有酵母菌H8,用该菌与全美梅氏酵母、葡萄有孢汉生酵母以等比例混合,与葡萄酒酿酒活性干酵母RX顺序接种发酵,目的在于增加非酿酒酵母的种类,以期提高葡萄酒香气。通过实验比较,结果得出:混菌发酵优于RX单菌发酵,香气分值明显增高。因此,利用非酿酒酵母与酿酒酵母发酵,是一种增加葡萄酒复杂香气的较好方法。
[1]齐晓琴,刘建花,李金鹏,等. 贺兰山东麓马瑟兰干红葡萄酒香气成分的分析[J]. 中国酿造,2016,35(9):163-167.
[2]王家梅,张军翔. 葡萄酒香气来源和形成研究进展[J]. 中国酿造,2014,33(5):5-9.
[3]高晓航,李雪雁,孙春丽. 贺兰山东麓葡萄酒产区酿酒酵母的分离及其主要特性研究[J]. 食品与发酵工业,2016,42(6):62-66.
[4]柳黄,蒋婉似,刘晋敏,等. 红茶菌的实验研究[J]. 食品科学,1984,5(5):6-11.
[5]林娟,叶秀云,曹泽丽,等. “红茶菌”中微生物的分离及纯菌混合发酵生产[J]. 中国食品学报,2015,15(2):39-48.
[6]唐欣昀. 从红茶菌中分离纯化酿酒酵母菌的方法:CN 100429302[P]. 2008.
[7]王仁才. 刺葡萄天然功效成分的提取、药理评价及果汁加工研究[D]. 长沙:湖南农业大学,2006.
[8]王国增,林娟,叶秀云,等. “红茶菌”的抑菌作用及抗氧化性[J]. 中国食品学报,2015,15(9):173-179.
[9]丁艳如,陈爽,朱忠顺,等. 红茶菌的发酵条件及抗氧化活性[J]. 食品科技,2016(3):21-26.
[10]王晓昌. 宁夏贺兰山东麓非酿酒酵母的分离鉴定与发酵特性研究[D]. 银川:宁夏大学,2016.
[11]王星晨,胡凯,陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J]. 食品科学,2016,37(3):103-108.
[12]汪立平. 苹果酒酿造中香气物质的研究[D]. 无锡:江南大学,2004.
[13]王晓昌,李京宁,张惠玲,等. 优良非酿酒酵母的分离与发酵性能研究[J]. 酿酒科技,2016(6):57-60.
[14]Wang S S,Brandriss M C. Proline utilization inSaccharomycescerevisiae:Sequence,regulation,and mitochondrial localization of the PUT1 gene product.[J]. Molecular & Cellular Biology,1987,7(12):4431.
[15]Spencer J F T. Yeasts-characteristics and identification[J]. Food Microbiology,1984,1(4):349-350.
[16]袁磊,张国华,Faizan,等. 发酵条件对红茶菌发酵品质及风味的影响[J]. 食品科学,2017,38(2):92-97.
[17]郝林. 食品微生物学实验技术[M]. 北京:中国农业出版社,2001.
[18]邢国良,王捷,姚玉军,等. 一种酿酒酵母菌及其应用:CN 102181372 B[P]. 2013.
[19]张珍,韩舜愈,王婧,等. 祁连葡萄酒产区葡萄酒相关野生酵母菌株的分离及初步分类[J]. 食品工业科技,2013,34(8):179-182.
[20]李进,李泽福,都振江,等.低醇半干白葡萄酒的酵母菌耐受性研究[J]. 中国酿造,2011,30(10):119-121.
[21]刘胜,刘品何,韩宁,等.云南德钦产区野生酵母菌株的耐受性分析[J].中外葡萄与葡萄酒,2013(6):10-13.
[22]秦伟帅,王海燕,李吕朋,等.不同葡萄酒酵母耐受性实验比较[J]. 中外葡萄与葡萄酒,2009(9):16-19.
[23]赵宾宾. VR与MGFSH-5共酵对‘蛇龙珠’干红葡萄酒香气品质的影响[D]. 兰州:甘肃农业大学,2016.
[24]王星晨,胡凯,陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J]. 食品科学,2016,37(3):103-108.
[25]中华人民共和国国家质量监督检验检疫总局.GB/T 15038-2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006
[26]李宝丽,邓建玲,蔡欣,等. 顶空固相微萃取-气质联用结合主成分分析研究纯葡萄汁的香气成分[J]. 中国食品学报,2016,16(4):258-270.
[27]郑青. 不同陈酿年份、葡萄品种及葡萄产地葡萄酒香气成分的研究[D]. 南昌:南昌大学,2015.
[28]王伟,王方,张岱,等. 搅拌子吸附萃取结合气相色谱/质谱技术分析起泡葡萄酒中香气物质[J]. 酿酒科技,2011(1):96-98.
[29]孙亮亮,葛斌. 葡萄酒感官评价结果的统计分析方法研究[J]. 中国食品学报,2015,6(2):126-131.
[30]齐晓琴. 半甜型无醇葡萄酒生产技术研究[D].银川:宁夏大学,2017.
[31]谢惠,张丽芬,邵佩兰,等. 紫外辐射对红枣色素抗氧化活性的影响[J]. 食品工业科技,2017,38(23):50-54.
[32]巴尼特. 酵母菌的特征与鉴定手册[M].青岛:海洋大学出版社,1991.
[33]徐亚男. 非酿酒酵母菌的筛选及产酶研究[D].新疆:石河子大学,2016.
[34]刘景. 非酿酒酵母发酵低醇苹果汁的研究[D].杨凌:西北农林科技大学,2015.
[35]Yamagishi H,Otsuta Y,Funahashi W,et al. Differentiation between brewing and non-brewing yeasts using a combination of PCR and RFLP[J]. Journal of Applied Microbiology,1999,86(3):505-513.
[36]韩姗姗. 柠檬形克勒克酵母(Kloeckeraapiculata)在葡萄酒发酵中的应用研究[D]. 杨凌:西北农林科技大学,2008.
