浓香型白酒大曲在发酵和成熟过程中主要功能酶活力分析
2018-07-02王玉霞申孟林尹旭敏郭小丽
王玉霞,李 兵,2,申孟林,2,尹旭敏,郭小丽,陈 桥,张 超,*
(1.宜宾学院生命科学与食品工程学院,四川宜宾 644000; 2.西华大学食品与生物工程学院,四川成都 610039; 3.重庆农业科学院农产品贮藏加工研究所,重庆 401329)
白酒是中国的国酒[1],具有悠久的历史,与威士忌、白兰地、朗姆酒、伏特加和金酒并称为世界六大蒸馏酒。我国是世界上利用微生物制曲酿酒最早的国家,具有世界独创性的白酒固态发酵、固态蒸馏生产工艺。制曲酿酒技术,经历了几千年的传承和发展,使中国白酒成为享誉全球的发酵酒精饮品[2]。大曲是影响大曲酒酿造最为关键的因素之一,具有糖化、发酵、酒化和生香等功能,不仅为大曲酒的发酵、成香提供必不可少的微生物菌群和风味前驱物,还提供发酵所必需的丰富生物催化剂——酶类[3]。
大曲中的酶类根据催化功能可分为淀粉酶、蛋白酶、氧化还原酶、酯化酶、脂肪酶、纤维素酶、半纤维素酶、单宁酶、裂解酶、果胶酶和异构酶等酶类[4]。大曲内丰富的功能酶系在酿酒过程中所起的复杂作用,是大曲酒品质和产量的重要保障,这使得大曲成为我国白酒酿造过程品质控制的核心指标之一。大曲具有“一菌产多酶,一酶源于多菌”的特征,构成了大曲复杂的菌系、酶系基础[5-7]。
大曲的生产工艺主要包括:原料选配、润粮破碎、压制成型、接种发酵和贮存后熟等五个工序[6],其中后两个工序,通过不同的工艺手段,控制温度、水分和曲块内部氧气浓度等各项条件,使其有利于特定风格大曲的形成。期间通过微生物菌群错综复杂的发展演变和更迭交替,最终形成种类繁多而又必不可少的庞大功能酶系。
基于大曲发酵环境状况以及大曲内菌群微生态条件的不断变化,曲块表层与内部微生物群系的演变更迭,以及微生物产生的功能酶系对白酒酿造所具有的非凡意义,许多学者针对大曲与特定酶活力的研究,主要集中在各酶系的作用、制曲时间对酶活力的影响,以及成品曲存放期酶活力的变化和特殊产酶微生物等方面[6,8-9]。如李祖明对清香和酱香四种成熟酒曲的糖化酶和蛋白酶等活力进行了分析比较,结果显示不同类型大曲糖化酶和蛋白酶活力变化差异明显[10]。鲁珍等从高温酱香白酒大曲中分离了高产糖化酶菌株,其中蜡样芽胞杆菌(Bacilluscereus)GX06产糖化酶能力最强,糖化酶活性可达917.03 U/g[11]。在众多大曲酶相关研究中,针对浓香型大曲特殊发酵、成熟工艺,跟踪同一批大曲,从制作、发酵到存放成熟过程中主要酶活力变化规律,以及与同时期微生物类群相互对应关系的研究,还较为少见。因此,课题组对大曲制作、发酵、成熟过程中主要功能酶活力变化规律及特定产酶微生物种属多样性进行了考察。拟通过对不同时期α-淀粉酶、单宁酶、木聚糖酶和脂肪酶活力的测定,分析曲皮和曲心酶活变化规律,以期为高产功能酶微生物的利用、制曲工艺的优化以及特定加强型功能大曲酶制剂的研制提供基础数据和理论参考。
1 材料与方法
1.1 材料与仪器
大曲样品 宜宾传统浓香型大曲制曲工厂;冰乙酸、酒石酸钾钠、三氯乙酸、可溶性淀粉、果胶、酪氨酸、酪蛋白、福林酚试剂、环己烷、3,5-二硝基水杨酸 均为分析纯,成都科龙化工试剂厂。
PB2002-N称量天平、AB204-E分析天平 Mettler-Toledo公司;Delta 320-S精密pH计 瑞士Mettler Toledo公司;Spectramax-M2酶标仪 美国Molecular Devices;3K冷冻高速离心机 德国Sigma公司。
1.2 实验方法
1.2.1 取样及处理 随机选择夏季开始制作的某批大曲,全程跟踪其制作、发酵和成熟过程,并在成形、长霉、起火、大火、后火、养曲、成熟1月、成熟2月、成熟3月和出库使用十个关键点取样。在曲房不同位置随机挑6块大曲,每块大曲沿对角线分开,每半块大曲分别切取表皮往内的0~3 cm为曲皮样、从曲块的心部往外0~3 cm为曲心样品,再将其分别粉碎,-20 ℃储存备用。各样品编号见表1。
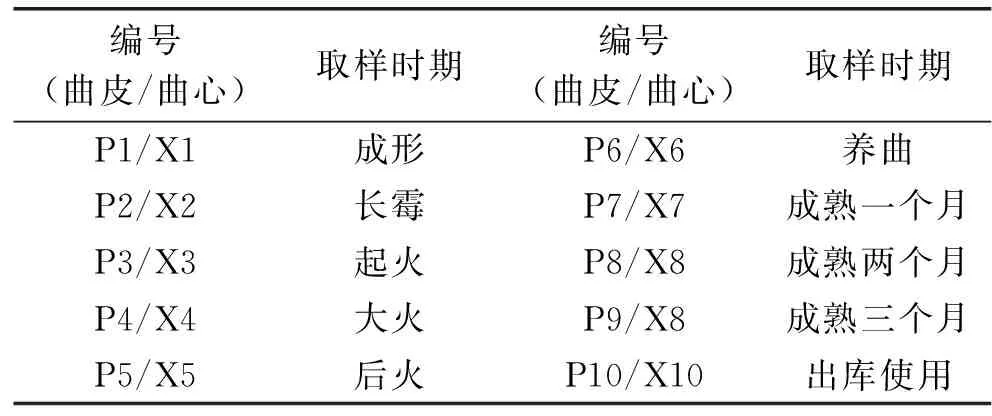
表1 样品编号及说明Table 1 Sample code and detail
1.2.2 大曲宏蛋白酶液的提取 根据文献[12]方法改进:称取5.0 g大曲粉,于10 mL乙酸-乙酸钠缓冲溶液中(0.1 mol/L,pH4.6),4 ℃条件浸提过夜,4层纱布过滤,滤液在4 ℃条件下4000 r/min离心10 min,弃去沉淀,上清液即为大曲宏蛋白粗酶提取液,重复三次,合并提取液于-20 ℃条件下保存备用。
1.2.3α-淀粉酶活力测定 根据文献[13]方法稍作改进:取1 mL粗酶液于70 ℃保温15 min后,加入1%(w/v)淀粉溶液1 mL,于40 ℃水浴中保温反应5 min后,迅速冷却至室温。取适量酶解液适当稀释后,以DNS法测定反应体系中还原糖浓度并换算成大曲α-淀粉酶活力,重复三次。
α-淀粉酶活力定义(U):在40 ℃、pH4.6的条件下,1.0 g大曲1 min分解可溶性淀粉产生1.0 mg麦芽糖所需要的酶量。
α-淀粉酶活力(U)=C×稀释倍数×10/5/T/反应酶量
式中:C为还原糖浓度(mg/mL);10为提取的粗酶液量(mL);5为称取的大曲量(g);T为反应时间(min)。
1.2.4 单宁酶活力测定 按照参考文献[14-15]的方法进行操作。
单宁酶活力定义(U):在30 ℃、pH5.0条件下,1.0 g大曲1 min分解没食子酸丙酯产生1.0 mg没食子酸所需要的酶量。
单宁酶活力(U)=C×稀释倍数×10/5/T/反应酶量
式中:C为没食子酸浓度(mg/mL);10为提取的粗酶液量(mL);5为称取的大曲量(g);T为反应时间(min)。
1.2.5 木聚糖酶活力测定 按照参考文献[16-17]的方法进行操作。
木聚糖酶活力定义(U):在40 ℃、pH4.6条件下,1.0 g大曲1 h分解木聚糖产生1.0 mg木糖所需要的酶量。
木聚糖酶活力(U)=C×10/5/T/反应酶量
式中:C为木糖浓度(mg/mL);10为提取的粗酶液量(mL);5为称取的大曲量(g);T为反应时间(h)。
1.2.6 脂肪酶活力测定 按照参考文献[18-19]的方法进行操作。
脂肪酶活力定义(U):在37 ℃、pH4.6的条件下,1.0 g大曲1 min分解对硝基苯酚棕榈酸酯产生1.0 mg对硝基苯酚所需要的酶量。
脂肪酶活力(U)=C×10/5/T/反应酶量
式中:C为对硝基苯酚浓度(mg/mL);10为提取的粗酶液量(mL);5为称取的大曲量(g);T为反应时间(min)。
1.3 数据统计
数据应用SPSS 19.0处理分析,以平均值±标准偏差表示。
2 结果与分析
2.1 大曲α-淀粉酶活力变化情况
大曲制作的原料中含有大量淀粉类物质,为提供给自然接种后曲块表层与内部微生物生长繁殖需要,离不开原料中淀粉类物质的降解,α-淀粉酶能催化淀粉分子内部α-1,4糖苷键断裂而获得还原糖和糊精为微生物提供营养[20-21]。实验对大曲发酵与成熟过程中α-淀粉酶活力变化规律的分析,结果如图1所示。

图1 大曲α-淀粉酶活力分析Fig.1 α-Amylase activities in the Daqu注:(A):曲皮,(B):曲心;不同小写字母 表示差异显著(p<0.05),不同大字字母 表示差异极显著(p<0.01),图2~图4同。
图1数据显示,在整个考察时间段内,曲皮样品中α-淀粉酶活力变化情况,总体上呈现出先升高再降低,最后趋于平缓的变化趋势。在曲块的发酵阶段(P1~P4),酶活力迅速升高,于大火期(P4)达到最大值765.78 U,较初始样品(P1)酶活力提高了8.39倍。进入成熟阶段后(P7~P10),曲块的α-淀粉酶活力呈现出较为缓慢的降低变化,至成熟三个月时期后,酶活力基本保持着550 U左右较为平稳的状况(P9~P10)。
曲心样品中最高酶活力出现在大曲成熟阶段(X7~X10),为成熟一个月大曲样品(X7)912.09 U,较初始样品酶活力提高了863.56%,且曲块发酵和成熟阶段曲心α-淀粉酶活力变化差异较大(p<0.05)。发酵阶段,曲心样品α-淀粉酶活力表现出迅速升高与较缓回落的变化情况,峰值为曲心大火期X4样品。而进入成熟阶段后一个月时,α-淀粉酶活力又再次快速升高,达到整个考察期的活力极值(X7),随后又迅速下降并维持着平稳活力状况直至出库使用。分析这个现象的原因可能为,曲块培育期间微生物大量生长繁殖,α-淀粉酶产生菌群产生的酶在细胞内,进入存贮期后,曲库环境与曲块内的微环境的差异变化较大,使得原本在细胞内的酶类,由于菌体营养细胞的大量死亡而释放了出来[20]。
2.2 大曲单宁酶活力变化情况
单宁酶(E.C.3.1.1.20)是指能水解单宁酸分子中酯缩酚酸键而释放出没食子酸、葡萄糖和没食子酰基酯的一类水解酶[22]。以没食子酸法测定大曲曲皮和曲心样品单宁酶活力情况如图2所示。

图2 大曲单宁酶活力分析Fig.2 Tannase activities in Daqu
通过测定反应体系中没食子酸含量,考察浓香型大曲曲块在发酵和成熟阶段,单宁酶活力变化结果(图2)显示,所有大曲样品酶活力变化范围为5.07~34.18 U。其中,曲皮样品的酶活力变化幅度是5.24~34.18 U,曲心为5.07~27.89 U。
大曲曲皮样品中的单宁酶活力在整个研究阶段有两个较为快速的上升时期和一个较缓慢的下降时期(图2A)。P1到P2时期为第一个快速上升的阶段,单宁酶活力由5.24 U上升到20.20 U,随后出现小幅波动(P2~P4),由大火进入后火期时,浓香型大曲的曲皮单宁酶活力再次迅速升高,达到曲皮样品中最大酶活力34.18 U(P5)。随着发酵的进行和曲块入库的存贮成熟,酶活力又开始逐渐下降至三个月成熟期的最低值6.70 U。根据图2B结果可以得出,由大曲成形开始,曲心单宁酶活力呈现出相对较为平稳的增大变化,至后火样品(X5)酶活力最大,比成形(X1)时酶活力提高了5.50倍,但比同时期曲皮样品(P5)最大单宁酶活力值低了6.29 U。
分析比较曲皮和曲心样品单宁酶活力变化情况可以发现,曲皮和曲心样品总单宁酶活力变化趋势较为相似,平均单宁酶活力为16.09 U和14.47 U,差异不显著(p>0.05)。整个研究阶段中,酶活力的动态变化现象,揭示出随着曲块发酵成熟的进行,大曲曲皮或曲心微生态环境条件的改变,导致产酶微生物类群或产酶优势微生物种属发生变化,以及衰老细胞的凋亡使原本在细胞内的酶被释放到大曲物料中的可能机制。
2.3 大曲木聚糖酶活力变化情况
在白酒酿制过程中,木聚糖酶能降解原料中的半纤维素,加速其它酶或微生物对原料的转化利用,从而提高发酵效率、增加出酒率[23-24]。在整个研究阶段内,大曲样品木聚糖酶活力结果如图3所示。

图3 大曲木聚糖酶活力分析Fig.3 Xylanase activities in Daqu
由图3可知,曲皮与曲心样品的木聚糖酶活力变化趋势具有一定相似性。其中,曲皮样品的木聚糖酶活力在曲块的发酵期间(图3A),逐级上升至P6时期达到最大值119.72 U,显著高于其它曲皮样品酶活力,较大曲成形时样品(P1)的酶活力提高了106.05 U。随着曲块入库成熟时间的延长,大曲曲皮样品木聚糖酶活力逐级下降,在使用时略有上升,最终酶活力值为99.85 U,较成熟阶段的最小值增加了31.61 U,但比养曲时期的最大活力降低了19.87 U。
曲心样品中木聚糖酶活力变化情况主要表现出逐级升高再迅速下降的规律。曲心样品木聚糖酶活力范围为13.67~80.51 U,最高活力也为养曲阶段的X6样品,进入曲库后的成熟期前期(X7),曲心样品酶活力并未如曲皮样品同一时期(P7)活力值出现下降的情况,而是大致保持着最高酶活力。随着成熟时间的进一步延长,曲心样品木聚糖酶活力急速下降,达到三个月成熟时间的最低值(47.09 U),较最高活力降低了41.51%。
2.4 大曲脂肪酶活力变化情况
在白酒制曲和发酵期间,脂肪酶参与脂肪类物质的水解,使白酒发酵过程中酵母等微生物能够较为充分地利用和转化原料,提高出酒率。此外,脂肪酶的酶促作用,还能提高酒体中有机酸和甘油的含量,对白酒口感的醇厚、丰满有较好的提升作用。大曲在整个发酵、成熟过程中脂肪酶活力变化趋势显示(图4),曲皮、曲心样品间变化规律差异明显,但总体趋势上呈现出初期低后期高的变化。曲皮各样品在整个考察时期内,脂肪酶酶活力呈现出先上升后下降再上升下降的波浪式动态变化。曲皮样品脂肪酶活力在曲块成形时(P1)只有75.31 U,随着曲块发酵的进行,酶活力迅速升高到起火时期(P3)达到一个小峰值(288.64 U);当曲块发酵进入大火期后,酶活力下降了104.05 U(P4),随后再次迅速升高达到曲皮样品的最大酶活力阶段(P6),较P1提高了7.29倍。随着大曲发酵进程的结束,进入成熟期的曲块脂肪酶活力,处于持续降低的阶段,到曲块成熟完成时,曲皮样品脂肪酶活力值仅为231.38 U。

图4 大曲脂肪酶活力分析Fig.4 Lipase activities in Daqu
与曲皮样品相比,曲心样品中脂肪酶活力在大曲发酵至成熟的整个过程中,发酵阶段的酶活力一直处于较为平稳的缓慢增长,至入库成熟的一个月时期达到极大值597.50 U(X7),比曲皮样品P6的最大活力高48.42 U。随着成熟期的延长,至成熟两个月(X8)时曲心样品脂肪酶活力急剧降低了221.26 U。随后,酶活力再次开始缓慢升高,至曲块使用时活力达到496.33 U,比曲心样品的最高酶活力降低了16.93%。
3 结论
大曲是大曲酒生产必不可少的起酵剂,其中功能各异的酶系是大曲酒品质和产量保障的重要基础。在大曲发酵和成熟过程中,不同的微生物在曲块中的竞争生长和优胜劣汰,并随着微生物生长和微环境条件的改变,造成了主要产酶微生物类群或产酶优势微生物的种属变化,使四种酶活力出现不同程度波动或升降的变化。
本研究主要针对大曲中α-淀粉酶、单宁酶、木聚糖酶和脂肪酶活力在大曲发酵、成熟过程中的变化情况进行测定分析。实验结果表明,在整个考察时间内:
a.曲皮样品中α-淀粉酶活力在发酵初期升高后,基本在523.28~765.78 U范围内波动,而曲心样品中该酶活力升降变化幅度大于曲皮样品。
b.单宁酶活力在曲皮和曲心样品间变化规律较为相似,都呈现出先迅速升高,在后火期达到最大值后再缓慢降低的变化情况。
c.曲皮样品的木聚糖酶活力变化情况为,持续上升至养曲阶段达到最大值119.72 U后逐渐下降;而曲心木聚糖酶活力在养曲和成熟初期活力最大。
d.脂肪酶活力变化趋势,曲皮样品与曲心样品之间差异较大,其中曲皮样品的酶活力是先升高再降低,然后出现再次升高降低的变化规律;而曲心样品的脂肪酶活力一直表现出持续升高至最大值后急剧下降,然后再次缓慢升高的变化情况。
分析曲皮和曲心样品最大酶活力出现阶段,为分离筛选特定功能酶产生菌提供了重要的借鉴,如筛选高产脂肪酶微生物的适宜时期主要集中在发酵后期至成熟前期阶段。本实验结果以及课题组同期进行的其它酶活力分析、相应产酶微生物多样性、大曲宏基因组分析等方向的研究,不但为特定功能加强型大曲的研制和功能酶制剂的开发提供参考,也将在一定程度上完善大曲微生物与功能酶系的关系打下基础,各种现象的可能性推测也为课题组对大曲的深入研究,提供了借鉴的思路。
[1]孙宝国,吴继红,黄明泉,等. 白酒风味化学研究进展[J]. 中国食品学报,2015,15(9):1-8.
[2]Jin G,Zhu Y,Xu Y. Mystery behind Chinese liquor fermentation[J]. Trends in Food Science & Technology,2017,63:18-28.
[3]李祖明,王德良,马美荣,等. 不同酒曲酶系与发酵性能的比较研究[J]. 酿酒科技,2010,187(1):17-22.
[4]张志刚,吴生文,陈飞. 大曲酶系在白酒生产中的研究现状及发展方向[J]. 中国酿造,2011,30(1):13-16.
[5]范文来,徐岩. 大曲酶系研究的回顾与展望[J]. 酿酒,2000,138(3):35-40.
[6]Zheng X-W,Tabrizi M R,Nout M J R,et al. Daqu-A Traditional Chinese Liquor Fermentation Starter[J]. Journal of the Institute of Brewing,2011,117(1):82-90.
[7]Wang H Y,Gao Y B,Fan Q W,et al. Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J]. Letters in Applied Microbiology,2011,53(2):134-140.
[8]鲁珍,余中华,李恩中. 酱香型高温大曲酶系的研究进展[J]. 食品安全导刊,2016,135(9):51-53.
[9]胡宝东,王晓丹,班世栋,等. 白酒大曲酶系研究进展[J]. 酿酒,2015,42(1):17-22.
[10]李祖明,王德良,马美荣,等. 不同酒曲酶系与发酵性能的比较研究[J]. 2010,187(1):17-22.
[11]鲁珍,魏姜勉,谌馥佳,等. 高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J]. 农业研究与应用,2016,(2):5-11.
[12]张强,黄丹. 大曲中酶蛋白提取条件研究[J]. 食品科技,2014,39(2):35-38.
[13]Doehlert D C,Duke S H,Anderson L.β-Amylases from alfalfa(MedicagosativaL.)roots[J]. Plant Physiology,1982,69(5):1096-1102.
[14]Prendecka M,Jaszek M,Grąz M,et al. Stimulation of the activity of a novel tannase produced in white rot fungi:Phellinus pini,Fomes fomentarius,and Tyromyces pubescens by medium supplementation[J]. Biotechnology & Applied Biochemistry,2015,7(1):148-149.
[15]保玉心,邱树毅,李秧针,等. 一种胞外单宁酶的活力检测方法[J]. 精细化工,2008,25(6):621-624.
[16]Sena L M,Morais C G,Lopes M R,et al. D-Xylose fermentation,xylitol production and xylanase activities by seven new species of Sugiyamaella[J]. Antonie Van Leeuwenhoek,2017,110(1):53-67.
[17]曾莹,钟晓凌,夏服宝. 木聚糖酶活力测定条件研究[J]. 生物技术,2003,13(5):21-22.
[18]Sreerama Y N,Takahashi Y,Yamaki K. Phenolic antioxidants in some Vigna species of legumes and their distinct inhibitory effects onα-glucosidase and pancreatic lipase activities[J]. Journal of Food Science,2012,77(9):C927-C933.
[19]江慧芳,王雅琴,刘春国. 三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程,2007,24(8):72-75.
[20]Sundarram A,Murthy T P K.α-Amylase production and applications:a review[J]. Journal of Applied & Environmental Microbiology,2014,2(4):166-175.
[21]谷军.α-淀粉酶的生产与应用[J]. 生物技术,1994,4(3):1-5.
[22]Cherita G K C,Appaiah K. Yeast as a potential candidate for tannase production:a review[J]. Current Biochemical Engineering,2016,3(2):82-88.
[23]Tenkanen M,Vršanská M,Siikaaho M,et al. Xylanase XYN IV from Trichoderma reesei showing exo-and endo-xylanase activity[J]. FEBS Journal,2012,280(1):285-301.
[24]岳晓禹,贺小营,牛天贵,等. 木聚糖酶的研究进展[J]. 酿酒科技,2007,154(4):113-115.
