发酵大豆豆粕水提物分离纯化ACE抑制活性小肽
2018-07-02崔云云王正全沈菊泉陈建康汪立平
崔云云,王正全,2,*,沈菊泉,陈建康,王 芳,杨 晗,刘 源,汪立平,*,谢 晶,4
(1.上海海洋大学食品学院,上海 201306; 2.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306; 3.上海市食品研究所,上海 200237; 4.上海水产品加工及贮藏工程技术研究中心,上海 201306)
大豆原产中国,古称菽,是全球特别是亚洲各国的主要粮食作物,因其富含植物蛋白和脂肪而被用于榨油和制作各种豆类制品,属于廉价易获得的优质蛋白质来源。其风味发酵制品豆豉源于汉朝,口味独特,近年更发现其含有诸多生物活性降解蛋白和肽,具有降低血压活性如ACE抑制[1-4]。另外,大豆蛋白主要包含大豆球蛋白glycinin和大豆伴球蛋白β-conglycinin,经水解、酶解、发酵后过滤、分离的小肽物质同样具有一定的血管活性或其他生物活性,如结合钙离子、调节免疫系统、脑功能、神经系统、平衡营养,甚至可以阻止肝、肺癌细胞克隆[5-7]。因此,大豆除食用外还用于调节人体内分泌和动物消化系统,甚至应用于儿童配方奶粉中[5-7]。其作用机理可能是钙离子聚集、心血管平滑肌胞内钙离子流出抑制、营养平衡、通过激活细胞通路来调节胆固醇代谢等[8-10]。
工业化生产大豆压榨油产生大量的废渣副产品豆粕,通常用作动物饲料,存在加工不完全、利用不彻底等浪费的问题。大豆粕本身就可以通过发酵和提取的方式直接再次利用其蛋白质,相关的分离提取ACE抑制活性小肽研究最多[11-13]。现在已知大豆粉和大豆豆粕发酵或水解产物中含有的降压活性小肽物质如LVNGS、HGK、VLIVP、EVG、MLP、IAVPGEVA、IAVPTGVA、LPYP、LVQGS、VLIVP、RPSYT等[2,7-9,14-15]。其制备多使用各种商业消化蛋白酶、枯草芽孢杆菌、豆豉曲等水解[1-3,9,11,12,16-20],而分离提取则常采用沉淀、过滤、超滤、纳滤、凝胶色谱、HPLC、大孔树脂吸附、脱盐等方式[16-18,21-23],尚有很多未知的活性物质未被发现。
因此,本研究在1965年Ferreira[24]和1971年Cushman[25]成功建立第一套ACE体外抑制的实验系统的基础上,结合Hyun[26]优化的HPLC检测改良方法,从大豆发酵水解超滤分离获得的组分开始逐步筛选ACE抑制活性最强的组分,并从该组分中逐步通过GFC初步分离,HPLC两轮分离纯化收集。利用PPSQ-21和MALDI-TOF-TOF/MS双重定性验证肽序列,再经多肽固相合成法(solid phase peptide synthesis,SPPS)合成足量小肽,分别验证其ACE抑制活性并比较。最后,筛选出的小肽的心血管体外实验活性也被测定。本研究寻找新的血管活性大豆小肽,并尝试阐释其可能的作用机理。
1 材料与方法
1.1 材料与仪器
二浸豆粕(粗蛋白质含量43%) 中粮集团;分析纯硼酸、硼砂、乙腈 上海安普科技公司;马尿酰组胺酰亮氨酸(HHL)、血管紧张素转化酶(ACE) Sigma公司;三氟乙酸(TFA) Merck公司;马尿酸、非极性DA201-C大孔树脂 江阴有机化工厂;NaCl和弗罗里硅土(60~100目) 国药集团提供;色谱纯甲醇、乙腈 Thermo-fisher公司;400目滤布、10000、1000、500Da滤膜 上海摩速科学器材有限公司;实验用水 Milli-Q提供;雄性8~11周龄的Sprague-Dawley(SD)大鼠 上海杰思捷实验动物有限公司;乙酰胆碱(acetylcholine,ACh)和苯肾上腺素盐酸(Phenylephrine,PE) 百灵威科技有限公司;本研究中使用的菌种 为实验室筛选于民间豆豉的枯草芽孢杆菌(Bacillussubtilis)。
HPLC(LC-20AT,搭载FRC-10A自动馏分收集系统)和蛋白测序仪PPSQ-21 日本Shimadzu公司;5800 MALDI-TOF-TOF/MS配有TOF/TOF Explorer和Data Explorer数据处理系统 美国AB SCIEX公司;实验用膜分离超滤纳滤反渗透装置(RE-2540型) 上海摩速科学器材有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;KQ-250E超声波清洗器、电热恒温水浴锅HHS型、SHB-Ⅲ循环水式多用真空泵 上海圣科有限公司;分析天平 Sartorius公司;ALC-M system Tissue-Organ bath体外组织浴系统 上海奥尔科特生物科技有限公司。
1.2 实验方法
1.2.1 原料处理 称取二浸豆粕4 kg于30 L的发酵罐中,加蒸馏水浸湿并搅拌均匀,高压蒸汽灭菌(121 ℃,30 min);接种10%菌悬液(取枯草芽孢杆菌管,在无菌操作条件下,用接种环挑取接种到适量的营养肉汤培养基中,30 ℃下振荡培养12 h),30 ℃,发酵72 h。发酵结束后振荡水浸提取1 h,后静止沉降,纱布过滤2遍除渣,得到发酵豆粕原液。
1.2.2 发酵豆粕原液ACE抑制肽的分离纯化
1.2.2.1 发酵液的超滤 发酵液依次加入活性炭、DA201-C大孔树脂吸附油脂、杂质颗粒并脱盐,后用400目滤袋过滤除去吸附剂,再加入弗罗里硅土结合板式过滤机过滤除掉活性炭和多余油脂,得到更澄清的发酵液。用截留分子量为10000、1000、500 Da 的超滤膜分级过滤发酵液,得到3个不同分子量的多肽混合液组分F1(1000~10000 Da)、F2(500~1000 Da)、F3(<500 Da),浓缩后在-20 ℃,高真空10 Pa下冷冻干燥48 h,干燥物用以验证各组分ACE抑制活性。
1.2.2.2 凝胶渗透色谱(GFC)法分离 将F3组分用Milli-Q水溶解制成浓溶液,用GFC进行分离并收集各洗脱峰组分。色谱条件:TSK-GEL G2000SWXL(φ7.8 mm×300 mm);流动相A,Milli-Q纯水(0.1%TFA);流动相B,乙腈(0.1% TFA)。梯度洗脱条件:0~10 min 5% B,10~15 min 5% B,15~20 min 10% B;流速,1 mL/min;柱温,30 ℃;波长,220 nm。
1.2.2.3 一次HPLC法分离 将经凝胶过滤色谱分离的组分用HPLC进行分离纯化,分别收集各洗脱峰组分,进行冷冻干燥备用。色谱条件:Cosmosil 5 C18-AR-Ⅱ(φ4.6 mm×250 mm,100A);梯度洗脱条件,0~5 min 2.5% B,5~18 min 80% B;流动相A、流动相B、流速、柱温、波长同1.2.2.2。
1.2.2.4 二次HPLC法再分离纯化 更换色谱柱为Cosmosil 5C18-MS-Ⅱ(φ4.6 mm×250 mm,100A),色谱条件和梯度洗脱条件同1.2.2.3。
1.2.2.5 大豆小肽的分子量测定及氨基酸序列分析 分别取2 μL的1000 mg/L最终分离纯品,直接采用MALDI-TOF-TOF/MS进行质谱分析。激光源为335 nm波长的Nd:YAG激光器,加速电压为20 kV,采用正离子模式和自动获取数据的模式采集数据。仪器先用myoglobin酶解肽段进行外标校正。基质和样品的质量扫描范围为100~1000 Da。得到的MS/MS谱图采用仪器软件DeNovo Explorer结合数据库比对进行测序。同时,目标小肽需经过PPSQ-21定性验证。
1.2.3 小肽固相合成 所有小肽使用标准固相肽合成法(SPPS),由Fmoc-citrulline-OH等试剂合成[9]。
1.2.4 ACE活性的测定 许多豆制品的ACE抑制活性测定使用紫外分光光度计快速检测,但由于前处理过程中的未挥发乙酸乙酯会干扰检测结果,而基于HPLC的检测方法准确而稳定[27-30]。因此,本研究使用改良方法测定小肽ACE抑制活性,在小试管中依次加入40 μL发酵酶解样品、40 μL ACE(25 mU/mL)溶液,放入37 ℃恒温水浴中保温5 min后加入50 μL的HHL溶液开始反应,37 ℃下反应60 min后加入200 μL 1.0 mol/L HCl中止反应,同时用40 μL pH=8.3的硼酸缓冲溶液替代发酵酶解液来制备反应液,作为空白对照组。反应液经过0.45 μmol/L滤膜过滤后上HPLC检测,通过定量马尿酸的生成量计算小肽的ACE抑制活性。
ACE活性抑制率计算公式为:
ACE活性抑制率(%)=(A1-A2/A1)×100
式(1)
式中,A1-未添加样品时的峰面积;A2-添加样品后的峰面积。
1.2.5 小鼠血管活性的测定 实验中使用SD大鼠,从腹主动脉放血致死后迅速取出胸主动脉,清除粘连的脂肪和结缔组织,剪切主动脉2~3 mm血管环,装于组织浴中的两根不锈钢丝之间。使血管环在37 ℃ PSS缓冲液中通入95% O2/5% CO2,平衡45 min。然后将环逐渐拉伸至1 g预加的张力,平衡30 min至稳定。通过配有MPA2000数据采集系统的张力传感器测量血管收缩反应(单位,g)。为验证主动脉环的生存活性,在肽诱导的血管舒张实验之前,需加入1.0 μmol/L PE和1 mmol/L ACh来检验血管收缩反应,以此作为活环的标准。每组实验以4 min时间间隔加入,以此记录小肽对血管的舒张作用。能够引起50%血管舒张效果(相较于血管最大收缩张力,g)的小肽的有效浓度,即小肽的血管舒张活性值EC50。
1.3 数据处理
用Microsoft Excel 2010和Origin 8.0软件进行处理数据及作图,统计学分析用SPSS 20.0软件进行未配对Student’st-test分析,实验结果以平均值±标准偏差表示,显著性差异水平为0.05。
2 结果与分析
2.1 超滤分离豆粕发酵组分及其ACE抑制活性
豆粕发酵酶解产物经超滤分离后得到3个肽组分(F1、F2、F3),它们的ACE抑制活性如图1所示。
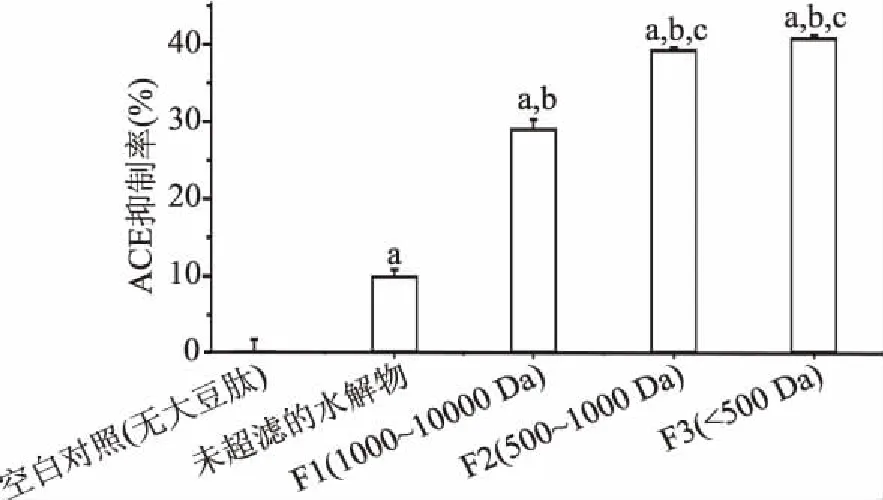
图1 不同分子量豆粕发酵液超滤组分的ACE抑制率(n=3)Fig.1 The ACE-inhibitory activity of different molecular weight ultrafiltrates of fermented soybean meal(n=3)注:小写字母不同代表差异显著(p<0.05)。
由图1可知,空白对照组未加发酵液,ACE抑制活性几乎为0,而F1、F2、F3组分均具有ACE抑制活性,与空白对照差异显著(p<0.05),且活性随着分子量的减小而增大,F2、F3组分无显著性差异(p>0.05)。其中,F3组分的ACE抑制活性相对最高,在浓度1 mg/mL时ACE抑制率为40.40%。这主要是因为F3组分含有更多2~6个氨基酸残基的小肽。因此,后续研究选择F3组分进行下一步分离纯化。类似的血管活性同样被记载于其他学者的研究中,如Chiang等[10]发现使用膜反应器获得的分离大豆蛋白水解物的1 kDa的组分ACE活性明显强于10 kDa和30 kDa组分及水解物原液,范远景等[25]也发现不论是使用中性蛋白酶、木瓜蛋白酶还是胰蛋白酶水解的大豆蛋白,小于1 kDa的组分的ACE抑制活性均远强于3 kDa和10 kDa及更大分子量组分。
2.2 GFC分离F3组分
本实验中用GFC分离豆粕发酵酶解产物F3组分,相比其他针对大豆蛋白水解物提取液等混合物的研究[1,10,25,33],找到关键起作用的活性物质并精准定性更加重要[2,13-14,18]。如图2(A)所示,大豆蛋白水解物提取液F3组分由单一混合物分离出三个主要组分P1、P2和P3,后续分离纯化以这三个GFC分离组分为主要研究对象。
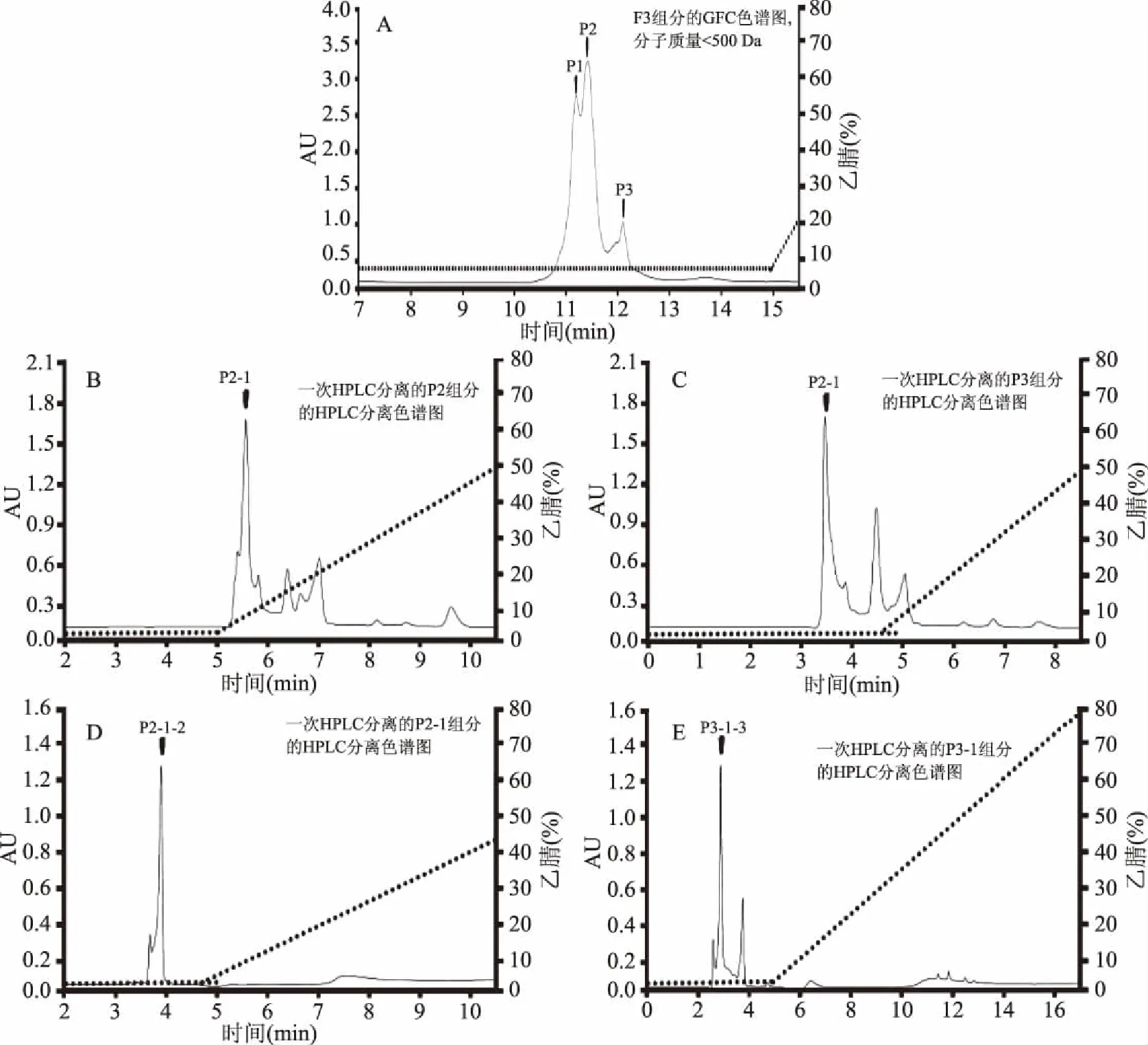
图2 大豆活性小肽分离纯化的GFC和HPLC色谱图Fig.2 GFC and HPLC chromatography of bioactive soybean small peptides during separation and purification
2.3 一次和二次HPLC分离P2、P3
用HPLC配合Cosmosil 5C18-AR-Ⅱ(φ4.6 mm×250 mm)色谱柱用于进一步分离P2见图2(B),P3见图2(C),由图知组分P2、P3又被分离出了多个物质,存在干扰物,收集主峰后再经二次HPLC继续分离纯化。更换色谱柱Cosmosil 5C18-MS-Ⅱ(φ4.6 mm×250 mm,100A)继续分离出P2-1见图2(D)和P3-1见图2(E),分别记为P2-1-2、P3-1-3。
2.4 MALDI-TOF-TOF/MS对组分P2-1-2、P3-1-3结构的解析
MAIDI-TOF-TOF/MS是目前蛋白质鉴定中精确测定分子质量的手段之一,特别适合对混合蛋白和多肽类物质的相对分子质量的测定,其灵敏度和分辨率较高。由图3显示,对组分P2-1-2、P3-1-3进行鉴定,肽序列分别为HAGR(His-Ala-Gly-Arg)和CGAAP(Cys-Gly-Ala-Ala-Pro)。相似技术也被应用于婴儿配方奶[7]和乳酸菌发酵的酸奶[32]中定性检测活性小肽成分。另外,PPSQ-21的序列分析结果确认了P2-1-2、P3-1-3确实是HAGR和CGAAP。
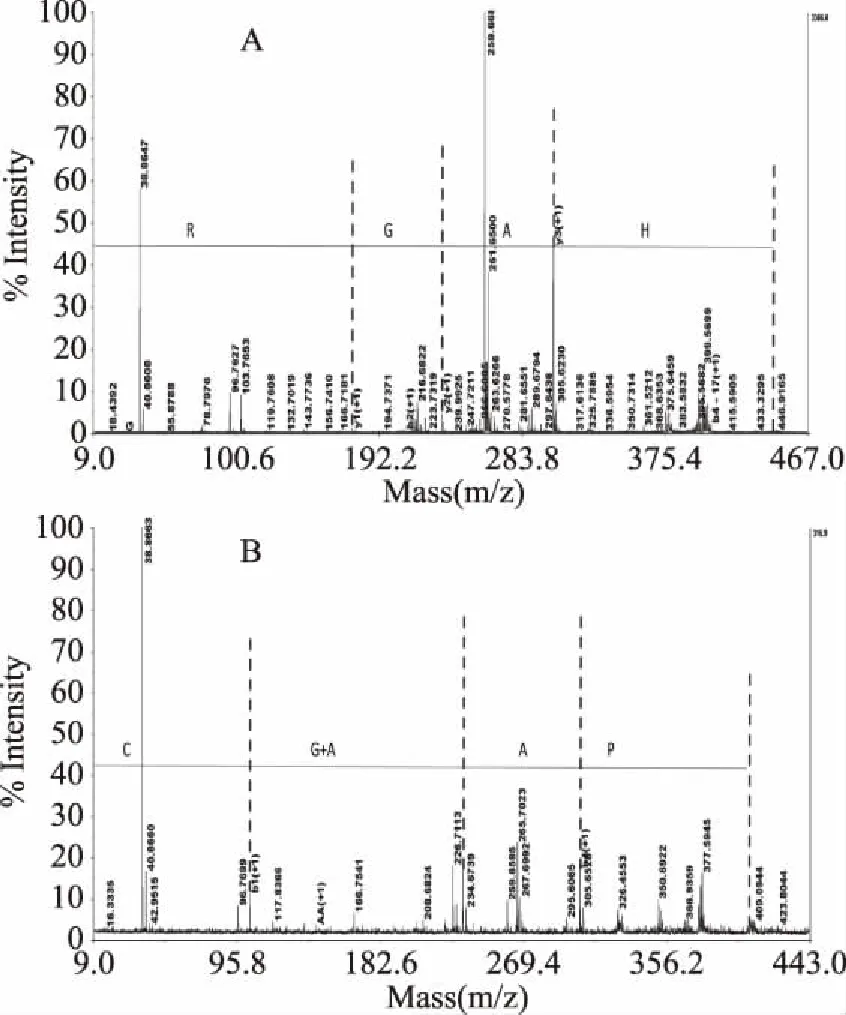
图3 MALDI-TOF-TOF/MS定性测定组分 P2-1-2、P3-1-3的肽序列谱图Fig.3 Peptide sequence profiles of components P2-1-2, P3-1-3 by MALDI-TOF-TOF/MS qualitative determination
2.5 小肽HAGR和CGAAP的ACE抑制活性鉴定
对于鉴定出肽序列的两个小肽HAGR和CGAAP,后续使用SPPS合成,相同浓度的合成肽(2 mg/mL)的ACE抑制活性被检测检定,如表1所示。由表1可知,HAGR的ACE抑制活性接近F3组分,但明显低于小肽CGAAP,而后者的ACE抑制率达到了77.79%,明显高于3个组分F1、F2、F3的ACE抑制活性。任锦等[7]也是研究合成肽的ACE抑制活性,主要是由于天然提取的活性小肽纯品量极少,仅足以定性判断结构,活性研究需要大量的小肽纯品,需要使用人工合成的方法获得高纯度的目标物。
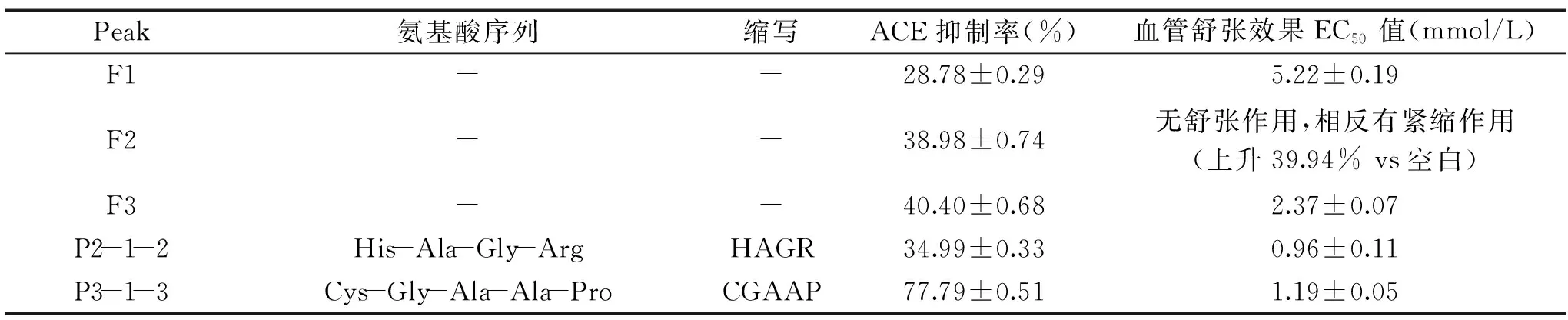
表1 大豆豆粕分离小肽的ACE抑制活性和血管活性汇总表(n=3)Table1 ACE inhibition activity and vasorelaxation activity of soybean meal isolated small peptides(n=3)
2.6 小肽HAGR和CGAAP的血管活性鉴定
如表1所示,发酵大豆豆粕膜过滤分离的3个组分F1、F2、F3的大鼠血管活性的检测结果显示,F1和F3可以引发不同程度的对1 μmol/L PE收缩过的大鼠主动脉心血管环的舒张作用,分子量范围是500 Da的F3组分的舒张血管活性最高,达到2.37 mmol/L。但是1000 Da的F2组分恰好展示了相反的趋势,不仅没有舒张血管,反而引起了血管收缩,收缩比例最高时达到39.94%。F3组分分离出的2个小肽的大鼠血管活性实验显示,HAGR和CGAAP对1 μmol/L PE收缩过的大鼠主动脉心血管环具有舒张作用,如图4所示,舒张效果强烈。另由表1可知,2个小肽的血管舒张活性都高于混合物组分F1和F3,但HAGR的血管活性(EC50=0.96 mmol/L)稍稍优于CGAAP的血管活性(EC50=1.19 mmol/L),同时,HAGR和CGAAP远强于F3组分的血管舒张活性。这一点与ACE抑制率并不完全一致,说明虽然所研究的发酵大豆豆粕提取物具有心血管活性,但其血管活性强度与ACE抑制活性并不直接相关,可能是活性机理不仅仅局限于ACE抑制这单一的一种机制,还有其他未阐明的机理共同作用下,显示为宏观上的具体差异。
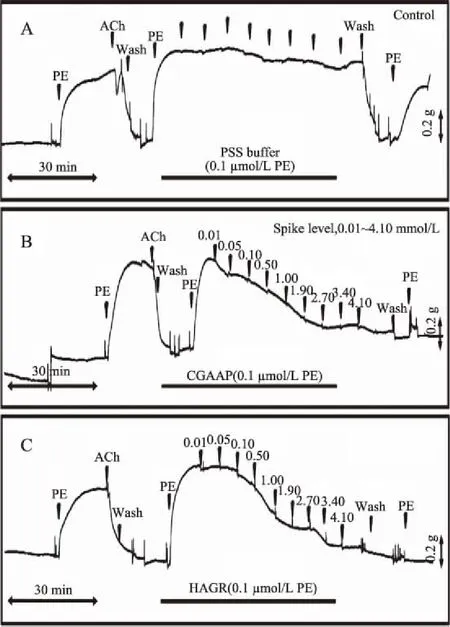
图4 CGAAP和HAGR对1 μmol/L PE收缩过的 大鼠主动脉心血管环的舒张作用Fig.4 Relaxaton of CGAAP and HAGR in 1 μmol/L phenyleohrine-contracted aorta ring
3 结论
豆粕发酵产物经超滤得到3个不同分子质量的组分F1、F2、F3,其中,ACE抑制活性随着分子质量的减小而增大,分子质量小于500 Da的F3组分显示了最高的ACE抑制活性,随后对F3组分进行GFC、HPLC的分离纯化,鉴定出两个小肽P2-1-2、P3-1-3的序列结构分别为HAGR和CGAAP,并对它们进行了ACE抑制活性和血管活性的分析,HAGR的ACE抑制活性明显低于小肽CGAAP的ACE抑制活性,而后者拥有77.79%的ACE抑制率。血管活性结果显示了不同的趋势,证实了豆粕发酵酶解分离的部分小肽具有血管活性,但与ACE抑制活性并不直接相关,还有其他活性机理等待后续研究。
[1]Zhang J H,Tatsumi E,Ding C H,et al. Angiotensin I-converting enzyme inhibitory peptides in douchi,a Chinese traditional fermented soybean product[J]. Food Chemistry,2006,98(3):551-557.
[2]Shinjoung R,Jisoo L,Yongil C,et al. Purification and identification of an angiotensin I-converting enzyme inhibitory peptide from fermented soybean extract[J]. Process Biochemistry,2009,44(4):490-493.
[3]Sanjukta S,Rai A K. Production of bioactive peptides during soybean fermentation and their potential health benefits[J]. Trends in Food Science & Technology,2016,50:1-10.
[4]Okamoto A,Hanagata H,Matsumoto E,et al. Angiotensin I converting enzyme inhibitory activities of various fermented foods[J]. Bioscience Biotechnology & Biochemistry,1995,59(6):1147-1149.
[5]Yimit D,Hoxur P,Amat N,et al. Effects of soybean peptide on immune function,brain function,and neurochemistry in healthy volunteers[J]. Nutrition,2012,28(2):154-159.
[6]Rayaprolu S J,Hettiarachchy N S,Chen P,et al. Peptides derived from high oleic acid soybean meals inhibit colon,liver and lung cancer cell growth[J]. Food Research International,2013,50(1):282-288.
[7]Puchalska P,Concepción G M,Luisa M M. Identification of native angiotensin-I converting enzyme inhibitory peptides in commercial soybean based infant formulas using HPLC-Q-ToF-MS[J]. Food Chemistry,2014,157(11):62-69.
[8]Liu H,Lv Y,Xu J,et al. Soybean peptide aggregates improved calcium binding capacity[J]. LWT-Food Science and Technology,2016,67(ISSN):174-180.
[9]Thanutchaporn K,Zheng-Quan W,Shinya M,et al. Identification of peptides from soybean protein,glycinin,possessing suppression of intracellular Ca2+concentration in vascular smooth muscle cells[J]. Food Chemistry,2014,152(152):218-224.
[10]Lammi C,Zanoni C,Arnoldi A. IAVPGEVA,IAVPTGVA,and LPYP,three peptides from soy glycinin,modulate cholesterol metabolism in HepG2 cells through the activation of the LDLR-SREBP2 pathway[J]. Journal of Functional Foods,2015,14:469-478.
[11]温雪琴,刘屾,黄弢,等. 大豆粕碱性蛋白酶水解肽及ACE抑制活性的研究[J]. 食品研究与开发,2014(9):9-12.
[12]田中原,王亚萍,刘屾,等. 碱性蛋白酶水解豆粕制备ACE抑制肽水解条件的优化[J]. 天津师范大学学报:自然版,2016,36(3):64-68.
[13]李庆波,刁静静,井雪莲,等. 绿豆渣ACE抑制肽的纯化鉴定及构效关系初探[J]. 农产品加工:学刊,2014(21):5-9.
[14]Puchalska P,García M C,Marina M L. Development of a capillary high performance liquid chromatography-ion trap-mass spectrometry method for the determination of VLIVP antihypertensive peptide in soybean crops[J]. Journal of Chromatography A,2014,1338(7):85-91.
[15]Kuroda M,Kato Y,Yamazaki J,et al. Determination and quantification of the kokumi peptide,γ-glutamyl-valyl-glycine,in commercial soy sauces[J]. Food Chemistry,2013,141(2):823.
[16]张雁平. 采用发酵法工业化生产大豆蛋白活性肽[J]. 大豆科技,2003(3):26-27.
[17]王喜波,迟玉杰,孙波. 大豆分离蛋白ACE活性抑制肽的研究[J]. 中国粮油学报,2009,24(11):33-37.
[18]刘健敏,钟芳,麻建国. 大豆生理活性肽的研究(Ⅱ)-抗氧化性和ACE抑制活性的初步研究[J]. 食品与生物技术学报,2004,23(4):50-55.
[19]Coscueta E R,Amorim M M,Voss G B,et al. Bioactive properties of peptides obtained from Argentinian defatted soy flour protein by Corolase PP hydrolysis ☆[J]. Food Chemistry,2016,198:36-44.
[20]李风娟,刘婉璐,方元元,等. 枯草芽孢杆菌发酵大豆过程中水提物的ACE抑制活性的变化[J]. 天津科技大学学报,2015(3):24-28.
[21]Chiang W D,Tsou M J,Tsai Z Y,et al. Angiotensin I-converting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J]. Food Chemistry,2006,98(4):725-732.
[22]富校轶,高永欣,张佰荣,等. 大豆肽的制备、提取与结构鉴定研究进展[J]. 吉林医药学院学报,2014,35(1):51-54.
[23]范远景,姬莹莹,张焱. 大豆蛋白酶解肽的分子量分布及抑制ACE活性关系研究[J]. 食品科学,2007,28(10):57-61.
[24]Ferreira S H. A Bradykinin-potentiating factor(bpf)present in the venom of bothrops jararca[J]. British Journal of Pharmacology,1965,24(1):163.
[25]Cushman D W,Cheung H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J].Biochemical Pharmacology,1971,20(7):1637-1648.
[26]Hyun C K,Shin H K. Utilization of bovine blood plasma proteins for the production of angiotensin I converting enzyme inhibitory peptides[J]. Process Biochemistry,2000,36(1-2):65-71.
[27]李笑梅. 具有抑制ACE活性的豆酱发酵条件研究[J]. 食品工业科技,2010(9):153-154.
[28]于胜男,吴非. 制备大豆降血压肽最佳用酶的筛选[J]. 食品工业科技,2010(5):199-201.
[29]王建国,闫冰雨,雷楗勇,等. 合成二肽ACE抑制活性及抗高血压初步研究[J]. 食品工业科技,2016,37(4):160-164.
[30]杭梅,赵新淮. 毛豆腐的毛霉发酵与其提取物的体外ACE抑制活性[J]. 食品工业科技,2011(11):187-190.
[31]Yust M M,Pedroche J,Gironcalle J,et al. Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J]. Food Chemistry,2003,81(3):363-369.
[32]Gobbetti M,Ferranti P,Smacchi E,et al. Production of angiotensin-I-converting-enzyme-inhibitory peptides in fermented milks started byLactobacillusdelbrueckiisubsp. bulgaricus SS1 andLactococcuslactissubsp. cremoris FT4[J]. Applied & Environmental Microbiology,2000,66(9):3898.
