超声波对肌原纤维蛋白理化和质构特性的影响
2018-07-02王静宇杨玉玲魏苏萌
王静宇,杨玉玲,周 磊,张 兴,魏苏萌
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心, 江苏高校粮油质量安全控制及深加工重点实验室,江苏南京 210023)
超声波作为一种快速、高效并且可靠的新兴技术,已经在食品加工行业得到广泛的应用[1-2]。它是指频率超过人类的听觉范围的一种弹性的机械振荡,其频率通常为20~1000 kHz。根据超声波的频率以及所产生的能量大小,可以将其分为低频率高场强(频率为20~100 kHz,场强为10~1000 W/cm2)和高频率低场强(频率为100~1000 KHz,场强<1 W/cm2)两种类型[3]。由于前者的能量较大,在食品工业中通常用此频率来改善物料的理化特性[4],同时超声波还可用于改变蛋白质的结构[5]。
鸡肉是非常受消费者欢迎的一种原料肉,鸡胸肉的脂肪含量较低而且具有较高的营养价值,是良好的动物蛋白质来源[6]。而肌原纤维蛋白(myofibrillar proteins,MP)是鸡胸肉中的主要蛋白质,约占其总蛋白含量的40%~60%[7]。质构特性又是MP热诱导凝胶的重要的功能特性之一。有文献表明,超声处理能够提高其凝胶的硬度[8]。Zisu等[9]的研究表明采用超声探头(20 kHz,4000 W)能够降低乳清蛋白和酪蛋白的粘性,并增加其凝胶性。Jambrak等[10]指出超声能够增加大豆分离蛋白的表面疏水性。同时超声波处理后的大豆分离蛋白的二硫键和表面疏水性也都有增加[11]。Gulseren等[12]研究表明超声能够显著提高乳清蛋白的溶解性并将其流变性改为剪切稀化流体。Jiang等[13]通过对黑豆蛋白经过高场强的超声波处理,发现对其粒径和静电斥力的影响结果相反。
目前,国内外尚未见超声波对MP的理化与质构特性共同影响的报道,因此研究超声波对MP理化与质构特性之间的影响,不仅为超声波提高肉制品品质具有重要意义,而且还在肌肉肉糜凝胶制品中的应用提供技术参数和理论依据。
本文通过不同超声功率0、100、200、300、400和500 W处理MP,然后测定其电位、粒径、表面疏水性、溶解度、流变特性以及凝胶的硬度和微观结构,探讨不同超声功率对MP理化和质构特性影响的关系。
1 材料与方法
1.1 材料与仪器
爱拨益加鸡(Arbor Acres,AA) 30只,其中公鸡和母鸡各15只,屠宰后取鸡胸肉,于-18 ℃下储存,一个月内使用,购于南京青龙山养鸡场;牛血清蛋白(Bovine Serum Albumin,BSA) 国药集团化学试剂有限公司,其他化学试剂 均为分析纯。
JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Avanti J-26XP高效冷冻离心机 美国Beckman Coulter公司;DS-1高速组织捣碎机 上海标本模型厂;F-7000 型荧光分光光度仪、U-3900紫外分光光度仪、日本TM 3000扫描电子显微镜 日本日立公司;Zeta 电位分析仪[Zetasizer Nano ZS90] 英国马尔文公司;Anton Paar MCR302流变仪 奥地利安东帕有限公司;TA-XT plus质构分析仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 鸡胸肉于4 ℃下解冻20 min,剔除结缔组织和脂肪,切碎后称取40 g,加入8倍分离缓冲液(0.1 mol/L KCl,2 mmol/L MgCl2,1 mmol/L EGTA,0.5 mmol/L DTT,10 mmol/L K2HPO4,pH7.0),冰浴,10000 r/min条件分散10 s,间隔10 s,分散3次,在2000×g条件下离心20 min,弃上清,取沉淀,重复该步骤共3次。加入8倍分离缓冲液(0.1 mol/L NaCl,pH6.0,含1 mmol/L NaN3),10000 r/min条件分散10 s,分散1次后,用一层干燥洁净的纱布过滤,2000×g条件下离心20 min,弃上清,取沉淀,重复该步骤3次,得到提纯的MP沉淀。蛋白浓度的测定采用双缩脲方法,具体参考杨玉玲等[14],4 ℃下保存。
1.2.2 MP的超声波处理以及凝胶的制备 处理方法参照Wang等[15],且稍做改动,将MP用磷酸盐缓冲液(10 mmol/L KH2PO4,0.6 mol/L KCl,pH6.0)溶解,稀释至质量浓度30 mg/mL的MP溶液,取20 mL该溶液于50 mL离心管中,并将其放在装有碎冰的烧杯中,一起置于超声波细胞破碎仪中(超声探头为频率20 kHz,直径6 mm的钛金属探头),设置超声功率为0、100、200、300、400、500 W(工作时间和间歇时间分别为1 s和3 s),超声时间设为6 min,加碎冰控制样品温度为4~8 ℃,处理后的样品于0~4 ℃冰箱内储存备用。将不同超声功率处理后的蛋白溶液配制成浓度为5 mg/mL和0.5 mg/mL,前者用于溶解度的测定,后者用于粒径、Zeta电位和表面疏水性的测定。将超声处理后的蛋白样品(30 mg/mL)置于水浴锅中从20℃程序升温至65 ℃(1 ℃/min)制成凝胶,保温20 min,取出,冷却至室温,凝胶在4 ℃下保存9~16 h,制备的MP凝胶用于质构特性和微观结构的测定。
1.2.3 粒径的测定 将超声波处理后的MP样品缓慢加入Malvern动态光散射粒度仪中,达到测试范围,进行测试[16],每次测定最终粒径分布都为连续3次测试的平均值。
1.2.4 表面疏水作用测定 测定方法参照Wang等[15],将超声波处理后的MP样品,稀释到一系列浓度(0.5、0.25、0.125、0.0625 mg/mL)。每个浓度取2 mL,分别加入10 μL缓冲液(8 mmol/L ANS、0.1 mol/L KH2PO4,pH6.0),混匀,黑暗中静置20 min后用于测定表面疏水性。荧光分光光度计的激发波长为374 nm,发射波长为485 nm。以荧光强度对蛋白浓度作曲线,曲线初始阶段的斜率即为蛋白质的表面疏水性指标(S0-ANS)。
1.2.5 溶解度的测定 取超声波处理后的MP样品于7 mL离心管中,于4 ℃下10000×g离心10 min,立即取上清液1 mL,并加入4 mL双缩脲试剂,混匀,于室温处静置30 min,540 nm下测定吸光度,重复3 次。空白对照为1 mL(0.6 mol/L KCl)和4 mL双缩脲试剂的混合液。蛋白质的溶解度表示为上清液蛋白质量浓度与总蛋白质量浓度的百分比[17]。
1.2.6 Zeta电位的测试 测定方法参照张兴等[16],将MP样品注入Zeta电位皿后,加塞,进行电位测试。测试参数:散射角:90°,平衡时间:60 s,测试温度:25 ℃。
1.2.7 动态流变的测定 将不同功率超声处理后的蛋白溶液,配制成浓度为30 mg/mL的样品用于流变特性的测定。动态流变的测定条件:直径50 mm平行板,狭缝0.5 mm,应变2%,频率0.1 Hz。升温速率1 ℃/min,升温范围20~80 ℃。
1.2.8 微观结构的测定 MP凝胶的微观结构用扫描电镜(scanning electron microscopy,SEM)测定,将制备的凝胶切成5 mm厚的小块,用3%的戊二醛固定2 h,之后用缓冲液(0.1 mol/L KH2PO4,pH6.0)清洗1 h,再进行不同梯度的乙醇脱水(50%、70%、90%、95%、100%),每次30 min,再用叔丁醇置换3次,-20 ℃预冻2 d,-70 ℃冷冻干燥72 h,喷金镀膜后用SEM观察微观结构,加速电压15 kV。
1.2.9 质构特性的测定 方法参考杨玉玲等[14],MP凝胶的硬度采用质构仪的TPA(Texture profile analyse,TPA)法测定。参数设置如下:选用P/6探头,测试前速度5 mm/s,测试中速度1 mm/s,测试后速度5 mm/s,探头深入距离为5 mm。每个样品共3个重复。
1.2.10 统计分析 每个实验三次重复。用SPSS 17.0软件进行相关性分析和方差分析,如果方差分析效应显著,使用Duncan multiple range test进行多重比较(p<0.05)。
2 结果与分析
2.1 超声波处理对MP粒径的影响
如图1所示,超声处理后,MP的平均粒径整体显著降低。经超声波处理,MP的平均粒径从1914.67 nm(0 W)显著降低到980.7 nm(100 W)(p<0.05),而后随着超声功率的增加又缓慢降低至624.5 nm(500 W)(p<0.05)。粒径变化主要由蛋白分子内的交联和聚集引起的[18]。粒径刚开始显著降低的原因可能是由于超声引起的空穴效应以及微束流效应产生的物理作用打断了MP之间的非共价键作用。而后随着功率的增加,粒径变化相对100 W时变化慢,可能是由于MP分子已经打开,分子间的相互作用相对变弱。Hu等[19]指出超声波能够降低大豆分离蛋白的粒径。

图1 超声波处理对MP粒径的影响Fig.1 Effect of ultrasound treatment on particle size of MP注:不同小写字母表示处理间 差异显著(p<0.05);图2~图7同。
2.2 超声波处理对MP表面疏水作用的影响
表面疏水性反映的是蛋白表面疏水集团数量以及溶剂质量的一个指标。如图2所示,随着超声功率的增加,MP的表面疏水性从398.63(0 W)显著增加到772.29(500 W)(p<0.05)。这表明在超声之前,很多疏水集团都包埋在蛋白分子或者聚合物内部,由于超声波的空穴效应和微流束作用,能够使这些集团暴露出来,这样ANS就很容易与原本埋藏在分子内部的疏水集团结合,从而MP的表面疏水性增加。Chen等[20]有相似的报道,超声处理后蛋白的表面疏水性显著增加。

图2 超声波处理对MP表面疏水性影响Fig.2 Effect of ultrasound treatment on surface hydrophobicity of MP
2.3 超声波处理对MP溶解度的影响
溶解度是蛋白质功能性质之一,可以作为衡量蛋白质变性和聚集的一种方法。MP经超声波处理后其溶解度的变化如图3所示,随着超声功率的增强,溶解度先从8.15%(0 W)增加到12.45%(300 W)(p<0.05),而后急剧增加到15.04%(400 W)(p<0.05),最后缓慢增加到15.50%(500 W)(p>0.05)。超声处理后平均粒径的降低导致其溶解度的增加(图3);而高强度的超声波可能使不溶性蛋白增多,从而使蛋白溶解度增加缓慢。Maity等[21]提出超声波的空穴效应产生的涡旋、湍流、剪切力和高压部分打断了分子间疏水相互作用,使蛋白质的溶解度提高;Wang等[15]发现低强度的超声波能够使鸡肉中的肌原纤维蛋白的溶解度增强。
2.4 超声波处理对MP Zeta电位的影响
Zeta电位是带电颗粒表面剪切层的电位,是表征胶体体系稳定性的重要指标,用于描述胶体颗粒之间的静电相互作用[22-23]。如图4所示,MP的电位全是负值,说明蛋白表面负电荷要比正电荷多,净电荷为负电荷。不同功率的超声处理MP的Zeta电位绝对值逐渐增大,表明蛋白质所带负电荷逐渐增加,蛋白质展开程度增加。MP的Zeta电位绝对值在100 W内,没有显著变化(p>0.05),然而随着超声功率的增加,Zeta电位绝对值先从5.43 mV(100 W)显著增加到7.40 mV(500 W)(p<0.05)。蛋白分子表面的电荷主要取决于其状态:分散或者聚集[24]。因此,Zeta电位绝对值增加的原因可能是超声破坏了蛋白分子的聚集,使得蛋白表面电荷暴露出来,负电荷增多。

图4 超声波处理对MP Zeta电位的影响Fig.4 Effect of ultrasound treatment on zeta potential of MP
2.5 超声波处理对MP动态流变的影响
研究动态流变主要用于在不破坏蛋白结构的情况下测定凝胶形成的过程[25]。而流变的温度扫描可以较好地说明蛋白在加热形成凝胶过程中蛋白的物理变化。流变参数储能模量(G′)和损耗模量(G″)分别反映流体的弹性和粘性大小。如图5A所示,G′值从初始温度升至48 ℃,这个过程表明弹性蛋白凝胶网络的形成,是由于温度增加促使肌原纤维蛋白分子打开。超过48 ℃之后G′值显著降低,这是因为随着温度进一步增加,肌球蛋白尾部开始解螺旋,从而蛋白的流动性增强,导致G′值突然降低[26]。而温度在48 ℃时,且与空白对照,当超声功率为200 W时,G′值最大(681.2 Pa),而只有超声功率为500 W(400.2 Pa)时,G′值低于空白组(448.6 Pa)。当温度超过53 ℃以后,G′值又快速增加,这是因为其是形成永久的凝胶网络结构的温度点,而超声处理200 W的G′值依然高于其他超声处理的(包括未超声处理的),可能是由于此时引力和斥力在最高水平上达到平衡,因此能形成更好的弹性凝胶。图5B中G″的流变趋势与G′相似,也说明了中强度的超声处理MP(200 W),流变特性最佳。

图5 超声波处理对MP G′(A)和G″(B)的影响Fig.5 Effect of ultrasound treatment on storage modulus(A)and loss modulus(B)of MP
2.6 超声波处理对MP微观结构的影响
超声波处理后的MP凝胶空间结构与未处理的样品相比,结构变得更加致密均匀,网孔更小(图6)。经过超声100 W处理后,网络凝胶结构变化很多,较未处理的凝胶相比,网孔变小,已经形成较好的凝胶。200 W处理后的凝胶网络细腻,孔径小且分布均匀,呈现蜂窝状胶束,蛋白分子间的相互作用达到较好的平衡。当超声时间达到300 W及以上时,静电斥力与疏水相互作用之间的平衡遭到破坏,致使其均匀的凝胶结构遭到破坏,凝胶网孔变大,且不均匀,蛋白质凝胶网络结构变得粗糙。

图6 超声波处理对MP凝胶微观 结构的影响(电镜照片2000×)Fig.6 Effect of ultrasound treatment on microstructure(SEM micrographs at 2000×)of MP gel
2.7 超声波处理对MP质构的影响
质构特性是反映MP凝胶结构稳定性的重要参数。如图7所示,随着超声功率的增加,MP凝胶的硬度从30.10 g(0 W)快速升至51.40 g(200 W),而后逐渐降至49.40 g(500 W)(p<0.05),这表明低强度超声波处理(0~200 W)可以显著增强凝胶的硬度(p<0.05),可能是由于低强度的超声能使MP分子打开,内部的疏水集团暴露出来(图2),当加热成凝胶时,暴露出的疏水集团使得蛋白质分子间的距离缩短,从而增加了蛋白质之间凝集的机会,凝胶中交联结合的更加紧密从而增强了凝胶的硬度。另外,图5中流变特性在200 W时也是最好的。而超声处理200 W后,凝胶网络孔洞更小且更加致密,有利于增强凝胶的硬度(图6)。Zhao等[27]也得出了相似的结论,低强度的超声波能够使蛋白的硬度增加。当超声功率 ≥200 W,反而会降低凝胶的硬度,这可能是因为超声波的空穴效应以及微束流能够破坏蛋白分子间的作用力,分子间的交联结构遭到破坏,凝胶网络孔径变得粗大(图6)。由此可知,超声功率为200 W时,MP凝胶强度最强。
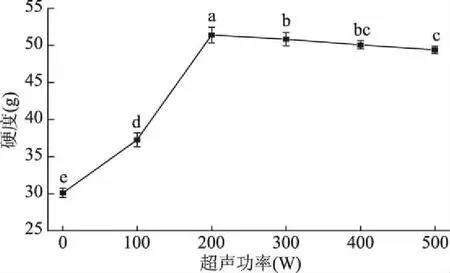
图7 超声波处理对MP凝胶硬度的影响Fig.7 Effect of ultrasound treatment on hardness of MP gel
2.8 相关性分析
由表1可知,超声波功率与MP的理化特性(溶解度,电位,表面疏水性)极显著相关(p<0.01),与粒径显著相关(p<0.05),和硬度相关性不大(p>0.05),因此超声波对MP的理化特性有显著的影响;而MP凝胶硬度与电位不太相关(p>0.05),与粒径显著负相关,与溶解度和表面疏水性显著正相关(p<0.05),相关系数分别为-0.890,0.814和0.813。超声波处理降低了蛋白粒径,导致凝胶结构改变,最终影响了凝胶的性质,Madadlou等[28]指出对蛋白粒径的减少后,再重新聚合可以使其结合更紧密,空间结构更稳定,凝胶强度更强。与溶解度相关可能也是因为粒径的改变。疏水相互作用是影响凝胶强度的作用力之一,而静电斥力却不是。

表1 超声波与MP理化特性以及凝胶强度之间的相关性Table 1 Correlation of ultrasound,physicochemical property of MP and strengh of MP gel
3 结论
超声波能够显著影响MP的理化特性(粒径、溶解度、Zeta电位和表面疏水性)与流变特性。低场强的超声波处理(0~200 W)促进肌原纤维蛋白适度展开,显著降低MP的粒径,提高其溶解度,疏水相互作用以及静电斥力,改变其流变特性并使硬度逐渐增加。在超声功率200 W时,蛋白分子进一步打开,此时大部分MP分子都还处于天然状态,当加热成胶时,MP展开的速度比聚集的速度快,此时其引力和斥力在最高水平上达到平衡,致使凝胶的网状结构更加均匀、致密,凝胶硬度最大。而高强度超声波处理后(300~500 W),G′、G″值和凝胶硬度都相对降低。
[1]Chandrapala J,Oliver C,Kentish S,et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry,2012,19(5):975-983.
[2]Jambrak A R,Lelas V,Mason T J,et al. Physical properties of ultrasound treated soy proteins[J]. Journal of Food Engineering,2009,93(4):386-393.
[3]Soria A C,Villamiel M. Effect of ultrasound on the technological properties and bioactivity of food:A review[J]. Trends in Food Science & Technology,2010,21(7):323-331.
[4]Kang D C,Zou Y H,Cheng Y P,et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J]. Ultrasonics Sonochemistry,2016,33:47-53.
[5]Mu L X,Zhao M M,Yang B,et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. Journal of Agricultural and Food Chemistry,2010,58(7):4494-4499.
[6]Choi Y S,Kim H W,Hwang K E,et al. Effects of gamma irradiation on physicochemical properties of heat-induced gel prepared with chicken salt-soluble proteins[J]. Radiation Physics and Chemistry,2015,106(1):16-20.
[7]韩敏义,刘永安,王鹏,等. 低场核磁共振法研究NaCl对肌原纤维蛋白凝胶水分分布和移动性的影响[J]. 食品科学,2014,35(21):88-93.
[8]Madalou A,Eman-djomeh Z,Mousavi M E,et al. Acid-induced gelation behavior of sonicated casein solutions[J]. Ultrasonics Sonochemistry,2010,17(1):153-158.
[9]Zisu B,Bhaskaracharya R,Kentish S,et al. Ultrasonic processing of dairy systems in large scale reactors[J]. Ultrasonics Sonochemistry,2010,17(6):1075-1081.
[10]Jambrak A R,Mason T J,Lelas V,et al. Effect of ultrasound treatment on particle size and molecular weight of whey proteins[J]. Journal of Food Engineering,2014,121:15-23.
[11]Hu H,Wu J H,Eunice C Y,et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI)dispersions[J]. Food Hydrocolloids,2013,30(2):647-655.
[12]Gulseren,Guzey D,Bruce B D,et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry,2007,14(2):173-183.
[13]Jiang L Z,Wang J,Li Y,et al. Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International,2014,62:595-601.
[14]杨玉玲,游远,彭晓蓓,等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学,2014,47(10):2013-2020.
[15]Wang J Y,Yang Y L,Tang X Z,et al. Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein[J]. Ultrasonics Sonochemistry,2017,38:225-233.
[16]张兴,杨玉玲,马云,等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学,2017,50(3):564-573.
[17]Samoto M,Maebuchi M,Miyazaki C,et al. Abundant proteins associated with lecithin in soy protein isolate[J]. Food Chemistry,2007,102(1):317-322.
[18]Promeyrat A,Gatellier P,Lebret B,et al. Evaluation of protein aggregation in cooked meat[J]. Food Chemistry,2010,121(2):412-417.
[19]Hu H,Fan X,Zhou Z,et al. Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre-treatments[J]. Ultrasonics Sonochemistry,2013,20(1):187-195.
[20]Chen L,Chen J,Ren J,et al,Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2600-2609.
[21]Maity I,Rasale D B,Das A K. Sonication induced peptide-appended bolaaMPhiphile hydrogels for in situ generation and catalytic activity of Pt nanoparticles[J]. Soft Matter,2012,8(19):5301-5308.
[22]Hunter R J. Zeta potential in colloid science:Principles and applications[M]. Academic press,2013.
[23]Runkana V,Somasundaran P,Kapur P C. Mathematical modeling of polymer-induced flocculation by charge neutralization[J]. Journal of Colloid and Interface Science,2004,270(2):347-358.
[24]Song X,Zhou C,Fu F,et al. Effect of high-pressure homogenization on particle size and film properties of soy protein isolate[J]. Industrial Crops and Products,2013,43:538-544.
[25]Egelandsdal B,Fretheim K,Samejima K. Dynamic rheological measurements on heat-induced myosin gels:Effect of ionic strength,protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture,1986,37(9):915-926.
[26]Sano T,Noguchi S F,Tsuchiya T,et al. Dynamic viscoelastic behavior of natural actomyosin and myosin during thermal gelation[J]. Journal of Food Science,1988,53(3):924-928.
[27]Zhao Y Y,Wang P,Zou Y F,et al. Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J]. Food Research International,2014,58:98-104.
[28]Madadlou A,Emam-Djomeh Z,Mousavi M E,et al. Acid-induced gelation behavior of sonicated casein solutions[J]. Ultrasonics Sonochemistry,2010,17(1):153-158.
