牦牛血胰蛋白酶水解液中抗菌肽的筛选研究
2018-07-02唐善虎李思宁
郝 刚,唐善虎,李思宁
(西南民族大学生命科学与技术学院,四川成都 610041)
寻求新型抗菌剂是解决目前日趋严重的细菌耐药性的一种途径。抗菌肽又称抗微生物肽(antimicrobial peptides)或肽抗生素(peptide antibiotics),是生物体内源性具有强抗菌作用的多肽,是生物先天免疫的重要组成部分[1-2]。自上世纪七十年代瑞典科学家Boman等[3]在天蚕血淋巴中首次发现抗菌肽以来,抗菌肽一直是生命科学研究的热点之一。国内外研究者相继在两栖动物、昆虫、鱼类、哺乳动物等各种生物中发现了大量的抗菌肽[4-6]。
现已从动物血红蛋白中分离出了具有抗菌活性的肽类,并对其生理功能进行了分析。张艳梅等从猪血中提取的抗菌肽不仅对供试细菌的形态结构有明显的损伤作用,同时还影响细菌的生长繁殖[7]。张庆华等从牛血中分离的血红蛋白抗菌肽对大肠埃希氏菌、金黄色葡萄球菌和白色念珠菌的MIC分别为0.5、1.0、0.25 mg/mL[8]。抗菌肽P3是从牛血红蛋白α亚基分离出来的一种广谱抗菌肽,对大肠杆菌、金黄色葡萄球菌和白色念珠菌均有一定的抑制活性[9]。
牦牛主要分布在我国青藏高原3000 m以上的高寒地带,牦牛血液红细胞中含有高达9%以上的血红蛋白[10-11]。目前,对牦牛血的研究报道主要集中在提取超氧化物歧化酶、血红素、免疫球蛋白等[12],关于牦牛血红蛋白抗菌肽分离纯化的研究未见报道。研究指出,利用抗菌肽与细菌细胞之间的吸附结合性质,将经过细菌细胞吸附后的样品与吸附前样品组分进行对比,能够快速准确的定位抗菌肽组分,提高分离效率[13]。本研究以牦牛血的胰蛋白酶水解液为原料,经胰蛋白酶酶解,利用抗菌肽与大肠杆菌细胞的吸附结合特性,用Sephadex G-15凝胶色谱和C18反相高效液相色谱(RP-HPLC)分离纯化新型抗菌肽,并检测新抗菌肽的抑菌活性,为抗菌肽这类含量较少的生物活性物质的利用提供参考。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichcoli)ATCC 25922、绿脓杆菌(Bacteriumpyocyaneum)ATCC 27553、鼠伤寒沙门氏菌(Salmonellatyphimurium)50013、痢疾志贺氏菌(Shigelladysenteriae)51302、金黄色葡萄球菌(Staphylococcusaureus)6538、枯草芽孢杆菌(Bacillussubtilis)9372、单胞李斯特菌(Listeriamonocytogene)54002、溶血链球菌(Streptococcushemolyticus)、变形链球菌(Streptococcusmutans)、肺炎链球菌(Streptococcuspneumoniae)ATCC 49619、恶臭假单胞菌(Pseudomonasputida)、粘质沙雷菌(Serratiamarcescens)、白色念珠菌(Candidaalbicans)、新型串酵母(Cryptococcusneoformans)、酿酒酵母(Saccharomycescerevisiae) 以上菌株由西南民族大学食品科学实验室保存;牦牛血 成都天屹生物科技有限公司;柠檬酸钠、乙酸、乙酸钠、盐酸、三羟甲基氨基甲烷(TRIS)、磷酸二氢钾、磷酸氢二钠 成都科龙化工试剂厂;苯甲基磺酰氟(PMSF) Amresco公司;胰蛋白酶(酶活10万U/g) 河南唐古食品配料有限公司;三氟乙酸(TFA) 色谱纯,Fluka公司;乙腈 色谱纯,Merck公司;Sephadex G-15 Sigma公司;LB培养基(溶菌肉汤培养基) 青岛青药生物工程有限公司;PDA培养基(马铃薯葡萄糖琼脂培养基) 南通凯恒生物科技发展有限公司。
半制备型高效液相色谱仪(YWG C18250 mm×10 mm) 美国Waters公司;Centrifuge 5804型离心机 德国Eppendorf公司;FE20型pH计 瑞士METTLER TOLEDO公司;HH-6型恒温水浴锅 国华电器有限公司;ELX808酶标仪 美国BIO-TEK公司。
1.2 实验方法
1.2.1 牦牛血酶解液的制备 收集新鲜的牦牛血,过100目筛网,加入10%柠檬酸钠迅速抗凝[14],2000×g离心10 min取红血球,按1∶1加水(重量比),快速搅拌破膜,调节pH至8.0,按红血球量加入0.03‰胰蛋白酶,50 ℃下酶解10 h。酶解结束后,调节pH至5.0以下,同时加热至90 ℃以上维持30 min灭酶,然后2000×g离心10 min取上清液,即得到牦牛血酶解液。
1.2.2 抗菌肽细菌吸附结合实验 参考Tang的方法[13]。将培养至对数生长期的大肠杆菌2000×g离心10 min,收集菌体,用无菌PBS(10 mmol/L,pH7.0)缓冲液洗涤,然后与牦牛血酶解液混合,于37 ℃孵育10 min,经0.22 μm滤膜过滤,滤液即为细菌吸附结合后的牦牛血酶解液,将其冷冻干燥,-70 ℃超低温冰箱保存备用。
1.2.3 凝胶过滤层析确定目标抗菌肽 实验采用Sephadex G-15凝胶柱(50 cm×2 cm),用缓冲液进行平衡。取3 mL牦牛血酶解液上样,缓冲液洗脱20 h,在220 nm监测洗脱情况;同样取3 mL细菌结合后的牦牛血酶解液(1.2.2制备)上样,洗脱条件同上。对比两凝胶色谱图,细菌结合后的牦牛血酶解液凝胶色谱图减少的洗脱峰即为含有目标抗菌肽的组分。在其他条件相同的情况下,探讨了洗脱液类型(pH7.0磷酸盐缓冲溶液、pH5.0醋酸缓冲溶液、Tris-盐酸缓冲溶液)与洗脱流速(0.1、0.4、1.0 mL/min)对Sephadex G-15分离抗菌肽效果的影响。
1.2.4 反相高效液相色谱(RP-HPLC)纯化 参考Hocquellet 的方法[15],对确定含有目标抗菌肽的凝胶色谱洗脱峰进行收集,采用YWG C18反相柱(250 mm×10 mm×10 μm)进行RP-HPLC分离纯化。流动相A:0.1% TFA溶液,B:80% 乙腈(含0.1% TFA);色谱条件:色谱柱用0.1% TFA平衡后,采用线性梯度法进行洗脱并收集,梯度为B:0~100%洗脱80 min,上样量2 μL,流速1 mL/min。在214 nm处测其光密度,收集各单峰进行纯化。抗菌活性组分冻干后,用0.1%TFA溶解后再次经过Kromasil C18反相柱(250 mm×4.6 mm×5 μm)进行二次HPLC分离,流速0.5 mL/min,其它色谱条件同上。
1.2.5 抗菌肽抑菌活性的测定 最低抑菌浓度(Minimal inhibitory concentration,MIC)参考文献[16]方法测定。将培养至对数生长期的待测菌液(细菌接种在LB培养基、真菌接种在PDA培养基,当菌数达到104~105CFU/mL时得到待测菌液)加入96孔细胞培养板,每孔50 μL,再向各孔中加入50 μL经倍比稀释的抗菌肽,使各孔中抗菌肽浓度分别为0.5、1、2、4、8、16 μg/mL。以加入0.4%多聚甲醛50 μL的孔为阳性对照,加入灭菌的去离子水50 μL的孔为阴性对照。细菌在37 ℃培养6 h,真菌在28 ℃培养12 h后,用酶标仪在λ=630 nm检测OD值。与初始值相比,OD值未有显著变化的最小抗菌肽浓度定义为抗菌肽对该菌的最低抑菌浓度。
2 结果与分析
2.1 Sephadex G-15凝胶过滤分离抗菌肽
2.1.1 洗脱液类型对Sephadex G-15分离抗菌肽效果的影响 其它层析条件不变的情况下,3种不同的缓冲溶液分离效果如图1所示(Ⅰ、Ⅱ、Ⅲ)。对比三种洗脱缓冲液,在其它分离条件不变的情况下,10 mmol/L、pH7.0的磷酸盐缓冲液分离效果相对较好(见图Ⅲ),牦牛血酶解液可大致分为7个组分。因此本实验采用磷酸盐缓冲液为最佳洗脱液。
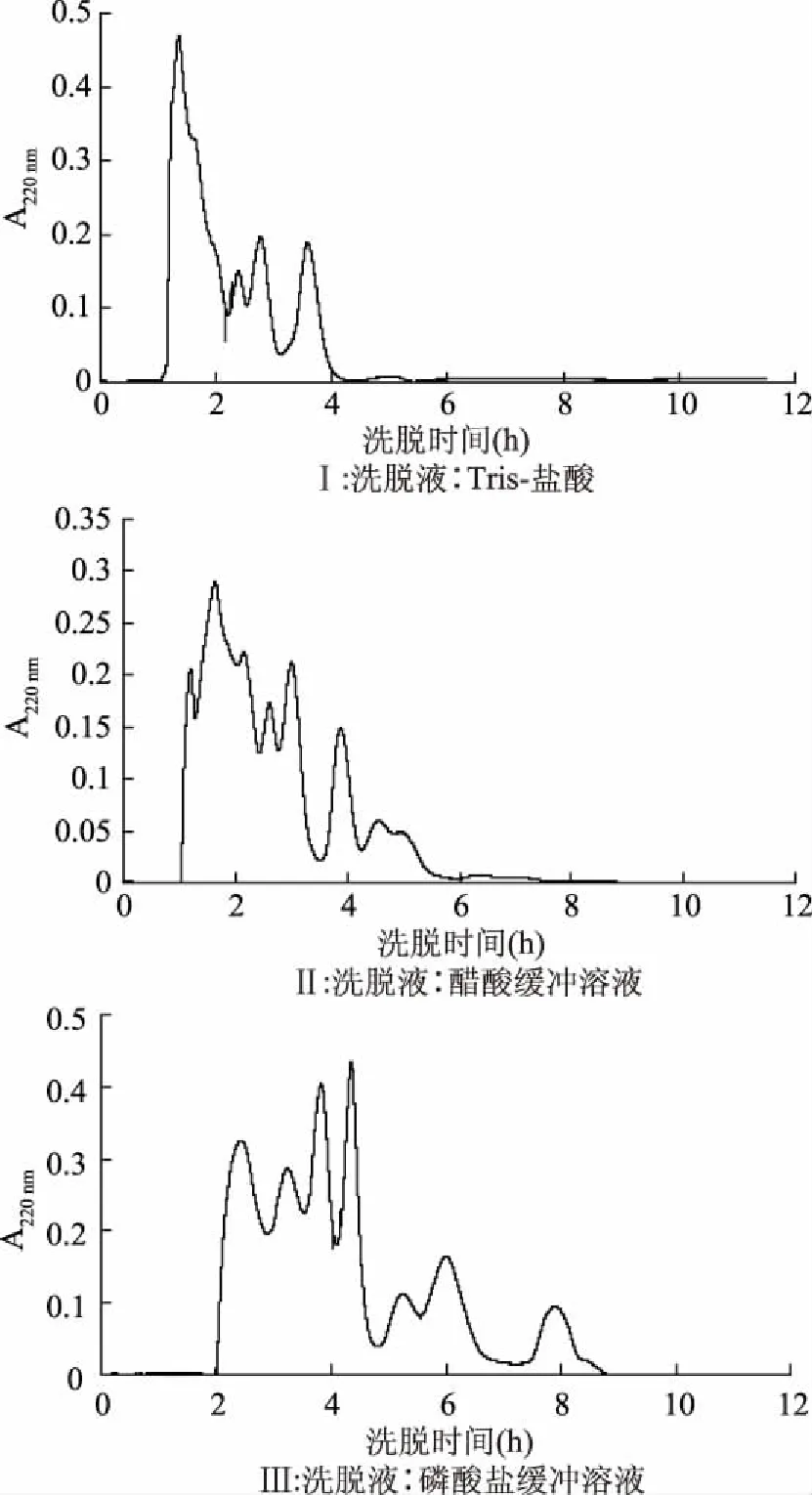
图1 不同类型洗脱液对Sephadex G-15 分离抗菌肽效果的影响Fig.1 Effect of different elution buffers on the separation of antimicrobial peptide
2.1.2 洗脱剂流速对Sephadex G-15分离抗菌肽效果的影响 洗脱液的流速也是影响分离效果的重要因素。不同流速洗脱液分离抗菌肽效果见图2(Ⅰ、Ⅱ、Ⅲ)。从图2可以看出,当流速为1 mL/min时,由于流速过快,导致出峰的时间相对提前,峰形扁平,有一些小峰没有分开。流速0.4 mL/min时分离效果好,分离时间较短。流速0.1 mL/min时,低流速会引起分离时间的延长,工作效率降低,因此本实验选择0.4 mL/min为最佳流速。
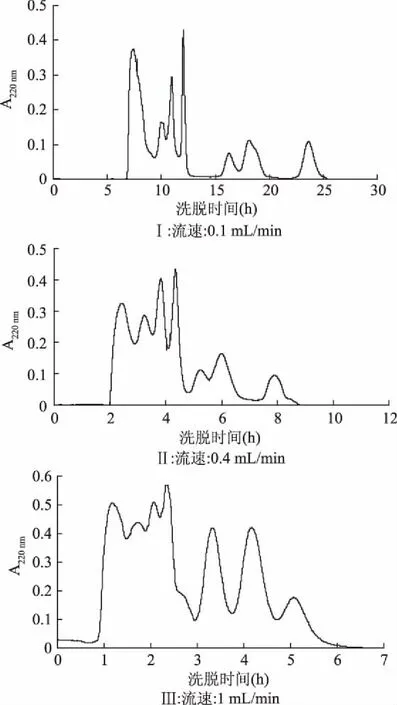
图2 不同洗脱流速对Sephadex G-15 分离抗菌肽效果的影响Fig.2 Effect of different flow rates on the separation of the antibacterial peptide
综合以上分析结果,用Sephadex G-15分离牦牛血酶解液抗菌肽时,样品浓度50 mg/mL,上样量3.0 mL,流速0.4 mL/min,磷酸盐缓冲液(10 mmol/L,pH7.0)为洗脱剂,可取得较好的分离效果。在此条件下,分离得到了7个组分,见图3。
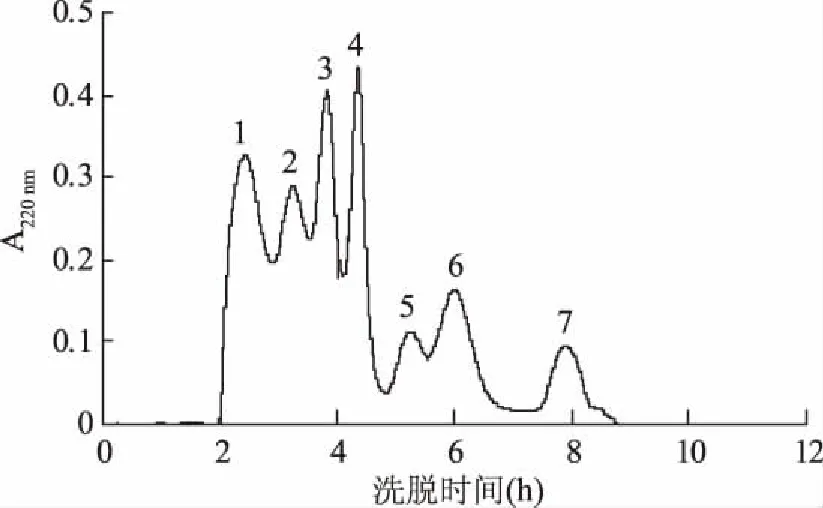
图3 Sephadex G-15分离抗菌肽凝胶色谱图Fig.3 Gel filtration chromatography profile of the antibacterial peptides on Sephadex G-15 column
2.2 细菌胞膜吸附分离牦牛血酶解液抗菌肽
2.2.1 细菌细胞结合实验 牦牛血酶解液与大肠杆菌孵育后,其中膜作用抗菌肽会与细菌细胞结合,并随菌体一同被过滤去除[13]。与细菌结合后的牦牛血酶解液的凝胶色谱图见图4。与图3(未与细菌孵育的牦牛血酶解液凝胶过滤图)相比,图4中洗脱峰2和峰5减少,其余洗脱峰与图3中相应洗脱峰的峰形和洗脱时间相类似。由此推断,峰2与峰5应该为含有目标抗菌肽的组分。分别对峰2和峰5组分进行活性测定,发现峰5抗菌活性高于峰2。因此选择峰5组分进行进一步的分离纯化。
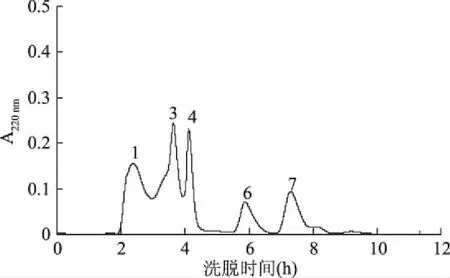
图4 与大肠杆菌结合后牦牛血酶解液的G-15凝胶色谱图Fig.4 Elution profile of yak blood zymolyte incubated with E. coli on Sephadex G-15 column
2.2.2 缓冲液pH对于细菌吸附结合实验的影响 为了验证细菌结合实验的准确性和重现性,将大肠杆菌在pH分别为5.0、6.0、7.0、8.0的缓冲液中与牦牛血酶解液孵育,孵育后的滤液用Sephadex G-15柱进行分析,结果见图5(Ⅰ、Ⅱ、Ⅲ、Ⅳ)。
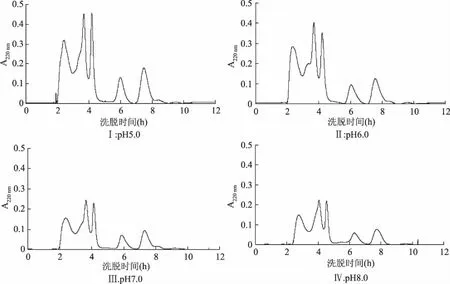
图5 不同pH下与大肠杆菌结合后的牦牛血酶解物的凝胶色谱图Fig.5 Elution profile of yak blood zymolyte incubated with E. coli on Sephadex G-15 column under different pH
从图5中可看出,滤液分离后都得到5个组分。与图3对比发现,图5中的峰2和峰5均显著下降或消失,因此认为利用细胞膜结合分离抗菌肽组分的重复性较好。在用Sephadex G-15凝胶柱分离抗菌肽时,发现洗脱液的类型对洗脱效果影响最大,醋酸缓冲液(pH5.0)和Tris-盐酸缓冲液(pH8.5)都无法把组分分离完全,这可能是相对于磷酸盐缓冲液(pH7.0),pH的改变使得酶解液中某些肽的氨基酸侧链基团的电离发生变化,肽与肽之间的相互作用发生了改变,从而使得某些组分难以分开。中性磷酸盐对于反相液相色谱分离效果是一种好的方法,且在此条件下蛋白可保持生物活性[17]。
2.3 RP-HPLC分离纯化抗菌肽
采用半制备型RP-HPLC(YWG C18250 mm×10 mm)进一步纯化图3中的峰5,结果见图6。对图6中的各个组分进行收集,检测其抗菌活性,活性最强的目标峰组分进一步采用RP-HPLC(Kromasil C18250 mm×4.6 mm)纯化,结果如图7所示。目标抗菌组分大约在53%乙腈(体积比)流动相洗脱下来的,这表明抗菌组分具有较强的表面疏水性。抗菌物质与细菌细胞膜的疏水作用对于其杀菌作用非常重要。Conlon等[18]研究表明抗菌肽可通过抗菌肽疏水的表面与细胞膜脂部分以及抗菌肽亲水基团与细胞膜磷脂头部亲水部分结合。膜肽相互作用是由静电相互作用和疏水相互作用决定的,而且这两种相互作用存在敏感的平衡关系[19]。因此综合实验分析,推测抗菌肽YakB-1/2在pH7.0时的带电荷量较少,与细菌细胞膜的吸附结合主要依靠疏水相互作用。
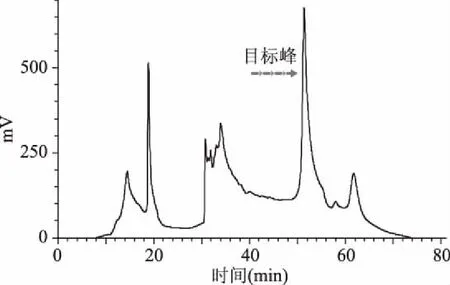
图6 峰5组分的RP-HPLC图谱(YWG C18 250×10 mm)Fig.6 RP-HPLC profile of peak 5(YWG C18 250×10 mm)
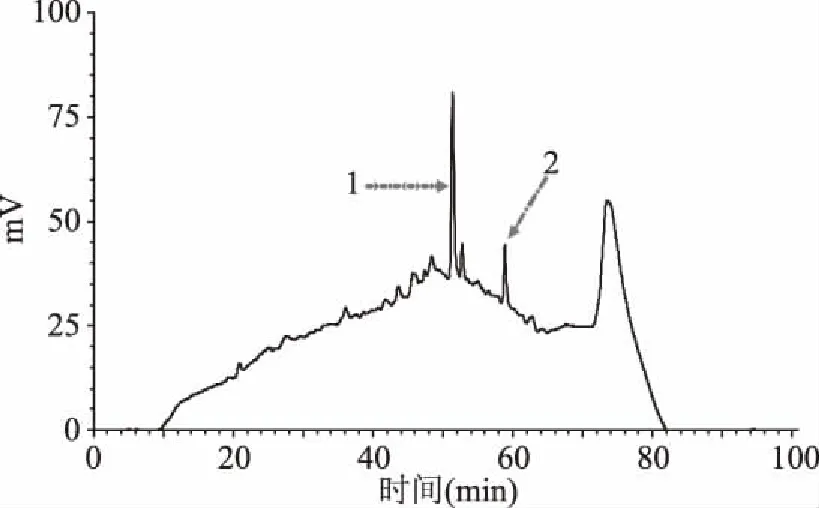
图7 抗菌组分目标峰进一步RP-HPLC纯化图谱(Kromasil C18 250 mm×4.6 mm)Fig.7 RP-HPLC profile of further purification of antimicrobial fraction(Kromasil C18 250 mm×4.6 mm)
对于RP-HPLC组分1和2再次进行高效液相分析,结果显示其为单一峰,已经达到色谱纯(图8),出峰时间分别为51.23 min及59.50 min。将组分1和2的抗菌肽分别命名为YakB-1和YakB-2。
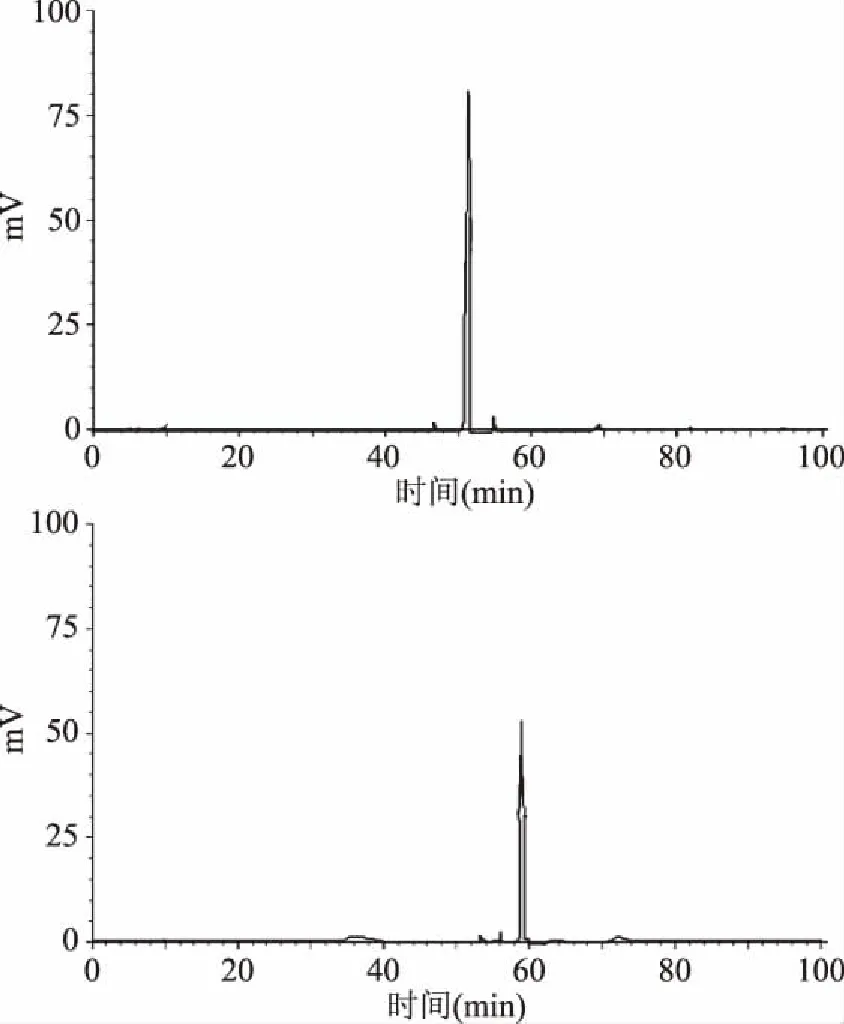
图8 抗菌肽RP-HPLC 组分1和2的二次RP-HPLC图谱Fig.8 Subfraction of fraction 1 and 2 from the RP-HPLC
2.4 抗菌肽YakB-1/2的抑菌活性检测
抗菌肽Buforin的MIC作为对照,抗菌肽YakB-1/2的抑菌活性结果见表1。
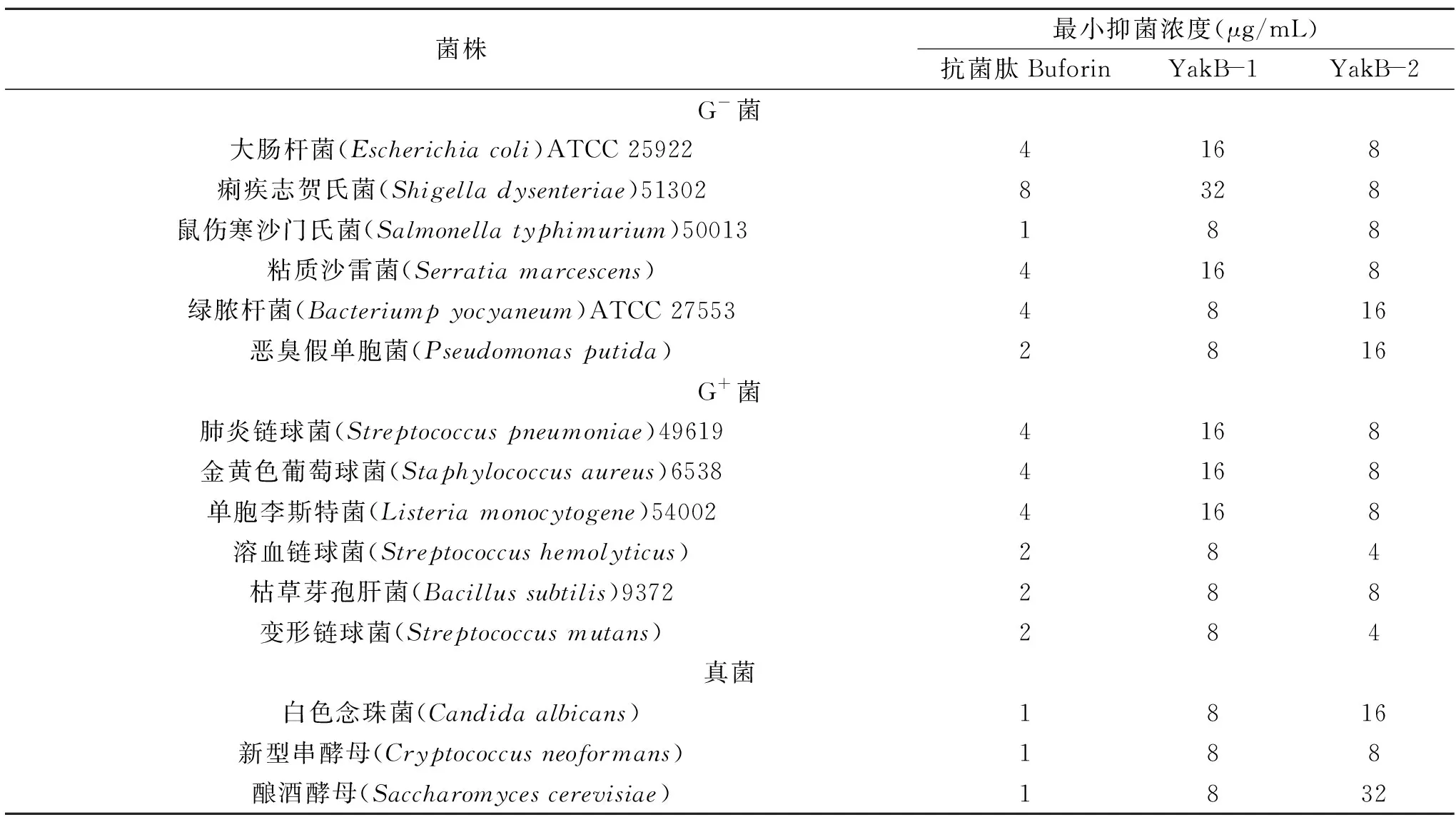
表1 YakB-1,YakB-2及抗菌肽Buforin的抗菌活性Table 1 Antimicrobial activitiy of YakB-1,YakB-2 and Buforin
总体上来看,抗菌肽YakB-2无论对G-菌还是G+菌的抗菌活性要比YakB-1强。无论是YakB-1还是YakB-2,对G+菌的抑菌活性比G-菌强,YakB-2尤其明显。这可能是因为G-菌和G+菌外膜的组成成分不同[20]。除了新型串酵母,YakB-1对真菌的抑菌活性比YakB-2强,而抗菌肽YakB-1/2对细菌和真菌的抑菌活性都弱于Buforin。抗菌肽YakB-1/2的抑菌机理、氨基酸序列、与胞膜作用时的结构变化及膜作用机制还需要在后续的研究中进一步摸索和探究。
3 结论
牦牛血酶解液浓度50 mg/mL,上样量3.0 mL,流速0.4 mL/min,10 mmol/L pH7.0磷酸盐缓冲液为洗脱剂,用Sephadex G-15分离牦牛血酶解液抗菌肽可取得较好的分离效果,获得分离度较好的7个组分。通过RP-HPLC纯化牦牛血酶解液中抗菌肽组分,分离得到两个色谱纯的抗菌肽YakB-1和YakB-2。菌肽YakB-1/2对细菌和真菌都具有广谱抗菌活性,但抗菌肽YaKB-2对细菌的抗菌活性比YakB-1强,YakB-1对真菌的抑菌活性更强。
[1]Hassan M,Kjos M,Nes IF,et al. Natural antimicrobial peptides from bacteria:Characteristics and potential applications to
Fight against antibiotic resistance[J]. Journal of Applied Microbiology,2012,113(4):723-736.
[2]李思明. 鳄鱼抗菌肽的分离纯化和抗菌效果研究[D]. 雅安:四川农业大学,2006.
[3]Boman HG,Nilsson I,Rasmuson B. Inducible antibacterial defense system inDrosophial[J]. Nature,1972,237:232-235.
[4]Bandyopadhyay S,Lee M,Sivaraman J,et al. Model membrane interaction and DNA-binding of antimicrobial peptide lasioglossin ii derived from bee venom[J]. Biochemistry Biophysical Research Communications,2013,430(1):1-6.
[5]Brandenburg LO,Merres J,Albrecht LJ,et al. Antimicrobial peptides:Multifunctional drugs for different applications[J]. Polymers,2012,4(1):539-560.
[6]翟培,侯利霞,乐国伟,等. 不同微生物诱导家蝇幼虫表达抗菌肽的特性[J]. 食品与生物技术学报,2006,25(3):41-45.
[7]张艳梅,佘锐萍,刘天龙,等. 猪血中抗菌肽类物质的分离纯化和抗菌活性研究[J]. 科技导报,2008,26(2):33-37.
[8]张庆华,王青,尚田田,等. 新型血红蛋白抗菌肽抑菌活性及溶血性研究[J]. 动物医学进展,2014,35(9):54-57.
[9]Hu J,Xu M,Hang B,et al. Isolation and characterization of an antimicrobial peptide from bovine hemoglobinα-subunit[J]. World Journal of Microbiology and Biotechnology,2011,27(4):767-771.
[10]卢福山,张才俊. 高原型牦牛8项血液指标的测定[J]. 青海畜牧兽医杂志,2006,36(4):3-4.
[11]车发梅,史福胜,李莉. 不同海拔地区牦牛血红蛋白、肌红蛋白含量的测定[J]. 家畜生态学报,2007,28(5):35-37.
[12]杜昕. 菌酶联合制备牦牛血抗氧化肽及其分离纯化的研究[D]. 雅安:四川农业大学,2016.
[13]宋涛. 奶牛血液红细胞抗菌肽的分离与纯化[D]. 洛阳:河南科技大学,2010.
[14]Tang YL,Shi YH,Zhao W,et al. Discovery of a novel antimicrobial peptide using membrane binding-based approach[J]. Food Control,2009,20(2):149-156.
[15]Hocquellet A,Odaert B,Cabanne C,et al. Structure-activity relationship of human liver-expressed antimicrobial peptide 2[J].Peptides,2010,31(1):58-66.
[16]Hao G,Shi YH,Tang YL,et al. The intracellular mechanism of action onEscherichiacoliof BF2-A/C,two analogues of the antimicrobial peptide Buforin 2[J]. Journal of Microbiology,2013,51(2):200-208.
[17]张冬玲,关瑞章,黄文树,等. pH和色谱柱对日本鳗鲡肝脏抗菌肽分离纯化效果的影响及抗菌活性检测[J]. 水产学报,2013,37(4):614-621.
[18]Conlon JM,Al-Kharrge R,Ahmed E,et al. Effect of aminoisobutyric acid(Aib)substitutions on the antimicrobial and cytolytic activities of the frog skin peptide,temporin-1DRa[J]. Peptides,2007,28:2075-2080.
[19]Brandenbuge LO,Merres J,Albrecht LJ,et al. Antimicrobial peptides:Multifunctional drugs for different applications[J]. Polymers,2012,4(1):539-560.
[20]高飞. 抗菌肽快速筛选方法与抗菌活性的研究[D]. 无锡:江南大学,2011.
