四川部分地区肉牛鼻腔中支原体的PCR检测及分析
2018-07-02马艳君阿比克哈莫
马艳君,阿比克哈莫,汤 承,岳 华
(西南民族大学生命科学与技术学院,四川 成都 610041)
支原体(Mycoplasma)通常寄生于动物的呼吸道、眼结膜等黏膜表面,当动物被其他病原感染、运输应激以及其他因素刺激导致机体抵抗力下降时,引起感染发病,以呼吸道疾病最为常见[1-3].已证明牛支原体(Mycoplasma bovis)、牛眼支原体(Mycoplasma bovoculi)、殊异支原体(Mycoplasma dispar)和牛鼻支原体(Mycoplasma bovirhinis)等几种支原体对牛有致病性[4-6].2008年我国首次从患有呼吸道疾病的犊牛肺脏中分离得到牛支原体[7],此后,广西、宁夏回族自治区、重庆等多个地区都有牛支原体感染引起呼吸道疾病的报道[8-10],目前,除西藏自治区和海南省外,其余省市均有牛支原体感染的报道[11].国内关于牛支原体的研究已经有很多报道,但关于其他种类支原体感染牛的情况知之甚少.
分离鉴定是支原体的经典检测方法,但支原体分离培养困难,难以作为常规检测方法普及推广[12].随着分子生物学检测技术的普及,PCR已成为包括支原体在内的多种病原检测的主流手段[13].由于支原体属16S rRNA基因兼有保守性和变异性于一体的特点,可作为支原体鉴定和分类的靶标基因[14].尹秋生等人用靶向支原体属16S rRNA基因设计的通用引物来进行PCR扩增,可同时鉴定出人型支原体、肺支原体等12种支原体[15].Rawdi等人用类似的方法鉴定出了咽支原体、上颌支原体等5种支原体[16].本研究采用支原体属的16S rRNA通用引物对四川部分地区肉牛场呼吸道病病例进行检测,并采用4种支原体特异性引物进行PCR检测.旨在了解支原体的感染情况,为肉牛呼吸道病的防控提供科学依据.
1 材料与方法
1.1 临床样本和参考菌株
2016年10月至2017年4月,在四川南充市、阆中市和仪陇县等地的6个肉牛场共采集54份患呼吸道疾病的病牛深部鼻腔棉拭子(B1~B54),所有病例均为从外省调运购回的3~4月龄西门塔尔牛或西杂牛,均在运回后7~10天内发病,主要表现为精神沉郁、食欲减退,鼻镜干燥,流出黄白色脓性鼻液,呼吸困难,体温升高,部分病牛结膜发炎,流泪等.
牛支原体参考菌株由西南民族大学动物医学实验室分离鉴定并保存.
1.2 主要试剂
rTaqDNA聚合酶、PMD19-T克隆载体购自TAKARA 公司;Gel Extraction Kit、Plasmid Miniprep Kit购自 Omega公司;DL2000 DNA Maker、DH5α感受态细胞购自宝生物工程(大连)股份有限公司.
1.3 肉牛鼻腔棉拭子样本PCR检测
将肉牛鼻腔棉拭子样本置1mL PBS中充分涮洗,涮洗液12 000 rpm 4℃离心30 min去上清,常规酚-氯仿法提取沉淀中的DNA作为模板,参照文献[16]报道的支原体属特异性PCR检测方法进行支原体检测,引物为靶向支原体属16S rRNA的通用引物,扩增片段大小为1021bp.同时以牛支原体作为阳性对照,以无模板对照作为阴性对照,PCR产物经1.0%琼脂糖凝胶电泳鉴定后,用Gel Extraction Kit对目的片段进行回收纯化后克隆至pMD19-T,将重组载体转化至大肠杆菌 DH5α感受态细胞,阳性克隆用 Plasmid Miniprep Kit提取的重组质粒送至上海生工生物工程有限公司测序.
1.4 序列分析及系统发育树的构建
DNAman同源性比对分析测序结果.选取Gen-Bank中13条分别来自中国、美国、瑞典、埃及德国等具有代表性的牛支原体16S rRNA以及GenBank中收录的牛眼支原体、殊异支原体和牛鼻支原体这三种支原体的全部16S rRNA序列,运用Mega5.0软件构建靶标基因与以上GenBank中的序列构建系统进化树,分析进化关系.
1.5 四种支原体的特异PCR检测
1.5.1 特异性检测引物
本试验中用于检测牛支原体的PCR方法是参照文献[17]报道的进行;牛眼支原体采用的是Schnee等人报道的PCR方法进行检测[18];殊异支原体检测方法按照文献[19]报道的进行;检测牛鼻支原体的方法参照文献[20]报道的PCR方法进行.上述4对特异性检测引物由生工生物工程(上海)股份有限公司合成,具体引物信息见表1.

表1 引物信息Table 1 Primers for detection of bacterial pathogens
1.5.2 特异性PCR检测
利用1.3中提取的肉牛鼻腔棉拭子的DNA作为模板,分别用牛支原体、牛眼支原体、殊异支原体以及牛鼻支原体特异性引物进行PCR检测.用1.5%琼脂糖凝胶对PCR产物电泳进行鉴定,在检测出的阳性样本中,每种支原体随机选取5个样本(检测少于5个阳性的支原体,全部克隆转化)用Gel Extraction Kit对目的片段进行纯化回收并将其克隆至pMD19-T,将重组载体转化至大肠杆菌DH5α感受态细胞,挑取阳性克隆用Plasmid Miniprep Kit提取重组质粒,送至上海生工生物工程有限公司进行测序.
2 结果
2.1 肉牛鼻腔棉拭子样本PCR检测及测序结果
从54份肉牛鼻腔棉拭子样本中检出23份阳性样本,部分样本的琼脂糖凝胶电泳结果显示,在约1000 bp处出现明亮的条带,与预期大小相符(图1),测序结果显示23个片段均为1021 bp,为支原体16S rRNA序列.54份样本支原体个体阳性率为42.6%(23/54),6个场中5个为阳性场(5/6),可见支原体在被检肉牛场呼吸道病牛中普遍存在.
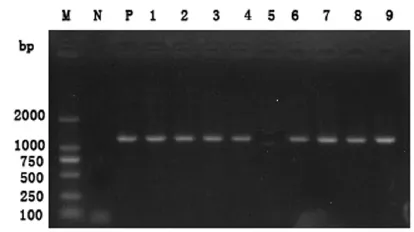
图1 部分样本PCR产物的电泳图Fig.1 PCR amplification results of partial samples
2.2 支原体种类的鉴定和序列分析
对PCR产物克隆测序结果同源性比对分析共鉴定出4种支原体(表2),分别是牛支原体(12/54)、牛眼支原体(6/54)、殊异支原体(3/54)和牛鼻支原体(2/54).12条牛支原体16S rRNA序列之间的同源性为99.9% ~100.0%,与GenBank中牛支原体参考序列之间的同源性为99.5% ~99.9%;6条牛眼支原体16S rRNA序列之间的同源性为99.0% ~100.0%,与GenBank中牛眼支原体参考序列之间的同源性为99.0% ~100.0%;3条殊异支原体16S rRNA序列之间的同源性为99.8% ~100.0%,与GenBank中的殊异支原体参考序列之间同源性为99.8% ~100.0%;2条牛鼻支原体16S rRNA序列之间的同源性为99.7% ~100.0%,与GenBank中的牛鼻支原体参考序列之间的同源性为99.5%~99.7%.
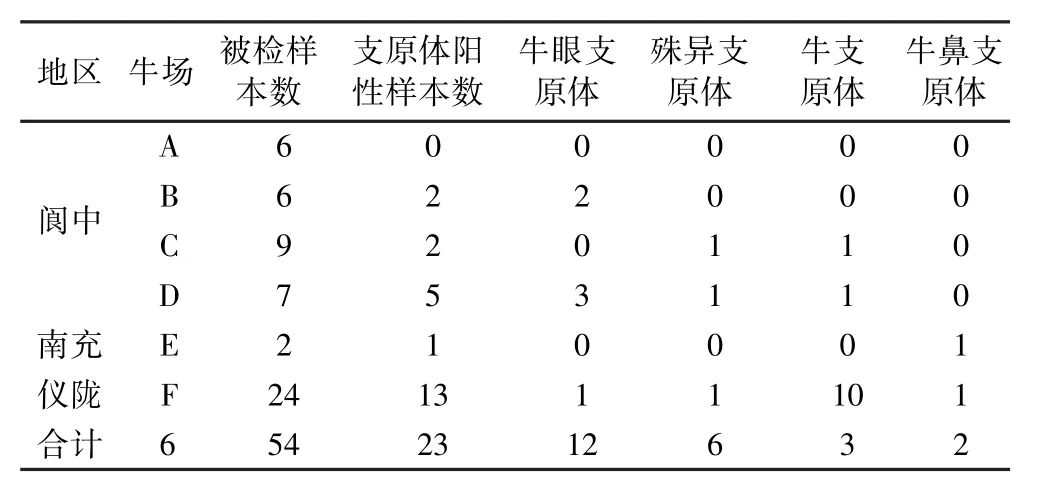
表2 54份临床样本中4种支原体的检出情况Table 2 Four kinds of Mycoplasmas in 54 clinical samples
2.3 基于支原体16S rRNA序列的系统发育分析
2.3.1 12条牛支原体的系统发育分析
12条牛支原体的进化树见图2.由图可见,其中9条与国内重庆株(CP005933.1)、广东株(KM576849.1)以及埃及株(JX993354.1)、瑞典株(AF332756.1)、美国株(GU99386.1)聚为1小支;其余3株各自聚为独立的一小支.

图2 牛支原体的进化树(邻近法)Fig.2 Consensus tree of Mycoplasma bovis(Neighbor-joining method)
2.3.2 6条牛眼支原体的系统发育分析
6条牛眼支原体的进化树见图3.由图可见,有2条和GenBank中唯一登录1条牛眼支原体美国株(NR_121731.1)16S rRNA序列聚为一支,其余4株独立聚为一支.
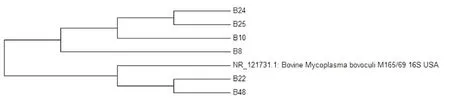
图3 牛眼支原体的进化树(邻近法)Fig.3 Consensus tree of Mycoplasma bovoculi(Neighbor-joining method)
2.3.3 3条殊异支原体的系统发育分析
3条殊异支原体的进化树见图4.由图可见,其中2条与国内甘肃株(CP024161.1)聚为一支,另外1株单独聚为一支.
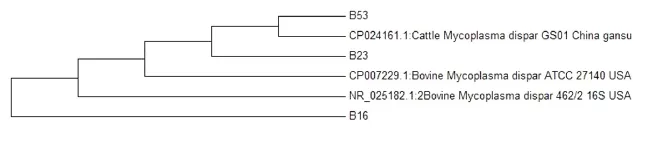
图4 殊异支原体的进化树(邻近法)Fig.4 Consensus tree of Mycoplasma dispar(Neighbor-joining method)
2.3.4 2条牛鼻支原体的系统发育分析
2条牛鼻支原体的进化树见图5.由图可见,2株聚为一小支,与甘肃株(CP024049.1)最近,而与国外毒株的遗传距离较远.

图5 牛鼻支原体进化树(邻近法)Fig.5 Consensus tree of Mycoplasma bovirhinis(Neighbor-joining method)
2.4 4种支原体特异性PCR检测结果
采用特异性PCR方法,分别对54份临床样本中的牛支原体、牛眼支原体、殊异支原体和牛鼻支原体进行检测,经过凝胶电泳对检测结果进行鉴定,片段大小与预期相符;随机挑选样本进行胶回收,克隆转化测序结果和检测结果符合.4种支原体部分样本的PCR检测结果如图6~图9.
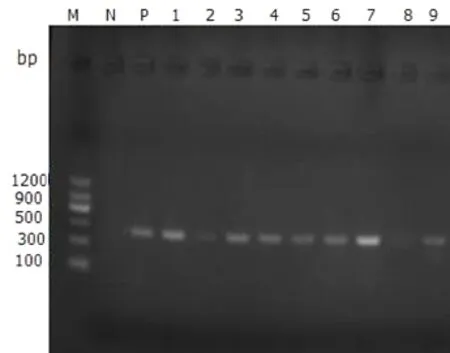
图6 牛支原体部分样本PCR检测结果Fig.6 PCR amplification results of partial samples for Mycoplasma bovis
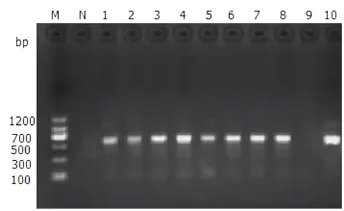
图7 牛眼支原体部分样本PCR检测结果Fig.7 PCR amplification results of partial samples for Mycoplasma bovoculi
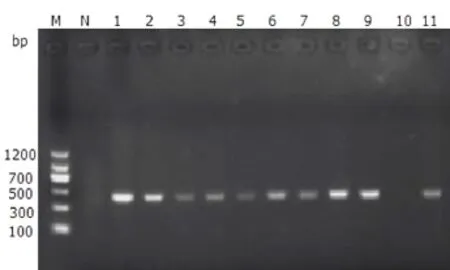
图8 殊异支原体部分样本PCR检测结果Fig.8 PCR amplification results of partial samples for Mycoplasma dispar
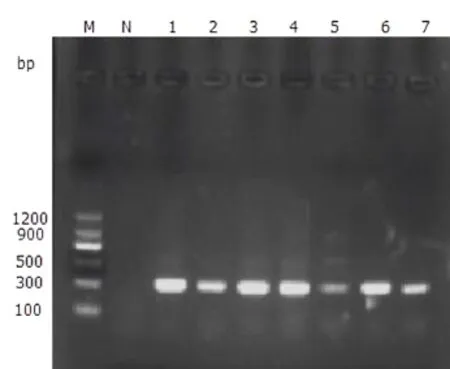
图9 牛鼻支原体部分样本PCR检测结果Fig.9 PCR amplification results of partial samples for Mycoplasma bovirhinis
4种支原体感染调查结果显示,肉牛的支原体感染较为普遍,也出现有几种支原体混合感染情况.
在肉牛的临床样本中,牛支原体的检出率为57.3%(29/54),是检出率最高的支原体,殊异支原体检出率为29.63%(16/54),牛鼻支原体的检出率为16.67%(9/54),以上这三种支原体是在患有呼吸道疾病的样本中经常检出的,本实验中牛眼支原体的检出率为20.37%(11/54),这可能是因为临床病例中有部分病牛出现了结膜炎等症状;在两种支原体混合感染中,检出率相对较高的是牛支原体+殊异支原体模式的混合感染,检出率为16.67%,与感染呼吸道病的支原体比较符合;三种支原体混合感染牛支原体+牛眼支原体+殊异支原体的检出率为5.56%,牛鼻原体+牛眼支原体+殊异支原体的检出率为0,而四种支原体的混合感染的检出率在肉牛样本中为0,这与支原体各自的自身特征及和宿主的相互作用以及环境因素都有很大关系.
3 讨论
本实验采用支原体属特异性PCR检测方法,对采集自四川6个肉牛场的54头患呼吸道病的肉牛鼻腔拭子样本54份进行支原体的检测,共检测出23份支原体阳性样本,表明该6个肉牛场呼吸道病牛中支原体感染较为普遍.牛的支原体健康带菌情况非常普遍,常常在运输等应激情况下由于机体的免疫力降低而引起原发或继发感染甚至死亡[21-23].该6个肉牛场均在牛运回后7~10天内发病,因此,长途运输时抗应激处理是减少支原等病因导致疾病发生的重要手段[24-25].
3.1 牛支原体是肉牛支原体感染的优势种
在引起牛呼吸道病的支原体中,牛支原体的感染很广泛,能引起多种疾病,其中牛肺炎、乳腺炎等最为常见[26].牛支原体病呈世界性分布,在法国,近30%的牛场有牛支原体的检出,在北美洲的肉牛场,由牛支原体引起的呼吸道疾病呈现出增加的趋势[27].随着世界各地贸易往来频繁,牛支原体病的感染就更加普遍[28].国内自2008年证实牛支原体与牛呼吸道疾病紧密相关以来[7],关于该菌的研究已经有很多报道,是国内肉牛呼吸道疾病的一个重要病原[29].本研究中牛支原体检出率最高,检出率为57.3%(29/54),与国内外的研究结果相似.
3.2 首次在国内证实牛眼支原体的存在
牛眼支原体可引起传染性牛角膜结膜炎(Infectious bovine keratoconjunctivitis,IBK),导致病牛流泪、角膜混浊等[30].1968年,在加拿大,Langford E V等人首次从患有IBK的牛的结膜拭子中分离出了牛眼支原体[31].在德国,Schnee C等人[32]从患有IBK的384头牛的结膜拭子中检出177头的结膜拭子中有牛眼支原体.Levisohn等人从患有呼吸道病并伴有流泪症状的牛眼分泌物中分离出了牛眼支原体和牛支原体[33],并认为该病原可能与呼吸道疾病有关.本研究首次从我国患呼吸道病并伴有结膜炎的病牛鼻腔样本中检出了牛眼支原体,检出率为20.37%(11/54),其在牛呼吸道病和结膜炎中的作用值得进一步关注.
3.3 牛鼻支原体和殊异支原体感染值得进一步关注
牛鼻支原体和殊异支原体也常在呼吸道病例中检出[34-35].在欧洲和北美,引起牛呼吸道疾病的支原体中,牛支原体和殊异支原体最常见[36].Thomas等人对比利时1997~2000年的300多份样本的检测结果显示,牛支原体和殊异支原体检测到最多,其次就是牛鼻支原体[37].2017年10月GenBank中登陆了来自我国甘肃的殊异支原体和牛鼻支原体的全基因序列,但未见这两种支原体的病原流行病学资料.本研究从患呼吸道疾病的病牛中检出殊异支原体和牛鼻支原体,检出率分别为29.63%(16/54)和16.67%(9/54).因此,进一步研究这两种支原体在国内牛呼吸道疾病中的作用,对牛呼吸道疾病的诊断和防控有积极的意义.
综上可见,支原体在四川呼吸道病肉中较为普遍,其中牛支原体带菌率最高;而牛眼支原体、殊异支原体和牛鼻支原体也有一定的检出率,这四种支原体在牛呼吸道疾病中的作用值得进一步研究.
[1] MINION F C.Molecular pathogenesis ofmycoplasmaanimal respiratory pathogens[J].Frontiers in Bioscience A Journal& Virtual Library,2002,7(1-3):d1410.
[2] GRIFFIN D,CHENGAPPA M M,KUSZAK J,et al.Bacterial Pathogens of the Bovine Respiratory Disease Complex[J].Veterinary Clinics of North America Food Animal Practice,2010,26(2):381.
[3] WAITES K B,KATZ B,SCHELONKA R L.Mycoplasmasand ureaplasmas as neonatal pathogens[J].Clinical Microbiology Reviews,2005,18(4):757.
[4] MAUNSELL F P,WOOLUMS A R,FRANCOZ D,et al.Mycoplasma bovisinfections in cattle[J].Journal of Veterinary Internal Medicine,2011,25(4):772 –783.
[5] MEGID R,NICHOLAS R A,MILES R J.Biochemical characterization ofMycoplasma bovirhinis,Mycoplasma disparand recent bovine isolates ofMycoplasma canis[J].Veterinary Research Communications,2001,25(1):1-12.
[6] ANGELOS J A.Infectious bovine keratoconjunctivitis(pinkeye)[J].Veterinary Clinics of North America Food Animal Practice,2015,31(1):61-79.
[7] 辛九庆,李媛,郭丹,等.国内首次从患肺炎的犊牛肺脏中分离到牛支原体[J].中国预防兽医学报,2008,30(9):661-664.
[8] 陶立,李军,庞观龙,等.广西南宁市疑似牛支原体肺炎的病原分离和PCR鉴定[J].黑龙江畜牧兽医,2015(15):169-171.
[9] 周伟,李能章,魏学良,等.重庆市某肉牛场牛支原体肺炎的诊断[J].中国预防兽医学报,2012,34(4):326-328.
[10] 郭亚男,曹思婷,何生虎,等.宁夏某肉牛场牛支原体分离鉴定及病理组织学观察[J].动物医学进展,2017,38(3):38-43.
[11] 胡长敏,石磊,龚瑞,等.牛支原体病研究进展[J].动物医学进展,2009,30(8):73-77.
[12] CASWELL J L,ARCHAMBAULT M.Mycoplasma bovispneumonia in cattle[J].Animal Health Research Reviews,2007,8(2):161.
[13] TENK M,BÁLINT A,STIPKOVITS L,et al.Detection ofMycoplasma boviswith an improved pcr assay[J].Acta Veterinaria Hungarica,2006,54(4):427-435.
[14] 李淳,朱翠明,吴移谋.16S rRNA基因检测在支原体鉴定中的应用[J].国际检验医学杂志,2011,32(1):75-77.
[15] 尹秋生,马立人,王北宁.支原体通用PCR引物的设计及在诊断的应用[J].中国人兽共患病学报,2000,16(3):61-62.
[16] GEORGES RAWDI,ANNICK DUJEANCOURT-HENRY,BRIGITTE LEMERCIER,et al.Phylogenetic position ofhuman mycoplasmas,Mycoplasma faucium,Mycoplasma buccale,Mycoplasma primatmandMycoplasma spermatophilum,based on 16s rRNA gene sequences[J].Internation Journal of Systematic Bacteriology,1998,48,305-309.
[17] 李大伟,黄灿平,张彦明,等.牛支原体、无乳支原体和丝状支原体丝状亚种小克隆三重PCR检测方法的建立及初步应用[J].畜牧兽医学报,2011,42(2):306-310.
[18] SCHNEE C,HELLER M,SCHUBERT E,et al.Point prevalence of infection withMycoplasma bovoculi,and Moraxella,spp.in cattle at different stages of infectious bovine keratoconjunctivitis[J].Veterinary Journal,2015,203(1):92-96.
[19] MARQUES L M,BUZINHANI M,YAMAGUTI M,et al.Use of a polymerase chain reaction for detection ofMycoplasma disparin the nasal mucus of calves.[J].Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc,2007,19(1):103.
[20] KOBAYASHI H,HIROSE K,WORARACH A,et al.In vitro amplification of the 16S rRNA genes fromMycoplasma bovirhinis,Mycoplasma alkalescensandMycoplasma bovigenitaliumby PCR.[J].Journal of Veterinary Medical Science,1998,60(60):1299-1303.
[21] 韩猛立,康立超,钟发刚,等.细菌性牛呼吸道疾病的研究进展[J].中国畜牧兽医,2013,40(5):165-172.
[22] 彭清洁,石磊,毛存志,等.抗应激处理对肉牛引入后发病的影响[J].中国牛业科学,2010,36(5):22-26.
[23]石磊,龚瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的初步诊断[J].华中农业大学学报(自然科学版),2008,27(5):629-633.
[24] SANDERSON M W,DARGATZ D A.Risk factors for initial respiratory disease in United States’feedlots based on producer-collected daily morbidity counts[J].The Canadian Veterinary Journal-La Revue Veterinaire Canadienne,2008,49(4):373.
[25] GUPTA S,EARLEY B,CROWE M A.Effect of 12-hour road transportation on physiological,immunological and haematological parameters in bulls housed at different space allowances[J].Veterinary Journal,2007,173(3):605.
[26] GIOVANNINI S,ZANONI M G,SALOGNI C,et al.Mycoplasma bovis,infection in respiratory disease of dairy calves less than one month old[J].Research in Veterinary Science,2013,95(2):576-579.
[27] NICHOLAS R A,AYLING R D.Mycoplasma bovis:disease,diagnosis,and control[J].Research in Veterinary Science,2003,74(2):105.
[28] CASTILLO-ALCALA F,BATEMAN K G,CAI H Y,et al.Prevalence and genotype ofMycoplasma bovisin beef cattle after arrival at a feedlot[J].American Journal of Veterinary Research,2012,73(12):1932.
[29] 冉智光,谢建华,骆璐,等.我国部分地区牛支原体肺炎和关节炎的病原体诊断[J].中国预防兽医学报,2010,32(1):40-43.
[30] ANGELOS J A.Infectious bovine keratoconjunctivitis(pinkeye)[J].Veterinary Clinics of North America Food Animal Practice,2015,31(1):61-79.
[31] LANGFORD E V,LEACH R H.Characterization of a mycoplasma isolated from infectious bovine keratoconjunctivitis:Mycoplasma bovoculisp.nov[J].Canadian Journal of Microbiology,1973,19(11):1435-1444.
[32] SCHNEE C,HELLER M,SCHUBERT E,et al.Point prevalence of infection withMycoplasma bovoculiand Moraxella spp.in cattle at different stages of infectious bovine keratoconjunctivitis[J].Veterinary Journal,2015,203(1):92-96.
[33] LEVISOHN S,GARAZI S,GERCHMAN I,et al.Diagnosis of a mixedmycoplasmainfection associated with a severe outbreak of bovine pinkeye in young calves[J].Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc,2004,16(6):579.
[34] ALMEIDA R A,WANNEMUEHLER M J,ROSENBUSCH R F.Interaction ofMycoplasma disparwith bovine alveolar macrophages[J].Infection & Immunity,1992,60(7):2914.
[35] TANSKANEN R.Growth and interaction ofMycoplasma bovirhinisandMycoplasma disparin vitro[J].Comparative Immunology Microbiology& Infectious Diseases,1987,10(3 – 4):205-217.
[36] MILES K,MCAULIFFE L,AYLING R D,et al.Rapid detection ofMycoplasma dispar,andMycoplasma bovirhinis,using allele specific polymerase chain reaction protocols[J].Fems Microbiology Letters,2004,241(1):103-107.
[37] THOMAS A,BALL H,DIZIER I,et al.Isolation ofmycoplasmaspecies from the lower respiratory tract of healthy cattle and cattle with respiratory disease in Belgium.[J].Veterinary Record,2002,151(16):472-476.
