18F-FDG PET/CT 扫描早期诊断重症急性胰腺炎继发感染的探讨
2018-07-02朱泽华邹明祥张现忠
朱泽华, 邹明祥, 张现忠, 胡 硕
(1 中南大学湘雅医院, 湖南 长沙 410008; 2 厦门大学分子影像中心, 福建 厦门 361102)
急性胰腺炎是临床常见的一种急腹症,大部分为自限性(约80%),但也有部分患者(约20%)可发展为重症急性胰腺炎(severe acute pancreatitis,SAP),这与延长患者住院时间关系密切[1-2]。SAP患者更易发生继发感染,一旦发生感染,患者病情明显加重,病死率升高。研究[3-5]表明,目前,引起患者继发感染的病原体,革兰阴性菌以肠杆菌科细菌为主(18.4%~23.4%);而革兰阳性菌则以金黄色葡萄球菌为主。引起继发感染发生的具体机制尚不明确,经内源性途径感染细菌,如经周围脏器胆道及十二指肠进入胰腺的“细菌易位学说”,目前已经被广泛认可[6]。感染发生早期临床上常规诊断感染的手段(如血常规、细菌培养)得到结果的时间往往要滞后于疾病进展;传统的影像学方法,如CT和MRI在急性胰腺炎早期诊断中有重要价值,但不具备检测感染的功能;穿刺液细菌培养作为诊断继发感染灶的“金标准”,有些病灶位置过深不能穿刺直接影响检测结果[7-8]。探索无创而特异的早期诊断感染的方法,对SAP继发感染给予及时治疗,降低患者病死率都将有极大的价值。本研究拟探讨氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(18F-FDG PET/CT)显像早期特异性诊断SAP继发感染的价值。
1 材料和方法
1.1 研究对象 本实验研究动物统一由中南大学实验动物中心提供,共有15只8~12 W的SD大鼠,均为雄性,体重250~350 g。动物实验遵循中南大学实验动物中心规定并通过中南大学湘雅医院伦理委员会的审核。细菌ATCC 25922和ATCC 25923作为研究菌株,购自上海复祥生物有限公司。
1.2 研究方法
1.2.1 动物和细菌制备 实验大鼠在中南大学实验动物中心饲养1 W后开始进行实验;实验前禁食10 h,禁水4 h。复苏细菌后将其接种于平板,然后从平板上挑取单个菌落加入到LB培养液中(5 mL/管),在温箱内以35℃、220 rpm震荡过夜;再分别取100 μL活化液,加入5 mL LB培养液中,继续震荡培养3 h。在酶标仪下测定菌液OD625nm,OD在0.5~0.8,此时的细菌浓度约为108/mL;分别取4 mL菌液,在5 500 rpm条件下离心8 min,吸掉上清,再用生理盐水稀释10倍,得到107/mL的ATCC 25922和ATCC 25923标准菌株悬浮液。
1.2.2 细菌摄取18F-FDG实验 按照上一步培养方法配制从108/mL到105/mL共计4个浓度梯度的标准菌株悬浮液,并以0作为起始浓度,每管内1 mL菌悬液,每个浓度分装3管。分别在每管菌悬液内加入18F-FDG 20 kBq/mL,在35℃水浴箱孵育2 h后离心弃掉上清,并用4℃PBS缓冲液清洗3遍。最后用gama计数仪(WIZARD2 2480)进行放射性计数,测定加入18F-FDG菌悬液和标准菌悬液的放射强度。
1.2.3 动物模型制备 首先将15只SD大鼠编号后随机分为三组,分别为革兰阳性菌组、革兰阴性菌组和生理盐水组,每组各5只。在SD大鼠腹腔内注射3 mL/kg的10%水合氯醛进行麻醉,麻醉后在恒温超净手术台(35℃)进行操作。备皮消毒后在腹部正中剑突下切开,切口长1~1.5 cm,切开后推开表面肠管,探查到胃及幽门,提起幽门,暴露十二指肠,向下顺序探查约5 cm,可见环形狭窄的乳头部,暴露充分后,发现十二指肠乳头开口隐匿于肠壁;用生理盐水滴淋乳头区域,观察胰腺呈淡粉红偏白色、未见积液;顺着胰胆管向上,探查到肝门处(数条主胰管汇集),用小血管夹(1.5 cm)夹闭近肝门侧;在乳头对侧用静脉留置针穿刺滑行进入胆胰管,深度约1~2 cm,用另一只血管夹夹闭乳头部,后退金属针芯。静脉留置针连接微量注射泵,恒速(6 mL/h)泵入3.6%牛磺胆酸钠(1 mL/kg);输注结束后拔除静脉留置针,继续夹闭3~5 min。所有大鼠输注牛磺胆酸钠后,以相同方法相同速度注入107/mL细菌悬浮液/生理盐水,继续夹闭3~5 min。操作完成后可见胰腺出现水肿,且胰腺颜色由粉红色变为暗黄色,最后变为黑色,包膜肿胀明显,周围有明显渗出物。手术完成后,所有大鼠禁食禁水,且每只大鼠给予皮下补液2 mL。
1.2.4 血生化检测 所有大鼠分别在手术后0、1、3 h取全血及血清,测定血清淀粉酶浓度和全血细胞计数。
1.2.5 PET/CT扫描及半定量分析 构建动物模型3 h后给予静脉注射18F-FDG 300 UCi/100g,静脉注射后1 h,采用小动物活体成像系统(Siemense Inveon PET/CT)进行多床位显像。扫描参量:电压80 kV,电流50 mA,Filter 0.5 cm。静态扫描过程中,采用恒温气体泵入动物仓进行保温。每只大鼠于矢状位图上,根据放射性浓聚范围勾画感兴趣区(region of interest,ROI),并使用MicroPET自带的配套软件系统(Inveon Research Workplace 4.1)进行数据处理。本实验以肌肉组织作为对照,ROI放射性计数与肌肉放射性计数之比(摄取比)作为评价标准。
1.2.6 病理和微生物检验 扫描完成后处死大鼠选取完整胰腺组织,肉眼观察胰腺改变,并且切取部分坏死感染灶,匀浆后做细菌LB培养基涂片和培养。感染灶组织进行HE染色和Gram染色后,显微镜下观察病理改变和微生物学结果。SAP继发感染诊断标准:HE染色经典评分≥8分,并且细菌培养阳性,Gram染色发现病原微生物。所有标本均由三位有经验的病理检验医生在未知实验分组的情况下进行独立判断。
1.2.7 生物学分布 PET/CT扫描完成后当即处死实验动物,尽量分离出完整的器官组织,包括脑、心、肺、肝、肾、脾、胃、肌肉、骨骼、小肠、血液、胰腺及生殖腺等共计13个。分别测量器官组织重量(合计重量减去已经测量的样品管重量),依照统一顺序放入全自动伽马计数仪(WIZARD2 2480)进行测量。测量完成后,仪器自动进行衰减矫正后,计算每个器官和组织的每克组织百分注射剂量率(%ID/g)。
2 结果
2.1 细菌摄取18F-FDG实验在细菌浓度达到106CFU/mL时,摄取开始明显增加。灭活的细菌吸收率为0,ATCC 25923比ATCC 25922吸收率略高,且两者均未达到饱和状态(饱和浓度>108CFU/mL)。见图1。
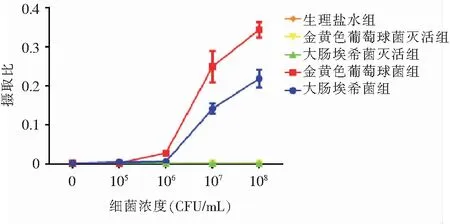
图1 细菌摄取18F-FDG实验
2.2 生化检测指标 15例样本中仅有4例大鼠全血细胞计数中白细胞计数较基线升高(金黄色葡萄球菌组2例,其余两组各1例),三组间白细胞计数差异无统计学意义(P>0.05)。全部样本血清淀粉酶基线为(318.315±145.118)U/L,15只大鼠血清淀粉酶均于建模后升高[1 h:(1 343.081±30.120) U/L;3 h:(3 472.925±689.834) U/L]。三组大鼠血清淀粉酶差异无统计学意义(P>0.05)。
2.3 病理改变和微生物检测结果
2.3.1 病理改变 三组大鼠感染灶HE染色后均见胰腺结构混乱,组织间隙显著增宽,腺体结构破坏明显,细胞坏死溶解,呈广泛液化性坏死,细胞质内可见伊红均染的无结构物质。间质内血管充血明显,可见弥漫红细胞浸润,并伴有广泛的中性粒细胞(脓细胞)浸润(400倍),三组病理改变评分均高于8分,差异无统计学意义(F=1.81,P=0.21)。见图2。
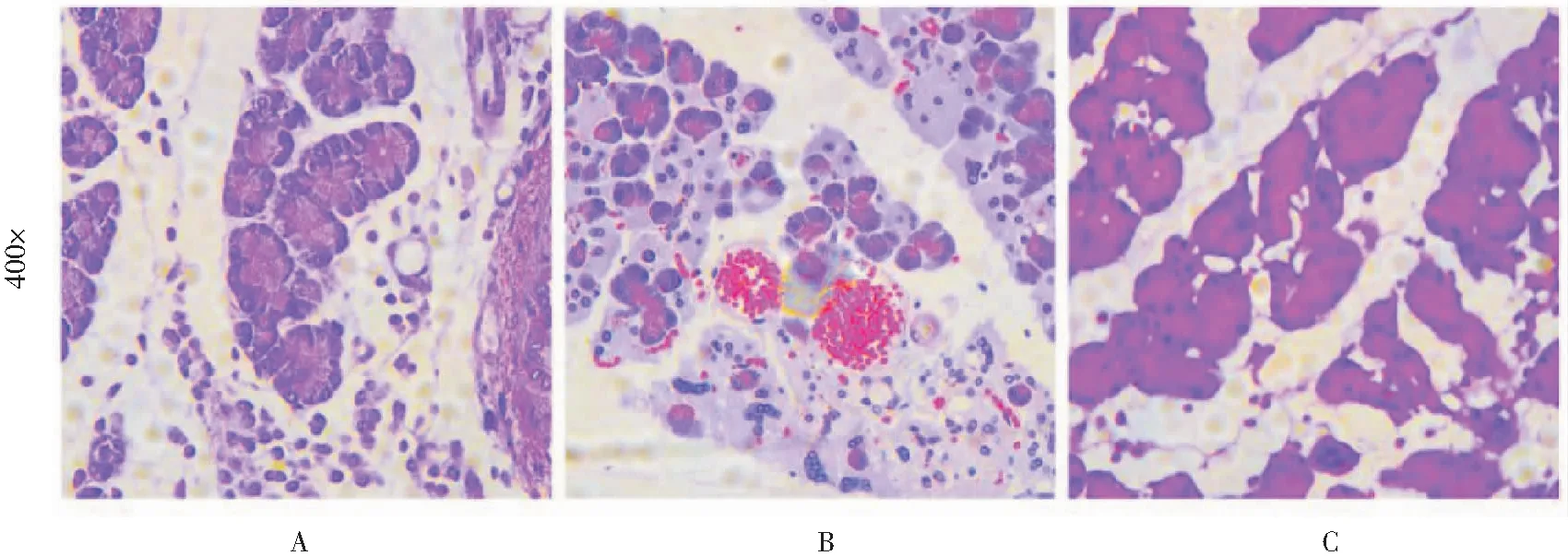
A:大肠埃希菌组;B:金黄色葡萄球菌组;C:生理盐水组
2.3.2 微生物检测结果 Gram染色后显微镜下可见感染灶中央呈明显的液化性坏死,腺体结构消失,脂肪细胞内为均染的无结构物质或空泡。大肠埃希菌组感染灶内可见短杆状阴性细菌,金黄色葡萄球菌组可见圆球形聚集成团的阳性菌,生理盐水组未发现明显的细菌定植征象,见图3。
2.4 PET/CT扫描 PET/CT扫描后显示三组大鼠胰腺部位均可见放射性特异性聚集,大肠埃希菌组和金黄色葡萄球菌组,放射性特异性聚集更为显著,见图4。PET/CT定量结果显示大肠埃希菌组、金黄色葡萄球菌组和生理盐水组靶(胰腺)与非靶(肌肉)比值分别为4.22±0.61、4.32±1.21和2.26±0.35,大肠埃希菌组和金黄色葡萄球菌组靶与非靶比值比较,差异无统计学意义(P>0.05);两个细菌感染组与对照组分别比较,差异均有统计学意义(均P<0.01)。见图5。
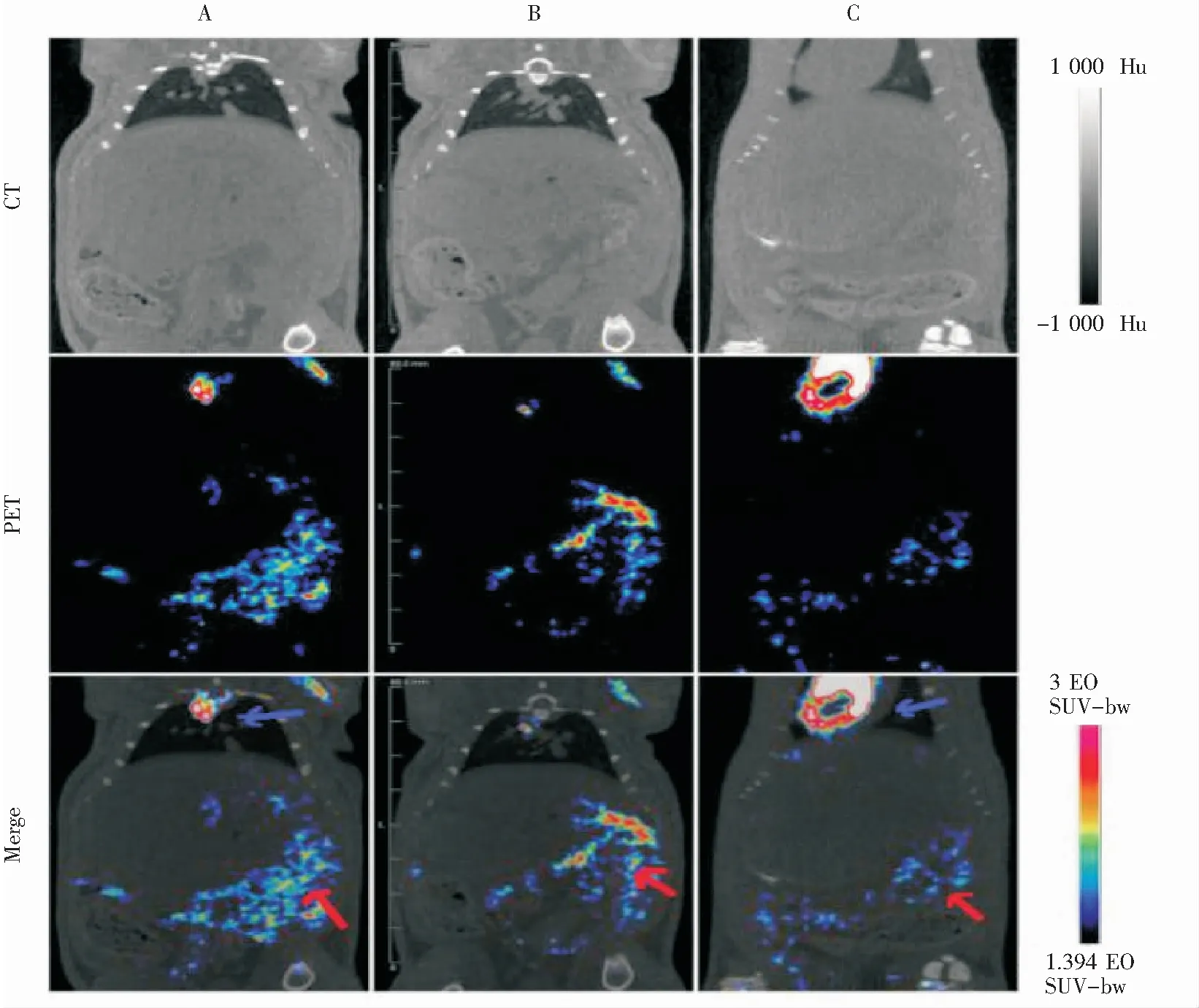
A:大肠埃希菌组;B:金黄色葡萄球菌组;C:生理盐水组;红色箭头所示为胰腺;蓝色箭头所示为心脏
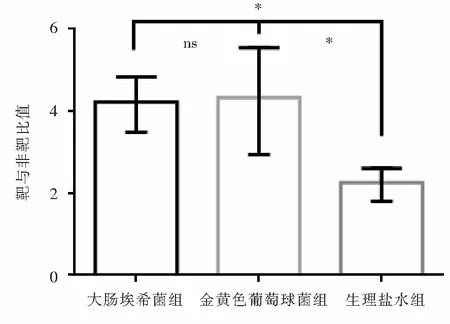
ns:差异无统计学意义;*:P<0.01
Figure5Quantitative results of target and non-target PET/CT imaging of three groups of rats
2.5 生物学分布 大肠埃希菌感染组胰腺的示踪剂摄取剂量为(1.33±0.11)%ID/g,金黄色葡萄球菌感染组的摄取剂量为(1.38±0.11)%ID/g,生理盐水组的示踪剂所测剂量为(0.71±0.08)%ID/g。见图6。两个感染组与生理盐水组结果比较差异有统计学意义(均P<0.001)。组织学分布情况:心脏摄取量最高,胰腺次之;两个细菌感染组之间相比,胰腺组织放射性分布差异无统计学意义(P>0.05)。见图7。
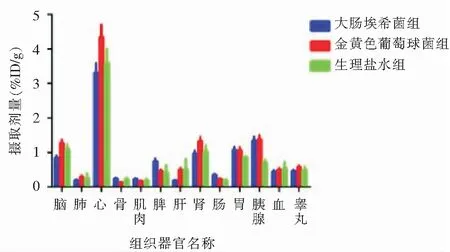
图6 示踪剂各组织摄取结果图

ns:差异无统计学意义;*:P<0.001
Figure7Quantitative results of pancreas distribution of three groups of rats
3 讨论
近年来,急性胰腺炎的发病率呈上升趋势,这可能与人们经济水平的改善和饮食习惯及结构的改变有关[7]。急性胰腺炎并发感染后,诊断和治疗的复杂性显著增加,若患者未得到及时精准的治疗干预,病死率明显升高[3]。有报道[8]指出,急性胰腺炎并发感染后,病死率是无感染患者的两倍。急性胰腺炎并发感染后病情复杂,病程迁延,花费巨大,可显著增加住院总花费,是延长总住院时间的第二大因素,也是导致患者死亡的第5大原因[7]。
SAP继发感染时主要通过以下几个指标予以提示:(1)临床症状改变:腹痛或者压痛,肌紧张或者肠鸣音消失;(2)至少符合全身炎症反应综合征诊断标准中的2项;(3)影像学:CT发现胰腺周围组织存在气泡征象;(4)诊断性穿刺,细菌培养结果阳性。满足4项中任意3项,可以诊断继发感染[9]。同时,降钙素原对继发感染的诊断有一定的预测价值[10]。传统的影像学检查如增强CT,虽然是诊断重症胰腺炎的金标准,并且可以发现胰腺坏死情况并评估坏死的程度,且根据Balthazar CT分级标准对病死率有一定的预测价值,但是继发感染的诊断均需要依赖于气泡征象的出现,且气泡征象出现的概率非常低,患者一般在出现症状后48 ~72 h才能够检测到该征象[11-13],所以,在感染发生早期很难判断感染的类型及迁延范围。引起继发感染的病原菌为革兰阴性菌,且感染类型较为单一,如得不到及时有效的治疗,常继发多重感染且细菌产生耐药性[14]。因此,急需发现一种既可以降低穿刺风险,又可以提高诊断准确性和时效性的科学方法。
数十年以来,核医学成像技术一直是感染性疾病和非感染性炎症疾病成像的重要组成部分[15-16]。18F-FDG PET/CT与传统放射性核素显像方法和单独形态成像相比有以下优点:(1)检测敏感性高;(2)图像分辨率高;(3)靶区与背景比值高;(4)采集快速,一次完成。在无菌性炎症和感染发生部位,局部免疫反应导致粒细胞和巨噬细胞聚集,其细胞内的葡萄糖代谢随着炎症反应而显著增加,所以18F-FDG可以特异聚集于病灶部位,其早期诊断的敏感性和特异性均在90%以上,已经被用于多种无菌性炎症/感染疾病的研究中[15-17]。本研究结果显示,继发细菌感染时可以加速疾病的进展,增加感染部位示踪剂的摄取量。PET/CT具有较高的组织分辨率,18F-FDG可以在无菌性炎症和感染发生部位快速聚集,与传统结构影像方法相比,利用功能显像以及该方法反映和评估疾病早期的活动和进展具有明显的优势。
18F-FDG PET/CT显像在鉴别感染性疾病和无菌性炎症中具有潜在的优势:在疾病发展早期,组织和器官结构上往往没有明显改变,故而相较于结构影像方法,功能显像在诊断时效上具有无可比拟的优势,且一次PET显像就可以进行全身评估[17]。尽早地诊断感染病灶,可以及时给予抗菌药物治疗,合理使用抗菌药物,从而降低细菌耐药性的产生。
本研究结果显示,18F-FDG PET/CT并不能鉴别继发感染是由哪种细菌感染引起,虽然两种细菌在体外摄取实验中存在吸收率的差异,但是在体内实验差异并不显著,因此,18F-FDG PET/CT不适宜用于检测感染病原体。18F-FDG PET/CT扫描虽然可以提示临床医生存在感染,从而减少抗菌药物的滥用,在一定程度上减少多重耐药菌的扩散;但是,由于对预测病原体无明显意义,对合理选用抗菌药物无指导价值;因此,探索检测感染病原体类型的特异显像剂的研究意义重大。 目前,18F-FDG还原产物18F-FDS(2-脱氧-2-氟-山梨醇)是一种比较有前途的针对肠杆菌科细菌靶向标记示踪剂[18-20]。尽管如此,18F-FDG PET/CT由于价格昂贵,采集过程时间较长等原因,目前18F-FDG PET/CT主要应用于肿瘤疾病的诊断和分期中,在包括SAP继发感染在内的无菌性炎症/感染疾病中的应用尚未广泛开展。
本研究中SAP动物模型的构建至关重要。目前,应用最广泛的方法是逆行胰腺胆管微泵注射法,选用的试剂通常为1.5% ~ 5%的牛黄胆酸钠[21-22]。研究[23]显示牛黄胆酸钠注射浓度过高,动物死亡率增加,浓度过低时,胰腺组织病理学和生化指标与高浓度时存在差异。因此,本研究选择中位浓度3.6%。本研究中“两步走”建立继发感染模型的优点在于:(1)不需要将细菌和高浓度的牛磺胆酸钠混合,从而造成细菌的死亡;(2)建立具有优良效果的动物模型[24]。有报道[25]显示应用头皮针花费较低,操作简便。但是,本研究发现使用头皮针构建模型时,容易对十二指肠乳头和胰腺管道造成损伤,诱导剂外溢引发造模失败。本研究采用操作步骤较为繁琐,但相对来说较为安全的24G静脉留置针作为穿刺注射器。
本研究中选择大肠埃希菌和金黄色葡萄球菌作为研究菌株,原因在于大肠埃希菌是人体肠道常见的机会致病菌,金黄色葡萄球菌是人体皮肤呼吸道黏膜机会致病菌[26]。引起SAP继发感染的病原体以大肠埃希菌为主,可以达到15%以上[27]。近十年来,SAP患者中预防性使用抗菌药物来降低病死率已经达成共识;但是,长期使用抗菌药物是继发真菌感染和耐药菌感染的一个危险因素;因此,及时发现感染并检测病原体,从而合理给予抗菌药物是减轻抗菌药物选择压力、降低多重耐药菌的产生和扩散[5,26,28-30]。为探索18F-FDG PET/CT早期显像的时效性,本实验将显像时间大大提前,显像时间定为细菌定植感染后3 h,是细菌稳定后的快速增长期。目前,国内外研究显像时间一般以天计数,感染后数小时内的早期显像研究报道较少[18-19]。
综上所述,本研究发现18F-FDG PET/CT在SAP继发感染的早期识别中有着重要价值,这不但有助于提高对疾病及继发改变的认识,也为抗菌药物早期应用提供依据,从而降低多重耐药菌的产生和扩散。本研究尚存在一些局限,如实验动物数量有限、类型单一;动物模型构建的继发感染与人体内复杂的疾病可能不同;细菌定植和增长过程中缺少动态监测的指标和可视化数据。目前,SAP的早期诊断仍需更多实验进一步探索研究。
[参考文献]
[1] Peery AF, Dellon ES, Lund J, et al. Burden of gastrointestinal disease in the United States: 2012 update[J]. Gastroenterology, 2012, 143(5): 1179-1187.
[2] Banks PA, Freeman ML. Practice guidelines in acute pancreatitis[J]. Am J Gastroenterol, 2006, 101(10): 2379-2400.
[3] Schepers NJ, Besselink MG, van Santvoort HC, et al. Early management of acute pancreatitis[J]. Best Pract Res Clin Gastroenterol, 2013, 27(5): 727-743.
[4] 李凤舞, 王红.急性坏死性胰腺炎感染期的诊断与治疗进展[J].临床和实验医学杂志, 2013, 12(10):812-815.
[5] Schwender BJ, Gordon SR, Gardner TB. Risk factors for the development of intra-abdominal fungal infections in acute pancreatitis[J]. Pancreas, 2015, 44(5): 805-807.
[6] Zhang J, Yuan C, Hua G, et al. Early gut barrier dysfunction in patients with severe acute pancreatitis: attenuated by continuous blood purification treatment[J]. Int J Artif Organs, 2010, 33(10): 706-715.
[7] Lankisch PG, Apte M, Banks PA. Acute pancreatitis[J]. Lancet, 2015, 386(9988): 85-96.
[8] Doctor N, Philip S, Gandhi V, et al. Analysis of the delayed approach to the management of infected pancreatic necrosis[J]. World J Gastroenterol, 2011, 17(3): 366-371.
[9] Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference[J]. Crit Care Med, 2003, 31(4): 1250-1256.
[10] 谭超超, 吴意, 曹友德, 等.PCT在感染性坏死性胰腺炎中的诊断价值[J].中国现代医学杂志, 2012, 22(7):56-59.
[11] 彭红芬, 张东友, 马志娟, 等.CT、MRI在急性胰腺炎诊断中的价值对比研究[J].实用医学杂志, 2013, 29(10):1649-1651.
[12] 郭子皓, 郝建宇.急性胰腺炎感染的诊治进展及国内外指南解读[J].中国实用内科杂志, 2014, 34(9):850-852.
[13] Pocard M, Soyer P. CT of acute pancreatitis: a matter of time[J]. Diagn Interv Imaging, 2015, 96(2): 129-131.
[14] 王瑶, 张友健, 叶美玲, 等.重症急性胰腺炎继发感染的病原菌分布及临床特点分析[J].实用医学杂志, 2017, 33(22):3773-3776.
[15] Ertay T, Sencan Eren M, Karaman M, et al.18F-FDG-PET/CT in initiation and progression of inflammation and infection[J]. Mol Imaging Radionucl Ther, 2017, 26(2): 47-52.
[16] Hess S, Hansson SH, Pedersen KT, et al. FDG-PET/CT in infectious and inflammatory diseases[J]. PET Clin, 2014, 9(4): 497-519.
[17] Sangeetha B, Sarat Chandra V, Praveen N, et al. Tunnel infection diagnosed by 18 F-FDG PET/CT scan[J]. CEN Case Rep, 2018, 7(1): 180-182.
[18] Weinstein EA, Ordonez AA, Demarco VP, et al. Imaging Enterobacteriaceae infection in vivo with18F-fluorodeoxysorbitol positron emission tomography[J]. Sci Transl Med, 2014, 6(259): 259ra146.
[19] Li J, Zheng H, Fodah R, et al. Validation of 2-18F-fluorodeoxysorbitol as a potential radiopharmaceutical for imaging bacterial infection in the lung[J]. J Nucl Med, 2018, 59(1): 134-139.
[20] Li ZB, Wu Z, Cao Q, et al. The synthesis of18F-FDS and its potential application in molecular imaging[J]. Mol Imaging Biol, 2008, 10(2): 92-98.
[21] Aho HJ, Nevalainen TJ, Lindberg RL, et al. Experimental pancreatitis in the rat. The role of phospholipase A in sodium taurocholate-induced acute haemorrhagic pancreatitis[J]. Scand J Gastroenterol, 1980, 15(8): 1027-1031.
[22] Aho HJ, Ahola RA, Tolvanen AM, et al. Experimental pancreatitis in the rat. Changes in pulmonary phospholipids during sodium taurocholate-induced acute pancreatitis[J]. Res Exp Med, 1983, 182(1): 79-84.
[23] Liang HY, Chen T, Wang T, et al. Time course of intestinal barrier function injury in a sodium taurocholate-induced severe acute pancreatitis in rat model[J]. J Dig Dis, 2014, 15(7): 386-393.
[24] 周蒙滔, 张启瑜, 邱燕军, 等.牛磺胆酸钠混合大肠杆菌逆行胰管注射法建立感染性坏死性胰腺炎大鼠模型[J].中华肝胆外科杂志, 2006, 12(7):459-462.
[25] Zhang XP, Ye Q, Jiang XG, et al. Preparation method of an ideal model of multiple organ injury of rat with severe acute pancreatitis[J]. World J Gastroenterol, 2007, 13(34): 4566-4573.
[26] Su MS, Lin MH, Zhao QH, et al. Clinical study of distribution and drug resistance of pathogens in patients with severe acute pancreatitis[J]. Chin Med J (Engl), 2012, 125(10): 1772-1776.
[27] 刘敏雪, 戴仲秋, 王远芳, 等.不同临床类型胰腺炎患者病原学感染的特点[J].世界华人消化杂志, 2015, 23(30):4905-4910.
[28] Greenberg JA, Hsu J, Bawazeer M, et al. Clinical practice guideline: management of acute pancreatitis[J]. Can J Surg, 2016, 59(2): 128-140.
[29] 黄勋, 邓子德, 倪语星, 等.多重耐药菌医院感染预防与控制中国专家共识[J].中国感染控制杂志, 2015, 14(1):1-9.
[30] 吴安华.提高常规手段执行力应对超级细菌挑战[J].中国感染控制杂志, 2011, 10(1):1-4.
