固相萃取-紫外可见分光光度比色法测定金花茶中总皂苷含量
2018-06-30曾永明陈松武栾洁周丽珠蒙芳慧罗玉芬韦晓娟廖仲秋
曾永明 陈松武 栾洁 周丽珠 蒙芳慧 罗玉芬 韦晓娟 廖仲秋


【摘 要】金花茶叶、花中的总皂甙测定方法尚无国家标准。采用VM24固相萃取提取装置具有洗脱液流速恒定可控、可批量处理,保证试验系统的密闭性等优点,可保证结果的平行性和准确性。用CNWBOND Alumina-N/XAD-2 SPE Cartridge固相萃取小柱、对总皂苷测定前处理过程进行了优化,整套方法简单,数据结果离散性小,平行性得到提高。人参皂苷Re含量(mg)的回归方程为y=8.149 9x+0.234 1,R2=0.999 1,结果表明,总皂苷(以人參皂苷Re计)在0.000 0~0.114 2 mg范围内线性关系良好。
【关键词】金花茶;总皂甙;固相萃取;紫外分光光度法
【中图分类号】R284.1 【文献标识码】A 【文章编号】1674-0688(2018)12-0073-02
金花茶[Camellia chrysanth(Hu)Tuyama]系山茶科(Theaceae)、山茶属(Camellia)、金花茶组(set.Chrysantha)植物,是中国特产的传统名茶,也是世界性的名贵观赏植物。金花茶化学成份复杂,其主要活性物质有皂甙、黄酮、茶多酚、茶多糖等,研究证实金花茶中物质具有降低血清中胆固醇、提高机体免疫能力、抑制肿瘤生长、降血脂、降血糖等多种生理功能。总皂甙是金花茶叶、花的主要活性成分之一,目前金花茶叶、花中的总皂甙测定方法尚无国家标准,大多都是按照《保健食品检验与评价技术规范 (2003年版)》“保健食品中总皂甙的测定”方法检测,本文主要研究金花茶叶、花总皂甙含量的固相萃取-紫外可见分光光度比色法测定方法,并以相对标准偏差、稳定性、加标回收率为指标进行方法验证,取得了可靠的试验结果。
1 实验目的
目前金花茶叶、花中的总皂甙测定方法尚无国家标准,大多都是按照《保健食品检验与评价技术规范(2003年版)》“保健食品中总皂甙的测定”方法检测。该方法采用人参皂苷Re为对照,用香草醛比色法测定总皂苷,其显色体系为香草醛-冰醋酸-高氯酸。但在实际操作和相关文献报道中,采用该方法检测的结果误差较大,尤其是不同实验室间测定结果差异更大,不利于产品的质量控制。
本实验采用VM24固相萃取提取装置具有洗脱液流速恒定可控、可批量处理、保证实验系统的密闭性等优点,可保证结果的平行性和准确性。用CNWBOND Alumina-N/XAD-
2 SPE Cartridge固相萃取小柱(规格0.8 g/2.7 g,6 mL)、对总皂苷测定前处理过程进行了优化,整套方法简单,数据结果离散性小,平行性得到提高。
2 实验方法
2.1 标准溶液制备
精密称取5.71 mg人参皂苷Re对照品置于25 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀。吸取10 mL人参皂苷Re标准溶液(0.228 4 mg/mL)放蒸发皿中,水浴(低于60 ℃)挥干,准确加入10 mL水溶解,作为标准溶液。
2.2 样品溶液制备
精密称取适量样品,置于50 mL离心管中,加水适量溶解,超声30 min,放置至室温,用水稀释至刻度,摇匀,
3 500 r/min离心5 min,0.45μm微孔滤膜过滤。
2.3 样品溶液吸附及洗脱
取样品溶液上清液置于收集管中(大于2 mL),放置于VM24固相萃取系统中,按以下步骤进行吸附及洗脱。
(1)活化:在固相萃取柱中,以2.5 mL/min流速冲洗70%乙醇25 mL,然后以2.5 mL/min流速冲洗水25 mL。
(2)上样:以1 mL/min流速加1 mL样品溶液于固相萃取柱中。
(3)洗脱:以0.8 mL/min流速,依次用25 mL水,25 mL70%乙醇进行洗脱,收集70%乙醇洗脱液。
(4)挥干:将收集的洗脱液转入50 mL的刻度试管中,在60 ℃下氮气吹干。
2.4 显色与测定
在上述已挥干的洗脱液中准确加入0.2 mL5%香草醛冰乙酸溶液,使残渣全部溶解,再加0.8 mL高氯酸,混匀后60 ℃水浴上加热10 min,冰浴冷却后,准确加入冰乙酸5.0 mL,摇匀后,以1 cm比色管于540 nm波长处与标准管一起进行比色测定。实验方案见表1。
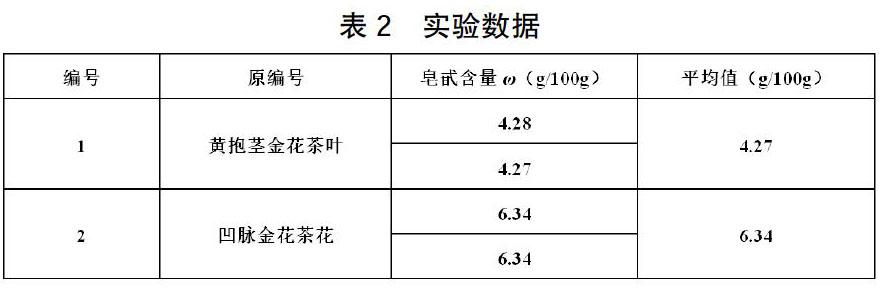
3 实验数据
样品含量测定:分别取金花茶叶、花,进行测定,于540 nm波长处测定吸光度值,根据所得到的标准曲线计算样品中总皂苷的含量。实验数据见表2。
4 结果分析及讨论
线性关系考察:精密吸取前述“2.1”项标准溶液0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL人参皂苷Re标准溶液(0.228 4 mg/mL),按“2.3”“2.4”项的方法进行前处理并测定。以吸光度值为横坐标,以人参皂苷Re含量(mg)为纵坐标进行回归计算,回归方程为y=8.149 9x+0.234 1,R2=0.999 1,结果表明,总皂苷(以人参皂苷Re计)在0.000 0~0.114 2 mg范围内线性关系良好,图1为线性关系图。
加样回收率试验:采用加标回收率法,精密称取金花茶花适量,分别按样品量100%的比例各6份加入对照品,进行测定,并分别计算回收率,结果加标回收率在99.58%~100.05%,RSD0.18%,并与传统方法(手填层析柱、人工进行柱洗脱)进行比较,表明该方法准确度良好,且离散度低于传统方法。加样回收率试验结果见表3。凹脉金花茶花加标回收率试验结果见表4。
5 稳定性试验
将显色后样品分别放置0 h、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h,测定吸光值,结果表明该显色体系在1 h内吸光度基本不变,1 h后吸光度有所降低,故在显色后1 h内测定。
6 讨论
(1)《保健食品检验与评价技术规范(2003年版)》中,保健食品总皂苷的测定,样品采用过大孔吸附树脂,再加显色剂显色后测定吸收值。操作过程中,在柱层析时,树脂活化的时间长短以及样品在过柱时,洗脱速度快慢不一,使得测定的总皂苷结果誤差较大,无法确保检测结果稳定。采用VM24固相萃取提取装置具有洗脱液流速恒定可控、树脂活化时间适当延长,可大批量处理样品,保证实验系统的密闭性等优点,可保证结果的平行性和准确性。
(2)不同厂家的大孔树脂、填料松紧和载药量也对总皂苷测定影响较大,选择CNWBOND Alumina-N/XAD-2 SPE Cartridge固相萃取小柱,简化实验前处理过程,数据结果离散性小,平行性得到提高。
(3)本实验分析的金花茶有叶和花,在上柱前的样品需经离心,并经微孔滤膜过滤,保证不阻塞固相萃取提取仪进样系统。
(4)对于总皂苷的测定实验,柱层析是关键步骤,而柱层析的关键在于柱子是否装好和淋洗剂是否选择恰当。传统手装的柱子很难保证填料的质量相同、松紧一致,在洗脱过程中可能会出现气泡,柱子塌陷等现象,进而导致提取效果不佳,测定的数据重复性差。CNWBOND Alumina-N/XAD-2 SPE Cartridge固相萃取小柱将所需的填料质量细化,并且采用了砂芯隔板,使填料的松紧一致,而且顶端的砂芯隔板使层析面平整,在洗脱时防止了柱子内部质量不均现象出现,优化了本实验的前处理方案。采用SPE小柱进行多次试验,发现试验的数据重复性明显优于传统实验方案。将CNWBOND Alumina-N/XAD-2 SPE Cartridge固相萃取小柱与VM24固相萃取仪相结合,也实现了多批样品的同时测定,减轻实验室工作量。
参 考 文 献
[1]苏琳,莫建光,韦英亮,等.金花茶叶皂苷类成分研究[J].中草药,2012,43(5):877-879.
[2]陈全斌,湛志华,张巧云,等.金花茶叶中黄酮甙元的分离提纯及其表征[J].广西热带农业,2005(6):10-11.
[3]邹登峰,张可锋,高雅,等.金花茶生药学研究[J].中药与天然药物,2008,20(6):85-86.
[4]宁恩创,熊燕,韦璐,等.金花茶黄酮的分离及体外抗氧化活性研究[J].广西轻工业,2011(3):1-2,19.
[5]秦小明,林华娟,宁思创,等.金花茶也水提物的抗氧化活性初探[J].食品科技,2008,(2):189-191.
[6]覃小玲,史艳财,韦霄,等.FTIR比较分析与鉴定3种金花茶叶片中的化学成分[J].光谱实验室,2012,29(3):1303-1307.
[7]田晓春,秦小明,林华娟,等.金花茶多糖理化性质的研究[J].中国食品学报,2011,11(8):47-52.
[8]林华娟,田晓春,秦小明,等.金花茶多糖单一成分的化学结构特征解析[J].食品科学,2013,34(3):141-146.
[9]彭晓,于大永,冯宝民,等.金花茶花化学成分的研究[J].广西植物,2011,31(4):550-553.
[10]曾秋文,林华娟,秦小明,等.金花茶皂甙的分离纯化研究[J].食品科技,2010(10):233.
