液相色谱串联质谱法测定猪肉中克伦特罗手性对映体残留量
2015-08-08陈国等
陈国等
摘 要:建立测定猪肉中克伦特罗手性对映异构体残留量的液相色谱串联质谱分析方法。5 g猪肉样品在碱化的条件下用乙酸乙酯提取,提取后用稀盐酸进行反萃取,萃取液过SCX固相萃取小柱,最后用5%氨化甲醇洗脱,洗脱液经氮气吹干后用500 μL甲醇(含0.02%的乙酸和0.1%的乙酸铵)定容。采用Astec CHIROBIOTICTM V手性色谱柱,以甲醇∶冰乙酸∶乙酸铵=99.88∶0.02∶0.10(V/V)为流动相进行液相分离,电喷雾正离子(ESI+)模式电离,多反应监测(MRM)模式检测,内标法定量。克伦特罗单一对映体在2.0~200 μg/L质量浓度范围内呈良好的线性,线性相关系数均大于0.997 0,猪肉样品中克伦特罗最低检测限和定量限分别为0.10 μg/kg和0.25 μg/kg。猪肉中克伦特罗手性对映体在0.25~0.75 μg/kg范围内的回收率为95.8%~102.1%之间,相对标准偏差均小于5%。
关键词:克伦特罗;手性对映体;液相色谱串联质谱法;固相萃取
Determination of Residual Clenbuterol Enantiomers in Pork by Liquid Chromatography with Tandem Mass Spectrometry
CHEN Guo1, LIU Yongjun2, Lü Yan1, SUN Yami1, WU Yinliang1,*
(1. The Ningbo Academy of Agricultural Sciences, Ningbo 315040, China;
2. The Center for Animal Disease Control and Prevention of China, Beijing 100125, China )
Abstract: A method was developed for determining residual clenbuterol enantiomers in pork by liquid chromatography with tandem mass spectrometry. Five grams of samples were extracted with ethyl acetate under basic condition. Then, clenbuterol enantiomers were back-extracted from the extracts using diluted hydrochloric acid. The hydrochloric acid extract was purified by SCX solid phase extraction (SPE) cartridge. The eluent was dried by blowing nitrogen and the residue was dissolved in 500 μL of methanol with 0.02% acetic acid and 0.1% ammonium acetate. The analytes were analyzed by LC-MS/MS on a chiral column (Astec CHIOBIOTICTM V) with a mixture of methanol-acetic acid-ammonium acetate as the mobile phase and quantified by the internal standard calibration curve method. Good linearities were obtained for two enantiomers in the concentration range of 2.0 – 200 μg/L with a correlation coefficient more than 0.997 0. The recoveries for the two enantiomers in pork were 95.8% – 102.1% at the fortified levels of 0.25 – 0.75 μg/kg with relative standard deviations less than 5%. The limits of detection (LOD) and quantitation (LOQ)were 0.10 and 0.25 μg/kg, respectively.
Key words: clenbuterol; enantiomers; liquid chromatography with tandem mass spectrometry; solid phase extraction
中图分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2015)05-0022-05
doi: 10.7506/rlyj1001-8123-201505006
克伦特罗(clenbuterol)俗称“瘦肉精”,曾常被非法应用于畜牧业,用来提高酮体瘦肉率。然而,由于克伦特罗易在动物组织中形成残留,曾多次发生严重的人畜中毒事故。目前,我国和欧盟已禁止克伦特罗作为生长促进剂使用。然而在评估克伦特罗对人体健康造成的危害时,往往对该药物作为单一化合物来看待,未考虑其是手性药物这一特征。而手性药物不同异构体之间在毒性、致畸、致癌、致突变上往往存在差异,必然导致对其危害估计不准确。因此若要更加科学评估该药物对人体健康造成的危害,首先应建立该药物在动物组织中的对映体残留分析方法。
由于包括克伦特罗在内的β2-受体激动剂类药物对动物性食品安全的影响较大,目前无论国内外对动物性食品中β2-受体激动剂类药物残留的分析方法较多,主要有酶联免疫吸附法[1-3]、液相色谱法[4-7]、气相色谱质谱法(gas chromatography,GC)[8-11]和液相色谱串联质谱(liquid chromatography tandem mass spectrometry,
LC-MS/MS)法 [12-18]等;但对生物样品中克伦特罗对映体水平上的分析方法研究多集中在生物体液,而对动物组织中的对映体分析报道相对较少,且所采用的分析手段主要为气相色谱法和液相色谱法。氧氟沙星的手性分离方法主要包括采用手性流动相或衍生的方法以及采用手性色谱柱进行分离[19-20]。本实验采用手性色谱柱实现了克伦特罗对映体的拆分,并在前期对动物性食品中β2-受体激动剂类药物残留分析方法研究的基础上,建立提取、净化效果较好,分离相对较快的猪肉中克伦特罗对映体残留量分析方法,该方法的建立为进一步研究克伦特罗在对映体水平上的毒性毒理、代谢等提供参考。
1 材料与方法
1.1 材料与试剂
空白猪肉样品购于宁波市江东区欧尚超市,实验用肉猪为健康肉猪,体质量70 kg左右,用药前测定是否含克伦特罗。
盐酸克伦特罗(99%) 中国药品生物制品检定所;盐酸克伦特罗-D9(100 μg/L) 德国
Dr. Ehrenstorfer公司;甲醇(色谱纯) 美国默克公司;
甲酸(色谱纯) 美国天地有限公司;强阳离子交换柱(SCX,500 mg/3 mL) 美国Supelco公司;其他试剂均为分析纯试剂。
1.2 仪器与设备
液相色谱串联质谱联用仪 美国Waters公司;3K15离心机 美国Sigma公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
1.3.1.1 标准储备液
准确称取含100.0 mg克伦特罗的标准品于100 mL容量瓶中,用甲醇定容至刻度,得克伦特罗标准储备液,该储备液含单一克伦特罗对映体质量浓度为500 μg/mL。
1.3.1.2 标准工作液
用流动相稀释克伦特罗标准储备液配制含单一对映体质量浓度分别为2、10、20、50、100、200 μg/L的标准工作液,各工作液中含克伦特罗-D9单一对映异构体质量浓度均为25 μg/L,现配现用。
1.3.2 样品前处理
准确称取5.0 g猪肉样品于带盖的50 mL聚四氟乙烯离心管中,加入3 mL 10%碳酸钠溶液,再加入20 mL乙酸乙酯,旋涡混合30 s, 5 000 r/min离心2 min,吸取上层溶液,再以15 mL乙酸乙酯同样步骤提取1次,合并提取液;在收集的提取液中加入5 mL 0.20 mol/L的盐酸溶液,旋涡混合30 s,5 000 r/min离心2 min,吸取下层溶液,同样步骤重复萃取1 次,合并2 次萃取液。混匀萃取液后过已经5 mL甲醇、5 mL水和5 mL 30 mmol/L盐酸活化的SCX小柱,在溶剂流过固相萃取柱后,抽干SCX小柱,再用5 mL 4%氨化甲醇溶液洗脱,在50 ℃水浴中用氮气吹干上述洗脱液,待试管冷却后加入500 mL流动相溶解,过0.22 μm滤膜后进行LC-MS/MS分析。
1.3.3 仪器条件
色谱柱Astec CHIROBIOTICTM V手性色谱柱(250 mm×4.6 mm,5.0 μm);流动相:甲醇∶乙酸∶乙酸胺=99.88∶0.02∶0.10(V/V),流速1.0 mL/min,柱温30 ℃;进样量50 μL。ESI正离子电离模式;毛细管电压3.9 kV;源温110 ℃;去溶剂气温度350 ℃;克伦特罗监测离子对分别为277>203、277>168和277>132;克伦特罗-D9监测离子对286>204。
2 结果与分析
2.1 分离条件的选择和优化
目前对于分离克伦特罗对映体,最有效的方式采用大环内酯类抗生素型手性色谱柱来进行分离。本研究采用Astec CHIROBIOTICTM V手性色谱柱在甲醇-冰乙酸-乙酸铵体系内对克伦特罗对映体进行了拆分,结果发现当柱温30 ℃时,同一乙酸浓度下,乙酸胺浓度增加时,分离度降低,分析时间缩短,灵敏度增高;同样在同一乙酸铵浓度下,乙酸浓度增加时分离度降低,分析时间缩短,灵敏度增高。而通过已有的研究可知包括克伦特罗在内的β2-受体激动剂与大环内酯类药物手性固定相最重要的相互作用主要为氢键作用、π-π电子相互转移、偶极诱导作用。而本实验主要是通过乙酸和乙酸胺浓度的变化影响氢键作用后导致两对映体的洗脱速度发生变化最终造成出峰时间和分离度变化。为了在保证克伦特罗对映体分离的情况下尽可能获得最大的灵敏度,因此本方法进行残留分析时最终选择甲醇∶乙酸∶乙酸胺=
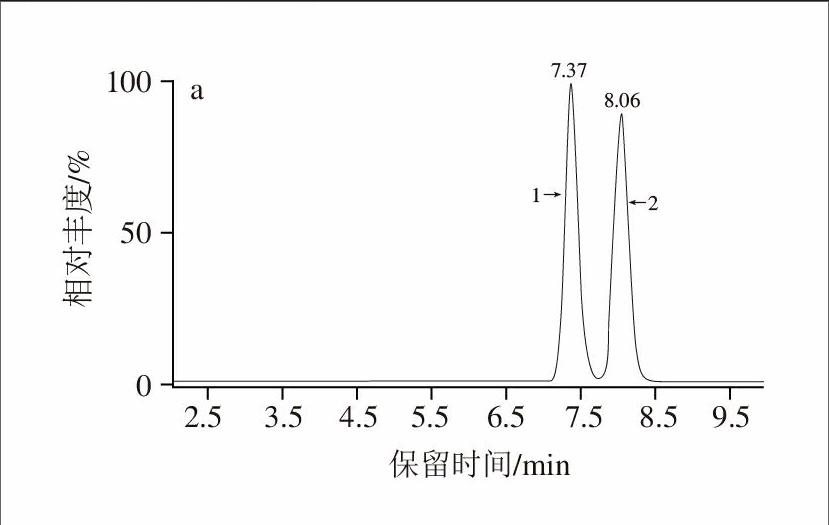
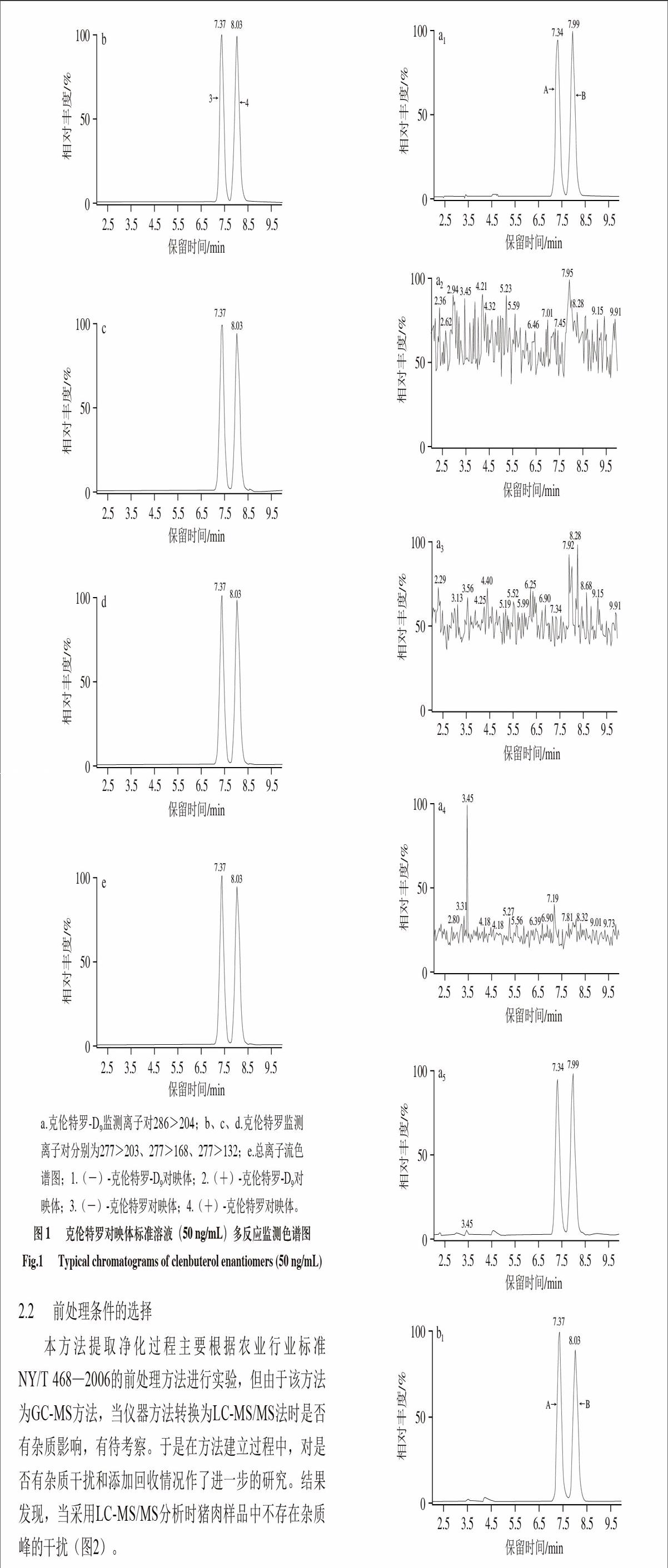
99.88∶0.02∶0.10(V/V)作为流动相。在此条件下,先出峰的为(-)-对映体,后出峰的为(+)-对映体,两对映体分离良好(图1)。
a.克伦特罗-D9监测离子对286>204;b、c、d.克伦特罗监测离子对分别为277>203、277>168、277>132;e.总离子流色谱图;1.(-)-克伦特罗-D9对映体;2.(+)-克伦特罗-D9对映体;3.(-)-克伦特罗对映体;4.(+)-克伦特罗对映体。
图 1 克伦特罗对映体标准溶液(50 ng/mL)多反应监测色谱图
Fig.1 Typical chromatograms of clenbuterol enantiomers (50 ng/mL)
2.2 前处理条件的选择
本方法提取净化过程主要根据农业行业标准
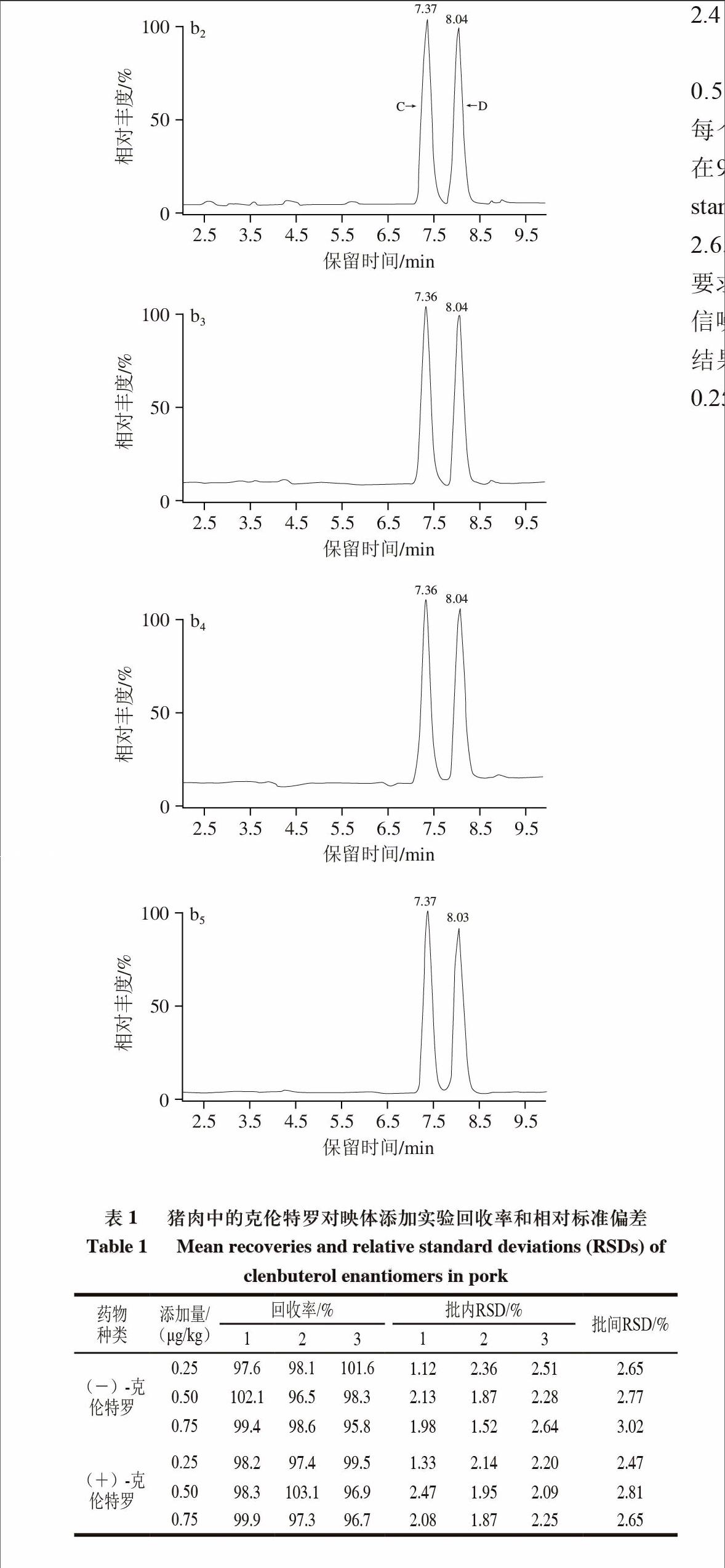
NY/T 468—2006的前处理方法进行实验,但由于该方法为GC-MS方法,当仪器方法转换为LC-MS/MS法时是否有杂质影响,有待考察。于是在方法建立过程中,对是否有杂质干扰和添加回收情况作了进一步的研究。结果发现,当采用LC-MS/MS分析时猪肉样品中不存在杂质峰的干扰(图2)。
1.克伦特罗-D9监测离子对286>204;2~4.克伦特罗监测离子对分别为277>203、277>168、277>132;5.总离子流色谱图;A.(-)-克伦特罗-D9对映体;B.(+)-克伦特罗-D9对映体;C.(-)-克伦特罗对映体;D.(+)-克伦特罗对映体。
图 2 猪肉空白样品(a)和猪肉添加样品(b, 0.50 μg/kg)色谱图
Fig.2 Chromatograms of clenbuterol enantiomers in blank pork (a) and pork fortified sample (b, 0.50 μg/kg)
2.3 线性实验
根据1.3.1.2节配制标准工作溶液,对克伦特罗2 种对映异构体在2.0~200 μg/L质量浓度范围内以待测物定量离子对与内标离子对峰面积比值对质量浓度作图,所得标准曲线方程分别为y=0.044 4x―0.073 4((―)-克伦特罗对映体)和y=0.043 7x―0.066 9((+)-克伦特罗对映体),相关系数(R2)分别为0.997 7和0.997 0,说明本方法适用于2 种克伦特罗对映体残留量的定量分析。
2.4 回收率、精密度和检出限
取空白猪肉样品,加入标准工作溶液配制成0.25、0.50、0.75 μg/kg的加标样品,按照1.3.2节进行操作,每个添加水平重复3 次。从表1可见,各添加量回收率在95.8%~103.1%之间。批内相对标准偏差(relative standard deviation,RSD)为1.12%~2.64%,批间RSD为2.65%~3.02%,可见该方法能满足现行药物残留分析的要求。本实验选择0.25 μg/kg添加实验中响应最低样品的信噪比,并按RSN=3计算2 种克伦特罗对映体的检出限,结果均为0.10 μg/kg;按RSN=10计算定量限,结果均为0.25 μg/kg。
表 1 猪肉中的克伦特罗对映体添加实验回收率和相对标准偏差
2.5 方法应用
利用该方法进行了克伦特罗外消旋体在猪体内克伦特罗立体选择性降解行为实验,停药后7 d测定猪肉中克伦特罗2个对映体含量,发现(-)-克伦特罗对映体含量为1.45 μg/g,(+)-克伦特罗对映体含量为1.76 μg/g,可见克伦特罗外消旋体在猪体内降解存在立体选择性。
3 结 论
本研究建立了猪肉中克伦特罗对映体测定的LC-MS/MS方法。猪肉样品在碱性条件下用乙酸乙酯提取,经稀盐酸反萃取后通过SCX固相萃取小柱净化,净化后的样品利用手性色谱柱进行分离,进行LC-MS/MS法测定。该方法具有快速、灵敏、准确的特点,利用该方法可为进一步开展克伦特罗在对映体水平上的毒性毒理、代谢等提供参考。
参考文献:
[1] 王选年, 杨艳艳, 李青梅, 等. 盐酸克伦特罗单克隆抗体的制备及其特性[J]. 河南农业科学, 2002, 31(6): 30-33.
[2] 王选年, 杨艳艳, 邢广旭, 等. 盐酸克伦特罗单克快速检测试剂盒的研制[J]. 中国兽医学报, 2004, 24(1): 75-78.
[3] SHEU S Y, LEI Y C, TAI Y T, et al. Screening of salbutamol residues in swine meat and animal feed by an enzyme immunoassay in Taiwan[J]. Analytica Chimica Acta, 2009, 654: 148-153.
[4] RASHID B A, KWASOWSKI P, STEVENSON D. Solid phase extraction of clenbuterol from plasma using immunoaffinity followed by HPLC[J]. Journal of Pharmaceutical and Biomedical Analysis, 1999, 21: 635-639.
[5] LAWRENCE J F, M?NARD C. Determination of clenbuterol in beef liver and muscle tissue using immunoaffinity chromatograhic cleanup and liquid chromatography with ultraviolet absorbance detection[J]. Journal of Chromatography B, 1997, 696: 291-297.
[6] ARESTA A, PALMISANO C F, ZAMBONIN C G. Determination of clenbuterol in human urine and serum by solid-phase microectraction coupled to liquid chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47: 641-645.
[7] POSYNIAK A, ZMUDZKI J, NIEDZIELSKA J. Screening procedures for clenbuterol residue determination in bovine urine and liver matrices using enzyme-linked immunosorbent assay and liquid chromatography[J]. Analytica Chimica Acta, 2003, 483: 61-67.
[8] 吴银良, 李晓薇, 刘素英, 等. 气相色谱-质谱法测定肝脏组织中盐酸克伦特罗和盐酸莱克多巴胺[J]. 分析化学, 2006, 34(8): 1083-1086.
[9] 孙泽祥, 鲍伟华, 杨挺, 等. 克伦特罗在猪尿液和血液中残留消除相关性研究[J]. 中国畜牧兽医, 2010, 37(8): 160-163.
[10] WANG L, LI Y Q, ZHOU Y K, et al. Determination of four β2-agonists in meat, liver and kidney by GC-MS with dual internal standards[J]. Chromatographia, 2010, 71: 737-739.
[11] GONZ?LEZ P, FENTE C A, FRANCO C, et al. Determination of residues of the β-agonist clenbuterol in liver of medicated farm animals by gas chromatography-mass spectrometry using diphasic dialysis as an extraction procedure[J]. Journal of Chromatography B, 1997, 693: 321-326.
[12] NIELEN M W F, LASAROMS J J P, ESSERS M L, et al. Multiresidue analysis of beta-agonists in bovine and porcine urine, feed and hair using liquid chromatography electrospray ionisation tandem mass spectrometry[J]. Analytical Bioanalytical Chemistry, 2008, 391: 199-210.
[13] BLANCA J, MUNOZ P, MORGADO M, et al. Determination of clenbuterol, ractopamine and zilpaterol in liver and urine by liquid chromatography tandem mass spectrometry[J]. Analytica Chimica Acta, 2005, 529: 199-205.
[14] ZHENG H, DENG L G, LU X, et al. UPLC-ESI-MS-MS determination of three β2-agonists in pork[J]. Chromatographia, 2010, 72: 79-84.
[15] DU X D, WU Y L, YANG H J, et al. Simultaneous determination of 10 β2-agonists in swine urine using liquid chromatography-tandem mass spectrometry and multi-walled carbon nanotubes as a reversed dispersive solid phase extraction sorbent[J]. Journal of Chromatography A, 2012, 1260: 25-32.
[16] SHISHANI E, CHAI S C, JAMOKHA S, et al. Determination of ractopamine in animal tissues by liquid chromatography-fluorescence and liquid chromatography/tandem mass spectrometry[J]. Analytica Chimica Acta, 2003, 483: 137-145.
[17] WILLIAMS L D, CHURCHWELL M I, DOERGE D R. Multiresidue confirmation of β-agonists in bovine retina and liver using LC-ES/MS/MS[J]. Journal of Chromatography B, 2004, 813: 35-45.
[18] THEVIS M, SCHEBALKIN T, THOMAS A, et al. Quantification of clenbuterol in human plasma and urine by liquid chromatography-tandem mass spectrometry[J]. Chromatographia, 2005, 62: 435-439.
[19] 吴银良, 杨挺, 单吉浩, 等. 高效液相色谱法测定猪尿中克伦特罗对映异构体残留量[J]. 分析化学, 2010, 38(6): 833-837.
[20] SMITH D J. Stereochemical composition of clenbuterol residues in edible tissues of swine[J]. Journal of Agricultural and Food Chemistry, 2000, 48(12): 6036-6043.
