2型糖尿病家族血清vaspin水平与瘦素、hs-CRP及炎症因子的相关性
2018-06-30孙明珠李秀丽权晓娟于俊霞
孙明珠,李秀丽,权晓娟,于俊霞
(西安交通大学医学院第二附属医院内分泌科二病区,西安 710004;*
2型糖尿病(type 2 diabetes mellitus,T2DM)是世界性公共卫生问题,近年来研究发现T2DM发生发展的过程是一种慢性的炎症过程,炎症反应在T2DM发生发展以及其并发症发病机制中起着非常重要的作用[1]。炎症因子例如白细胞介素(interleukin,IL)-1、IL-6、IL-18和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等与T2DM的发生发展密切相关[2]。血浆IL-6、瘦素、C反应蛋白(C reaction protein,CRP)、纤维蛋白原和血清淀粉样蛋白A(serum amyloid A,SAA)的变化起着重要的媒介作用,并可以预测T2DM的发生[3]。研究发现T2DM患者血清CRP、SAA和IL-6水平比正常对照健康组明显升高[4]。
vaspin,近年来新发现的一种脂肪细胞因子,是一种内脏脂肪组织丝氨酸蛋白酶抑制剂。既往研究表明vaspin可能作用于白色脂肪组织,发挥着胰岛素增敏的作用,并发现vaspin水平升高可能通过一些未知的蛋白酶对抗肥胖和胰岛素抵抗,从而发挥一种潜在的补偿作用[5]。Heiker等[6]进一步提出,vaspin通过抑制丝氨酸蛋白酶抑制剂家族中的一员—激肽释放酶7而发挥这种补偿作用。在本研究中,我们测定T2DM家族血清vaspin水平和炎症因子的浓度,研究vaspin水平与炎症因子的相关性,寻找二者之间的关系,为揭示vaspin在T2DM发病机制中的作用提供依据,以期获得对临床的指导和研究新的治疗策略提供实验资料。
1 材料和方法
1.1 研究对象
T2DM患者来源于我院2017-01~2017-12门诊或住院患者,健康对照组来源于我院健康体检部,本研究获得伦理委员会批准、所有研究对象均签署书面知情同意书。
T2DM的诊断标准:按WHO 1999年推荐的诊断与分型标准:症状+空腹血糖≥7.0 mmol/L或症状+OGTT 2 h血糖≥11.1 mmol/L,或症状+随机血糖≥11.1 mmol/L,或无症状者须两次空腹血糖≥7.0 mmol/L,或OGTT 2 h血糖≥11.1 mmol/L。
我们将研究对象分三组:①DM组(120例):T2DM患者,且家族中与其有血缘关系的T2DM患者≥2人;②NFDR组(120例):T2DM患者的一级亲属中糖耐量正常者;③NC组(120例):与T2DM无血缘关系且糖耐量正常的健康人群,且经OGTT排除糖尿病空腹血糖受损(IFG)及糖耐量减低(IGT)者。每组按体质量指数(body mass index,BMI)再分为2个小组,即肥胖组(BMI≥25 kg/m2)和非肥胖组(BMI<25 kg/m2)。
排除标准:18岁以下的患者,肾脏病患者除外糖尿病肾病、急性肾损伤,晚期心血管或呼吸系统疾病,晚期慢性肝病、肝炎患者,血清转氨酶水平较正常值升高两倍,自身免疫性疾病,近3个月恶性肿瘤疾病、全身感染性疾病、炎症性疾病或急性缺血性血管疾病患者。
1.2 一般资料的收集
所有研究对象的体检指标均通过受过专业训练的研究小组用标准的调查问卷形式采集。记录并测量所有研究对象的性别、年龄、体质量、身高、臀围和腰围。体质量为脱去外衣及鞋帽后的质量。身高为去鞋后所量净高。腰围测量:被测人取垂直站立姿势,双足分开25-30 cm,使体质量均匀分布,平稳呼吸,用一个无弹性、最小刻度是1 mm的软尺置于右腋中线髂嵴最外侧缘以及第12肋下缘连线的中点,沿水平方向绕腹部一周,紧贴但不压迫皮肤进行测量。臀围测量:通过测量臀围的最大周径而得到。计算腰臀围比值:腰围和臀围的比值是判断脂肪分布的指标,具体计算方法如下:腰臀围比值=腰围(cm)/臀围(cm)。计算体质量指数=体质量(kg)/身高(m2)。使用美国GE内脏脂肪分布计算机断层扫描分析仪测定体脂百分比。并记录其糖尿病病程。抽血前3 d正常饮食,禁酒。禁食8 h以上,抽取空腹肘静脉血3-4 ml,于抽血后2 h内送至实验室,每个血液样本以3 500 r/min离心5 min获得血清,并保存在-80 ℃。
1.3 仪器和试剂及样本检测
瑞士罗氏Integra 800生化分析仪;日本Hitachi 7600全自动生化分析仪;美国Thermo全自动多功能酶标仪;美国GE内脏脂肪分布计算机断层扫描分析仪。空腹血糖采用葡萄糖氧化酶法测定。糖化血红蛋白使用瑞士罗氏Integra 800生化分析仪进行测量。空腹血清胰岛素浓度通过放射免疫分析方法检测(Ray Bio,GA)。血脂系列,包括甘油三酯、总胆固醇、低密度脂蛋白和高密度脂蛋白。使用日本Hitachi 7600全自动生化分析仪测定。所有这些都在同一时间同一地点进行。测算稳态模型胰岛素抵抗指数(HOMA-IR)。计算方法为:空腹血糖的水平(mmol/L)×空腹胰岛素的水平(mIU/L)/22.5。血清vaspin浓度、CRP、TNF-α、IL-1、IL-6和瘦素水平测定采用酶联免疫吸附法(武汉华美生物工程有限公司,中国)使用美国Thermo全自动多功能酶标仪。
1.4 统计学分析
使用SPSS 17.0软件进行统计分析。计量资料是以均数±标准差的方法所表示。如果检验结果符合正态分布,则采用独立样本的t检验。若检验结果为非正态分布的数据,则另采用非参数检测的Mann-WhitneyU检验。本研究所有的计数资料均采用χ2分析。三组之间指标的比较采用协方差分析的方法,把BMI作为协变量进行校正,各组之间的相关性分析采用Pearson分析和线性回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 三组人群一般资料的比较
本研究中,以BMI作协变量,对DM组、NFDR组、NC组三组进行校正后,腰臀比和空腹胰岛素在三组差异无统计学意义(P>0.05)。校正BMI协变量后,甘油三酯在三组中差异有统计学意义(P<0.05),胆固醇、高密度脂蛋白和低密度脂蛋白三组间差异无统计学意义(P>0.05)。BMI、空腹血糖、OGTT 2 h血糖、C肽、糖化血红蛋白、HOMA-IR和体脂百分比在DM组、NFDR组、NC组三组中呈递减趋势,而且三组间的差异具有统计学意义(P<0.05,见表1)。
表1三组一般资料的比较
Table1ComparisonofthegeneraldataamongDMgroup,NFDRgroupandnormalNCgroup

参数DM组NFDR组NC组FP 性别(男/女)75/4571/4972/480.720.058 年龄(岁)66.3±7.0 65.9±10.166.1±9.2 0.930.059 病程(年)11.4±2.7 -- BMI(kg/m2)25.2±4.8 23.9±15.322.7±16.28.770.027 腰臀比0.9±0.20.86±0.3 0.8±0.26.290.069 空腹血糖(mmol/L)7.0±6.96.3±7.36.1±7.47.390.035 OGTT 2h血糖(mmol/L)16.4±11.66.1±5.65.9±5.87.420.037 空腹胰岛素(mIU/ml)22.8±7.5 19.3±7.2 18.3±7.4 9.310.055 C肽(nmol/L)2.5±3.61.7±2.31.6±2.45.310.039 HOMA-IR12.1±3.1 6.9±4.16.1±4.010.250.012 糖化血红蛋白(%)8.8±1.25.6±1.15.4±1.37.160.031 甘油三酯(mmol/L)1.9±1.31.6±0.91.3±0.55.310.042 胆固醇(mmol/L)5.4±1.24.9±1.14.7±1.04.520.074 高密度脂蛋白(mmol/L)1.2±0.21.3±0.31.39±0.555.250.058 低密度脂蛋白(mmol/L)3.2±1.22.9±1.12.8±1.01.220.081 体脂百分比(%)27.3±16.923.8±30.123.4±33.49.230.023
DM组:T2DM患者,且其家族中有血缘关系的T2DM者≥2人;NFDR组:T2DM患者的一级亲属中糖耐量正常者;NC组:与T2DM无血缘关系且糖耐量正常的健康人群,且经OGTT排除糖尿病空腹血糖受损(IFG)及糖耐量减低(IGT)者
2.2 DM组、NFDR组和NC组vaspin和炎症因子比较
IL-6、TNF-α和瘦素浓度在DM组、NFDR组和NC组依次减少,且三组间差异有统计学意义(P<0.05,见表2),IL-1和hs-CRP浓度在三组中差异没有统计学意义,vaspin浓度在DM组、NFDR组、NC组三组中呈递减趋势,而且三组间的差异具有统计学意义(P<0.05,见表2)。
2.3 三组以BMI分层进行vaspin水平的比较
按BMI将各组分为肥胖者和非肥胖者,DM组、NFDR组和NC组三组中肥胖者vaspin水平均比非肥胖者明显升高,组间差异均具有统计学意义(P<0.05);非肥胖者中DM组的vaspin水平比NFDR组和NC组明显升高,组间差异均具有统计学意义(P<0.05),而NFDR组和NC组间差异没有统计学意义(P>0.05,见表3)。
表2三组的vaspin和炎症因子、hs-CRP、瘦素浓度检测
Table2Comparisonofinflammatoryfactors,hs-CRPandleptinbetweenDMgroup,NFDRgroupandnormalcontrolgroup

组别IL-1(pg/ml)IL-6(pg/ml)TNF-α(ng/ml)hs-CRP(mg/dl)瘦素(ng/ml)vaspin(ng/ml) DM组33.8±36.114.9±2.739.6±20.10.5±0.82.2±0.8462.8±31.5 NFDR组30.7±19.512.4±2.829.4±17.00.4±0.82.1±0.7231.7±21.9 NC组31.6±13.411.1±2.325.1±12.10.3±0.42.0±0.3223.1±20.6 F8.329.879.3212.8610.2112.65 P0.0730.0040.0010.2700.0390.008
DM组:T2DM患者,且其家族中有血缘关系的T2DM者≥2人;NFDR组:T2DM患者的一级亲属中糖耐量正常者;NC组:与T2DM无血缘关系且糖耐量正常的健康人群,且经OGTT排除糖尿病空腹血糖受损(IFG)及糖耐量减低(IGT)者
表3三组以BMI分层进行vaspin水平的比较(ng/ml)
Table3Comparisonofvaspinlevelbetweenobeseandnon-obesesubjectsinthreegroups(ng/ml)

参数DM组NFDR组NC组nvaspinnvaspinnvaspin肥胖 68524.1±32.1*71290.8±21.9*65291.1±20.6*非肥胖66408.5±31.5△#59154.5±23.455148.7±21.0
同组与非肥胖者比较,*P<0.05;与NFDR组非肥胖者比较,△P<0.05;与NC组非肥胖者比较,#P<0.05
2.4 vaspin与瘦素、hs-CRP和炎症因子的相关性
对于vaspin水平与炎症因子IL-1,IL-6和TNF-α以及hs-CRP、瘦素水平的相关性,使用线性回归进行多因素分析,在这些参数中,发现IL-6、TNF-α和瘦素水平为影响vaspin水平的重要因素。对DM组使用线性回归进行多因素分析,vaspin水平与IL-6、TNF-α、瘦素呈正相关,vaspin水平与IL-1和hs-CRP水平没有相关性(见表4)。
表4线性回归分析DM组vaspin血清高浓度的相关因素
Table4RelatedfactorsofhighserumconcentrationofvaspininDMpatientsbylinearregressionanalysis
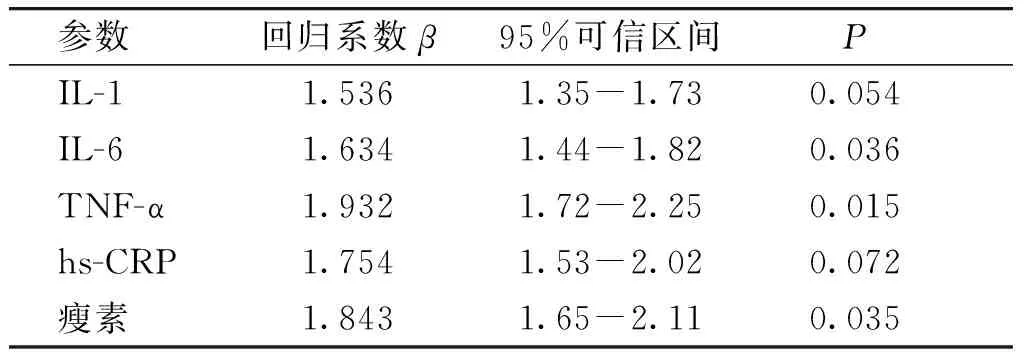
参数回归系数β95%可信区间P IL-11.5361.35-1.730.054 IL-61.6341.44-1.820.036 TNF-α1.9321.72-2.250.015 hs-CRP1.7541.53-2.020.072 瘦素1.8431.65-2.110.035
3 讨论
vaspin最早从OLETF大鼠(the Otsuka Long-Evans Tokushima fatty rat)内脏白色脂肪组织中分离出来,该T2DM动物模型的特点是腹型肥胖、胰岛素抵抗、高血压和血脂异常。vaspin属于丝氨酸蛋白酶抑制剂家族,是内脏脂肪组织分泌的脂肪细胞因子。在脂肪组织的体外培养研究中,vaspin能够增加肥胖小鼠腹内网膜白色脂肪组织和皮下白色脂肪组织中葡萄糖转运子-4(GLUT-4)和脂联素的表达,抑制瘦素、抵抗素和TNF-α的表达[7]。DNA芯片分析发现vaspin能逆转约50%由高脂高糖饮食诱导的白色脂肪组织基因表达的异常[8],但在肝脏和骨骼肌未发现相似作用[9]。在细胞实验中,却没有发现重组人vaspin对体外培养的3T3-L1脂肪细胞具有调节基因表达的作用,而且重组人vaspin对脂肪细胞的葡萄糖摄取作用的影响也不存在[10]。这也许是因为在肥胖的状态下,vaspin通过调节白色脂肪组织基因表达而发挥增强胰岛素敏感性的作用,而vaspin的这种作用依赖靶向丝氨酸蛋白酶;但是其靶向丝氨酸蛋白酶仅存在于白色脂肪组织,却不存在于体外培养的脂肪细胞中[11]。研究表明vaspin不仅与肥胖和胰岛素敏感性密切相关,而且具有增加胰岛素敏感性的作用。我们的研究发现,vaspin浓度在DM组、NFDR组和NC组中依次减少,且三组差异有统计学意义(P<0.05)。在T2DM中研究vaspin与炎症因子、hs-CRP和瘦素的关系,可更好地理解vaspin与糖尿病、肥胖、胰岛素敏感性及脂代谢的关系,探讨vaspin在T2DM发生发展中的作用及临床检测意义,为早期防治糖尿病提供科学的理论依据。目前国内外在此方面开展较少。
T2DM是一种严重危害人类健康的慢性代谢性疾病[12、13]。炎症反应在T2DM发生发展及其并发症发病机制中均发挥着重要的作用,炎症因子例如IL-1、IL-6、TNF-α、hs-CRP和瘦素在此发病机制中起重要媒介作用,并可以预测糖尿病的发生[14]。本研究探讨T2DM家族中vaspin与炎症因子、瘦素和超敏C反应蛋白之间的相关性。
瘦素(leptin,LP)是一种蛋白质类激素,主要由白色脂肪组织产生、分泌。瘦素具有非常广泛的生物学效应,而其最重要的生物学效应是作用于下丘脑代谢调节中枢,发挥减少能量摄取、增加能量消耗、抑制食欲以及抑制脂肪合成的作用。目前研究发现瘦素编码基因ob,特异性敲除ob基因的大鼠,体质量明显增加、食欲变得较之前旺盛,最终导致病态肥胖[15]。体内瘦素浓度反馈到神经系统,从而控制食欲、调节新陈代谢的速度。瘦素通过抑制体内神经肽Y(neuropeptide Y, NPY)刺激鼠肽基因相关蛋白(agouti-related peptide,AgRP)的活跃程度,从而使体内另一种荷尔蒙黑色素细胞刺激激素(alpha-melanocortin stimulating hormone,α-MSH)的活跃程度增强[16]。TNF-α是单核巨噬细胞、脂肪细胞所分泌的一种细胞因子,可通过干扰周围组织的胰岛素作用而引起胰岛素抵抗,肥胖者脂肪组织中的TNF-α在mRNA水平和蛋白质水平均显著增加,导致脂肪组织特别是内脏脂肪组织发生胰岛素抵抗,增加脂肪分解,最终引起包括肝脏、肌肉等的广泛胰岛素抵抗[17]。IL-6是一种具有内分泌特性的细胞因子,它引起胰岛素抵抗的可能机制为:①与瘦素竞争结合STAT位点,导致瘦素抵抗,减弱对胰岛素分泌的抑制作用,引起高胰岛素血症,最终产生胰岛素抵抗;②降低GLUT-4的表达,降低胰岛素介导的葡萄糖摄取,导致周围组织尤其是脂肪组织发生胰岛素抵抗[18]。
以上三种炎症因子均可导致胰岛素抵抗,我们推测炎症因子在T2DM发生之前已经产生了作用,并且参与了T2DM的发病机制。我们在相关性分析中研究发现,IL-6、TNF-α和瘦素浓度在DM组、NFDR组、NC组中依次下降,vaspin水平与IL-6、TNF-α、瘦素呈正相关,提示瘦素、TNF-α和IL-6的异常可能出现在T2DM发生之前,炎症因子可能参与了胰岛素抵抗甚至T2DM的发病过程,vaspin可能在胰岛素抵抗中发挥代偿性作用,我们既往研究发现T2DM家族正常糖耐量的一级亲属其胰岛素抵抗与血清瘦素、TNF-α和IL-6均呈正相关[19],这与既往国内研究相似[20-23]。而且我们既往研究发现按照BMI分层,T2DM家族中肥胖组的血清瘦素、TNF-α和IL-6水平均比非肥胖组明显升高[19]。因此我们进一步以BMI分层进行三组间vaspin水平的比较,发现DM组、NFDR组和NC组三组中肥胖者的vaspin水平均比非肥胖者明显升高,组间差异均具有统计学意义(P<0.05)。这提示T2DM家族vaspin水平与炎症因子、瘦素水平存在相关性。
综合分析得出,血清vaspin水平可能在炎症反应和T2DM发病机制等方面发挥重要作用。在后续研究中,需要进一步研究vaspin的调节作用以及它在炎症反应与T2DM的进程中发挥怎样的作用。需要注意的是,目前的研究仍有一些局限性:首先,样本量不大,具有大样本的进一步前瞻性研究是必要的;其次,需要进一步的实验研究阐明血清vaspin浓度与各种炎症因子之间关系的分子机制。目前vaspin对T2DM中炎症反应的影响还需进一步研究。
参考文献:
[1] Karadag S, Sakci E, Uzun S,etal.The correlation of inflammatory markers and plasma vaspin levels in patients with diabetic nephropathy[J].Ren Fail, 2016,38(7):1044-1049.
[2] Lu H, Fouejeu Wamba PC, Lapointe M,etal. Increasedvaspin levels are associated with beneficial metabolic outcome pre-and post-bariatric surgery[J]. PLoS One, 2014,9:e11100223.
[3] 彭艳哲,邓开慧,达静静,等.糖尿病肾病患者血清vaspin与血清脂联素的相关性[J].国际移植与血液净化杂志,2016,14(2):37-40.
[4] 李凝旭,涂艳,刘晓霞,等.糖尿病合并骨质疏松症患者炎症因子、脂肪因子变化的研究[J].海南医学院学报,2016,22(5):438-440.
[5] Jaganathan R, Ravindran R, Dhanasekaran S. Emerging role of adipocytokines in type 2 diabetes as mediators of insulin resistance and cardiovascular disease[J].Can J Diabetes,2017: Epub ahead of print.
[6] Heiker JT, Kloting N, Kovacs P,etal. vaspin inhibits kallikrein 7 by serpin mechanism[J]. Cell Mol Life Sci, 2013,70:2569-2583.
[7] Castro CA, da Silva KA, Buffo MM,etal. Experimental type 2 diabetes induction reduces serum vaspin, but not serum omentin, in Wistar rats[J]. Int J Exp Pathol, 2017,98(1):26-33.
[9] Derosa G, Carbone A, D’Angelo A,etal. Variations in inflammatory biomarkers following the addition of sitagliptin in patients with type 2 diabetes not controlled with metformin[J]. Intern Med, 2013,52(19):2179-2187.
[10] Zieger K, Weiner J, Krause K,etal. vaspin suppresses cytokine-induced inflammation in 3T3-L1 adipocytes via inhibition of NFκB pathway[J]. Mol Cell Endocrinol, 2018,460:181-188.
[11] Kadoglou NP, Fotiadis G, Kapelouzou A,etal. The differential anti-inflammatory effects of exercise modalities and their association with early carotid atherosclerosis progression in patients with type 2 diabetes[J]. Diabet Med, 2013,30(2):e41-50.
[12] 刘灵燕,钟政荣,陈福祥.尿微量蛋白对2型糖尿病早期肾损伤的诊断价值[J].山西医科大学学报,2017,48(1):40-43.
[13] 马瑞,高雷,寇惠娟,等.2型糖尿病患者血尿酸水平与肾损害及血浆致动脉硬化指数的相关性[J].山西医科大学学报,2017,48(9):891-894.
[14] Saalbach A, Tremel J, Herbert D,etal. Anti-inflammatory action of keratinocyte-derived vaspin: relevance for the pathogenesis of psoriasis[J]. Am J Pathol, 2016,186(3):639-651.
[15] Maijer KI, Neumann E, Müller-Ladner U,etal. Serum vaspin levels are associated with the development of clinically manifest arthritis in autoantibody-positive individuals[J]. PLoS One, 2015,10(12):e0144932.
[16] Ghallab NA, Amr EM, Shaker OG.Expression of leptin and visfatin in gingival tissues of chronic periodontitis with and without type 2 diabetes mellitus: a study using enzyme-linked immunosorbent assay and real-time polymerase chain reaction[J]. J Periodontol, 2015,86(7):882-889.
[17] Vinitha R, Ram J, Snehalatha C,etal.Adiponectin, leptin, interleukin-6 and HbA1c in the prediction of incident type 2 diabetes: A nested case-control study in Asian Indian men with impaired glucose tolerance[J]. Diabetes Res Clin Pract, 2015,109(2):340-346.
[18] Esser N, Paquot N, Scheen AJ.Anti-inflammatory agents to treat or prevent type 2 diabetes, metabolic syndrome and cardiovascular disease[J]. Expert Opin Investig Drugs, 2015,24(3):283-307.
[19] 李秀丽,章琳,梁春联,等.2型糖尿病一级亲属血清leptin、TNF-α、IL-6表达与胰岛素抵抗的相关性研究[J].实用老年医学,2013,27(9):767-770.
[20] Darko SN, Yar DD, Owusu-Dabo E,etal.Variations in levels of IL-6 and TNF-α in type 2 diabetes mellitus between rural and urban Ashanti Region of Ghana[J]. BMC Endocr Disord, 2015,15:50.
[21] Schloot NC, Pham MN, Hawa MI,etal. Inverse relationship between organ-specific autoantibodies and systemic immune mediators in type 1 diabetes and type 2 diabetes: action LADA 11[J]. Diabetes Care, 2016,39(11):1932-1939.
[22] Mohamed HG, Idris SB, Ahmed MF,etal.Influence of type 2 diabetes on local production of inflammatory molecules in adults with and without chronic periodontitis: a cross-sectional study[J]. BMC Oral Health, 2015,15:86.
[23] Andrews M, Soto N, Arredondo-Olguín M. Association between ferritin and hepcidin levels and inflammatory status in patients with type 2 diabetes mellitus and obesity[J]. Nutrition, 2015,31(1):51-57.
