两种转染试剂转染重组质粒至Caco-2细胞转染效率的比较
2018-06-30杜圣家
原 媛,杜圣家,岳 丹
(山西医科大学基础医学院实验教学中心形态学实验室,太原 030001)
细胞转染是一种将外源性基因通过某种方法导入真核细胞的常用技术。目前常用的转染方法有病毒介导的细胞转染法、磷酸钙转染法、脂质体转染法、电穿孔法等[1,2]。其中脂质体转染具有对基因片段大小限制小、转染细胞毒性低、重复性好等优点。但是对于不同的细胞而言,不同脂质体转染试剂的转染效率也不尽相同。因此需要选择一种相对适合的转染试剂,将细胞的转染效率提高,为之后的阳性细胞筛选提供前期实验基础[3]。本实验以荧光素酶(Luc)和绿色荧光蛋白(GFP)作为报告基因,通过比较两种不同转染试剂转染的效率,优化转染条件,在保证转染效率与降低成本的前提下,达到较为理想的转染效果,旨在为今后建立稳定转染的细胞系提供实验基础。
1 材料与方法
1.1 细胞株与主要试剂
人结肠癌细胞株为Caco-2,购自中科院上海细胞库。绿色荧光蛋白(GFP)表达载体;人p53基因启动子驱动的萤火虫荧光素酶报告基因载体(pGL-p53-luc)和组成型启动子CMV驱动的海肾荧光素酶报告基因载体(pRL-CMV)由美国德州大学安德森癌症研究中心癌症生物学院赠送。转染试剂为Lipofectamine LTX & PLUS(Invitrogen)和X-tremeGENE HP DNA Transfection Reagent(Roche),质粒大提试剂盒为无内毒素质粒大提试剂盒(康为世纪公司),双荧光素酶报告基因系统E1910试剂盒(Promega),Caco-2细胞培养采用高糖DMEM培养基(Gibco),胎牛血清(Gibco)。
1.2 质粒载体的扩增
3种质粒经LB培养基扩大培养后,用无内毒素质粒大提试剂盒提取质粒,紫外分光光度计测定质粒的浓度和纯度。
1.3 细胞培养
Caco-2细胞复苏传代后,37 ℃ 5% CO2培养箱培养。处于对数生长期的细胞经0.25%胰酶消化离心,调整细胞浓度为2×105/ml,1 ml/孔,接种于24孔板。当每孔内的细胞密度为60%-80%时进行转染。
1.4 Lipofectamine LTX & PLUS与报告基因混合物的制备和细胞共转染
取无血清无抗生素培养基,依次加入2种质粒(pGL-p53-luc ∶pRL-CMV=100 ∶1),再加入1 μl的PLUS,混合均匀后,室温条件下孵育5 min,将Lipofectamine LTX和质粒分别以不同比例2 ∶1,3.5 ∶1,4 ∶1混匀,室温条件下孵育30 min,制成DNA-转染试剂的复合物,共转染Caco-2细胞,设3个重复孔,未转染荧光素酶载体的细胞作对照,继续培养细胞,4 h每孔更换新鲜培养基。在48 h收集细胞,按照试剂盒操作步骤,使用荧光检测仪(Promega)检测荧光信号。测得所有样品的荧光信号后,算出每个样品的荧光信号比值=RLU(Firefly)/RLU(Renilla),比较样品的荧光蛋白的表达情况。
1.5 X-tremeGENE HP DNA Transfection Reagent与报告基因混合物的制备和细胞共转染
无血清培养基中依次加入2种质粒,按照不同的比例分别加入罗氏转染试剂1,2,3 μl,室温孵育20 min,制成X-tremeGENE HP DNA Transfection Reagent与报告基因复合物,加入到细胞中,转染后的细胞于37 ℃培养箱中继续培养。未转染荧光素酶载体的细胞作对照。4 h时每孔更换新鲜培养基,48 h收集细胞,使用荧光检测仪检测荧光信号,比较样品的荧光蛋白的表达情况。
1.6 Lipofectamine LTX & PLUS和罗氏试剂转染GFP质粒与检测
无血清培养基中1 ∶1加入GFP质粒0.5 μg和0.5 μl PLUS试剂,温和混合,室温孵育10 min,加入1.75 μl转染试剂,室温静置25 min。将细胞更换为完全培养基后进行转染,放于37 ℃培养箱中继续培养,在24,48,72 h时通过倒置荧光显微镜观察转染的情况。
血清培养基中加入DNA 0.5 μg,与罗氏转染试剂1 ∶3温和混匀,室温孵育20 min,转染细胞,在24,48,72 h时倒置荧光显微镜下观察。
1.7 统计学分析
所得数据以均数±标准误表示,采用SPSS 16.0软件对数据进行统计分析。多组间比较采用单因素方差分析,组间两两比较采用最小显著差异法(LSD)法,P<0.05认为差异具有统计学意义。
2 结果
2.1 两种转染试剂共转染荧光素酶报告基因至Caco-2细胞效率的比较
通过荧光检测系统检测转染后细胞的荧光信号水平,表达质粒与内参质粒的共转染比例为100 ∶1时,检测到的荧光信号最稳定。当用罗氏X-HP试剂转染时,转染试剂与质粒的比值为3 ∶1时,检测到的荧光值比值最高(P<0.05,见图1A)。而用LTX转染试剂转染时,转染试剂与质粒的比值为4 ∶1和3.5 ∶1时,荧光比值显著增高(P<0.05),但是两者之间没有统计学差异(P>0.05,见图1B)。因此根据转染效果对实验条件进行优化,LTX转染试剂与DNA质粒的最佳比例为3.5 ∶1,罗氏X-HP转染试剂与DNA质粒的最佳比例是3 ∶1。当用罗氏X-HP转染试剂在转染48 h荧光比值达到最高值,LTX转染试剂转染细胞后,检测到的荧光信号稍弱,荧光蛋白基因表达水平低于罗氏转染后的表达水平(P<0.05,见图1C)。所以对于萤火虫报告基因转染至Caco-2细胞,罗氏转染试剂转染效果更佳。
2.2 两种转染试剂转染GFP质粒至Caco-2细胞效率比较
使用倒置荧光显微镜观察绿色荧光蛋白表达情况:LTX转染试剂在转染48 h绿色荧光蛋白的表达很低(见图1A),72 h表达量稍微明显(见图1C)。而罗氏转染试剂在转染48 h绿色荧光蛋白的表达量明显上升(见图1B),转染效率高于LTX。两种转染试剂在转染过程中,Caco-2细胞形态基本没有发生变化,细胞死亡率都比较低。

Control表示未转染的Caco-2细胞;与control比较,*P<0.05;与2 μl比较,#P<0.05 A. 罗氏X-HP转染Control表示未转染的Caco-2细胞;与control比较,*P<0.05;与2 μl比较,#P<0.05 B. Lipofectamine LTX转染与LTX 3.5 μl比较,*P<0.05 C. 转染效率比较图1 两种转染试剂分别共转染表达质粒至Caco-2细胞中荧光信号表达情况Figure 1 Luminescent signals of Caco-2 cells after co-transfected with the two expression plasmids using two transfection reagents
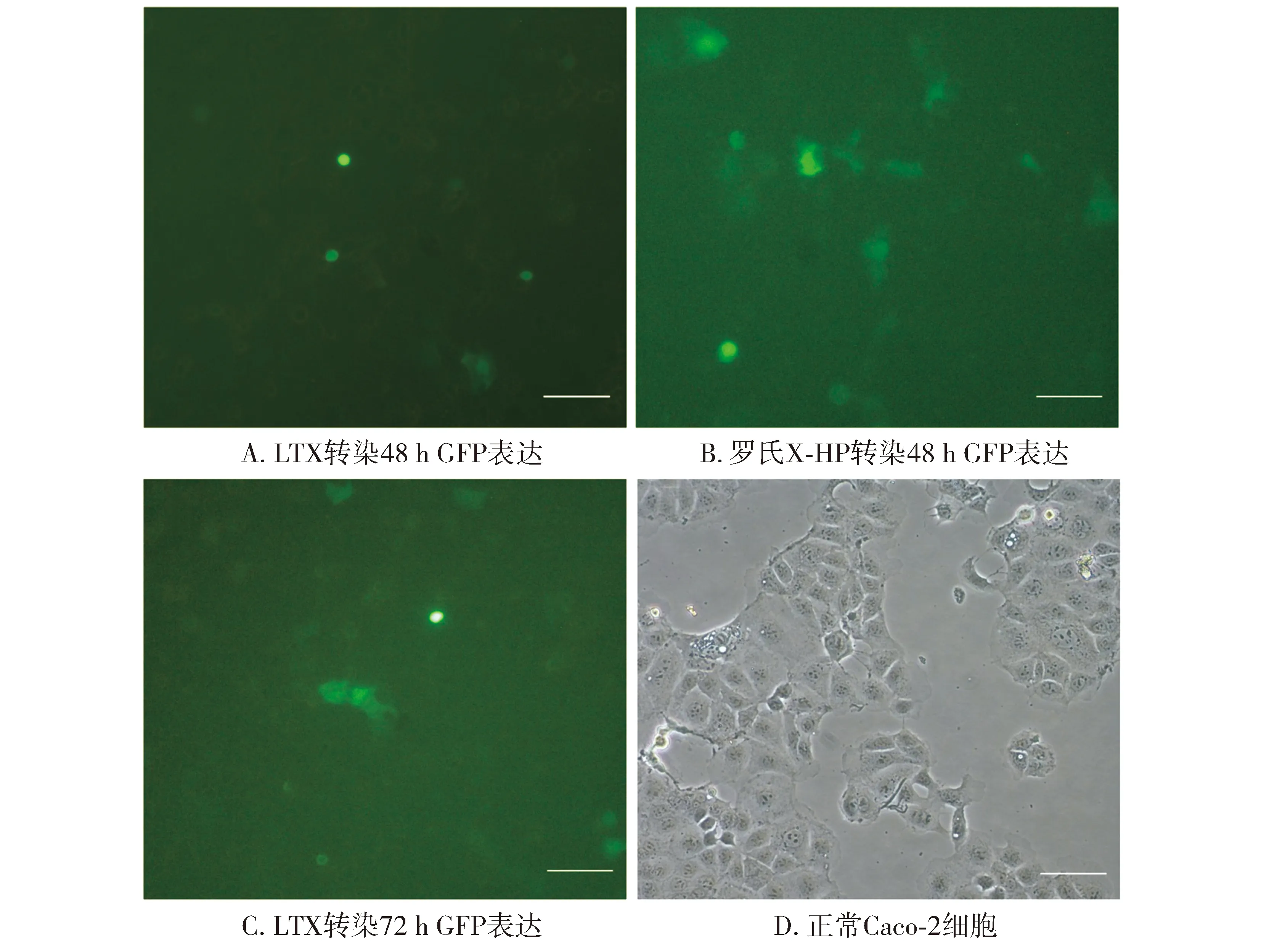
图2 两种转染试剂转染Caco-2细胞绿色荧光蛋白表达情况 (×100)Figure 2 Expression of GFP in Caco-2 cells after transfection with two transfection reagents (×100)
3 讨论
细胞转染是将目的基因整合到染色体DNA中并指导适量目的蛋白的合成,主要用来研究基因表达、基因检测、转基因模型的构建等。因此首先需要构建稳转的细胞系,而细胞转染是建立稳转细胞系的基础[4]。如何选择合适的转染试剂,保证较高的转染效率,对实验研究尤为重要[5]。脂质体转染在科研领域运用的比较广泛,它具有类细胞结构和生物膜的特性,进入细胞后可自行降解,对它运载的基因片段的生物活性没有影响,利用脂质体作为细胞转染试剂的应用较多,但是对于不同的细胞而言,不同的脂质体转染试剂的转染效率也不尽相同。罗氏试剂不仅具有细胞毒性低、转染效率高等优点,同时操作更加方便,比如转染时无需血清以及转染后无需换液[6]。最好在传代前不要更换新鲜的培养液,以保证高效转染。在实验过程中罗氏转染试剂在某些情况下使细胞底部产生一些小颗粒,虽然不影响细胞的形态改变,也需要尽量避免[7]。Lipofectamine LTX & PLUS试剂是一种动物性来源的脂质体转染试剂,毒性低、转染效率高、适用细胞类型广,且细胞密度和微量误差对转染效果影响较小。本实验利用罗氏X-HP和LTX两种转染试剂去转染Caco-2细胞,细胞形态均未发生明显变化,细胞死亡率较低,但是罗氏X-HP转染效率要高于LTX。
转染效率会受诸多因素的影响,比如细胞类型、细胞生存状态、转染试剂与质粒的孵育条件、质粒DNA的大小以及细胞与DNA转染混合物的作用时长、转染方法的操作细节等[8,9]。本实验对两种转染试剂分别进行了优化,确定了LTX转染试剂与DNA质粒的最佳比例为3.5 ∶1和罗氏X-HP转染试剂与DNA质粒的最佳比例是3 ∶1,为进一步实验提供基础。
双荧光素酶报告基因检测技术是一种先进的辅助报告基因技术,它是通过结合萤火虫和海肾荧光素酶进行检测的,具有方便、快捷、灵敏度高等特点[10]。本实验中,在Caco-2细胞中共转染了同时表达的两种荧光素酶:报告基因和内参基因,减少外部实验条件的干扰。
综上所述,针对Caco-2细胞,利用绿色荧光蛋白(GFP)和荧光素酶(Luc)两种不同的报告基因,比较了两种脂质体转染试剂的转染效率,并优化了转染质粒与质粒的比例。对于Caco-2细胞的转染,X-tremeGENE HP DNA Transfection Reagent转染试剂的转染效果更为理想,为今后建立稳定转染的细胞系提供选择。
参考文献:
[1] Caracciolo G, Amenitsch H. Cationic liposome/DNA complexes: from structure to interactions with cellular membranes[J]. Eur Biophys J, 2012, 41(10):815-829.
[2] Bouard D, Alazard-Dany D, Cosset FL. Viral vectors: from virology to transgene expression[J]. Br J Pharmacol, 2009, 157(2):153-165.
[3] 倪银芸,丁雨,吴思思.四种转染试剂对H9C2细胞转染效率的比较[J].华西医学,2017,32(7):1024-1028.
[4] 樊占威,王晗,王柏春,等.悬浮细胞电穿孔转染参数的选择研究[J].黑龙江医学,2010,34(12):893-895.
[5] 李吉,刘作金.不同试剂转染RIP140-siRNA至库普弗细胞的效率及毒性比较[J].南方医科大学学报,2015,35(12):1694-1700.
[6] 张文智,李亚,王鹏雁,等.三种转染试剂对PEF细胞与BHK细胞转染效率的比较[J].新疆农业科学,2013,50(4):753-758.
[7] Li F,YamaguchiK,OkadaK,etal. Efficient transfection of DNA into primarily cultured rat sertoli cells by electroporation[J]. Biol Reprod, 2013, 88(3): 61,1-6.
[8] Lee ER, Marshall J, Siegel CS,etal. Detailed analysis of structures and formulations of cationic lipids for efficient gene transfer to the lung[J].Hum Gene Ther, 1996, 7(14):1701-1717.
[9] 王双,陈欣,姜政.SOX15基因对Caco2结肠癌细胞增殖、凋亡及迁移侵袭的影响[J].第三军医大学学报,2017,39(2):137-142.
[10] 薛秀花,黄晨西.荧光素酶基因的研究进展[J].生物学通报,2013,48(9):1-4.
