人LDHB的原核表达及体外抑制剂筛选模型的建立
2018-06-30金科华
吴 珊,刘 洁,金科华
(1湖北科技学院医药研究院,咸宁 437100;2湖北省咸宁市妇幼保健院妇产科;3湖北科技学院护理学院;*通讯作者,E-mail:striveapple@126.com)
糖酵解产生ATP的效率远低于氧化磷酸化,但肿瘤细胞高表达葡萄糖转运体和糖酵解酶,摄取大量的葡萄糖,加速糖酵解,仍产生大量ATP;糖酵解的中间产物为肿瘤细胞的蛋白质、核酸和脂质的合成提供大量前体物质[1-3]。抑制糖酵解是极具潜力的抗肿瘤策略。乳酸脱氢酶(lactate dehydrogenase,LDH)是糖酵解重要酶之一,催化乳酸和丙酮酸、NAD+和NADH的相互转化。LDH是由LDHA和LDHB两种亚基组成的四聚体,单亚基和四聚体均具有酶活性。LDHB主要催化乳酸氧化为丙酮酸,反应速度慢;LDHA主要催化丙酮酸还原为乳酸,反应速度快。不少肿瘤细胞中,LDHB丰度异常升高[4-8]。干扰LDHB的表达可抑制多种肿瘤细胞的生长[7,9],故靶向LDHB的抑制剂极有可能抑制某些肿瘤细胞的生长。为此,建立LDHB抑制剂筛选模型,筛选靶向LDHB的抑制剂具有重要意义。细胞内LDHB常与其他蛋白质结合,难以提取。为此,本文在大肠杆菌中表达和纯化人LDHB,建立其抑制剂的体外筛选模型,为发现LDHB的抑制剂奠定基础。
1 材料与方法
1.1 菌株、DNA与主要试剂
大肠杆菌DH5α、BL21(DE3)及pET-28a质粒为湖北科技学院生物化学教研室保存;LDHB cDNA由韩家淮教授惠赠。Pyrobest DNA聚合酶、Solution Ⅰ购自大连宝生物工程有限公司;引物、DNA操作试剂盒、丙酮酸钠、NADH购自生工生物工程(上海)股份有限公司;快速限制性酶、Ni-Sepharose 6 Fast Flow(NS6FF)、棉酚(gossypol,GL)分别购自美国Thermoscientific、美国GE、美国Sigma公司;抗人LDHB IgG单克隆抗体购自杭州Epitomics公司,辣根过氧化物酶标记的羊抗兔IgG抗体(二抗)购自北京中杉金桥公司。按Latner等[10]的方法配制LDHB反应缓冲液(0.1 mol/L Tris-HCl pH7.4)。丙酮酸钠和NADH的浓度分别为1.6 mmol/L,0.8 mmol/L[11]。
1.2 PCR扩增LDHB cDNA
设计扩增LDHB cDNA的正向引物Ps:5′-CGACATATGATGGCAACTCTTAAGGAAAAACTC-3′,反向引物Pa:5′-AGTCTCGAGTCACAGGTCTTTTAGGTCCTTCTG-3′。下划线处分别为NdeⅠ、XhoⅠ位点。PCR体系:H2O 75.5 μl,10×Pyrobest Buffer 10 μl,dNTP Mixture、Ps(10 μmol/L)、Pa(10 μmol/L)各4 μl,LDHB cDNA 2 μl,Pyrobest DNA聚合酶0.5 μl。PCR参数:95 ℃3 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。取2 μl PCR产物进行电泳检测,剩余PCR产物按胶回收试剂盒回收。
1.3 PCR产物、质粒的酶切与回收
PCR产物酶切体系:H2O 21 μl,PCR产物20 μl,10×Fastdigest Buffer(下称FB)5 μl,NdeⅠ、XhoⅠ各2 μl,37 ℃酶切1 h。质粒酶切体系:H2O 42 μl,pET-28a 8 μl,10×FB 6 μl,NdeⅠ和XhoⅠ各2 μl,37 ℃酶切3 h。按试剂盒回收酶切的PCR产物和质粒。
1.4 PCR产物与pET-28a的连接、转化
取酶切的pET-28a和PCR产物各2.5 μl、Solution I 5 μl,混匀,16 ℃连接3 h。将连接产物热激法转化DH5α感受态细胞,于50 μg/ml卡那霉素的LB平板(下称抗性平板)筛选抗性菌落。
1.5 重组质粒的鉴定
将两个抗性菌落接种于4 ml含50 μg/ml卡那霉素的LB(下称抗性LB)中,于摇床上37 ℃ 250 r/min培养12 h,提取质粒,记为pLB1、pLB2。重组质粒分子量大小鉴定:通过电泳比较pET-28a、pLB1、pLB2的分子量。重组质粒单酶切鉴定:pET-28a(或pLB1,或1pLB2)6 μl,XhoⅠ1 μl,10×FB 1 μl,H2O 2 μl,混匀,酶切1 h。重组质粒双酶切鉴定:pET-28a(或pLB1,或1pLB2)15 μl,NdeⅠ、XhoⅠ各1 μl,10×FB 2 μl,H2O 1 μl,混匀,酶切1 h。酶切产物(以pET-28a单、双酶切为对照)进行电泳检测,将酶切鉴定的阳性质粒委托英潍捷基公司进行测序。
1.6 LDHB的表达
取pLB1和pET-28a各5 ng,热激法转化大肠杆菌BL21(DE3),于抗性平板筛选菌落。挑抗性菌落各一个,分别记为BL21-pET-28a和BL21-pLB1,接种于5 ml抗性LB中,37 ℃ 250 r/min培养过夜,作种子液。次日,将种子液1 ml加入100 ml抗性LB中,37 ℃培养至OD600 nm为0.6。加入终浓度0.2 mmol/L的IPTG,对照加等体积的无菌水,37 ℃ 250 r/min培养3 h。室温5 000 r/min离心5 min,弃上清,加10 ml PBS洗涤沉淀两次。室温10 000 r/min离心1 min,弃PBS,加40 ml 100 mmol/L pH7.5 Tris-HCl重悬沉淀。以225 W功率(占空比为5 s/5 s),冰浴超声30 min。4 ℃ 13 000 r/min离心10 min。取300 μl上清,加100 μl 4×Loading Buffer,混匀,100 ℃加热10 min,取10 μl进行SDS-PAGE检测。剩余上清用于纯化LDHB。
1.7 LDHB的纯化
向层析柱中加0.5 ml NS6FF,流尽保存液,用10 ml超纯水洗涤一次。将35 ml裂解液上清与NS6FF于4 ℃混合30 min,流出未结合的裂解液,分别用含20,40,80 mmol/L咪唑的100 mmol/L pH7.5 Tris-HCl的洗涤液40 ml,依次洗涤层析柱。加15 ml洗脱液(200 mmol/L咪唑,100 mmol/L pH7.5 Tris-HCl)洗脱LDHB。取洗脱液300 μl,4×Loading Buffer 100 μl,混匀100 ℃加热10 min,室温13 000 r/min离心5 min,取上清备用。将剩余洗脱液用截留分子量10 kD的超滤管超滤浓缩至约1 ml,取0.9 ml超滤后的洗脱液,加0.1 ml甘油,混匀,50 μl/管分装,-80 ℃保存。用BCA法测定洗脱液蛋白浓度。
1.8 LDHB的western blotting检测
取变性蛋白样品10 μl,SDS-PAGE分离。湿法100 V电转1 h,将蛋白印迹至聚偏二氟乙烯膜(PVDF膜)。PVDF膜于5 % BSA中室温封闭1 h,此后与稀释10 000倍抗LDHB的抗体4 ℃孵育过夜。TBST洗涤PVDF膜3次。加入1 ∶5 000稀释的羊抗兔二抗,室温孵育1 h,TBST洗涤3次。将增强型化学发光液覆盖PVDF膜,于ChemiDoc XRS+成像仪曝光显影。
1.9 建立LDHB抑制剂筛选模型
将1.6 mmol/L丙酮酸钠和0.8 mmol/L NADH等体积混匀,即为底物混合液,4 ℃避光备用。取-80 ℃保存的LDHB,冰浴解冻,用反应缓冲液依次稀释1 000,2 000,5 000,10 000倍,备用。向96孔板的5个孔中各加入190 μl底物混合液,置Varioskan Flash酶标仪中,25 ℃保温10 min,每孔分别加入10 μl上述不同稀释倍数的LDHB(LDHB含量分别为22.5,11.3,4.5,2.3 ng)或10 μl反应缓冲液(空白对照),混匀,于340 nm波长处,每30 s测定一次光密度值(OD340 nm),连续测定6 min。以反应时间为横坐标,OD340 nm为纵坐标,绘制t-OD340 nm曲线,根据曲线确定LDHB的最适浓度。
以棉酚(GL)为阳性对照[12,13],建立抑制剂筛选模型。反应体系:180 μl底物混合液,10 μl浓度分别为200,20,2 μmol/L的GL溶液(GL终浓度分别为10,1,0.1 μmol/L)或DMSO,10 μl最适浓度的LDHB。按上述程序绘制t-OD340 nm曲线。根据Zhang等[14]的方法计算Z因子并评价高通量筛选模型。
以上实验分别进行三次生物学重复。
2 结果
2.1 重组质粒的构建
PCR扩增产物约1 000 bp,与LDHB cDNA分子量(1 005 bp)一致(见图1A),空白对照无扩增产物。pLB1、pLB2分子量略大于Supercoiled marker的6 133 bp条带(见图1B泳道1-3),与理论值相符(pET-28a分子量为5 369 bp,NdeⅠ、XhoⅠ位点间插入LDHB cDNA后,获得的pLB1、pLB2理论分子量约6 300 bp)。pLB1、pLB2单酶切产物均略大于线性DNA marker的6 000 bp条带(见图1B泳道5-6),与理论相符;pLB1、pLB2双酶切产生的小片段略大于1 000 bp,与LDHB cDNA分子量相符,大片段与pET-28a空质粒酶切片段一致(见图1B泳道7-9)。测序结果显示插入到pET-28a的序列与人LDHB cDNA序列一致。
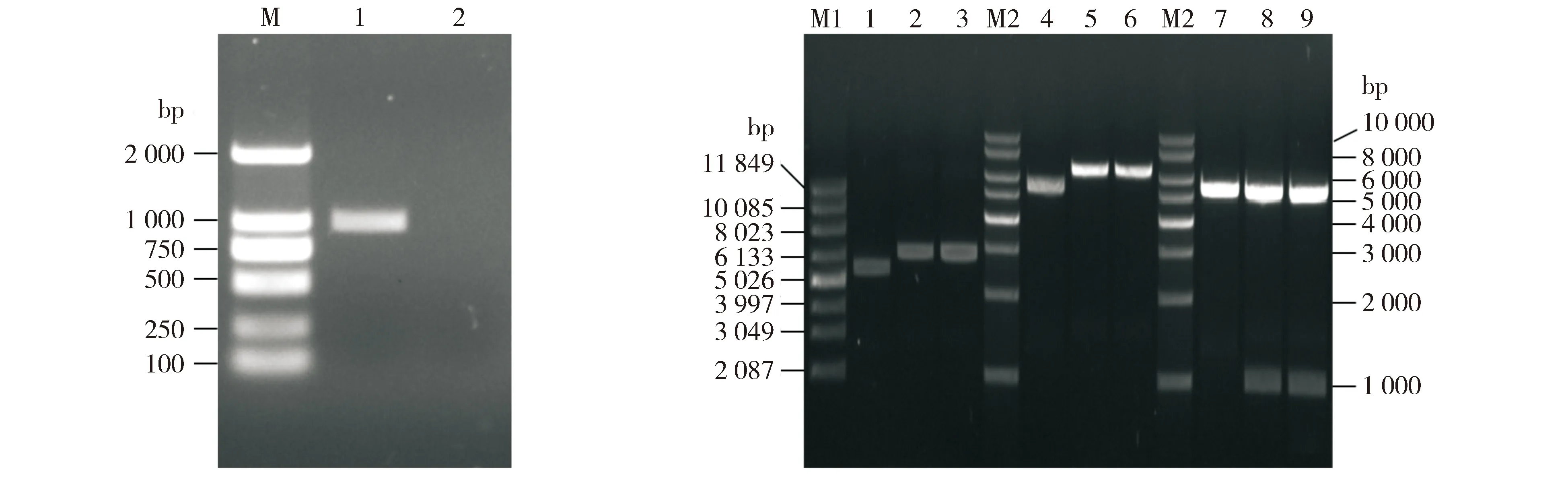
M.Trans2K DNA marker; 1. LDHB cDNA PCR 产物; 2.空白对照 A. PCR扩增LDHB cDNAM1. Supercoiled marker; 1-3.分别为pET-28a, pLB1, pLB2; M2.1kb DNA ladder; 4-6.分别为pET-28a, pLB1, pLB2 Xho I酶切产物;7-9.分别为pET-28a, pLB1, pLB2 Nde I+Xho I双酶切产物 B.重组质粒的鉴定图1 重组质粒pET-28a-LDHB的构建Figure 1 The construction of recombinant plasmid pET-28a-LDHB
2.2 表达产物的鉴定
LDHB cDNA插入pET-28a质粒的NdeⅠ和XhoⅠ酶切位点之间,重组表达的LDHB(recombinant expressed LDHB,rLDHB)较之人源LDHB(human LDHB, hLDHB)多29个氨基酸(载体翻译产生),氨基酸平均分子量约0.118 kD,多出的氨基酸分子量为3.4 kD,hLDHB分子量约37 kD,故rLDHB分子量约40.4 kD。由图2A可见,无论IPTG诱导与否,BL21-pET-28a裂解液上清中均未出现40 kD左右的主带;未经IPTG诱导时,BL21-pBL1亦无40 kD左右的主带出现,但诱导后出现一条略小于43 kD的主带,与rLDHB分子量相符。裂解液上清纯化后,获得分子量约43 kD的高浓度条带。经Quantity One分析,其纯度为86.5%(见图2B)。Western blotting结果提示,IPTG诱导后BL21-pBL1及纯化的rLDHB均出现约40 kD的条带,与rLDHB分子量相符;未经IPTG诱导的BL21-pBL1无此条带(图2C)。浓缩的rLDHB浓度为2.5 g/L。由此可知,浓缩后的rLDHB总量为2.5 mg,rLDHB的表达量为25 mg/L。
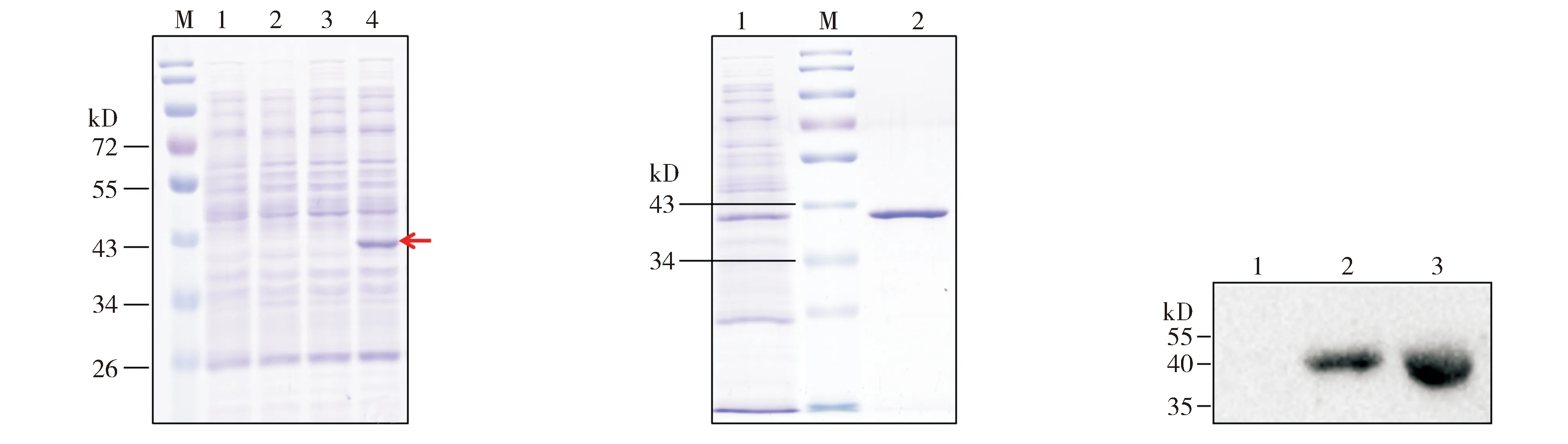
M. protein marker; 1, 2. 分别为BL21-pET-28a不经、经IPTG诱导后裂解液上清; 3, 4. 分别为BL21-pLB1不经、经IPTG诱导后裂解液上清 A. SDS-PAGE鉴定rLDHBM. protein marker; 1. BL21-pLB1经IPTG诱导后裂解液上清; 2. 纯化的 rLDHB B. SDS-PAGE鉴定纯化的rLDHB1.BL21-pLB1不经IPTG诱导后裂解液上清; 2, 3. 分别为纯化前、后的rLDHB C. Western blotting鉴定rLDHB图2 表达产物的鉴定Figure 2 The identification of the expressed product
2.3 LDHB抑制剂筛选模型的建立
2.3.1 最适LDHB浓度的确定 不同浓度LDHB的t-OD340 nm曲线见图3A。由图3A可知,无LDHB时,NADH在25 ℃保温6 min过程中,OD340 nm的降低值可忽略不计。因此,可排除NADH自身氧化对OD340 nm降低的影响。随着LDHB浓度的增大,OD340 nm降低速度加快。在测定起点,稀释1 000,2 000,5 000,10 000倍时,OD340 nm平均值依次为0.582,0.742,0.884,0.910,而对照为0.930。可见,从加入酶液至第一次读数(约30 s),4种稀释倍数的LDHB导致OD340 nm平均值降低依次为0.348,0.188,0.046,0.02;第一、二次读数时间间隔内降低的OD340 nm依次为0.192,0.122,0.050,0.0197,分别约为各自读数前降低值的0.5,0.67,1,1倍。可见,稀释1 000,2 000倍时,酶浓度过大,反应的最大速度(初速度)发生在加入酶液至第一次读数的时间间隔内,由于NADH被大量氧化,浓度急剧降低,反应速度骤然下降;稀释5 000,10 000倍时,酶浓度较低,最大速度保留在开始读数后3-4 min内。酶学研究中,反应酶活力的是初速度。稀释1 000,2 000倍时,无法通过OD340 nm的变化来观测LDHB酶活力,不适合抑制剂的筛选;稀释5 000,10 000倍时,均能通过OD340 nm的变化来观测LDHB酶活力,但从大规模筛选的时间考虑,稀释5 000倍时反应速度较快,可缩短筛选时间,故LDHB最佳浓度为22.5 μg/L。
2.3.2 模型的可靠性 由图3B可知,随GL浓度增大,OD340 nm降速逐步变慢。10,1,0.1 μmol/L的GL对LDHB的抑制率依次为88.3%,33.5%,0.654%。以10 μmol/L GL为阳性对照,模型的Z因子为0.91。
3 讨论
真核生物蛋白质的翻译后修饰会影响其结构和功能[15-18]。原核表达系统缺少翻译后加工修饰功能,某些存在翻译后修饰的真核蛋白质不适合在原核表达系统表达。本文在大肠杆菌中表达的LDHB仍具有较高活性,可见,翻译后修饰对LDHB酶活性无决定性影响。
LDH催化的反应是可逆的,因逆向反应的速度远快于正向反应[19],为此本文选择逆向反应来筛选LDHB的抑制剂。20-37 ℃范围内,温度对LDHB的催化活性影响较小[20]。本文建立LDHB筛选模型时,室温约20 ℃,故将酶促反应的温度设定为25 ℃,较之37 ℃,极大缩短了底物升高温度所需时间,加快抑制剂筛选的速度。3-磷酸甘油醛脱氢酶(GAPDH)催化3-磷酸甘油醛脱氢需NAD+作为氢受体。LDHB催化NADH氧化为NAD+,使得NAD+得以再生,保障糖酵解的持续进行[21],故抑制LDHB活性,可抑制糖酵解,从而抑制肿瘤细胞的生长。正向反应主要由LDHB催化,但速度远低于逆向反应的速度。基于本模型筛选的是LDHB逆向反应的抑制剂,逆向反应的抑制剂对正向反应有无抑制作用,需要进一步研究。
本文构建了原核表达载体pET-28a-LDHB,通过IPTG诱导表达、NS6FF纯化,LDHB的表达量达25 mg/L。以丙酮酸钠和NADH为底物,以10 μmol/L棉酚为阳性对照,以22.5 μg/L LDHB为最适浓度,建立了可靠的LDHB体外抑制筛选模型,为发现LDHB的小分子抑制剂奠定了基础。
参考文献:
[1] DeBerardinis RJ, Lum JJ, Hatzivassiliou G,etal. The biology of cancer:metabolic reprogramming fuels cell growth and proliferation[J]. Cell Metab, 2008, 7(1):11-20.
[2] Dang CV, Hamaker M, Sun P,etal. Therapeutic targeting of cancer cell metabolism[J]. J Mol Med (Berl), 2011, 89(3):205-212.
[3] Porporato PE, Dhup S, Dadhich RK,etal. Anticancer targets in the glycolytic metabolism of tumors: a comprehensive review[J]. Front Pharm, 2011, 2(49):1-18.
[4] Tambe Y, Hasebe M, Kim CJ,etal. The drs tumor suppressor regulates glucose metabolism via lactate dehydrogenase-B[J]. Mol Carcinog, 2016, 55(1):52-63.
[5] 张惟.膀胱移行细胞癌组织中乳酸脱氢酶B亚基蛋白表达变化及意义[J].山东医药,2013,53(2):82-83.
[6] 骆平,查小军,汪宏.mTOR和LDHB在肝细胞癌组织中的表达及意义[J].安徽医学,2012,33(8):965-969.
[7] McCleland ML, Adler AS, Shang Y,etal. An integrated genomic screen identifies LDHB as an essential gene for triple-negative breast cancer[J]. Cancer Res, 2012, 72(22):5812-5823.
[8] Kinoshita T, Nohata N, Yoshino H,etal. Tumor suppressive microRNA-375 regulates lactate dehydrogenase B in maxillary sinus squamous cell carcinoma[J]. Inter J Oncol, 2012, 40(1):185-193.
[9] 金科华,刘复兴.敲低和过表达LDHB对HeLa细胞生长的影响[J].山西医科大学学报,2016,47(1):41-45.
[10] Latner AL, Siddiqui SA, Skillen AW. Pyruvate inhibition of lactate dehydrogenase activity in human tissue extracts[J]. Science, 1966, 154(3748):527-529.
[11] 万雄萍.乳酸脱氢酶催化反应的动力学特征和分析条件的选择[J].上海医学检验杂志,1989,4(2):65-68.
[12] Lin YC, Chitcharoenthum M, Rikihisa Y. Effect of gossypol on spermatozoal lactate dehydrogenase-X (LDH-X) in male rats[J]. Contraception, 1987, 36(5):581-592.
[13] Yu Y, Deck JA, Hunsaker LA,etal. Selective active site inhibitors of human lactate dehydrogenases A4, B4, and C4[J]. Biochem Pharmacol, 2001, 62(1):81-89.
[14] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays[J]. J Biomol Screening, 1999, 4(2):67-73.
[15] 胡笳,郭燕婷,李艳梅.蛋白质翻译后修饰研究进展[J].科学通报,2005,50(11):1061-1072.
[16] 董雷,周文霞,张永祥.Tau蛋白的异常翻译后修饰与阿尔茨海默病[J].军事医学科学院院刊,2006,30(1):72-75.
[17] 费尔康.神经退行性疾病相关蛋白的翻译后修饰对蛋白功能影响的研究[D].合肥:中国科学技术大学,2008.
[18] 郭会灿.蛋白质翻译后修饰研究进展[J].生物技术通报,2011,50(7):18-21.
[19] Adams MJ, Buehner M, Chandrasekhar K,etal. Structure-function relationships in lactate dehydrogenase[J]. Proc Natl Acad Sci USA, 1973, 70(7):1968-1972.
[20] Vesell ES. Lactate dehydrogenase Isozymes: substrate inhibition in various human tissues[J]. Science, 1965, 150(3703):1590-1593.
[21] Fan J, Hitosugi T, Chung TW,etal. Tyrosine phosphorylation of lactate dehydrogenase A is important for NADH/NAD(+) redox homeostasis in cancer cells[J]. Mol Cell Biol, 2011, 31(24): 4938-4950.
