下调USP9X表达对胃癌AGS细胞凋亡和侵袭能力的影响*
2018-06-30张彩凤夏永华杜学芳肖怀葱赵润根张利利杨双梅
张彩凤,韩 宇,夏永华,杜学芳,肖怀葱,赵润根,张利利,杨双梅
(新乡医学院第一附属医院 1消化内科, 2皮肤科, 3麻醉科, 河南 卫辉 453100)
胃癌是最常见的消化道恶性肿瘤之一[1]。尽管在早期诊断和治疗中具有明显的进展,但胃癌患者仍占全球所有肿瘤相关死亡的9%[2-3]。因而寻找新的分子靶点对于胃癌患者的治疗具有十分重要的价值。X染色体连锁的泛素特异性肽酶 9(ubiquitin-specific peptidase 9, X-linked,USP9X)作为一种去泛素化酶(deubiquitylating enzyme,DUB)能调控多种不同的信号途径[4-5]。USP9X也被证实参与很多疾病特别是肿瘤的发生发展过程[6-10]。USP9X在不同的肿瘤中可能发挥不同的作用,在胰腺癌的研究中发现USP9X的缺失能加速胰腺癌的产生,表明其在胰腺癌中主要是肿瘤抑制基因;但在多发性骨髓瘤中,USP9X的过表达与患者的不良预后密切相关,提示其可能是癌基因。最近来自胃癌的一项研究表明,USP9X在胃癌组织中呈现高表达,其表达与淋巴结转移、远端转移和肿瘤分期密切相关,USP9X的高表达能降低胃癌患者总的生存率,是胃癌患者独立的预后因子[11],因而在胃癌中USP9X可能发挥癌基因的作用。但其在胃癌中确切的功能尚不清楚。因此,在本研究中,我们利用RNA干扰技术下调胃癌细胞中USP9X的表达,分析其表达下调对胃癌细胞凋亡和侵袭的影响,并初步探讨其可能的分子机制。该研究有望为以USP9X为靶点的胃癌基因治疗奠定基础。
材 料 和 方 法
1 实验材料
人胃癌AGS细胞购自中科院上海细胞库。脂质体2000转染试剂购自Invitrogen;USP9X小干扰RNA(small interfering RNA, siRNA)、对照siRNA以及鼠抗人USP9X、髓样细胞白血病蛋白1(myeloid cell leukemia 1,Mcl-1)、Bax、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和β-actin单克隆抗体均购自Santa Cruz;RPMI-1640 购自Life Technologies;胎牛血清购自HyClone;凋亡检测试剂盒Annexin V-FITC购自eBiosciences;基质胶购自BD。
2 方法
2.1细胞培养 胃癌AGS细胞用RPMI-1640培养基,并补充10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素,于37 ℃、5%的CO2培养箱中培养。实验所用的AGS细胞处于对数生长期。
2.2siRNA转染及分组 当AGS细胞融合度达90%左右时,将USP9X siRNA和对照siRNA按照脂质体2000说明书进行转染,并于转染后48 h进行相关的实验。实验分为3组:AGS组(未处理的AGS细胞)、siRNA control组(用对照siRNA转染AGS细胞)和USP9XsiRNA组(用USP9XsiRNA转染AGS细胞)。
2.3Real-time PCR 从各个不同转染的胃癌AGS细胞中提取总RNA,并反转录成cDNA,以cDNA为模板,利用实时荧光定量PCR特定的试剂盒(北京天根生化科技有限公司)将各个不同的组份加入至反应体系中,扩增USP9X的上游引物序列为5’-CATGGACCTGGCTCTCAGTG-3’, 下游引物序列为5’-AAACACATGGGGACTTCGCT-3’,产物大小为220 bp;扩增内参照β-actin的上游引物序列为5’-AACTGGGACGACATGGAGAAAA-3’, 下游引物序列为5’-GGATAGCACAGCCTGGATAGCA-3’,产物大小为192 bp。USP9X的mRNA相对表达水平采用2-ΔΔCt法进行计算。
2.4Western blot实验 从各个不同转染的胃癌AGS细胞中提取总蛋白,采用SDS-PAGE对蛋白进行分离,然后将其转膜,封闭后加入针对USP9X、Mcl-1、Bax、MMP-2和β-actin的 I 抗,然后加入 II 抗,最后采用ECL发光液进行曝光显示出特定的蛋白条带,蛋白的相对表达水平=目的蛋白的灰度值/β-actin的灰度值。
2.5CCK-8法检测细胞活力 将不同处理的胃癌AGS细胞接种至96孔板中,每孔为2 000个细胞。按照CCK-8试剂盒(中国碧云天生物工程有限公司)的说明书,检测不同时点AGS细胞的活力。最后利用GraphPad Prism 6.0软件绘制细胞的生长曲线。
2.6流式细胞术检测细胞凋亡USP9XsiRNA和对照siRNA转染胃癌AGS细胞后于48 h收获细胞,采用预冷PBS缓冲液漂洗,按1×109/L的密度重悬细胞,接着取100 μL细胞置于流式管中,加入Annexin V-FITC和碘化丙啶各5 μL,于避光下孵育15 min后采用流式细胞术检测10 000个细胞,最后采用CellQuest软件分析细胞凋亡的结果。
2.7Boyden小室检测细胞的侵袭能力 将各个不同处理的胃癌AGS细胞(每组1×105个)分别悬浮在含有0.2%小牛血清的800 μL培养基中,然后将各个不同处理的胃癌AGS依次接种至Boyden小室的上层,培养6 h。然后收集滤膜下层的细胞,并采用甲醇进行固定,并通过HE染色来观察下层细胞的数量,最后通过计算滤膜下层的细胞数来评估其穿膜的细胞数(30个视野,×200)。
3 统计学处理
采用SPSS 17.0统计学软件进行统计学处理。所有的实验数据以均数±标准差(mean±SD)表示,3组之间差异的比较采用单因素方差分析(one-way ANOVA),以P<0.05表示差异有统计学意义。
结 果
1 USP9X siRNA下调胃癌AGS细胞中USP9X的mRNA表达
Real-time PCR结果表明,USP9XsiRNA组中USP9X的mRNA相对表达水平显著低于未处理的AGS组和对照siRNA组,差异具有统计学意义(P<0.05);然而,未处理的AGS组和对照siRNA组之间USP9X的mRNA相对表达水平的差异无统计学显著性,见图1。
Figure 1. The mRNA expressions of USP9X in the AGS cells with different treatments detected by real-time PCR. Mean±SD.n=3.*P<0.05vsAGS group and siRNA control group.
图1Real-timePCR检测各个不同处理的AGS细胞中USP9XmRNA的表达
2 USP9X siRNA下调胃癌AGS细胞中USP9X蛋白的表达
Western blot实验结果显示,USP9XsiRNA组中USP9X蛋白的表达水平显著低于未处理的AGS组和对照siRNA组,差异具有统计学意义(P<0.05);然而,未处理的AGS组和对照siRNA组之间USP9X蛋白表达水平的差异无统计学显著性,见图2。
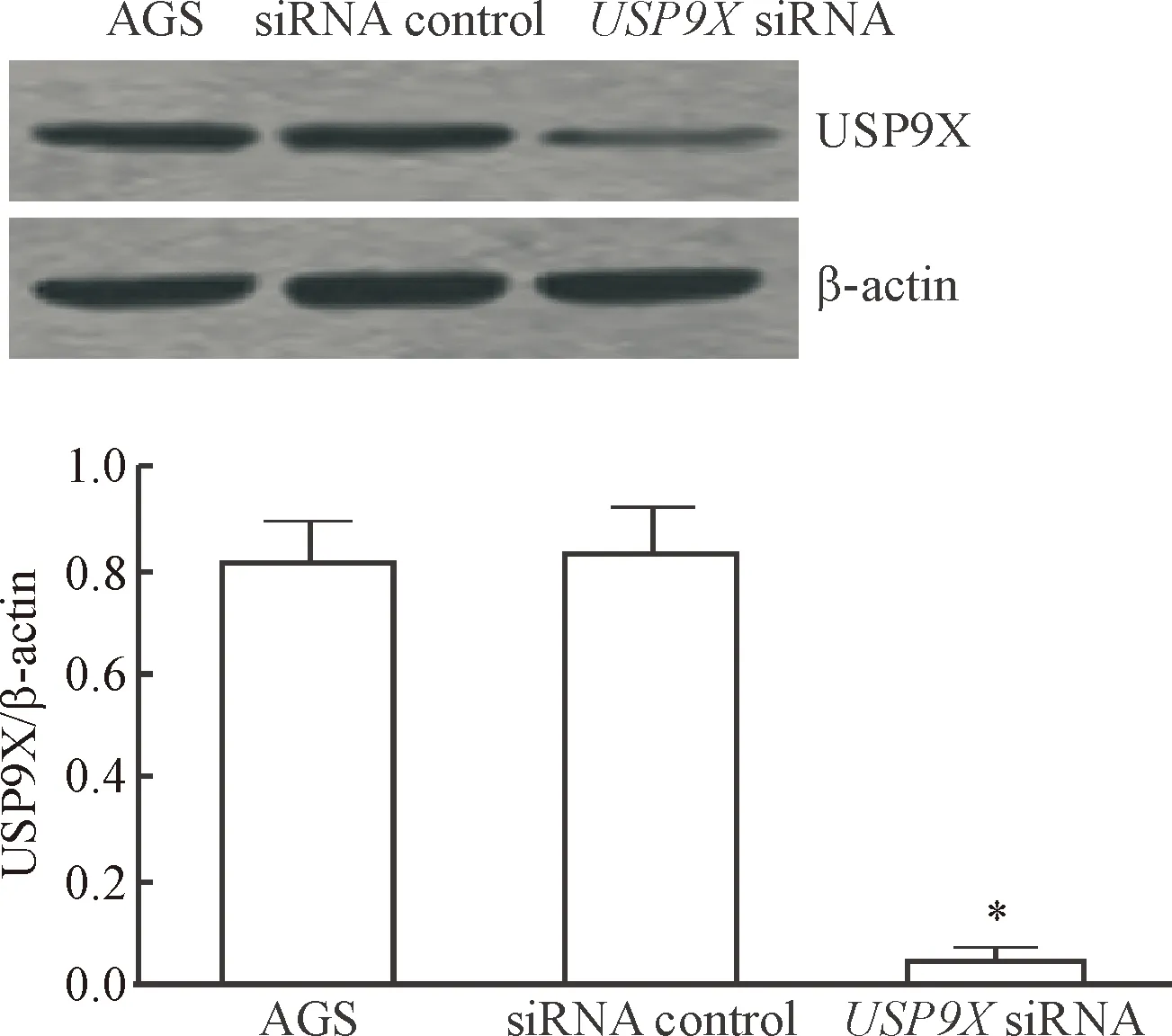
Figure 2. The protein expression of USP9X in the AGS cells with different treatments. Mean±SD.n=4.*P<0.05vsAGS group and siRNA control group.
图2USP9X蛋白在各个不同处理的AGS细胞中的表达
3 USP9X表达下调显著抑制胃癌AGS细胞的活力
CCK-8实验分析不同处理组别AGS细胞的活力,结果见图3。与未处理组和对照siRNA组相比,USP9XsiRNA转染的AGS细胞的活力显著受到抑制,且差异具有统计学意义(P<0.05);然而,未处理组的AGS细胞和对照siRNA转染的AGS细胞之间相比,其细胞活力的差异无统计学显著性。

Figure 3. The effect of USP9X down-regulation on the viability of gastric carcinoma AGS cells. Mean±SD.n=4.*P<0.05vsAGS group and siRNA control group.
图3USP9X表达下调对胃癌AGS细胞活力的影响
4 下调USP9X表达对胃癌AGS细胞凋亡的影响
流式细胞术结果表明,USP9XsiRNA组中胃癌细胞的早期凋亡率显著高于未处理的AGS组和对照siRNA组,差异有统计学意义(P<0.01);此外,USP9XsiRNA组中胃癌AGS细胞的活细胞比率显著低于未处理的AGS组和对照siRNA组(P<0.01),见图4。
5 下调USP9X表达对胃癌AGS细胞侵袭能力的影响
Boyden小室实验结果表明,USP9XsiRNA组中胃癌AGS细胞的穿膜数显著低于未处理的AGS组和对照siRNA组,差异有统计学意义(P<0.01);然而,未处理的AGS组和对照siRNA转染的AGS组相比,胃癌AGS细胞穿膜数的差异无统计学显著性,见图5。
6 下调USP9X表达对凋亡和侵袭相关蛋白表达的影响
为了进一步探讨USP9X在胃癌细胞凋亡和侵袭调控中的可能分子机制,我们采用Western blot检测不同处理组别胃癌AGS细胞中Mcl-1、Bax和MMP-2蛋白的表达。结果表明,与未处理的AGS组和对照siRNA转染的AGS组相比,USP9X siRNA组中Mcl-1和MMP-2表达显著下调,而Bax蛋白表达显著上调(P<0.05或P<0.01),提示USP9X表达下调介导的凋亡和侵袭能力变化可能与Mcl-1、Bax和MMP-2表达变化密切相关,见图6。

Figure 4. The effects of down-regulation of USP9X expression on apoptosis of gastric carcinoma AGS cells. Mean±SD.n=4.**P<0.01vsAGS group and siRNA control group.
图4USP9X表达下调对胃癌AGS细胞凋亡的影响
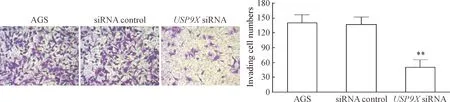
Figure 5. Down-regulation of USP9X expression inhibited invasion ability of gastric carcinoma AGS cells (HE staining,×200). Mean±SD.n=4.**P<0.01vsAGS group and siRNA control group.
图5USP9X表达下调抑制胃癌AGS细胞的侵袭能力

Figure 6. The protein expression of Mcl-1, Bax and MPP-2 in the AGS cells with different treatments determined by Western blot. Mean±SD.n=4.*P<0.05,**P<0.01vsAGS group and siRNA control group.
图6Westernblot检测各个不同处理的AGS细胞中Mcl-1、Bax和MMP-2蛋白的表达
讨 论
研究表明,泛素化在蛋白质降解和蛋白质功能调控中发挥重要作用[12],这个过程受泛素连接酶和去泛素化酶的精确调控[13]。USP9X作为去泛素酶家族的成员之一,能使底物去泛素化,并使其在细胞内稳定存在,从而调控多种不同的细胞功能。研究表明,高表达的USP9X通过调控特定的基因从而牵涉到肿瘤的生长、侵袭和转移,如Mcl-1、β-catenin和转化生长因子-β等。最近研究进一步显示在人肿瘤组织中USP9X的表达与Mcl-1(Bcl-2家族的成员之一)相关[7],提示USP9X可能参与肿瘤细胞的凋亡调控,因而可能成为肿瘤分子靶向治疗潜在的分子靶点。
由于去泛素化酶包括USP9X在许多人类肿瘤中发挥重要作用[14],因此有必要开发特异性的去泛素化酶抑制剂作用于肿瘤潜在的治疗靶点。在本研究中,我们首先采用RNA干扰技术,将USP9XsiRNA转染胃癌AGS细胞,发现其在48 h能显著抑制胃癌AGS细胞中USP9X mRNA和蛋白的表达,这一结果为进一步探讨USP9X在胃癌中的功能奠定基础。
研究表明,USP9X牵涉到许多重要的细胞生物学过程的调控,如细胞黏附、侵袭、转移以及细胞凋亡等。Dupont等[15]发现USP9X能调控细胞的黏附过程,这主要通过β-catenin和E-cadherin表达的变化发挥作用。此外,USP9X能调控mTOR和TGFβ信号途径,这些信号途径广泛参与肿瘤的发生发展过程。USP9X也能通过调控p53和抗凋亡蛋白Mcl-1从而调控肿瘤细胞的凋亡过程[7]。这些研究从分子水平解析USP9X在调控肿瘤细胞侵袭和凋亡中所涉及的关键分子事件。此外,Fu等[11]研究小组研究胃癌组织中USP9X的表达时发现USP9X的表达与Mcl-1呈正相关,并且与淋巴结转移、远端转移、肿瘤分期密切相关,提示USP9X可能在胃癌细胞凋亡、侵袭和转移中发挥重要作用,但确切的生物学功能尚不清楚。因此,在目前的研究中,我们采用流式细胞术和Boyden小室检测下调USP9X表达对胃癌AGS细胞凋亡和侵袭的影响,结果表明下调USP9X表达能明显诱导胃癌细胞凋亡,并显著降低胃癌细胞的侵袭能力,这些结果提示USP9X可能在胃癌细胞的凋亡和侵袭过程中发挥重要的作用。此外,在此基础上,我们进一步分析不同处理的胃癌AGS细胞中凋亡相关蛋白Mcl-1和Bax以及侵袭相关蛋白MMP-2的表达,发现下调USP9X表达能明显降低Mcl-1和MMP-2的表达,但显著增加Bax蛋白的表达,这可能是下调USP9X表达引发胃癌细胞凋亡和侵袭改变的原因之一,但确切的分子机制仍需要进一步阐明。
总之,本研究采用的USP9XsiRNA能显著下调胃癌细胞中USP9X mRNA和蛋白的表达水平,其表达水平的下调诱导胃癌细胞凋亡和降低其侵袭能力,并明显降低Mcl-1和MMP-2的表达,但显著增加Bax蛋白的表达。这些研究表明未来进一步阐明其详细的分子调控机制有望为以USP9X为靶点的胃癌的分子靶向治疗提供理论依据。
[参 考 文 献]
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] Graham DY. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits[J]. Gastroentero-logy, 2015, 148(4):719-731.
[3] Chen K, Yang D, Li X, et al. Mutational landscape of gastric adenocarcinoma in Chinese: implications for prognosis and therapy[J]. Proc Natl Acad Sci U S A, 2015, 112(4):1107-1112.
[4] Xie Y, Avello M, Schirle M, et al. Deubiquitinase FAM/USP9X interacts with the E3 ubiquitin ligase SMURF1 protein and protects it from ligase activity-dependent self-degradation[J]. J Biol Chem, 2013, 288(5):2976-2985.
[5] Agrawal P, Chen YT, Schilling B, et al. Ubiquitin-specific peptidase 9, X-linked (USP9X) modulates activity of mammalian target of rapamycin (mTOR) [J]. J Biol Chem, 2012, 287(25):21164-21175.
[6] Murtaza M, Jolly LA, Gecz J, et al. La FAM fatale: USP9X in development and disease[J]. Cell Mol Life Sci, 2015, 72(11):2075-2089.
[7] Schwickart M, Huang X, Lill JR, et al. Deubiquitinase USP9X stabilizes MCL1 and promotes tumour cell survival[J]. Nature, 2010, 463(7277):103-107.
[8] Harris DR, Mims A, Bunz F. Genetic disruption of USP9X sensitizes colorectal cancer cells to 5-fluorouracil[J]. Cancer Biol Ther, 2012, 13(13):1319-1324.
[9] Pérez-Mancera PA, Rust AG, van der Weyden L, et al. The deubiquitinase USP9X suppresses pancreatic ductal adenocarcinoma[J]. Nature, 2012, 486(7402):266-270.
[10] Wang Y, Liu Y, Yang B, et al. Elevated expression of USP9X correlates with poor prognosis in human non-small cell lung cancer[J]. J Thorac Dis, 2015, 7(4):672-679.
[11] Fu X, Xie W, Song X, et al. Aberrant expression of deubiquitylating enzyme USP9X predicts poor prognosis in gastric cancer[J]. Clin Res Hepatol Gastroenterol, 2017, 41(6):687-692.
[12] Salmena L, Pandolfi PP. Changing venues for tumour suppression: balancing destruction and localization by monoubiquitylation[J]. Nat Rev Cancer, 2007, 7(6):409-413.
[13] Nijman SM, Luna-Vargas MP, Velds A, et al. A genomic and functional inventory of deubiquitinating enzymes[J]. Cell, 2005, 123(5):773-786.
[14] D’Arcy P, Wang X, Linder S. Deubiquitinase inhibition as a cancer therapeutic strategy[J]. Pharmacol Ther, 2015, 147:32-54.
[15] Dupont S, Mamidi A, Cordenonsi M, et al. FAM/USP9x, a deubiquitinating enzyme essential for TGFβ signaling, controls Smad4 monoubiquitination[J]. Cell, 2009, 136(1):123-135.
