经胸肺动脉去神经支配术在肺动脉高压大鼠模型中的治疗作用
2018-06-30黄源刘一为项理邢珺月苏展豪张晓玲孟健王佩合张浩
黄源,刘一为,项理,邢珺月,苏展豪,张晓玲,孟健,王佩合,张浩
肺动脉高压(Pulmonary arterial hypertension,PAH)是以平均肺动脉压力和肺血管阻力不断升高,肺血管重构为特征的临床综合征,持续升高的肺血管压力及阻力可导致右心后负荷增加,最终导致右心衰竭而死亡[1-5]。PAH的发病机制尚不明确,近年来有研究表明交感神经系统(Sympathetic nervous system,SNS)在肺动脉高压患者中被激活[6-8],同时神经激素活化一定程度上促进了肺动脉高压的病理生理改变[9]。与此同时,有动物研究表明经皮肺动脉交感神经消融术(Percutaneous pulmonary artery denervation,PADN)能消除球囊堵塞左肺动脉远端导致的肺动脉高压[10],同时也有临床研究表明通过PADN可以降低PAH患者的平均肺动脉压力及肺血管阻力,提高患者6分钟步行距离[11,12]。本研究拟通过对野百合碱诱导的肺动脉高压大鼠模型行经胸肺动脉去神经支配术,探讨该手术是否可以降低肺动脉高压大鼠的肺动脉压力,并逆转肺血管重构及右心室肥厚。
1 材料与方法
实验动物及分组:将24只雄性无特定病原体(Specefic pathogen free,SPF) 级 Sprague Dawley(SD)大鼠,按1:1:1比例随机分为对照组、假手术组及手术组。以上大鼠均购自北京维通利华实验动物技术有限公司,体重280~300 g。
方法:首先测量各组SD大鼠的平均肺动脉压等血流动力学基线参数,之后对照组给予颈背部皮下一次性注射生理盐水(60 mg/kg),假手术组和手术组给予颈背部皮下一次性注射野百合碱 (60 mg/kg)造模。注射野百合碱4周后,采用右心导管测量各组大鼠平均肺动脉压等血流动力学参数,造模成功后手术组遂行经胸肺动脉去神经支配术,假手术组只开胸并不进行肺动脉去神经支配术。手术2周后再采用右心导管测量各组大鼠平均肺动脉压等血流动力学参数。之后取心肺组织观察其显微形态学变化,并测量右心室肥厚指数(RVHI)。(1)SD大鼠平均肺动脉压的测量:常规麻醉大鼠,分离大鼠右侧颈外静脉,剪口后插入自制2F右心导管,导管通过压力传感器与生物机能实验系统(PowerLab数据采集分析系统,澳大利亚)相连,监测压力变化,在压力波形的引导下,导管经上腔静脉进入右心房、三尖瓣口、右心室,最后进入肺动脉干,测定平均肺动脉压力等血流动力学参数。 (2)经胸去肺动脉交感神经术过程:常规麻醉大鼠(腹腔注射戊巴比妥钠 40 mg/kg),气管插管,连接动物呼吸机(ALC-V8S型小动物呼吸机,奥尔科特生物科技公司),设定呼吸频率30 次/min,潮气量10 ml/kg。常规在大鼠左侧2~3肋间小切口开胸,暴露肺动脉后,剔除肺动脉主干附近结缔组织,之后关胸,常规术后护理。(3)右心室肥厚指数测定:处死三组SD大鼠后,剪除心房组织,沿室间隔边缘分离出右心室(RV),左心室(LV)和室间隔(S),滤纸吸净组织水分,以电子天平分布称重RV和(LV+S)质量,以公式RV/(LV+S)计算RVHI。 (4)心肺组织形态学检查:分别取其肺组织、心脏组织,对肺组织分别进行弹力纤维、胶原、肌纤维三色染色(EVG染色)和肺动脉平滑肌肌动蛋白-内皮细胞染色(SMA-VWF染色)。每只大鼠随机选取5张肺组织切片,每张切片随机选取10个直径小于300 μm的肺小动脉,用IPP3D(Image-Pro Plus 3D)图像处理软件进行图像分析,计算动脉中层壁厚占外径的百分比(MT%)。心脏组织分别进行右心室心肌细胞膜染色(WGA染色)。每只大鼠随机选取5张心脏组织横断面切片,每张切片随机选取10个右心室心肌细胞的横切面视野,用IPP 3D进行图像分析,计算右心室心肌细胞的横截面积。 (5)肺动脉交感神经的染色,将大鼠肺动脉及周围结缔组织置于4%的多聚甲醛溶液固定48 h,石蜡包埋5 μm连续切片,进行酪氨酸羟化酶(abcam公司)染色。
统计学处理:应用SPSS 23.0软件进行分析。实验数据全部采用均数±标准差(±s)表示,组内前后比较采用配对t检验,两组间比较采用两独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 三组大鼠血流动力学指标变化情况(表1)
研究结果表明,手术组和假手术组在注射野百合碱第4周后,平均肺动脉压、右心室收缩压,以及平均右心室压和肺动脉收缩压均较注射前(基线水平)显著升高 (P均<0.01);与对照组相比,手术组及假手术组这四项血流动力学指标均显著升高(P均<0.01),这表明肺动脉高压大鼠造模成功。此外,手术组在第6周,即术后2周时,其平均肺动脉压、右心室收缩压,平均左心室压及肺动脉收缩压较术前显著降低(P<0.01),而假手术组术后与术前相比持续升高(P<0.01);同时术后2周时,与假手术组相比,手术组平均肺动脉压、右心室收缩压,平均左心室压及肺动脉收缩压明显下降(P<0.01)。
表1 三组大鼠血流动力学指标变化情况(mmHg,±s)
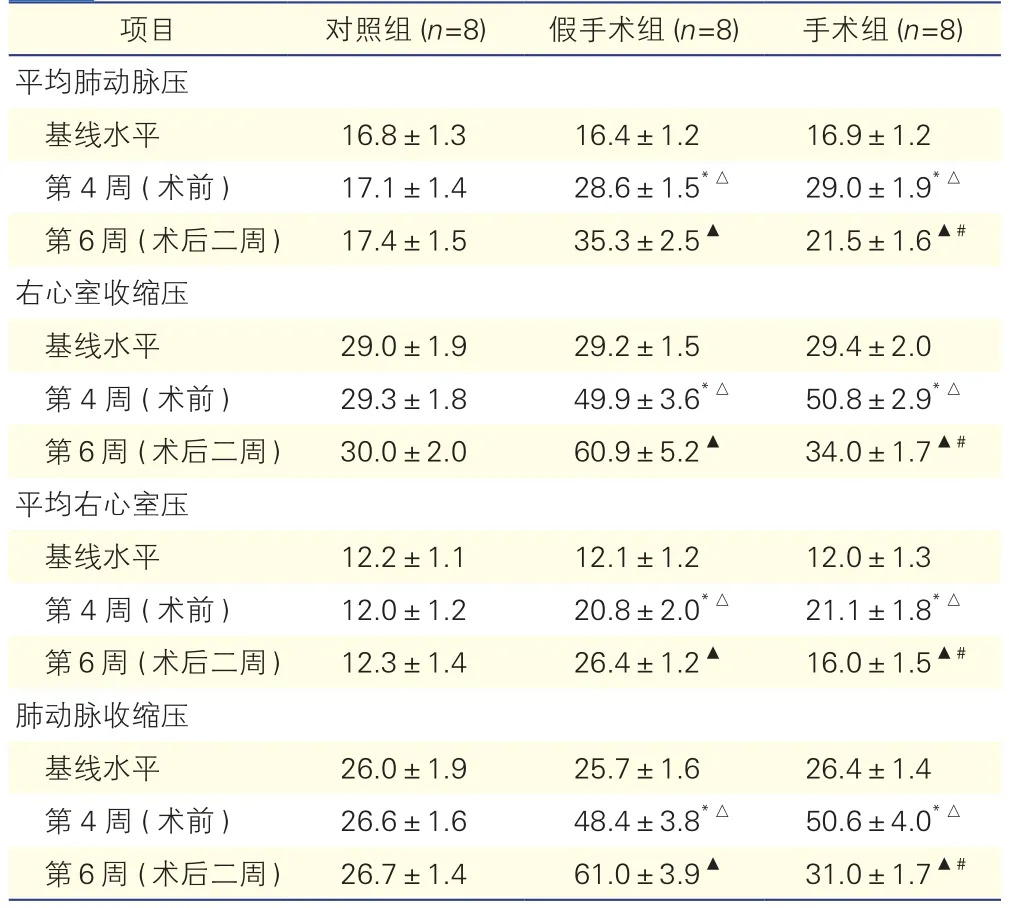
表1 三组大鼠血流动力学指标变化情况(mmHg,±s)
注:与基线水平相比*P<0.01;与对照组相比△P<0.01;与同组术前相比▲P<0.01;与假手术组相比 #P<0.01。1 mmHg=0.133 kPa
项目 对照组(n=8) 假手术组(n=8) 手术组(n=8)平均肺动脉压基线水平 16.8±1.3 16.4±1.2 16.9±1.2第 4 周 (术前 ) 17.1±1.4 28.6±1.5*△ 29.0±1.9*△第 6周 (术后二周) 17.4±1.5 35.3±2.5▲ 21.5±1.6▲#右心室收缩压基线水平 29.0±1.9 29.2±1.5 29.4±2.0第 4 周 (术前 ) 29.3±1.8 49.9±3.6*△ 50.8±2.9*△第 6周 (术后二周) 30.0±2.0 60.9±5.2▲ 34.0±1.7▲#平均右心室压基线水平 12.2±1.1 12.1±1.2 12.0±1.3第 4 周 (术前 ) 12.0±1.2 20.8±2.0*△ 21.1±1.8*△第 6周 (术后二周) 12.3±1.4 26.4±1.2▲ 16.0±1.5▲#肺动脉收缩压基线水平 26.0±1.9 25.7±1.6 26.4±1.4第 4 周 (术前 ) 26.6±1.6 48.4±3.8*△ 50.6±4.0*△第 6周 (术后二周) 26.7±1.4 61.0±3.9▲ 31.0±1.7▲#
2.2 三组大鼠肺小动脉中层壁厚占外径的百分比及形态学比较(图1)
三组大鼠肺小动脉中层壁厚占外径的百分比(MT%)统计结果表明:与对照组相比,假手术组肺小动脉中层平滑肌厚度明显增厚[(39.7%±3.3%)vs( 22.3%±1.5%),P<0.01]; 与 假 手 术 组 相比,手术组的肺小动脉中层平滑肌厚度明显减轻[(30.8%±2.1%) vs (39.7%±3.3%),P<0.01]。三组大鼠肺小动脉EVG和SMA-VWF染色结果显示:对照组肺小动脉管壁清楚菲薄,血管内皮扁平;假手术组肺小动脉管壁增厚,管腔狭窄甚至闭塞,平滑肌细胞增生,血管内皮肥厚,重构特征明显;手术组肺小动脉管壁清楚,管腔不狭窄,中层平滑肌肥厚减轻(图1)。
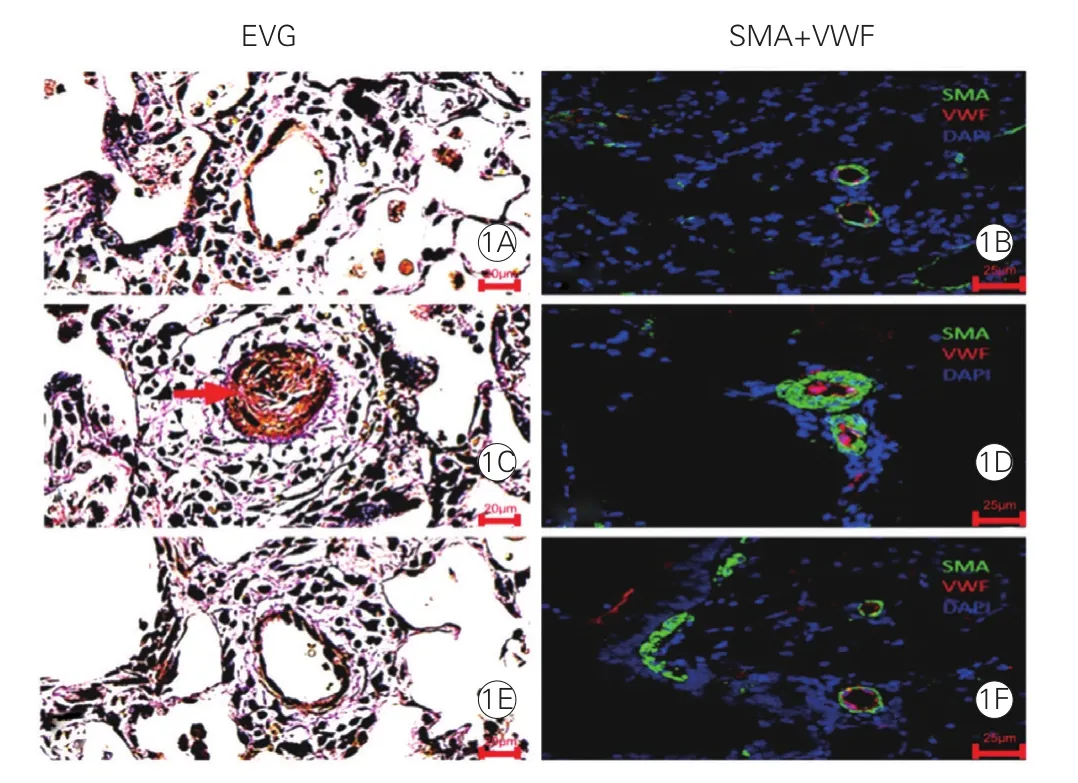
图1 三组大鼠肺小动脉弹力纤维、胶原、肌纤维三色染色和肺动脉平滑肌肌动蛋白-内皮细胞染色
2.3 三组大鼠右心室肥厚指数(表2)及右心室心肌细胞形态学比较(图2)
研究结果显示,与对照组相比,假手术组右心室心肌细胞横截面积和RVHI明显增大(P均<0.01);与假手术组相比,手术组右心室心肌细胞横截面积明显减小、RVHI明显降低(P均< 0.01)(表2)。右心室心肌细胞膜染色显示,与对照组相比,假手术组右心室心肌细胞明显增大肥厚;与假手术组相比,手术组右心室心肌细胞明显减小,肥厚程度减轻。
表2 三组大鼠右心室心肌细胞横截面积及右心室肥厚指数的比较(±s)

表2 三组大鼠右心室心肌细胞横截面积及右心室肥厚指数的比较(±s)
注:与对照组相比 *P<0.01;与假手术组相比△P<0.01
项目 对照组(n=8)假手术组(n=8)手术组(n=8)右心室肥厚指数 (%) 28.4±1.2 46.7±1.3* 34.4±1.0△右心室心肌细胞横截面积 (μ m2) 128±11.0 539±19.0* 230±14.0△
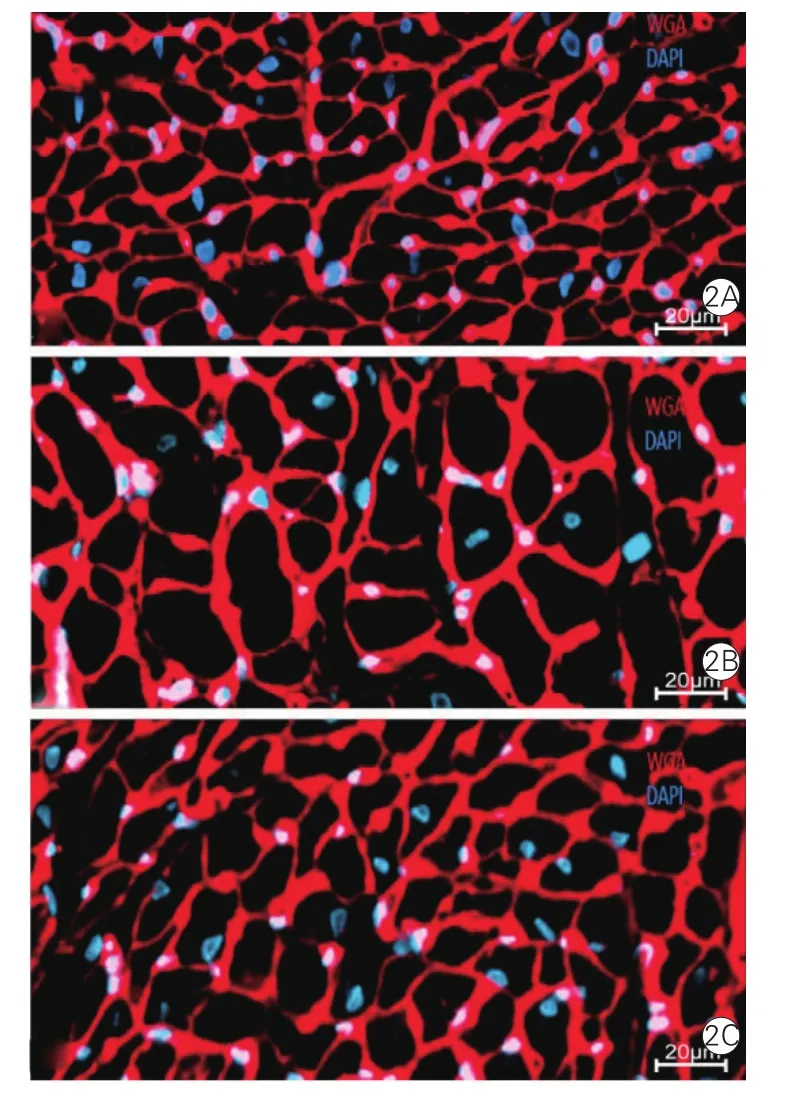
图2 三组大鼠右心室心肌细胞膜染色
2.4 肺动脉周围交感神经的酪氨酸羟化酶染色结果(图3)
分离大鼠肺动脉及其周围结缔组织进行交感神经的酪氨酸羟化酶染色,发现其肺动脉主干周围结缔组织中存在大量交感神经分布。
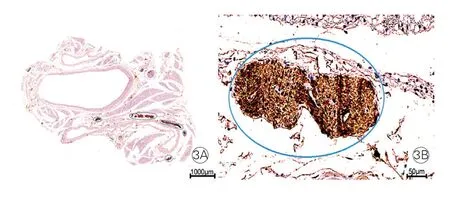
图3 肺动脉周围交感神经的酪氨酸羟化酶染色
3 讨论
有临床研究表明,交感神经系统在肺动脉高压患者中激活[13],也有研究发现肺动脉高压患者血浆去甲肾上腺素水平升高,并且与肺动脉压、肺血管阻力相关[14]。交感神经系统的激活可能是肺动脉高压患者肺血管重塑及右心室功能障碍的促进因素[15]。其具体机制可能是由于患者交感神经系统激活,血浆去甲肾上腺素水平增加,增加的去甲肾上腺素通过肺动脉平滑肌上的α1受体介导了肺动脉平滑肌的增殖失调和肺血管的异常收缩,从而导致肺血管重塑和肺动脉压力升高,进而促成右心室后负荷增加、右心衰竭。那么,如果经胸去除肺动脉周围交感神经,是否会达到改善肺动脉高压患者血流动力学,改善肺血管重构及右心室肥厚?本实验中,我们通过成功构建肺动脉高压大鼠,并实施这一外科手段来印证这一假设。
首先,本实验证明在野百合碱诱导的肺动脉高压大鼠,其肺动脉主干周围结缔组织中存在大量交感神经纤维。而这为肺动脉高压中交感神经系统的激活提供了基础。在切除这部分结缔组织后,与假手术组相比,手术组的右心室收缩压、平均肺动脉压力明显下降,而且随着肺动脉压力的下降,手术组的肺小动脉中层平滑肌厚度明显减轻,右心室心肌细胞横截面积和RVHI明显减小,肺血管重构和右心室肥厚明显改善。与经皮肺动脉去神经术相比,由于本研究发现大鼠肺动脉周围交感神经主要分布在肺动脉壁外的结缔组织中,所以经胸手术切除这些富含交感神经的结缔组织可以更加彻底地实现肺动脉去神经化的目的,加强了手术效果。此外,该外科干预手段可避免导管射频消融对消融处肺动脉内皮的炎症性损伤。
虽然本研究首次证明经胸肺动脉去神经支配术可以有效降低野百合碱诱导的大鼠肺动脉高压模型的肺动脉压力,改善其肺动脉重构及右心室肥厚,为临床干预和治疗肺动脉高压提供了新的潜在方向,但依然存在一些局限性。本实验中应用野百合碱制作了肺动脉高压大鼠模型,野百合碱通过选择性损伤肺血管内皮,引起慢性血管炎性病变,进而导致肺动脉高压和肺血管重构[16],这一定程度模拟了临床上特发性肺动脉高压的模型,但该手术对于其它病因所致的肺动脉高压是否有效仍需进一步探索。同时由于缺乏相关实验设备,我们并未检测三组大鼠心排量和肺动脉阻力,从而没能全面反映各组大鼠的心功能状态和肺血管阻力。此外,这一外科手段对肺动脉高压大鼠的治疗作用,其具体分子机制还需进一步探索。
[1]Chin KM, Rubin LJ. Pulmonary arterial hypertension [J]. J Am Coll Cardiol, 2008, 51 (16): 1527-1538. DOI: 10. 1016/j. jacc. 2008. 01.024.
[2]Hansmann G. Pulmonary hypertension in infants, children, and young adults[J]. J Am Coll Cardiol, 2017, 69 (20): 2551-2569. DOI: 10.1016/j. jacc. 2017. 03. 575.
[3]Farber HW, Loscalzo J. Pulmonary arterial hypertension[J]. N Engl J Med, 2004, 351 (16): 1655-1665. DOI: 10. 1056/NEJMra035488.
[4]杨涛, 何建国. 对肺动脉高压患者的管理应有一套完整的策略—2009 年欧洲肺动脉高压诊断和治疗指南解读[J]. 中国循环杂志,2012, 27(Supplment): 81-86. DOI: 10. 3969/j. issn. 1000-3614.2012.
[5]罗鹏, 黄石安, 何建国. 动脉型肺动脉高压靶向药物治疗的中国证据[J]. 中国循环杂志. 2014, 29(7): 552-554. DOI: 10. 3969/j.issn. 1000-3614. 2014. 07. 019.
[6]Velez-Roa S, Ciarka A, Najem B, et al. Increased sympathetic nerve activity in pulmonary artery hypertension[J]. Circulation, 2004,110(10): 1308-1312. DOI: 10. 1161/01. CIR. 0000140724. 90898. D3.
[7]Ciarka A, Doan V, Velez-Roa S, et al. Prognostic significance of sympathetic nervous system activation in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2010, 11(11): 1269-1275.DOI: 10. 1164/rccm. 200912-1856OC.
[8]Mak S, Witte KK, Al-Hesayen A, et al. Cardiac sympathetic activation in patients with pulmonary arterial hypertension[J]. Am J Physiol Regul Integr Comp Physiol, 2012, 302 (10): R1153-1157. DOI: 10.1152/ajpregu. 00652. 2011.
[9]de Man FS, Handoko ML, Guignabert C, et al. Neurohormonal axis in patients with pulmonary arterial hypertension: friend or foe?[J]. Am J Respir Crit Care Med, 2013, 187(1): 14-9. DOI: 10. 1164/rccm.201209-1663PP.
[10]Chen SL, Zhang YJ, Zhou L, et al. Percutaneous pulmonary artery denervation completely abolishes experimental pulmonary arterial hypertension in vivo[J]. Euro Intervention, 2013, 9(2): 269-276. DOI:10. 4244/EIJV9I2A43.
[11]Chen SL, Zhang FF, Xu J, et al. Pulmonary artery denervation to treat pulmonary arterial hypertension: the single-center, prospective, firstin-man PADN-1 study (first-in-man pulmonary artery denervation for treatment of pulmonary artery hypertension)[J]. J Am Coll Cardiol,2013, 62(12): 1092-1100. DOI: 10. 1016/j. jacc. 2013. 05. 075.
[12]Chen SL, Zhang H, Xie DJ, et al. Hemodynamic, functional, and clinical responses to pulmonary artery denervation in patients with pulmonary arterial hypertension of different causes: phase Ⅱ results from the Pulmonary Artery Denervation-1 study[J]. Circ Cardiovasc Interv, 2015, 8(11): e002837. DOI: 10. 1161/CIRCINTERVENTIONS.115. 002837.
[13]Nagaya N, Nishikimi T, Uematsu M, et al. Plasma brain natriuretic peptide as a prognostic indicator in patients with primary pulmonary hypertension[J]. Circulation, 2000, 102 (8): 865-870. DOI: 10.1161/01. cir. 102. 8. 865.
[14]Nootens M, Kaufmann E, Rector T, et al. Neurohormonal activation in patients with right ventricular failure from pulmonary hypertension:relation to hemodynamic variables and endothelin levels[J]. J Am Coll Cardiol, 1995, 26 (7): 1581-1585. DOI: 10. 1016/0735-1097(95)00399-1.
[15]Maron BA, Leopold JA. Emerging concepts in the molecular basis of pulmonary arterial hypertension: part Ⅱ: neurohormonal signaling contributes to the pulmonary vascular and right ventricular pathophenotype of pulmonary arterial hypertension[J]. Circulation,2015, 131 (23): 2079-2091. DOI: 10. 1161/CIRCULATIONAHA. 114.006980.
[16]Hill NS, Gillespie MN, McMurtry IF. Fifty years of monocrotalineinduced pulmonary hypertension: what has it meant to the field? [J].Chest, 2017, 152 (6): 1106-1108. DOI: 10. 1016/j. chest. 2017. 10.007.
