原始热带雨林鹦歌岭土壤抗MRSA放线菌的分离与筛选
2018-06-29潘洁明张荣意邓加艾谭志琼
潘洁明 张荣意 邓加艾 谭志琼
(海南大学热带农林学院,海口 570228)
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)耐药性强,能够引起致死性感染,危害性十分严重,已经成为临床抗菌感染治疗的首要难题,并与乙型肝炎、艾滋病一起被称为当今世界三大感染顽疾,给人类带来了极大危害[1-2]。自1961年英国Jevons发现首例耐甲氧西林金黄色葡萄球菌MRSA以来[3],在欧美、亚洲等各地相继出现MRSA所致的感染,到20世纪80年代,有关MRSA的感染几乎遍及全球,成为临床上最常见的病原菌之一。MRSA本在医院重症监护室和外科手术室中泛滥,但据最近报道,其已从医院扩散到社区人群和食用动物之中[4-5]。自Saravolatz等[6]首次报道社区获得性耐甲氧西林金黄色葡萄球菌(Community-acquired methicillinresistant Staphylococcus aureus,CA-MRSA)感染后,CA-MRSA感染病例在全球陆续被报道,MRSA已严重威胁人类的健康。
MRSA一般具有多重耐药特征,MRSA感染已引起世界范围的广泛关注,目前治疗MRSA感染的抗生素十分有限,仅有万古霉素和利奈唑胺[7]。但最近的研究结果表明,新的抗万古霉素和利奈唑胺的MRSA已经出现[8]。因此,面对MRSA耐药性的日趋严重,寻找和开发高效抑制MRSA的抗生素显得相当重要[9-10]。放线菌(Actinomycetes)是产生抗生素最多的一类微生物,目前世界上已经发现的抗生素80%是由放线菌产生的[11]。鹦歌岭位于海南省乐东县,海拔1 811 m,山高坡陡,交通闭塞,人烟稀少,绝大部分从未有过正规和大规模的开发利用,表现出非常明显的原始特征,生物多样性极其丰富[12],目前对放线菌的研究未见报道。其中可能蕴藏着抗MRSA的丰富放线菌资源。本研究从鹦歌岭土壤中分离、筛选抗MRSA的放线菌,并对其进行初步鉴定和抗菌活性物质研究,目的是从中发现新的抗MRSA的放线菌及其活性物质。
1 材料与方法
1.1 材料
1.1.1 样品土壤 本实验所用的土壤采自海南省乐东县原始热带雨林鹦歌岭。采样深度为20 cm,土壤表面覆盖茂盛的乔木(表1)。
1.1.2 供试菌株 MRSA ATCC 9551由海南省药监所提供。
1.1.3 培养基 高氏一号培养基用于分离培养土壤放线菌,牛肉膏蛋白胨培养基用于MRSA的培养和测定,高氏一号液体培养基用于菌株发酵[13]。
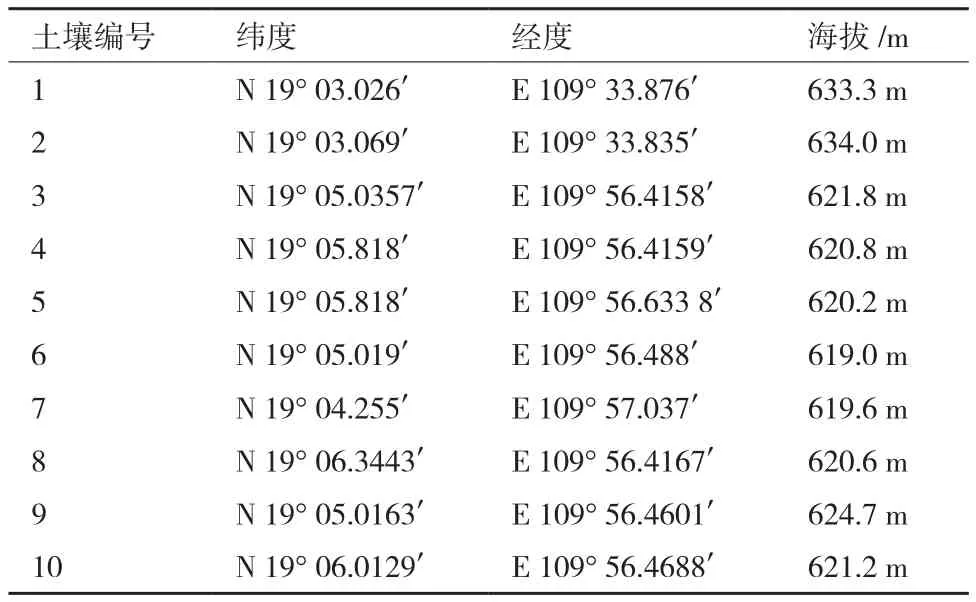
表1 土壤样品
1.2 方法
1.2.1 土壤中拮抗放线菌的分离与筛选 采用平板稀释法分离各土壤样本中的放线菌[14]。取浓度为10-3、10-4和10-5的土壤悬浮液200 μL加入至高氏一号培养基(加入70 μg/mL重铬酸钾来抑制细菌和真菌)上,并用无菌的涂布棒涂布均匀,贴好标签,28℃培养7-10 d。待长出放线菌菌落后,挑取不同类型的菌落在高氏一号试管斜面上保存。采用琼脂块法筛选抗MRSA的菌株:将斜面上的MRSA用无菌水制成悬浮液,并与45℃牛肉膏蛋白胨培养基充分混匀后倒平板,将高氏1号平板上已经培养好的放线菌打菌块(6 mm),然后挑取至含MRSA培养基上,28℃培养24-48 h,观察拮抗效果[15-16]。挑取拮抗性好的放线菌进行纯化,复筛,保存。
1.2.2 抗MRSA菌株发酵粗提物的制备 将筛选出的菌株接种到高氏一号固体培养基上,28℃培养8 d,取分生孢子制备孢子悬浮液,采用摇瓶发酵培养法,将悬浮液接种到装有100 mL高氏一号液体培养基的锥形瓶(100 mL/250 mL)中,于28℃、200 r/min摇瓶培养7 d,然后用8层灭菌纱布过滤,滤液用乙酸乙酯萃取3次,合并萃取液,菌丝体用70%的乙醇浸泡48 h,减压浓缩后,用水溶解,再用乙酸乙酯萃取3次,合并萃取液,减压蒸馏浓缩可得到乙酸乙酯粗提物,用甲醇溶解,4℃冰箱中保存备用。
1.2.3 粗提液对MRSA的抑菌作用 采用滤纸片法测定粗提液对MRSA的抑菌活性。将MRSA与牛肉膏蛋白胨培养基混合后倒平板,用移液枪分别吸取5 μL粗提液加到灭菌滤纸片(6 mm)上,将该加样的滤纸片放置到带MRSA的平板上,每个平皿3个重复,然后置于28℃培养箱内培养24-48 h,观察拮抗效果,同时用甲醇作对照。
1.2.4 抗MRSA菌株的16S rDNA序列测定及其系统发育分析 采用OMEGA公司细菌DNA提取试剂盒(D3350-01)提取菌株基因组DNA[17]。引物序列 如 下 :27f:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-TACGGCTACCTTGTTACGACTT-3′。 扩 增反应体系总体积为25 μL,其中包括Genomic DNA 1μL,Primer F 1 μL,Primer R 1 μL,PCR-Mixture 12.5 μL,dd H2O 9.5 μL。PCR应条件:预变性,94℃,5 min;变性,94℃,30 s;退火,52℃,30 s;延伸,72℃,1 min;35个循环;终止延伸,72℃,10 min;4℃保存[18]。将PCR测序产物送上海生工生物工程技术服务公司测序,结果用BLAST软件比对,查找相似性最高的同源菌株,并利用Mega6.0[19]构建系统发育树。
1.2.5 HPLC指纹图谱的建立 用安捷伦高效液相色谱仪(Agilent Technologies 1260 Infinity HPLC)检测分析发酵液粗提物的指纹图谱,安捷伦DADG1315D检测器,色谱柱YMC-packed C 18(5 mm,250 mm× 4.6 mm)。在HPLC上以相同的条件进行梯度洗脱(1 mL/min,10%甲醇10 min,10%-100%甲醇,20min,100%甲醇5 min,总时间35 min)。
2 结果
2.1 拮抗放线菌的分离与筛选
从10份土壤样本中共分离到168株放线菌,其中10株具有较强的抗MRSA活性(表2)。由表2可知,放线菌菌块的抑菌直径在17-31 mm之间,抗MRSA能力强。根据《消毒技术规范》可知,抑菌效果主要有3个等级,抑菌直径在20 mm以上为抑菌效果强,在10-20 mm为抑菌效果中等,在10 mm以下为抑菌效果弱。由此可见,该10株放线菌中有4株为强抑菌菌株,6株为中等抑菌菌株。
液体发酵的乙酸乙酯粗提物对MRSA抑菌结果见表2。菌株7抑菌直径达到25 mm,抑菌能力强,表明产生了高活性的抗菌物质;菌株5抑菌直径为15 mm,抑菌能力仅次于菌株7;菌株8-1、8-4抑菌直径分别为10 mm和11 mm,抑菌能力中等,而菌株8-3、9-1、4-1、4-2、3-13和3-14抑菌直径小于10 mm,抑菌能力弱。由此可见,菌株7、菌株5值得进一步深入研究。

表2 放线菌对MRSA的抑菌效果

表3 抗MRSA放线菌分离菌株的分子鉴定
2.2 抗MRSA菌株的系统发育分析
获得10株具有抗MRSA菌株16S rDNA序列均在1 400 bp左右,其在NCBI进行BLAST分析,发现与这10株菌相似率最高的均为链霉菌(Streptomyces),均达到99%(表3),初步判断这10株放线菌均为链霉菌。用Mega 6.0中的N-J法构建系统发育树(图1),其中菌株9-1、8-4、8-1和4-2与Streptomyces lunalinharesii strain RCQ 1071T聚在一支,相似率98%;菌株7与Streptomyces yunnanensis strainT聚为一支,相似率84%;菌株8-3和菌株5与Streptomyces aureofaciens strain KACC 20180T聚为一支,相似率96%-99%;菌株3-13、3-14、4-1与Streptomyces lateritius strain LMG 19372T聚为一支,相似率95%。
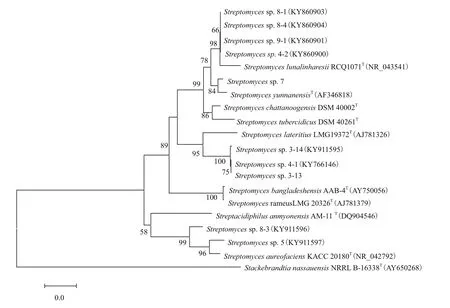
图1 10株放线菌16S rDNA序列的系统发育树
2.3 抗MRSA菌株的HPLC指纹图谱
根据10株放线菌发酵液粗提物的HPLC指纹图谱(图2)发现,菌株7、菌株5和菌株9-1的主峰出峰时间主要集中在12-27 min,在220-340 nm波长处均有吸收。由图2可见,发酵液50%甲醇-水洗脱部分有明显的次级代物产物峰,显示3株菌代谢产物均丰富,但是3株菌株的代谢产物有区别。菌株7在21.6-23.6 min为系列化合物,紫外吸收主要在250 nm左右有强吸收峰;菌株5在23-26 min之间为系列化合物,从紫外吸收图谱上看,在250 nm,300 nm,440 nm有强吸收峰;菌株9-1在21-26 min有强吸收,从紫外吸收图谱看,有不同系列的化合物。3株菌株有不同类型的化合物,但3株菌对MRSA均有活性。菌株5的系列化合物最丰富,有可能是抗MRSA的主要成分,有利于构效关系的分析。
3 讨论
海南素有“天然大温室”的美称,温高少寒,蕴藏着极其丰富的放线菌资源,至今仍未被充分开发利用[20]。样品土壤来源于海南省乐东县鹦歌岭,该地处热带,气候适宜,微生物丰富。在海南有关放线菌的分离来源报道主要有霸王岭和红树林土壤[21-22],而对于鹦歌岭土壤报道甚少,因此很有可能从这一土壤中得到新的抑菌活性化合物,从而研发出新型的抗MRSA药物。缪承杜[23]从海南文昌红树林保护区分离到608株真菌,其中7株具有较强的抗MRSA活性;宓伟等[24]发现黄连、黄柏、大黄、银柴胡与石榴皮5种中药具有较高的抗MRSA作用;唐依莉[25]从清澜港头苑村红树林保护区分离到138株内生放线菌,其中27株具有抗MRSA活性;高正航[26]从海南省霸王岭土壤共分离到287株放线菌,得到抗MRSA活性放线菌35株;黄惠琴[27]从海南、湛江和北海沿海地区采样分离获得放线菌395株,43株有抗MRSA活性。
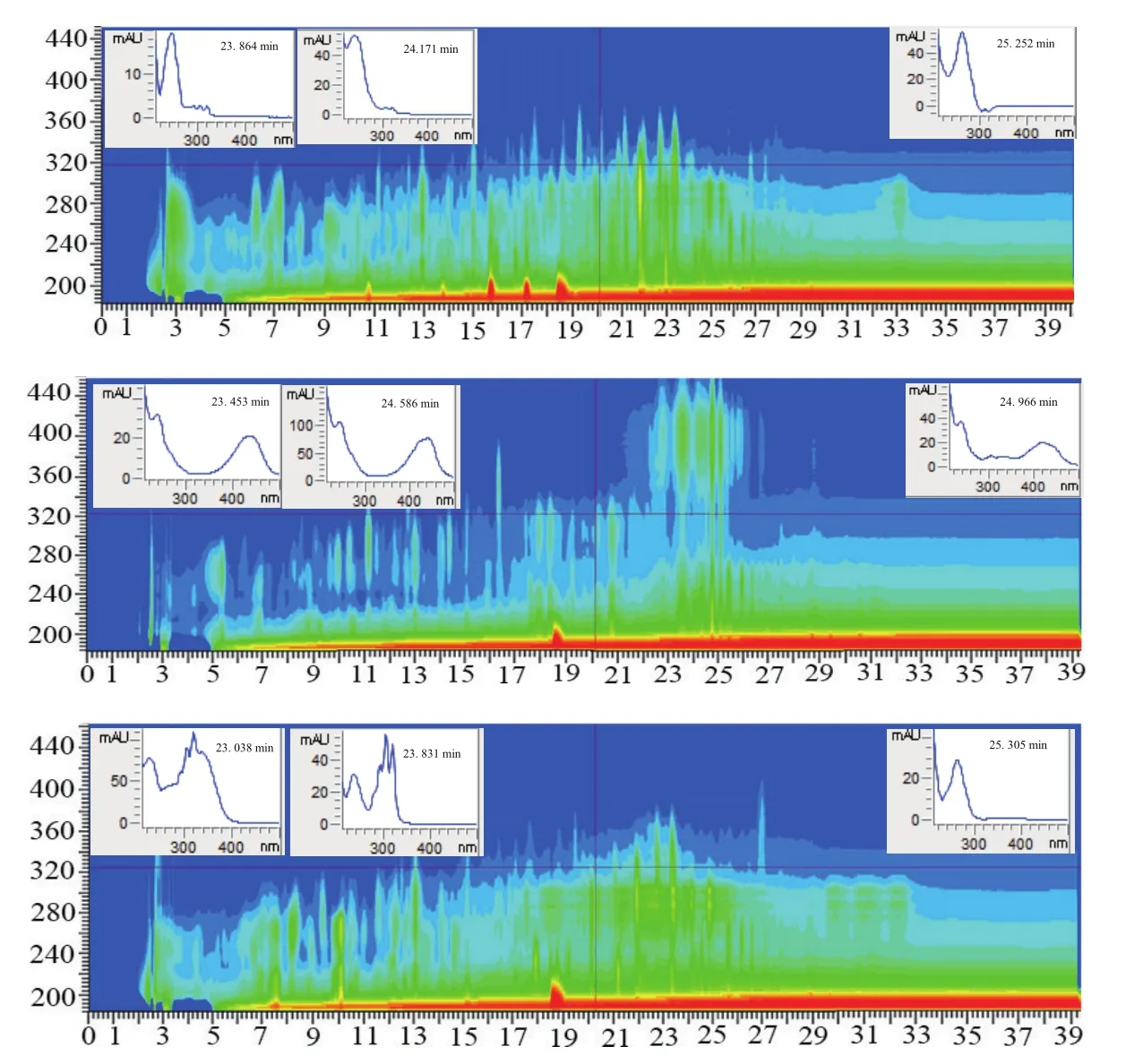
图2 菌株7、5、9-1的紫外吸收图谱(从上到下依次为菌株7、5、9-1)
本研究通过平板稀释法分离获得放线菌168株,从中筛选到10株具有抗MRSA的活性菌株,并对筛选菌株进行16S rDNA序列测定、对比,初步确定该放线菌是链霉菌属;采用滤纸片法和高效液相色谱仪检测粗提液的活性物质,发现10株放线菌对MRSA的生长均有明显的抑制作用。HPLC指纹图谱显示菌株7、菌株5、菌株9-1的次级代谢产物十分丰富,且存在系列化合物,其丰富化合物的生物活性很有研究价值,为探寻新的抗MRSA药物提供依据。此外分离到的168株放线菌中,对MRSA有拮抗作用的放线菌就高达10株,说明鹦歌岭放线菌资源丰富。其特殊的原始森林环境可能会赋予其特殊的代谢途径,进而获得新颖的代谢产物。而且,鹦歌岭不同海拔高度,不同植被覆盖情况的土壤可能存在更多尚未发现和利用的抗MRSA放线菌,值得对其开展系统而全面的研究。下一步研究将对具有抗MRSA活性的放线菌的次级代谢产物进行分离纯化,寻找结构新颖的生物活性物质,探寻新的抗生素。
在研究中我们发现如3-14菌株,其琼脂块的抑菌活性很好,可液体发酵或固体发酵后,乙酸乙脂粗提物的抑菌活性却较弱,可能与乙酸乙酯只提取脂溶性活性成分有关。另外,本研究分离筛选的菌株经鉴定为链霉菌属,对MRSA有拮抗作用,但对农业病原菌的作用如何需要进一步研究。
4 结论
从10份鹦歌岭土壤中分离、筛选到10株具有抗MRSA活性的放线菌,经16S rDNA测序比对分析,10株均属于链霉菌属(Streptomyces)。7号菌抑菌效果最强,乙酸乙酯粗提物的抑菌圈直径高达25 mm,属强抑菌,其余9株的抑菌直径在8-15 mm,对MRSA有一定的抑制作用。HPLC指纹图谱显示,菌株7、菌株5、菌株9-1在220-340 nm均有吸收,330 nm上存在最大吸收峰,发酵液次级代谢产物丰富。
[1]Klevens RM, Morrison MA, Nadle J, et al. Invasive methicillinresistant Staphylococcus aureus infections in the United States[J].The Journal of the American Medical Association, 2007, 298(15):1763-1771.
[2]Jones D, Lee L, Liu JL, et al. Marek’s disease virus encodes a basic-leucine zipper gene resembling the fos/jun oncogenes that is highly expressed in lymphoblasttoid tumor[J]. Proceedings of the National Academy of Sciences USA, 1992, 89(9):4042-4046.
[3]Witter RL, Schat K. Marek’s disease[M]//Saif YM. In diseases of poultry. 11th edition. Ames:Iowa State Press, 2003:407-464.
[4]Frazee BW, Lynn J, Charlebois ED, et al. Highprevalence of methicillin-resistant Staphylococcus aureus in emergency department skin and soft tissue infections[J]. Annals of Emergency Medicine,2005, 45(3):311-320.
[5]Vanderhaeghen W. Hermans K, Haesebrouck F, et al. Methicillinresistant Staphylococcus aureus(MRSA)in food production animals[J]. Epidemiology and Infection, 2010, 138(5):606-625.
[6]Saravolatz LD, Markowitz N, Arking L, et al. Methicillin-resistant Staphylococcus aureus epidemiologic observations during a community-acquired outbreak[J]. Annals of Internal Medicine,1982, 96(1) :11-16.
[7]Fusco NM, Toussaint KA, Prescott WA. Antibiotic management of methicillin-resistant Staphylococcus aureus-associated acute pulmonary exacerbations in cystic fibrosis[J]. Annals of Pharmacotherapy, 2015, 49(4):458-468.
[8]George S, Robert CM. Increasing antibiotic resistance among methicillin-resistant Staphylococcus aureus strains[J]. Clinical Infectious Disease, 2008, 46(5):360-367.
[9]Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. Journal of Natural Products, 2012, 75(3):311-335.
[10]Singh SB, Barrett JF. Empirical antibacterial drug discovery:foundation in natural products[J]. Biochemical Pharmacology,2006, 71(7):1006-1015.
[11]北京农业大学. 微生物命名学[M]. 北京:农业出版社,1986.
[12]林家怡, 吴世捷, 庄雪影, 等. 海南鹦歌岭轮叶三棱栎(Trigonobalanus verticillata)群落特征与保护对策[J]. 生态学报, 2007(6):2230-2238.
[13]方中达. 植病研究方法[M]. 第3版. 北京:中国农业出版社,1998:248-249.
[14]彭云霞, 姜怡一, 段淑蓉, 等. 稀有放线菌的选择性分离方法[J]. 云南大学学报:自然科学版, 2007, 29(1):86-89.
[15]陈国华, 邵伟, 乐超银. 抗多重耐药金黄色葡萄球菌土壤放线菌筛选[J]. 安徽农业科学, 2008, 36(35):15369-15401.
[16]陈电容. 1株抗MRSA的土壤放线菌的分离与鉴定[J]. 生物技术, 2008, 18(2):24-26.
[17]Spatz SJ, Silva RF. Sequence determination of variable regions within the genomes of gallid herpsvirus -2 pathotypes[J].Archives of Virology, 2007, 152:1665-1678.
[18]杨静, 易麟乙, 刘美, 等. 1株抗耐甲氧西林金黄色葡萄球菌放线菌的鉴定及其代谢产物活性分析[J]. 西北农林科技大学学报:自然科学版, 2014(8):8-14.
[19]Murata S, Okada T, Kano R, et al. Analysis of transcriptional activities of the Meq proteins present in highly virulent Marek’s disease virus strains, RB1B and Md5[J]. Virus Genes, 2011,43:66-71.
[20]韩秀芳. 海南土壤放线菌分离与多相分类[C]. 第五届全国微生物资源学术暨国家微生物资源平台运行服务研讨会论文摘要集, 2013.
[21]马伏宇, 郭刚殷, 晓敏, 等. 一株香蕉枯萎病拮抗链霉菌抑菌成分初步分析[J]. 分子植物育种, 2016, 14(11):3190-3194.
[22]袁维道. 四株红树林底泥放线菌的多相分类坚定[D]. 海口:海南大学, 2013.
[23]缪承杜, 林海鹏, 张志华, 等. 一株抗MRSA红树林真菌的分离和鉴定[J]. 热带作物学报, 2010, 31(11):2015-2019.
[24]宓 伟, 何深一. 抗耐甲氧西林金黄色葡萄球菌的中药筛选[J].中国生化药物杂志, 2011, 32(1):44-46.
[25]唐依莉, 谢修超, 洪葵. 红树植物根内生放线菌的分离鉴定及其生理活性的评价[J]. 热带生物学报, 2012, 3(01):32-37+41.
[26]高正航. 霸王岭土壤抗MRSA活性放线菌的筛选及菌株Gda031、Gda0305发酵工艺的优化[D]. 海口:华南热带农业大学, 2006.
[27]黄惠琴. 海洋放线菌抗MRSA菌株的筛选及菌株AM105活性物质的研究[D]. 海口:华南热带农业大学, 2005.
