重症感染患者替考拉宁血药谷浓度68例次监测分析
2018-06-29郭晓芳
梁 培,郭晓芳
0 引言
替考拉宁属于糖肽类抗菌药物,其分子结构、抗菌谱、抗菌活性等与万古霉素类似,适用于治疗耐甲氧西林葡萄球菌(MRSA)感染。有报道,替考拉宁血药谷浓度与抗感染疗效之间有一定相关性,治疗中重度感染,其谷浓度应>10 mg/L,当谷浓度>60 mg/L时,发生血小板减少的几率明显增加[1-2]。由于重症患者机体状态与代谢具有特殊性,影响血药浓度及治疗效果,所以,有必要监测重症患者替考拉宁血药谷浓度。本研究回顾性分析本院ICU感染患者替考拉宁血药谷浓度结果,为重症患者的合理用药提供依据。
1 资料与方法
1.1 研究对象的选择 回顾性收集2015年1月至2016年12月入住我院ICU患者的临床资料。入选标准:①年龄≥18岁;②疑诊或确诊MRSA、耐甲氧西林表皮葡萄球菌(MRSE)等革兰阳性菌感染;③应用替考拉宁治疗并监测血药谷浓度。排除标准:①连续性肾脏替代治疗(CRRT)或腹膜透析等;②使用替考拉宁未达到稳态浓度。
1.2 替考拉宁使用方法 将替考拉宁400 mg或200 mg加入5%葡萄糖注射液或0.9%氯化钠注射液100 mL中,1 h静滴完,负荷剂量,头3剂,每12 h给药1次,维持剂量,q24 h,维持剂量给药1次达到稳态。达稳态后根据血药谷浓度调整剂量。
1.3 替考拉宁血药谷浓度检测方法 替考拉宁达稳态后,在每次用药前30 min抽静脉血4 mL送检。浓度不达标者经过剂量调整后按照同样方法再次抽血送检。采用高效液相色谱法(HPLC)测定替考拉宁血药谷浓度[3]。
2 结果
2.1 患者一般情况 最终纳入41例患者,测量替考拉宁血药谷浓度68例次,男27例,女14例;年龄19~97岁,平均(76.24±17.59)岁;急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分9~34分,平均(21.68±6.90)分;肺部感染34例,腹腔感染7例,血流感染10例,尿路感染4例。共检出阳性菌株29株,其中MRSA 12株,MRSE 11株,屎肠球菌4株,粪肠球菌2株;共检出阴性菌32株,包括肺炎克雷伯杆菌8株、克氏柠檬酸杆菌1株、鲍曼不动杆菌7株、粘质沙雷菌5株、奇异变形杆菌3株、铜绿假单胞菌5株、嗜麦芽窄食单胞菌2株、阴沟肠杆菌1株;真菌3株,均为白色念珠菌;其中13例患者培养出2种及以上致病菌。
2.2 替考拉宁血药谷浓度分布情况 68例次替考拉宁血药谷浓度分布范围为2.58~60 mg/L,平均(9.37±7.83)mg/L,其中10 mg/L以下占69.11%(见表1),10~60 mg/L占30.89%,显示本研究纳入的重症感染患者仅30.89%达到了目标浓度,且个体差异较大,提示重症患者应用替考拉宁时,需注意其血药浓度不达标情况。对达标患者进一步分析,10~20 mg/L占26.47%;而20~60 mg/L仅3例,占4.41%;3例谷浓度分别为21.48、23.15、60 mg/L;谷浓度为60 mg/L患者其肌酐清除率仅3.30 mL/min,且未行CRRT。
2.3 肌酐清除率(Creatinine clearance rate,Ccr)与用药剂量及血药谷浓度 Ccr计算采用标准24 h留尿计算法,Ccr=尿肌酐浓度(μmol/L)×每分钟尿量(mL/min)/血肌酐浓度(μmol/L),分析不同Ccr重症患者替考拉宁血药谷浓度水平,按照Ccr分为1组(<15 mL/min)、2组(15~29 mL/min)、3组(30~59 mL/min)、4组(60~89 mL/min)和5组(≥90 mL/min)。由表2可见,2、3、4、5组之间谷浓度比较差异无统计学意义(P>0.05),但2、3、4、5组与1组比较,差异有统计学意义(P<0.01)。各组间日用药剂量差异无统计学意义(P>0.05)。
2.4 影响替考拉宁血药谷浓度因素的回归分析 临床上影响替考拉宁血药谷浓度的可能因素包括年龄、性别、体重、血肌酐、Ccr、给药剂量、血清白蛋白水平等,对所搜集的以上数据进行多重线性回归分析显示,患者的Ccr对替考拉宁血药谷浓度的影响具有统计学意义(P=0.039),而年龄、性别、体重、APACHEⅡ评分、血清白蛋白、CREA及给药剂量无统计学意义(P>0.05)。见表3。

表1 替考拉宁血药谷浓度分布情况
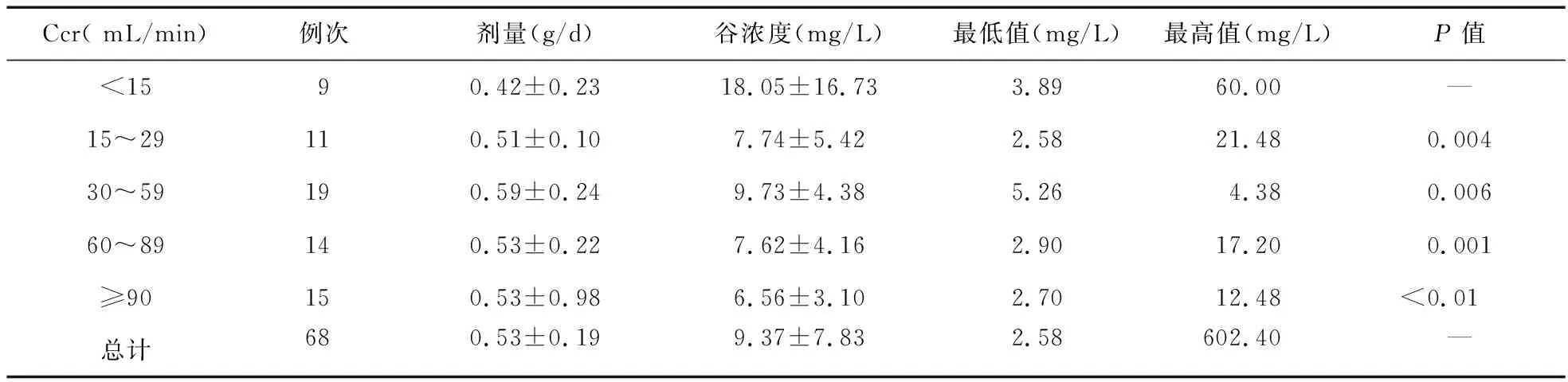
表2 Ccr与替考拉宁用药剂量及血药谷浓度

表3 多重线性回归分析替考拉宁血清谷浓度的影响因素
2.5 替考拉宁血药谷浓度与预后的关系 见图1。根据替考拉宁血药谷浓度,将患者分为谷浓度达标组与未达标组,两组患者的28 d生存曲线分析结果显示,谷浓度达标组死亡率为14.29%,未达标组死亡率为29.63%,两组比较差异无统计学意义(χ2=1.066,P=0.302)。
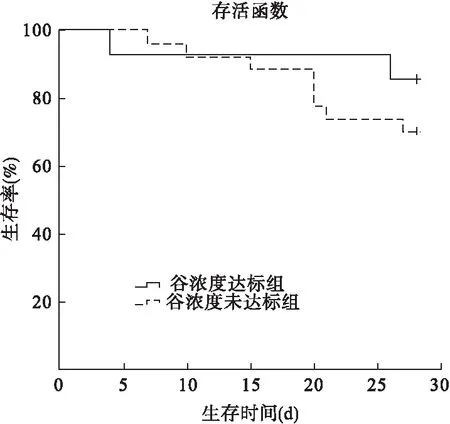
图1 重症患者替考拉宁血药谷浓度达标组与未达标组28 d生存曲线
3 讨论
替考拉宁通过抑制细菌细胞壁合成而抑制细菌生长,可用于治疗革兰阳性菌特别是耐药革兰阳性菌引起的重症感染[4]。替考拉宁与万古霉素相比的特殊性在于,较高的蛋白结合率(90%~95%),半衰期较长(30~170 h),除静脉给药外亦可肌内注射,97%的药物由肾脏从尿中以原形排出,肾功能障碍患者半衰期明显延长(102~347 h)[5]。
Tobin等[6]对1994-2006年英国检测系统替考拉宁血药谷浓度的结果进行分析,按以下标准判定结果:<10 mg/L(未达到满意治疗浓度);10~20 mg/L(治疗革兰阳性菌感染的有效浓度);20~60 mg/L(治疗严重金黄色葡萄球菌感染包括心内膜炎的有效浓度);≥60 mg/L(产生毒性的血药浓度)。结果显示,替考拉宁血药谷浓度<10 mg/L患者的百分比从1994年的23%下降至13%,10~60 mg/L在2006年约占89%。Ueda等[7]将替考拉宁谷浓度目标设定为15~30 mg/L,78例患者予以方案A(6 mg/kg q12 h给药2 d,后改为6 mg/kg qd),60例患者予以方案B(10~12 mg/kg q12 h给药3 d,后改为6 mg/kg qd),两组达标率及谷浓度达标率分别为25.6%、68.3%(P<0.001)。而本研究结果显示,替考拉宁血药谷浓度达标率较低,仅30.89%,远远低于Tobin等[6]的研究结果,略高于Ueda等[7]方案A研究结果。考虑原因主要为本研究样本量较小,仅41例患者共计68例次替考拉宁谷浓度检测结果,还需进一步大样本量的研究,加大给药剂量应可提高达标率。
根据肌酐清除率分组,结果显示,Ccr在15~29 mL/min、30~59 mL/min、60~89 mL/min及>90 mL/min组血药谷浓度与Ccr<15 mL/min组比较差异有统计学意义(P<0.05),Ccr<15 mL/min时谷浓度较高。而多重线性回归分析显示,患者的Ccr对替考拉宁血药谷浓度的影响具有统计学意义(P=0.039),而年龄、性别、体重、APACHEⅡ评分、血清白蛋白、CREA及给药剂量无统计学意义(P>0.05)。对于重症患者,Ccr对替考拉宁血药谷浓度的影响显著而血肌酐影响不显著,主要原因为,在危重患者中,血肌酐水平会受到以下几方面的影响:肾脏功能、肌酐生成异常及体液平衡[8-9]。肌酐生成会因患者的营养不足、消耗状态及肝脏功能异常而减少,创伤、发热、激素及某些代谢性疾病会使肌酐生成增加,体液平衡紊乱改变肌酐的分布体积,影响肌酐水平。血肌酐与Ccr的改变并非完全一致,有研究表明,Ccr改变48 h或更久以后,血肌酐水平才开始升高[10-11]。
本研究结果显示,替考拉宁血药谷浓度与预后之间不存在显著相关性。考虑原因为本研究纳入的患者部分为混合细菌或其他真菌、病毒感染,单一替考拉宁血药谷浓度难以成为影响预后的独立因素;另一方面可能与研究样本量较小有关。而且替考拉宁的一个重要药代学特点是高蛋白结合率(约90%~95%),导致替考拉宁的药动学变异性的增加。Yano等[12-13]证明,血浆白蛋白浓度是这种变异性的重要决定因素,白蛋白浓度较低则替考拉宁的未结合部分较多。在危重患者中,低白蛋白血症是一种普遍现象,因此,替考拉宁药动学变异性在该类人群中可能更加明显,低蛋白血症改变替考拉宁的分布容积和清除率,导致其游离的药物浓度增加[14]。而游离的药物浓度是评价药理学作用的重要指标,相对于总浓度与临床结果具有更好的相关性。Mimoz等[15]通过对患有呼吸机相关性肺炎和严重低白蛋白血症(中位白蛋白浓度为16.1 g/L)患者的游离谷浓度和总谷浓度进行回顾性分析,发现替考拉宁游离部分变化范围为8%~42%,认为游离谷浓度测定应优于总浓度。Roberts等[16]也通过对重症患者应用替考拉宁后的游离和总血药谷浓度测定,发现在重症患者中,替考拉宁的蛋白结合变异性很高,游离替考拉宁占总浓度百分比极低,仅占8.2%。可见,目前很多学者开始质疑替考拉宁总血药浓度监测的有效性,均认为监测游离替考拉宁浓度更适当。
综上所述,考虑重症患者病理生理学的变化使抗菌药物在体内药动学发生改变,在替考拉宁的使用过程中,应考虑肌酐清除率对替考拉宁血药谷浓度的影响,监测血药谷浓度,调整药物剂量,以达到个体化给药的目的。
参考文献:
[1] Roberts JA,Norris R,Paterson DL,et al.Therapeutic drug monitoring of antimicrobials[J] .Br J Clin Pharmacol,2012,73(1):27-36.
[2] Ueda T,Takesue Y,Nakajima K,et al.Evaluation of teicoplanin dosing designs to achieve a new target trough concentration[J] .J Infect Chemother,2012,18(3):296-302.
[3] 胡萨萨,庞成森,董海燕,等.危重症感染患者血清中替考拉宁浓度测定[J] .中国医院药学杂志,2011,31(9):753-755.
[4] 文业,王定淼,陈勇,等.替考拉宁治疗ICU患者革兰阳性菌所致呼吸机相关性肺炎的临床疗效与安全性评价[J] .中华医院感染学杂志,2017,27(15):3397-3400.
[5] 徐丙发,李秀.特殊患者替考拉宁药物浓度监测的临床应用进展[J] .中国医院药学杂志,2017,37(15):1536-1539.
[6] Tobin CM,Lovering AM,Sweeney E,et al.Analyses of teicoplanin concentrations from 1994 to 2006 from a UK assay service[J] .J Antimicrob Chemother,2010,65(10):2155-2157.
[7] Ueda T,Takesue Y,Nakajima K,et al.High-dose regimen to achieve novel target trough concentration in teicoplanin[J] .J Infect Chemother,2014,20(1):43-47.
[8] Doyle JF,Forni LG.Acute kidney injury:short-term and long-term effects[J] .Crit Care,2016,20(1):188.
[9] Bragadottir G,Redfors B,Ricksten SE.Assessing glomerular filtration rate (GFR) in critically ill patients with acute kidney injury--true GFR versus urinary creatinine clearance and estimating equations[J] .Crit Care,2013,17(3):R108.
[10] Bellomo R,Kellum JA,Ronco C.Defining acute renal failure:physiological principles[J] .Intensive Care Med,2004,30(1):33-37.
[11] 何颜霞.复苏后急性肾损伤[J] .中国实用儿科杂志,2013,28(6):409-412.
[12] Yano R,Nakamura T,Tsukamoto H,et al.Variability in teicoplanin protein binding and its prediction using serum albumin concentrations[J] .Ther Drug Monit,2007,29(4):399-403.
[13] Brink AJ,Richards GA,Lautenbach EE,et al.Albumin concentration significantly impacts on free teicoplanin plasma concentrations in non-critically ill patients with chronic bone sepsis[J] .Int J Antimicrob Agents,2015,45(6):647-651.
[14] Ulldemolins M,Roberts JA,Rello J,et al.The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients[J] .Clin Pharmacokinet,2011,50(2):99-110.
[15] Mimoz O,Rolland D,Adoun M,et al.Steady-state trough serum and epithelial lining fluid concentrations of teicoplanin 12 mg/kg per day in patients with ventilator-associated pneumonia[J] .Intensive Care Med,2006,32(5):775-779.
[16] Roberts JA,Stove V,De Waele JJ,et al.Variability in protein binding of teicoplanin and achievement of therapeutic drug monitoring targets in critically ill patients:lessons from the DALI Study[J] .Int J Antimicrob Agents,2014,43(5):423-430.
