排草香细胞毒性及木犀草素含量的测定
2018-06-29吴泽幼
杨 芳,吴泽幼,包 思,梁 敬
0 引言
排草香[Anisochiluscarnosus(L.f.) Benth. et Wall]为报春花科排草属植物细梗香草(LysimachiacapillipesHemsl)的全草,为一年生草本植物,原产地印度,在我国多分布于广西、广东、湖南等地,具有祛风、止咳、调经的功效,主要用于胃溃疡及皮肤类疾病的治疗[1-2]。研究表明,排草香中主要药理活性成分为黄酮类化合物,具有抑菌、抗炎、保肝、抗肿瘤等多种药理作用[3]。近年来,针对其药理活性成分的抗肿瘤作用研究虽然取得了一定的进展,但针对其具体活性成分仍未得到明确阐述[4]。本研究通过测定排草香不同溶剂提取物对人胃癌细胞MGC-803的细胞毒性,并建立高效液相色谱(HPLC)法测定其中所含木犀草素的含量,以探讨排草香的细胞毒性与木犀草素含量之间的关系,以期为排草香抗肿瘤活性的研究提供一定的理论参考。
1 材料与方法
1.1 材料
1.1.1 细胞株 人胃癌细胞MGC-803细胞,购于上海慧颖生物科技有限公司。
1.1.2 药物 排草香,批号:161201,由广东致信药业股份有限公司提供,经广州中医药大学生药教研室杜勤教授鉴定为报春花科排草属植物细梗香草(LysimachiacapillipesHemsl)的全草;紫杉醇,国药准字:H20067344,规格:30 mg*1支/盒,购于江苏红豆杉药业有限公司;木犀草素对照品,批号:111520-200201,规格:20 mg/支,纯度≥95%,购于中国药品生物制品检定所。
1.1.3 试剂盒及试剂 DMEM培养液,购于美国Hyclone公司;胎牛血清,购于江苏科特生物科技有限公司;胰蛋白酶,购自赛奥生物科技有限公司;四甲基偶氮唑盐(MTT),磺酰罗丹明B (Sulforhodamine B,SRB),均购于美国Sigma公司;乙腈、甲醇:色谱级,购于德国默克;其他试剂均为分析级,购于广东光华化学试剂厂。
1.1.4 仪器 岛津LC-20AT高效液相色谱仪,SPD-M2OA二极管阵列检测器,SIL-20A自动进样器,CTO-20A柱温箱,LC-solution工作站;实验室超纯水系统,型号:MU4100P,上海淼康实业公司;HH-6A磁力搅拌水浴锅,常州澳华仪器有限公司;R-100旋转蒸发仪,瑞士布琦。
1.2 样品制备
1.2.1 水提物制备 取500 g干燥排草香全草,粉碎,以8倍量水室温浸提2 d后过滤,再于滤渣中加10倍量水室温浸提2 d,过滤,合并2次滤液,水浴浓缩至干,得排草香水提物(5.5%,W/W)。
1.2.2 醇提物制备 取500 g干燥排草香全草,粉碎,以8倍量95%乙醇索氏回流(85 ℃)提取2次,每次6 h,合并2次提取液,以70 ℃水浴减压浓缩至干,得排草香醇提物(8.6%,W/W)。
1.2.3 乙醚提取物制备 取500 g干燥排草香全草,粉碎,以8倍量乙醚索氏回流(40 ℃)提取2次,每次6 h,合并2次提取液,以30 ℃水浴减压浓缩至干,得排草香醚提物(10.2%,W/W)。
1.3 细胞培养 取出冻存于-80 ℃液氮罐中的细胞,快速置于37 ℃温水中融化细胞进行复苏;于MGC-803细胞培养瓶中加入DMEM生长液(10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素),置于37 ℃、5%CO2培养箱中培养,每天换液。待细胞生长至铺满瓶底80%~90%的单层细胞时,弃去培养液,加入适量胰蛋白酶消化2~3 min后,加入DMEM培养液终止消化,得单层细胞,取对数生长期生长良好的细胞,以PBS清洗2~3次,转移至新的培养瓶中进行传代培养。将对数生长期的细胞以DMEM培养液稀释后,使细胞密度在计数板上计数为2×105个/mL,接种于96孔板中,每孔100 μL,置于37 ℃、5%CO2培养箱中培养为单层细胞。每次传代培养及实验用的细胞均为处于对数生长期细胞。
1.4 MTT法检测细胞存活率 采用MTT法测定细胞毒性:以含2%胎牛血清的DMEM培养液分别将各溶剂提取物稀释为不同浓度(25、50、100、200 μg/mL)的样品培养液。以样品培养液替换长有单层细胞的96孔板中的培养液,每个浓度平行接种3孔,每孔100 μL,为样品组。同时以不同浓度(6.25、12.5、25、50 μg/mL)的紫杉醇组为阳性对照组,设正常培养液组作为空白对照组(每孔加含2%胎牛血清的DMEM培养液100 μL)。将上述各组细胞均置于37 ℃、5%CO2培养箱中培养48 h。再于每孔加入10 μL MTT溶液,置于37 ℃、5%CO2培养箱中培养4 h后弃去培养液,每孔加入150 μL二甲基亚砜,使完全溶解。采用酶标仪于570 nm下测定隔空的吸光度值(OD570),并按照公式计算细胞存活率:细胞存活率(%)=100-[(OD对照组) -(OD样品组)/(OD对照组)]×100。
1.5 SRB法检测细胞存活率 采用SRB比色法测定细胞毒性:将96孔板中的细胞培养液分别以不同浓度(25、50、100、200 μg/mL)的样品培养液替换,为样品组。同时以不同浓度(6.25、12.5、25、50 μg/mL)的紫杉醇组为阳性对照组,设正常培养液组作为空白对照组(每孔加含2%胎牛血清的DMEM培养液100 μL)。将上述各组细胞均置于37 ℃、5% CO2培养箱中培养48 h后,每孔加入10%三氯乙酸100 μL,并于4 ℃条件下反应1 h,以蒸馏水洗涤3~5次并干燥。再于每孔分别加入0.05%的SRB冰乙酸溶液(1%,V/V)100 μL,置于室温条件下染色处理30 min,再以1%冰乙酸溶液洗涤3~5次,甩干。每孔加入10 mmol/L的Tris-base (pH=10.5) 200 μL,置于震荡器中振荡处理10 min,使SRB完全溶解。采用酶标仪于570 nm波长处测定隔空的吸光度值(OD570),并按照公式计算细胞存活率:细胞存活率(%)=100-[(OD对照组)-(OD样品组)/(OD对照组)]×100。
1.6 木犀草素含量测定
1.6.1 对照品溶液的配制 精密称定木犀草素对照品20.17 mg于25 mL量瓶中,以色谱甲醇溶解定容至刻度,制成每1 mL中含0.77 mg的溶液,作为木犀草素对照品母液。
1.6.2 供试品溶液的制备 分别精密称取各溶剂提取物50 mg于5 mL量瓶中,以少量色谱甲醇超声溶解并定容至刻度,混匀得10 mg/mL的供试品溶液。
1.6.3 色谱条件 色谱柱:YMC-Hydroshpere C18柱(250 mm×4.6 mm);流动相:乙腈-0.5%磷酸(40∶60)等度洗脱;柱温:25 ℃;流速:1 mL/min;检测波长:254 nm;进样量:20 μL。
1.6.4 线性关系考察 取木犀草素对照品母液分别配制成浓度为0.77、0.38、0.19、0.15、0.08、0.04、0.03 mg/mL的一系列对照品溶液,按上述色谱条件测定。以木犀草素浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。
1.6.5 精密度考察 精密吸取木犀草素对照品母液连续进样6针,并计算RSD值。
1.6.6 重复性考察 取同一份样品,平行称取6份,按照“1.6.2”制备供试品溶液,以0.22 μm微孔滤膜过滤至进样瓶中,按照“1.6.3”色谱条件进样测定,计算RSD值。
1.6.7 加样回收率考察 分别取上述重复性已知含量样品,以1∶1的比例添加木犀草素对照品,平行6份,分别计算回收率及RSD值。
1.6.8 稳定性考察 分别将样品置于常温(25 ℃)条件下0、2、4、6、8、12 h,测定含量,并计算RSD值。
1.6.9 样品测定 分别按照“1.6.2”制备供试品溶液,各平行3份,以0.22 μm微孔滤膜过滤至进样瓶中,按照“1.6.3”色谱条件进样测定,计算平均百分含量。

2 结果
2.1 MTT法检测细胞存活率结果 排草香各提取物组及紫杉醇组均对MGC-803细胞显示出一定的毒性,经IC50对比各组细胞毒性:紫杉醇>醚提物>醇提物>水提物;醚提物及醇提物组的细胞毒性均显著高于水提物组(P<0.05),见表1、图1。
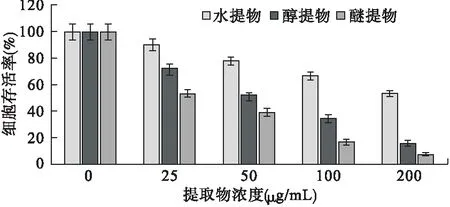
图1 MTT法检测排草香提取物对MGC-803细胞的毒性结果
2.2 SRB法检测细胞存活率结果 排草香各提取物组及紫杉醇组均对MGC-803细胞显示出一定的毒性,经IC50对比各组细胞毒性:紫杉醇>醚提物>醇提物>水提物;醚提物及醇提物组的细胞毒性均显著高于水提物组(P<0.05),与MTT法检测结果一致,见表2、图2。
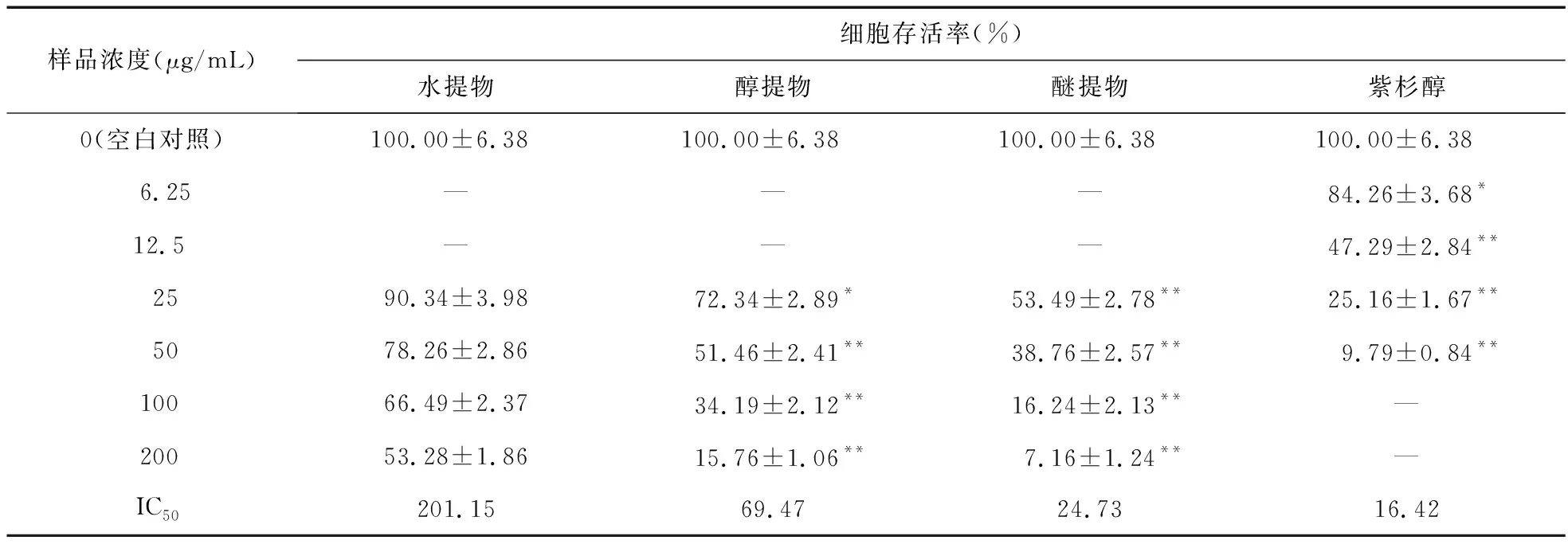
表1 MTT法检测各组对MGC-803细胞的毒性结果
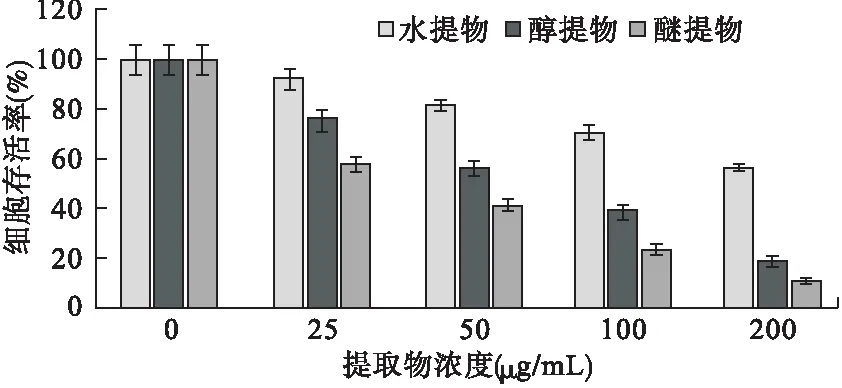
图2 SRB法检测排草香提取物对MGC-803细胞的毒性结果
2.3 方法学考察测定 按“1.6.3”色谱条件测定,以木犀草素浓度(X)为横坐标、峰面积(Y)为纵坐标,绘制标准曲线,得回归方程为Y=46 131 X+18.99 (r=0.999 9,n=7),木犀草素的检测浓度线性范围为0.03~0.77 mg/mL。精密度试验RSD为0.17% (n=6),仪器精密度良好,见图3A。重复性试验RSD为0.32% (n=6),目标峰分离度较好,重复性良好,见图3B。加样回收试验平均回收率为101.13% (RSD=1.43%,n=6)。稳定性试验RSD为0.16% (n=6)。上述结果表明,供试品制备及色谱条件稳定可行,可供样品含量测定。
2.4 样品测定 以经方法学验证的“1.6.3”色谱条件测定排草香各提取物中木犀草素的含量:醚提物>醇提物>水提物,见表3。
3 讨论
排草香,又名排草、香排草、香草,商品名亦称小叶灵香草,作为传统中药,其又具有多种药理功效,如化痰止咳、祛风除湿、补气养血、缓急止痛等[5-6]。近年来,随着对其所含化学成分及药理药效的深入研究表明,排草香具有较显著的保护肝脏、抗菌、抗炎及抗肿瘤等药理作用,其中最受研究者瞩目的当属其抗肿瘤活性的研究,但具体抗肿瘤的活性成分目前尚不明确[7]。研究表明,排草香中所含的主要药理活性成分为黄酮类化合物[6],主要为黄酮醇及黄酮苷,包括山奈酚、槲皮素、香草苷1级及2级等,目前针对黄酮类化合物的抗肿瘤活性成分研究较为广泛,张杜宇等[8]研究表明,总黄酮类化合物能显著抑制人类乳腺癌细胞的增殖,提示其显著的抗癌作用。孙锦秀等[9]研究表明,总黄酮具有诱导人肝癌HepG2细胞凋亡的作用;Du等[10]研究表明,总黄酮能显著抑制人结肠癌HT-29及SW-480细胞株的生长,均表明总黄酮具有显著抗肿瘤活性。但针对排草香中总黄酮类抗肿瘤活性中的具体成分,目前尚不清楚。
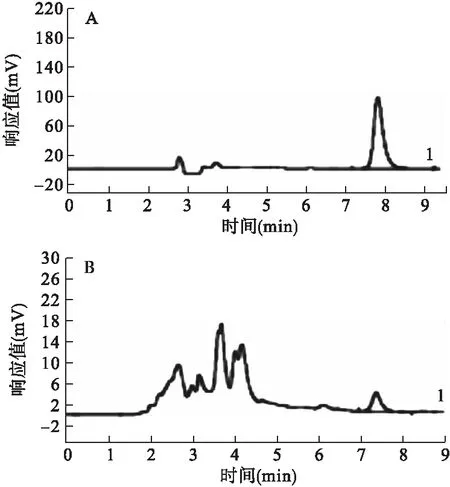
图3 木犀草素测定图谱
研究表明,总黄酮中的木犀草素具有显著的抗肿瘤活性,且其抗肿瘤作用具有多靶点、多途径、多环节的特点[11-12]。Verschooten等[13]研究表明,木犀草素可以通过下调PLK1的表达,抑制增殖相关基因的表达,实现对肿瘤细胞增殖的抑制作用。Lee等[14]研究表明,木犀草素能通过参与诱导人肺癌细胞CH27的凋亡实现抗肿瘤作用。胡春萍等[15]研究表明,木犀草素可通过诱导非小细胞肺癌细胞株A549凋亡及阻滞G2周期实现抗肿瘤细胞活性。王洪燕等[16]研究表明,木犀草素与化疗药物联合使用,能产生增敏效应,提高肿瘤细胞对药物的敏感性,增强药物抗肿瘤疗效。Muthuraman等[17]采用EAC法测定细胞毒性表明,排草香醇提物具有显著的细胞毒性。Kiruthiga等[18]研究表明,排草香醇提物能够通过调控线粒体膜蛋白及增加活性氧诱导肺癌细胞A549凋亡。本研究采用MTT法及SRB法测定排草香不同提取物组及紫杉醇组对人胃癌细胞MGC-803的细胞毒性,经IC50对比,各组细胞毒性由高到低依次为:紫杉醇组>醚提物组>醇提物组>水提物组,且排草香醚提物及醇提物组的细胞毒性均显著高于水提物组。两种方法测定结果均与上述研究结果一致,提示排草香乙醇及乙醚提取物中含有某些具有抗肿瘤活性的成分。近年研究发现,排香草中皂苷成分同样具有癌细胞抑制作用,LC-C单体成分对人体A-2780细胞具有显著细胞毒作用,还可对人前列腺癌细胞PC3的生长进行剂量和时间依赖性抑制,并具有诱导肿瘤细胞凋亡的作用[19]。

表2 SRB法检测各组对MGC-803细胞的毒性结果

表3 排草香提取物中木犀草素含量测定
本文通过建立稳定、准确的HPLC法,进行排草香水、乙醇及乙醚提取物中木犀草素含量的测定,结果表明,各提取物中木犀草素含量对比:乙醚提取物中含量最高,乙醇提取物次之,水提物中最低,与上述对人胃癌细胞MGC-803的细胞毒性作用具有较一致的趋势,提示排草香的抗肿瘤活性可能与木犀草素含量有关,同时为抗癌药物的研发提供一个新的方向。但本研究存在一定不足之处,即未对MGC-803的细胞毒性3种提取物中是否还含有黄酮类等其他活性成分,以及其对MGC-803细胞的毒性是否有共同作用进行探讨,今后还需扩大黄酮类活性成分的监测范围,对是否含有其他活性成分等加以观察和分析。
综上所述,排草香乙醇提物及乙醚提取物均具有显著的抗肿瘤活性,可能与其中木犀草素的含量有关,但具体的作用机制仍待进一步研究。
参考文献:
[1] Bhagat J,Lobo R,Parmar V,et al.In vitro free radical scavenging potential of Indian habitant anisochilus carnosus (L.F.) Wall[J].Chin J Nat Med,2011,9(6):456-460.
[2] 中国科学院,中国植物编辑委员会.中国植物志[M].北京:科学出版社,2013.
[3] Anbuvannan M,Ramesh M,Viruthagiri G,et al.Anisochilus carnosus,leaf extract mediated synthesis of zinc oxide nanoparticles for antibacterial and photocatalytic activities[J].Mater Sci Semicond Process,2015,39(1):621-628.
[4] Senatore F,Lentini F,Venza F,et al.Composition and antibacterial activity of the essential oil of Anisochilus carnosus (Linn.fil.) Benth.a Tamil plant acclimatized in Sicily[J].Flavour Fragrance J,2003,18(3):202-204.
[5] Setty MM,Nilesh G,Lobo R,et al.Anthelmintic activity of alcoholic and aqueous extract of Anisochilus carnosus (Wall)[J].Res J Pharm Biol Chem Sci,2013,4(4):1666-1670.
[6] Mohammed A,Kumar JR,Santosh HY,et al.Antiulcer activity of Anisochilus carnosus leaf extract in pylorus ligated rats[J].Indian Drugs,2008,45(12):979-981.
[7] Kumar AS,Samanta KC,Chipa RC.Hepatoprotective activity of alcoholic and aqueous extracts of leaves of Anisochilus carnosus (Linn.) Wall[J].Int J Pharm ResDevelop,2010,2(8):99-104.
[8] 张杜宇.土荆芥总黄酮类化合物对人类乳腺癌细胞MCF-7抑制作用的研究[D].四川师范大学,2014.
[9] 孙锦秀,姜慧妍,杜盼,等.杨黄总黄酮对人肝癌HepG2细胞凋亡的影响[J].中国药房,2015,26(10):1342-1345.
[10]Du WJ,Yang XL,Song ZJ,et al.Antitumor activity of total flavonoids from daphne genkwa in colorectal cancer[J].Phytother Res,2016,30(2):323-330.
[11]王月华,李爱峰,付崇罗,等.木犀草素抗肿瘤活性研究[J].时珍国医国药,2016,27(7):1587-1590.
[12]王伟,张犁.木犀草素抗肿瘤作用的研究进展[J].东南大学学报(医学版),2014,33(2):218-221.
[13]Verschooten L,Smaers K,Van Kelst S,et al.The flavonoid luteolin increases the resistance of normal,but not malignant keratinocytes,against UVB-induced apoptosis[J].J Invest Dermatol,2010,130(9):2277-2285.
[14]Lee HZ,Yang WH,Bao BY,et al.Proteomic analysis reveals ATP-dependent steps and chaperones involvement in luteolin-induced lung cancer CH27 cell apoptosis[J].Eur J Pharmacol,2010,642(1-3):19-27.
[15]胡春萍,蔡雪婷,胡婷婷,等.木犀草素诱导非小细胞肺癌细胞株A549凋亡和G2周期阻滞[J].中国中药杂志,2012,37(9):1259-1264.
[16]王洪燕,全康,蒋燕灵,等.木犀草素抗肿瘤细胞增殖及增敏抗肿瘤药物作用研究[J].浙江大学学报:医学版,2010,39(1):30-36.
[17]Muthuraman MS,Santharam L,Ariraman S,et al.Studies on anticancer and antimicrobial efficacy of Anisochilus carnosus wallich-extract[J].Int J Pharmacy Pharm Sci,2012,4:132-135.
[18]Kiruthiga,Sekar S.Anticancer activity of ethanol extracts of anisochilus carnosus in human lung cancer a549 cell lines[J].Acta Pathologica Japonica,2017,37(7):1071-1084.
[19]NotÉ OP,Lin MM,Mbing JN,et al.Pro-apoptotic activity of acylated triterpenoid saponins from the stem bark of Albizia chevalieri,harms[J].Phytochem Letters,2017,22:95-101.
