右美托咪定对卵巢癌细胞相关生物学行为的影响
2018-06-29连红梅姜丽华
连红梅,姜丽华
0 引言
卵巢癌的死亡率在妇科恶性肿瘤中居首位[1]。由于早期卵巢癌体征和症状不典型,而且缺乏有效的检测手段,大多数患者发展到疾病晚期才能被诊断[2]。许多患者初次被诊断时就已经发生了转移[3]。卵巢癌的治疗通常包括手术治疗和化疗[4],有时也会采取放射治疗[5]。大部分的卵巢癌患者需要进行全面分期手术、肿瘤减灭术[6],而术后需要补充化疗的患者占比较大[7],对于Ⅱ~Ⅳ期患者,如果残留病灶可以切除,推荐行减瘤术。如果怀疑有无法切除的残留病灶,可选择直接化疗6~8个疗程,也可先行3个疗程化疗,再行全面分期手术,术后再化疗[8]。随着肿瘤治疗的多样化发展,免疫治疗[9]、激素治疗[10]等也越来越多地被应用到卵巢癌的治疗中,但是效果并不理想,并没有使患者的生存率显著提升[11]。
右美托咪定是高度选择性的α2肾上腺素能激动剂,是一类抗焦虑、镇静、止痛类药物[12]。与阿片类药物和其他常用的镇静剂(如:丙泊酚、芬太尼和咪达唑仑)不同,右美托咪定能够达到同样的镇静效果而不引起呼吸抑制[13]。右美托咪定可以让用药者在镇静过程中有一定的自主呼吸,从而减少了呼吸抑制的风险[14]。除了自身的镇静麻醉效果外,吗啡[15]、丙泊酚[16]、咪达唑仑[17]、地西泮[18]、舒芬太尼[19]、曲马多[20]等许多经典的镇静镇痛药物均具有一定的抗肿瘤作用,而右美托咪定却鲜有研究。
本文通过卵巢癌SKOV3细胞研究右美托咪定对其细胞相关生物学行为的影响,探究右美托咪定在卵巢癌治疗中的潜能,为卵巢癌的辅助治疗,特别是在手术过程中和重症监护室中镇静麻醉药物的选择提供一定的依据。
1 材料与方法
1.1 细胞系和试剂 人卵巢癌细胞株SKOV3由上海细胞生物研究所提供。RPMI-1640培养液、10%新生小牛血清、100 U/mL 青霉素和100 μg/mL链霉素、0.25%胰酶溶液购自Gibco公司,二甲基亚砜(DMSO)购自Sigma公司。细胞在含有10% FBS、100 mg/mL青霉素和100 mg/mL链霉素的培养基中培养,置37 ℃、5% CO2培养箱中培养,生长至80%左右时进行传代和冻存,用于后续的实验。细胞培养瓶和96孔板购自杭州四季庆生物工程材料有限公司。
1.2 药物和试剂 右美托咪定购自南京莱富赛生物科技有限公司。CCK-8试剂盒购自日本同仁研究所。Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购于上海美季生物技术有限公司。
1.3 细胞活性的测定 使用CCK-8试剂盒测定细胞的活性。将SKOV3卵巢癌细胞接种在96孔板中,每孔1×104个细胞和100 μL培养基。在37 ℃、5% CO2的培养箱中孵育24 h。更换新培养基。细胞分别以0、1、10、100 nmol/L浓度右美托咪定处理24 h。处理后,将96孔板中的培养基用新鲜培养基替换。加入20 μL的CCK-8溶液,并在37 ℃下孵育4 h。使用酶标仪板在490 nm波长下测量不同组的OD值。
1.4 细胞凋亡实验检测SKOV3卵巢癌细胞的凋亡 流式细胞术FITC-Annexin V/PI双染色是理想的定量测定细胞凋亡的方法。将SKOV3卵巢癌细胞以2×106的密度接种在6孔板中细胞/孔并生长24 h。用不同浓度(0、1、10、100 nmol/L)的右美托咪定处理24 h。加入100 μL细胞悬液5 μL Annexin V-FITC和10 μL PI,并将细胞在黑暗中孵育30 min。PI (5 μL,浓度为10 μg/mL)加入细胞,在黑暗中再次孵育10 min。通过流式细胞术评估细胞以识别细胞周期的变化。
1.5 划痕愈合实验 将SKOV3卵巢癌细胞(48 h)进行胰蛋白酶消化,并将适量细胞平铺在6孔板上。细胞分别以0、1、10、100 nmol/L右美托咪定处理。使用200 μL无菌枪头轻划孔板,每个孔划4~5次,尽量保证所划线处于平行状态,放置37 ℃恒温细胞培育箱,48 h后,分别用适量PBS冲洗孔板,显微镜下观察SKOV3卵巢癌细胞迁移的距离,然后对比各组之间的差异。
1.6 Transwell侵袭实验 通过Transwell对SKOV3卵巢癌细胞侵袭能力测定。将SKOV3卵巢癌细胞在含有0.1%FBS的DMEM中培养。细胞分别以0、1、10、100 nmol/L右美托咪定处理。24 h后,在没有FBS或HGF的DMEM中的2×105个饥饿过的细胞,用含有基质胶的小室(直径6.5 μm,孔径8 μm,Corning,NY,USA)接种在上室中,将具有10%FBS的培养基置于下腔中。在37 ℃下孵育48 h后,小心去除上膜表面上的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净后,于倒置显微镜下计数。独立3次测定后取其平均值。
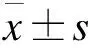
2 结果
2.1 右美托咪定对SKOV3细胞活性的影响 如图1所示,在各个不同的处理时间组中,SKOV3细胞活性随着右美托咪定浓度的上升而下降。在12 h处理组中,右美托咪定浓度达到100 nmol/L时,SKOV3细胞活性下降了9% (P<0.05)。在24 h和48 h处理组中,当右美托咪定的浓度达到10 nmol/L,细胞活性分别下降了16%和20% (P<0.01),当浓度为100 nmol/L时,细胞活性下降了18%和22% (P<0.01)。结果表明,SKOV3卵巢癌细胞的生长增殖能被右美托咪定抑制,最低作用浓度是10 nmol/L,最短的作用时间是12 h。
2.2 右美托咪定诱导SKOV3卵巢癌细胞凋亡 应用Annexin V-FITC和PI对细胞进行染色,再通过流式细胞学技术进行分析。如图2所示,存活的细胞位于左下象限,而凋亡的细胞位于右下象限。随着右美托咪定浓度的升高,凋亡细胞的百分比随之上升。当右美托咪定浓度达到10、100 nmol/L,凋亡率分别为8.21%、8.30%,与对照组比较差异有统计学意义(P<0.01)。结果表明,右美托咪定能诱导SKOV3卵巢癌细胞凋亡。

图1 不同浓度右美托咪定在不同作用时间下对SKOV3卵巢癌细胞活性的影响
2.3 划痕愈合实验检测右美托咪定对SKOV3卵巢癌细胞迁移能力的影响 如图3所示,与对照组相比,右美托咪定处理后SKOV3卵巢癌细胞的迁移能力明显下降。此外,右美托咪定的浓度越高,迁移的速率越慢。当用10、100 nmol/L浓度的右美托咪定处理时,SKOV3卵巢癌细胞的迁移率较对照组分别下降了12% (P<0.05)和25% (P<0.01),表明右美托咪定能抑制SKOV3细胞迁移能力。
2.4 Transwell侵袭实验检测右美托咪定对SKOV3卵巢癌细胞侵袭能力的影响 如图4所示,SKOV3卵巢癌细胞在经过不同浓度的右美托咪定处理后,细胞的侵袭能力显著下降,而且随着浓度的上升,侵袭细胞的数量下降更为明显。10、100 nmol/L右美托咪定处理时,SKOV3卵巢癌细胞的侵袭率较对照组分别下降了18%(P<0.05)和28%(P<0.01),表明右美托咪定削弱SKOV3细胞侵袭能力。

图2 流式细胞术检测右美托咪定诱导SKOV3卵巢癌细胞凋亡
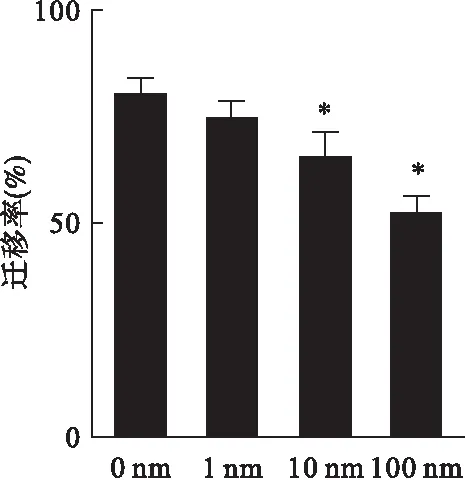
图3 划痕愈合实验检测右美托咪定对SKOV3卵巢癌细胞迁移能力的影响
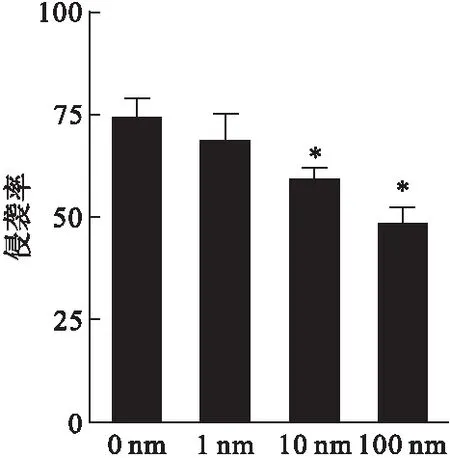
图4Transwell侵袭实验检测右美托咪定对SKOV3卵巢癌细胞侵袭能力的影响
3 讨论
根据美国SEER的统计结果显示,全球每年大约有22 240名女性被诊断为卵巢癌,其中有将近14 000名患者死于该病[21]。许多卵巢癌患者在初次诊断时就已经处于中晚期,失去了直接手术的机会,从而开始接受以铂类药物为主的全程化疗或新辅助化疗[22]。在这些无法手术接受化疗的患者中,大概有50%对一线化疗药物有效,中位生存时间为18个月[23]。而有20%~30%的患者在接受初次化疗时就已经出现了耐药情况[24]。约25%的患者在初次化疗后6个月病情复发,属于铂类耐药[25]。
研究表明,以下药物也具有一定的抗肿瘤效应,如二甲双胍[26-28]、阿司匹林[29]、米非司酮[30]等。Chen等[18]研究发现,地西泮能通过触发G0/G1细胞周期停止,抑制人恶性胶质瘤细胞GBM T98G的增生。Guo等[31]将丙泊酚作用于人食管癌(ESCC) EC-1细胞,发现丙泊酚是通过调节S100A4的表达来影响细胞的生物学行为。
右美托咪定已经广泛应用于手术和重症监护室中[32]。Xia等[33]研究显示,右美托咪定能通过激活α2肾上腺素受体/ERK信号通路来调节乳腺癌细胞的生物学行为。结果表明,右美托咪定能促进乳腺癌细胞MDA-MB-231的增殖和迁移。Takefumi等[34]发现,用催眠剂量的右美托咪定处理小鼠,可使小鼠体内抗原呈递细胞产生的IL-12减少,降低抗肿瘤免疫力,导致Th2的转变并削弱CTL的活性。而本研究结果显示,右美托咪定在SKOV3卵巢癌细胞中起抑制作用。
本研究中,细胞增殖实验结果显示,右美托咪定能抑制SKOV3卵巢癌细胞的活性,且其对SKOV3卵巢癌细胞活性的抑制呈剂量依赖性和时间依赖性。右美托咪定100 nmol/L处理SKOV3卵巢癌细胞48 h后,细胞活性下降22%。细胞凋亡是一种使细胞发生程序性死亡的病理生理过程,目的是为了去除损坏的细胞[35]。实验证实,卵巢癌SKOV3细胞的凋亡率随着右美托咪定浓度的升高而升高。当右美托咪定浓度达到10、100 nmol/L时,凋亡率分别为8.21%和8.30%,差异有统计学意义。结果表明,右美托咪定能诱导SKOV3卵巢癌细胞凋亡。此外,右美托咪定能抑制SKOV3卵巢癌细胞的迁移和侵袭能力。
但本实验结果仅限于针对SKOV3卵巢癌细胞进行初步研究,未检测其他卵巢癌细胞株的作用效果,并未对其机制进行深入研究,且缺乏体内实验证据支持。因此,右美托咪定对SKOV3卵巢癌细胞的作用机制及体内和临床试验效果有待于进一步的研究。
综上所述,右美托咪定能通过细胞凋亡抑制SKOV3卵巢癌细胞的活性,降低细胞的迁移和侵袭能力。右美托咪定在卵巢癌治疗中可能具有一定的作用,可以作为手术和重症监护室镇静麻醉药物的优先选择。
参考文献:
[1] Jayson GC,Kohn EC,Kitchener HC,et al.Ovarian cancer[J].Lancet,2014,384(9951):1376-1388.
[2] Matz M,Coleman MP,Carreira H,et al.Worldwide comparison of ovarian cancer survival:histological group and stage at diagnosis (CONCORD-2)[J].Gynecol Oncol,2017,144(2):396-404.
[3] Kenny HA,Chiang CY,White EA,et al.Mesothelial cells promote early ovarian cancer metastasis through fibronectin secretion[J].J Clin Invest,2014,124(10):4614-4628.
[4] Walsh CS.Two decades beyond BRCA1/2:homologous recombination,hereditary cancer risk and a target for ovarian cancer therapy[J].Gynecol Oncol,2015,137(2):343-350.
[5] Rai B,Bansal A,Patel FD,et al.Radiotherapy for ovarian cancers-redefining the role[J].Asian Pac J Cancer Prev,2014,15(12):4759-4763.
[6] 杨卓,王丹波.复发性耐药性卵巢癌手术价值[J].中国实用妇科与产科杂志,2015,31(3):203-207.
[7] Bowtell DD,Böhm S,Ahmed AA,et al.Rethinking ovarian cancer II:reducing mortality from high-grade serous ovarian cancer[J].Nat Rev Cancer,2015,15(11):668-679.
[8] Kehoe S,Hook J,Nankivell M,et al.Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS):an open-label,randomised,controlled,non-inferiority trial[J].Lancet,2015,386(9990):249-257.
[9] Odunsi K,Matsuzaki J,James SR,et al.Epigenetic potentiation of NY-ESO-1 vaccine therapy in human ovarian cancer[J].Cancer Immunol Res,2014,2(1):37-49.
[10]温宜萍,李艳,潘凌亚.卵巢癌与绝经激素治疗[J].实用妇产科杂志,2014,30(12):888-890.
[11]Jacobs IJ,Menon U,Ryan A,et al.Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS):a randomised controlled trial[J].Lancet,2016,387(10022):945-956.
[12]韩传宝,蒋秀红,周钦海,等.右美托咪定混合罗哌卡因用于患者硬膜外麻醉的效果[J].中华麻醉学杂志,2015,35(10):1251-1253.
[13]Devlin JW,Al-Qadheeb NS,Chi A,et al.Efficacy and safety of early dexmedetomidine during noninvasive ventilation for patients with acute respiratory failure:a randomized,double-blind,placebo-controlled pilot study[J].Chest,2014,145(6):1204-1212.
[14]Tsuzawa K,Minoura Y,Takeda S,et al.Effects of α2-adorenoceptor agonist dexmedetomidine on respiratory rhythm generation of newborn rats[J].Neurosci Lett,2015,597:117-120.
[15]Niu DG,Peng F,Zhang W,et al.Morphine promotes cancer stem cell properties,contributing to chemoresistance in breast cancer[J].Oncotarget,2015,6(6):3963-3976.
[16]Song J,Shen Y,Zhang J,et al.Mini profile of potential anticancer properties of propofol[J].PLoS One,2014,9(12):e114440.
[17]So EC,Chen YC,Wang SC,et al.Midazolam regulated caspase pathway,endoplasmic reticulum stress,autophagy,and cell cycle to induce apoptosis in MA-10 mouse Leydig tumor cells[J].Onco Targets Ther,2016,9:2519-2533.
[18]Chen J,Ouyang Y,Cao L,et al.Diazepam inhibits proliferation of human glioblastoma cells through triggering a G0/G1 cell cycle arrest[J].J Neurosurg Anesthesiol,2013,25(3):285-291.
[19]Bundscherer A,Malsy M,Gebhardt K,et al.Effects of ropivacaine,bupivacaine and sufentanil in colon and pancreatic cancer cells in vitro[J].Pharmacol Res,2015,95-96:126-131.
[20]Xia M,Tong JH,Zhou ZQ,et al.Tramadol inhibits proliferation,migration and invasion via α2-adrenoceptor signaling in breast cancer cells[J].Eur Rev Med Pharmacol Sci,2016,20(1):157-165.
[21]Howlader N,Noone AM,Krapcho M,et al.SEER Cancer Statistics Review,1975-2013,National Cancer Institute.Bethesda,MD[J].2016-02-16].http://seer.cancer.gov/csr,2016.https://seer.cancer.gov/csr/1975_2014/
[22]Tewari D,Java JJ,Salani R,et al.Long-term survival advantage and prognostic factors associated with intraperitoneal chemotherapy treatment in advanced ovarian cancer:a gynecologic oncology group study[J].J Clin Oncol,2015,33(13):1460-1466.
[23]Miow QH,Tan TZ,Ye J,et al.Epithelial-mesenchymal status renders differential responses to cisplatin in ovarian cancer[J].Oncogene,2015,34(15):1899-1907.
[24]McGuire WP,Hoskins WJ,Brady MF,et al.Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer[J].N Engl J Med,1996,334(1):1-6.
[25]Tempfer CB,Winnekendonk G,Solass W,et al.Pressurized intraperitoneal aerosol chemotherapy in women with recurrent ovarian cancer:a phase 2 study[J].Gynecol Oncol,2015,137(2):223-228.
[26]杨川,姚凯文,张华.二甲双胍抗肿瘤与 K-ras 突变的相关性[J].现代肿瘤医学,2016,24(7):1172-1174.
[27]李霞,李延海,王海珍, 等.细胞凋亡相关基因在二甲双胍抑制结肠癌细胞增殖中的作用[J].中国临床实用医学,2015,6(6):13-16.
[28]王雅琦,王美鑑,董涵之, 等.二甲双胍治疗绝经后内分泌失败激素受体阳性晚期乳腺癌的疗效和安全性[J].实用医学杂志,2017,33(9):1377-1380.
[29]蔡忠林,马骥,王朝阳,等.阿司匹林预防肿瘤的研究进展[J].现代肿瘤医学,2017,25(8):1329-1332.
[30]Check JH,Check D,Cohen R,et al.Mifepristone causing complete remission of rapidly advancing leukemia with measurement of progesterone-induced blocking factor[J].Anticancer Res,2014,34(5):2413-2416.
[31]Guo XG,Wang S,Xu YB,et al.Propofol suppresses invasion,angiogenesis and survival of EC-1 cells in vitro by regulation of S100A4 expression[J].Eur Rev Med Pharmacol Sci,2015,19(24):4858-4865.
[32]易利丹,彭六保,谭重庆,等.新型镇静镇痛药-右美托咪定[J].中国新药与临床杂志,2011,30(1):5-10.
[33]Xia M,Ji NN,Duan ML,et al.Dexmedetomidine regulate the malignancy of breast cancer cells by activating alpha2-adrenoceptor/ERK signaling pathway[J].Eur Rev Med Pharmacol Sci,2016,20(16):3500-3506.
[34]Inada T,Shirane A,Hamano N,et al.Effect of subhypnotic doses of dexmedetomidine on antitumor immunity in mice[J].Immunopharmacol Immunotoxicol,2005,27(3):357-369.
[35]李敏,林俊.细胞凋亡途径及其机制[J].国际妇产科学杂志,2014,41(2):103-107.
