11β-HSD1抑制剂对大鼠股骨头坏死微环境及骨重建影响的实验研究
2018-06-29王志勇
何 宁,曾 云,王志勇,韩 珩,唐 冰,熊 敏
0 引言
骨代谢过程中起决定作用的细胞是成骨细胞及破骨细胞,可促进骨形成和骨吸收,糖皮质激素在维持骨吸收、骨形成的平衡以及在促进骨代谢、骨骼生长等方面发挥了必不可少的作用[1-3]。然而,目前,随着糖皮质激素类药物的广泛使用,由激素所引发的股骨头坏死比较常见,后者可引起骨组织产生一系列的病理性变化,影响骨功能[4]。内源糖皮质激素的关键代谢酶是11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase,11β-HSD1),也是糖皮质激素在组织水平上的前受体调节剂,可以催化C11 位的酮基转化为羟基,使皮质醇向11-脱皮质酮转化,生物学活性丧失[5-7]。有研究表明,在特殊状态下,局部11β-HSD1可能改变,引起糖皮质激素水平变化,骨代谢稳态受到影响[8-11]。本文探讨了11β-HSD1抑制剂对大鼠股骨头坏死微环境及骨重建的影响,分析11β-HSD1的作用机制,现报道如下。
1 材料与方法
1.1 动物与试剂 上海斯莱克实验动物有限责任公司提供的清洁级SD大鼠40只,雌雄各半,体重(200±20) g,合格证号:SYXK2103-0003。悬吊动物饲养饮水瓶,使动物饮水时,下肢保持直立,喂养采用普通饲料。链霉亲和素-生物素复合物(SABC)购自武汉博士德公司;醋酸皮质酮购自Sigma公司;一抗11β-HSD1购自武汉博士德公司。
1.2 动物处理 采用抽签法随机分组,清洁级SD大鼠40只分为空白组10只和模型组30只,每次实验均精确称重,模型组建立激素诱导股骨头坏死模型。本研究参照文献[4]的造模法,模型组建立激素诱导股骨头坏死模型,于腹腔注射青霉素钠(14万U/只)和醋酸泼尼松龙(24.5 mg/kg),2次/周,连续使用4周。空白组用生理盐水代替激素,于腹腔内注射等剂量的青霉素和生理盐水。模型组造模成功后分为对照组与实验组,各15只,对照组不进行处理,实验组选择腹腔内注射11β-HSD1抑制剂(8 g/kg),2次/周,处理4周。
1.3 观察指标 ①11β-HSD1检测:颈椎脱臼法处死大鼠,无菌条件下摘取其双侧股骨头,制作标本,进行石蜡切片,采用兔抗大鼠多克隆一抗11β-HSD1,测定11β-HSD1在股骨头内的表达,选择β-actin作为内标,4 ℃冰箱孵育12 h,采用免疫印迹法。②TGF-β1检测:抽取实验大鼠的腹部静脉血,4 ℃ 2 000 r/min离心15 min,取上层血清,采用酶联免疫法测定血清TGF-β1含量。③SOD与MDA检测:实验后将10%水合氯醛350 mg/kg注射于腹腔,将大鼠颈椎脱臼法处死后,进行SOD与MDA的检测,检测区域为脑组织海马区。

2 结果
2.1 11β-HSD1表达情况对比 模型组的11β-HSD1相对表达量明显高于空白组(P<0.05),实验组的11β-HSD1相对表达量低于对照组(P<0.05)。见表1、图1。

表1 不同大鼠的11β-HSD1表达情况比较
2.2 血清TGF-β1含量对比 模型组的血清 TGF-β1含量为(51.44±6.39) pg/mL,空白组为(29.44±4.29) pg/mL,试验组为(48.29±5.11) pg/mL,对照组为(59.22±5.11) pg/mL,差异有统计学意义(P<0.05)。见表2。
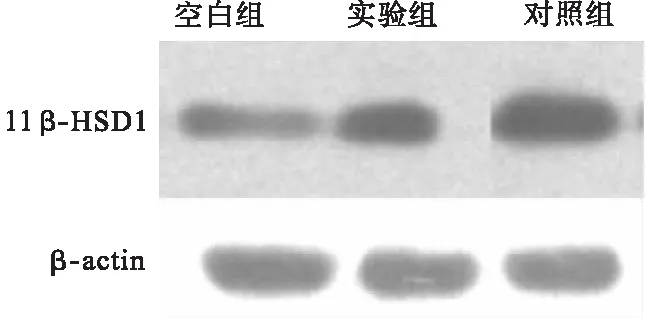
图1 各组大鼠11β-HSD1表达情况对比

表2 不同大鼠的血清 TGF-β1含量表达情况比较
2.3 SOD与MDA含量对比 与空白组相比,模型组SOD含量减少(P<0.05),MDA显著增加(P<0.05);实验组的SOD与MDA含量与对照组比较差异有统计学意义(P<0.05)。见表3。

表3 不同大鼠的脑组织SOD、MDA含量比较
3 讨论
骨重建过程是一个新骨替换旧骨的过程,伴随着骨吸收与骨形成过程相偶联。骨形成过程中,成骨细胞在骨基质的矿化、合成及分泌中起主要作用,为主要的功能细胞[12];对糖皮质激素较为敏感[13],正常剂量下功能维持,高剂量下不耐受,会引发骨小梁密度减少等情况的发生,延缓骨重建进程,诱导股骨头坏死的发生[14]。股骨头微环境内存在多种细胞成分,包括成骨细胞、骨髓间质细胞、脂肪细胞等。
现代研究表明,骨组织内的11β-HSD1与糖皮质激素所引发的骨代谢异常紧密相关。11β-HSD1属于短肽链乙醇氧化还原酶家族,定位于1号染色体上,含有2个糖基化位点,6个外显子。糖基化抑制剂对11β-HSD1的脱氢酶起到抑制作用[15]。有研究发现,地塞米松诱导人前成骨细胞株,11β-HSD1的活动随地塞米松剂量加大而逐渐下降,在IL-1β、TNF-α等炎症因子协同下,可导致11β-HSD1的表达增多,骨代谢异常及股骨头坏死发生的可能性增加[16];细胞碱性磷酸酶的矿化活动随地塞米松剂量加大而逐渐增多,具有平台期[17]。本研究显示,模型组的11β-HSD1相对表达量明显高于空白组,实验组的11β-HSD1相对表达量低于于对照组。也有研究显示,健康男性的外周血骨钙蛋白、N-末端Ⅰ型胶原前肽等骨形成标志物,在摄入过量的泼尼松后出现下降趋势,下降程度与体内11β-HSD1活动相关[18]。骨重建过程与成骨细胞分化的功能状态、不同的阶段、细胞数量等具有相关性。
11β-HSD1在成骨与脂肪细胞均有中等量表达,能影响细胞局部内源性糖皮质激素的二次激活。而在股骨头微环境中,随着成骨及脂肪细胞外部内源性糖皮质激素水平的下降,11β-HSD1的表达反而增强[19]。有报道,当糖皮质激素过量,11β-HSD1与糖皮质激素的关系呈现正相关,延长皮质醇的活性半衰期,增强激素对组织或成骨细胞的效应,影响微环境内骨小梁发育及生理状态[20]。TGF-β1在血小板和骨组织中含量丰富,是一种具有多种功能的多肽,可以促血管生长,与各类软组织的损伤修复相关,起促进作用。TGF-β1在骨与软骨的形成、炎症反应以及组织修复过程中也起到重要作用。本研究显示,11β-HSD1抑制剂对11β-HSD1表达的调节,有利于激素性股骨头缺血坏死大鼠股骨头的重建。也有研究表明,随着人类年龄增长,IGF-1β等生长因子含量减少,而11β-HSD1在骨组织中的表达增加,导致骨组织含水量减少,骨的弹性减弱,抗压能力降低[21]。
正常机体氧自由基产生与清除处于动态平衡,但是由于多因素的影响,机体氧自由基平衡失调,生成增加,而清除减少,过多的活性氧对DNA、酶类以及生物膜类等产生破坏作用,引发细胞死亡,损伤脑组织,产生破坏作用[22]。脂质过氧化的主要终产物是MDA,机体内MDA水平可间接反映脂质过氧化的程度以及氧自由基水平。SOD经歧化反应,使氧自由基减少,从而使细胞损害减少。本研究结果显示,与空白组相比,模型组SOD含量减少,MDA含量显著增加;实验组的SOD与MDA含量与对照组相比差异有统计学意义,表明11β-HSD1抑制剂清理自由基和抗氧化作用更强。有研究表明,11β-HSD1转基因小鼠经激素处理后,其成骨细胞、骨形成率、骨质面积与经激素处理的普通实验大鼠相比,明显增高,说明早期前分化细胞的排列及成熟过程受11β-HSD1影响,表达过多会出现一定的干扰[23]。
总之,11β-HSD1抑制剂能够改善大鼠股骨头坏死的微环境,抑制TGF-β1的表达,增强成骨作用,有利于骨重建。
参考文献:
[1] Cheleschi S,Cantarini L,Pascarelli NA,et al.Possible chondroprotective effect of canakinumab:an in vitro study on human osteoarthritic chondrocytes[J].Cytokine,2015,71(2):165-172.
[2] Wang J,Kalhor A,Lu S,et al.iNOS expression and osteocyte apoptosis in idiopathic,non-traumatic osteonecrosis[J].Acta Orthop,2015,86(1):134-141.
[3] 綦雯雯,贾凯英,孙达,等.吡格列酮对糖尿病大鼠中枢神经系统11β-羟类固醇脱氢酶1型表达的影响[J].神经疾病与精神卫生,2017,17(3):184-186.
[4] Wang L,Luo DK,Pan ZY.Expression of 11β-HSD in steroid-induced avascular necrosis of the femoral head[J].Mol Med Rep,2013,7(5):1482-1486.
[5] 余相地,曹红.姜黄素对神经病理性疼痛大鼠脊髓11β羟基固醇脱氢酶1表达的影响[J].国际药学研究杂志,2017,44(6):551-555,560.
[6] Gagala J,Buraczynska M,Mazurkiewicz T,et al.Endothelial nitric oxide synthase gene intron 4 polymorphism in non-traumatic osteonecrosis of the femoral head[J].Int Orthop,2013,37(7):1381-1385.
[7] Sekkat J,Rachidi O,Janani S,et al.Idiopathic avascular necrosis of the femoral heads in five members of a moroccan family[J].Joint Bone Spine,2012,79(5):504-506.
[8] 辛婧,叶磊,杨可,等.小鼠11β-HSD1基因真核表达载体的构建及应用[J].中国现代医学杂志,2017,27(16):12-17.
[9] 何丰,叶进.皮质醇和11βHSD mRNA 在 OSAHS 中表达的研究[J].新医学,2016,47(9):609-613.
[10]Okazaki S,Nagoya S,Matsumoto H,et al.TLR4 stimulation and corticosteroid interactively induce osteonecrosis of the femoral head in rat[J].J Orthop Res,2016,34(2):342-345.
[11]Mikobi TM,Lukusa TP,Aloni MN,et al.Correlation between the lactate dehydrogenase levels with laboratory variables in the clinical severity of sickle cell anemia in congolese patients[J].PLoS One,2015,10(5):e0123568.
[12]徐杰,李国平,唐蔚青,等.部分炎症因子活化11β-HSD1参与非酒精性脂肪肝发生的研究进展[J].心肺血管病杂志,2016,35(4):330-333.
[13]Zheng L,Wang W,Ni J,et al.The association of eNOS gene polymorphism with avascular necrosis of femoral head[J].PLoS One,2014,9(2):e87583.
[14]Gagala J,Buraczynska M,Mazurkiewicz T,et al.Prevalence of genetic risk factors related with thrombophilia and hypofibrinolysis in patients with osteonecrosis of the femoral head in Poland[J].BMC Musculoskelet Disord,2013,14:264.
[15]Kim HS,Bae SC,Kim TH,et al.Endothelial nitric oxide synthase gene polymorphisms and the risk of osteonecrosis of the femoral head in systemic lupus erythematosus[J].Int Orthop,2013,37(11):2289-2296.
[16]吴国琼,林梅,郭菲菲,等.11β-羟基类固醇脱氢酶1型抑制剂对高脂血症大鼠肝脏、脂肪和骨骼肌脂代谢基因的影响[J].中国老年学杂志,2016,36(22):5527-5529.
[17]Li X,Li YS,Li LJ,et al.Overactivated autophagy contributes to steroid-induced avascular necrosis of the femoral head[J].Exp Ther Med,2017,14(1):367-372.
[18]Jajosky RP,Lumm WC,Wise SC,et al.A suspected delayed hemolytic transfusion reaction mediated by anti-Joa[J].Immunohematology,2017,33(2):73-75.
[19]赵佳,魏波,刘军,等.皮质酮对大鼠股骨头微环境11β-H SD1表达及骨重建影响的初步实验研究[J].重庆医学,2016,43(3):336-338.
[20]Wang Y,Li X,Gao Y,et al.Genetic polymorphisms of CYP3A4 among Chinese patients with steroid-induced osteonecrosis of the femoral head[J].Medicine (Baltimore),2016,95(44):e5332.
[21]Zhou ZC,Gu SZ,Wu J,et al.VEGF,eNOS,and ABCB1 genetic polymorphisms may increase the risk of osteonecrosis of the femoral head[J].Genet Mol Res,2015,14(4):13688-13698.
[22]孙红爽,乜春城,朱小丽,等.11β-HSD1在糖皮质激素联合高脂喂养大鼠胰岛素抵抗中的作用[J].国际内分泌代谢杂志,2016,36(1):14-19.
[23]Ikemura S,Yamamoto T,Motomura G,et al.Cytochrome P4503A activity affects the gender difference in the development of steroid-induced osteonecrosis in rabbits[J].Int J Exp Pathol,2014,95(2):147-152.
