饱和氢生理盐水在氯化锂-匹罗卡品癫痫大鼠模型中的脑保护作用
2018-06-29冯清林范仕兵冉住国刘明冬
冯清林,范仕兵,赵 锐,宋 毅,冉住国,刘明冬,李 骥
0 引言
癫痫是一种不同病因引起的反复发作的神经系统疾病,全球大约有9 000万的患者,发病率约为5%,其发病原因主要是大脑中的神经元突然出现异常的电脉冲[1-2]。目前的治疗手段仍然是以药物为主,且1/3的患者对药物治疗效果差,导致发展为难治性癫痫[3]。癫痫发作后,线粒体是生产自由基的重要场所,同时也是氧化应激损伤的靶点。线粒体的损伤将导致脑组织ATP水平下降、神经元电活动紊乱,从而使神经元凋亡过程启动,加重癫痫造成的神经损伤,细胞凋亡又反过来易化癫痫发作[4-5]。目前研究发现,氢分子具有抗氧化作用,可以清除自由基。在动物实验中,氢气可有效清除自由基,改善脑及心肌缺血再灌注损伤;有效减轻小肠移植后的炎症损伤等[6-8]。通过这些研究,我们推测氢主要与神经元内源性凋亡途径相关,具有抗氧化、抗炎、抑制凋亡等作用。我们提出假设:氢对癫痫发病有治疗作用,并且有着不良反应小、价格低廉的优点。因此,本研究探讨了饱和氢生理盐水(Saturated hydrogen saline,SHN)对癫痫大鼠脑保护作用及其可能的机制。
1 材料与方法
1.1 材料
1.1.1 动物模型 30只健康6~8周龄SPF清洁级雄性SD大鼠,体重200~240 g,由重庆医科大学动物实验中心提供,动物许可证号:SCXK(渝2016-0001)。在室温(23±2) ℃、湿度为55%±5%,12 h昼/夜循环照明的环境下饲养。所有操作过程遵循实验动物伦理学要求,随机分为健康对照组(NC组)、SE组、SHN干预组。致痫模型前1 d即用SHN干预,对照组及SE组予以等量生理盐水,给药方式为腹腔注射1次/d (10 mL/kg)。致痫后第2~6天进行Morris水迷宫行为训练及测试,结束后予以断头处死并取双侧海马组织,-80 ℃低温保存。
1.1.2 饱和氢生理盐水的制备[9]采用氢水生成设备(ver.2,Blue Mercury Inc.Tokyo,Japan)高压下(0.4 Mpa)将分子氢溶于生理盐水制成饱和溶液。制备好的饱和氢溶液储存于铝制包装内,保证将氢浓度维持在>0.6 mmol/L,每周均新鲜配置。
1.1.3 试剂 氯化锂及匹罗卡品(购自Sigma公司),SOD、GSH-Px、CAT、MDA、IL-1β、TNF-α检测试剂盒(购自南京建成生物工程研究所);一抗:兔抗Bcl-2、Bax、caspase-3多克隆抗体(sc783、sc-6236、sc-7148,Santa Cruz);β-actin (sc-130656 Santa Cruz);二抗:山羊抗兔IgG(bs-0295G,北京博奥森公司);其余试剂为市售分析纯品。
1.2 方法
1.2.1 癫痫模型建立 采用氯化锂-匹罗卡品腹腔注射法建立颞叶癫痫模型[10],大鼠腹腔注射氯化锂3 mmol/kg,20 h后再腹腔注射新鲜配置的匹罗卡品30 mg/kg,给药后大鼠在15~45 min 后形成癫痫持续状态。根据经典的 Racine 癫痫发作行为标准进行观察记录[11]。模型组动物发作级别均达Ⅳ级以上,在癫痫持续状态60 min后,腹腔注射地西泮4 mg/kg,终止癫痫持续状态(Status epilepticus,SE)。
1.2.2 Morris水迷宫试验方法检测大鼠定位航行能力及空间探索能力 水迷宫仪器为直径140 cm、高60 cm的圆形水池,控制水温在(25±1) ℃,水池等分为4个象限,在第1象限正中距离池壁30 cm处放一透明圆形平台(直径10 cm),同时将水面高于平台表面1.0 cm。大鼠于致痫后第2天开始测试,4次/d,连续训练5 d。将大鼠每次随机从一个象限面朝池壁轻轻放入水中,记录大鼠到达平台所需时间(潜伏期),允许大鼠在平台上停留30 s,以强化记忆效果,时间以60 s为限,如大鼠在60 s内未达到平台,则逃避潜伏期以60 s记录,并由实验员引导至平台停留30 s。空间探索实验:致痫后第7天进行测试,移除平台,从大鼠前5 d的入水点放入,持续120 s,记录大鼠在隐藏平台所在象限的停留时间。
1.2.3 各组海马组织氧化还原反应指标及炎症指标 大鼠在完成Morris水迷宫实验之后,麻醉后予以断头处死,在冰浴上开颅并迅速取双侧大脑海马组织,电子天平称重,低温条件下匀浆后,在4 ℃离心机中4 000 r/min离心10 min,并取上清液,按照试剂盒说明测定氧化还原指标SOD、GSH-Px、CAT、MDA及炎症指标IL-1β、TNF-α。
1.2.4 Western blot检测各组海马组织中Bcl-2、Bax、caspase-3蛋白水平 将保存在-80 ℃冰箱的蛋白标本,65 ℃加热,每条泳道加样50 μg蛋白,用10%的聚丙烯酰胺凝胶电泳,将蛋白转移到硝酸纤维素膜上予以脱脂奶粉封闭后,分别加入一抗(1∶1 000)、二抗(1∶2 000)孵育,并予以ECL发光试剂显色及Tanon凝胶图像分析系统照相并分析结果。

2 结果
2.1 实验动物癫痫模型情况 大鼠注射匹罗卡品后15~45 min出现烦躁、点头、节律性咀嚼及洗脸样动作,继之出现双前肢阵挛或后肢伸展,然后出现四肢抽搐,反复强直-阵挛发作,达到Racine癫痫发作行为标准Ⅳ级,符合SE。
2.2 大鼠Morris水迷宫试验 随着训练时间的增加,大鼠寻找平台潜伏期时间逐渐缩短。各组大鼠从测试第2天开始,SE组大鼠寻找平台潜伏期时间较NC组延长,SHN干预组大鼠寻找平台潜伏期时间较SE组大鼠缩短(P<0.05)。各组训练结束后,SE组大鼠在隐藏平台象限游泳时间短于NC组,SHN干预组大鼠在隐藏平台象限游泳时间较SE大鼠延长(P<0.05),见表1、表2。
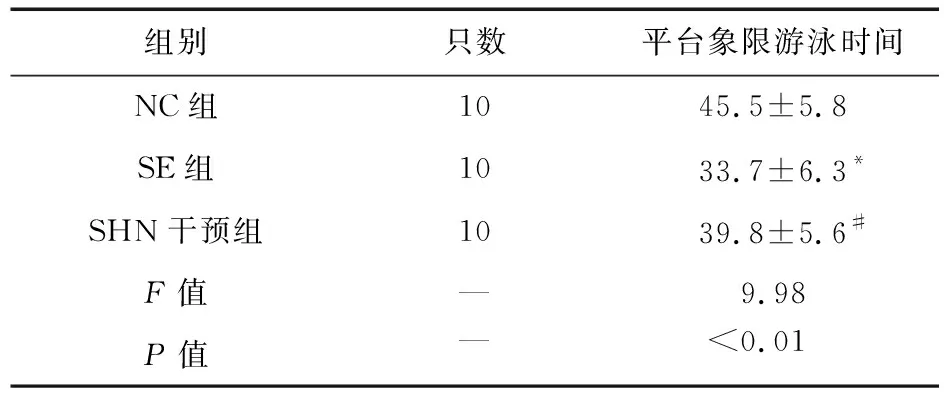
表1 Morris水迷宫定位航行实验平台象限游泳时间(n=10)
2.3 各组癫痫大鼠海马组织中SOD、GSH-Px、CAT、MDA的比较 SE大鼠大鼠海马组织中氧化还原反应指标与NC组比较,SOD、GSH-Px、CAT降低,MDA升高;SHN干预组大鼠海马组织中氧化还原反应指标与SE组比较,SOD、GSH-Px、CAT升高,MDA降低,差异有统计学意义(P<0.05),见表3。
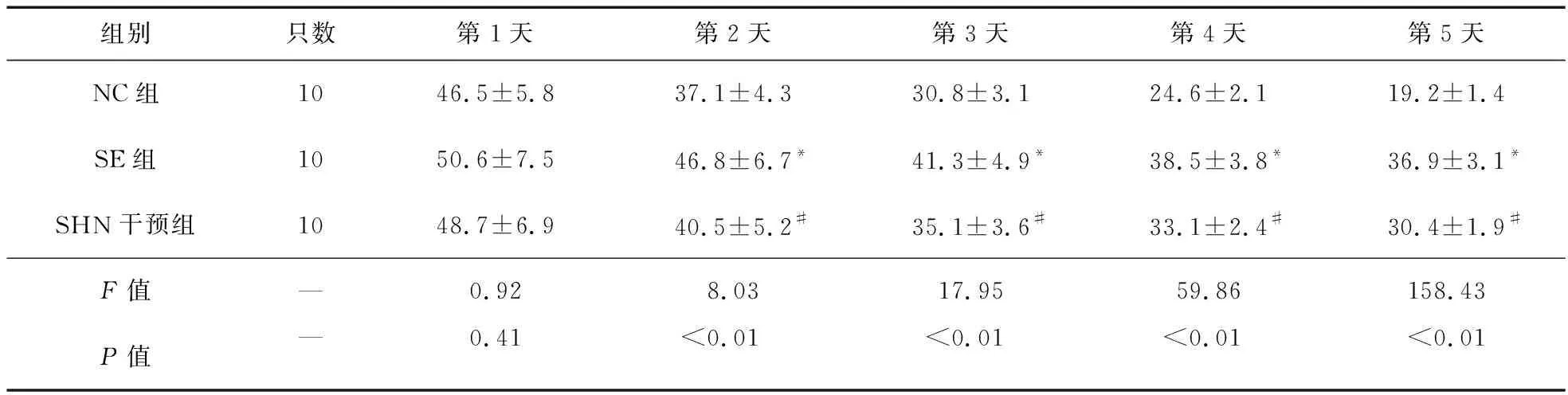
表2 Morris水迷宫定位航行实验逃避潜伏期比较(n=10)
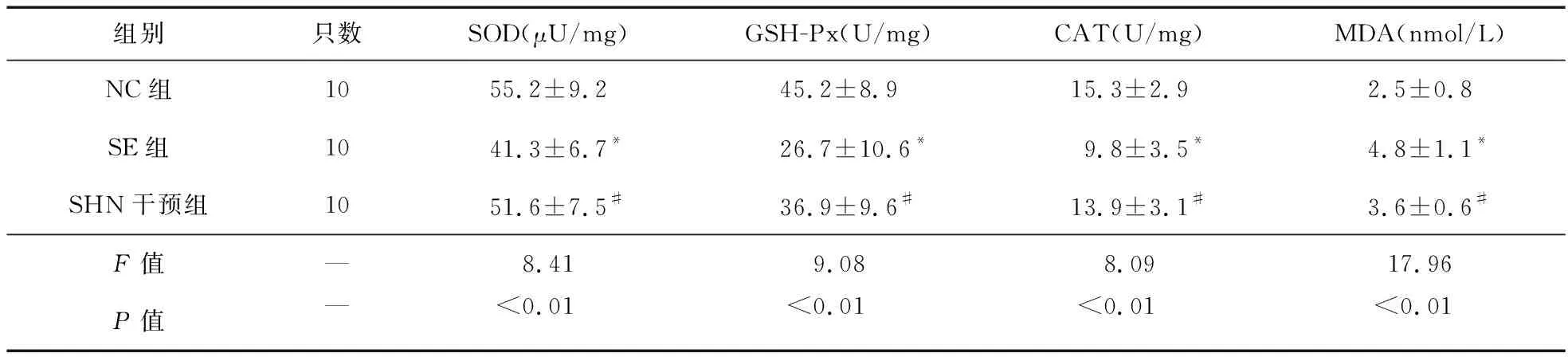
表3 各组大鼠海马组织中氧化还原反应酶指标水平比较(n=10)
2.4 各组大鼠海马组织中IL-1β、TNF-α的比较 与NC组比较,SE大鼠海马组织中炎症指标IL-1β、TNF-α升高,与SE组比较,SHN干预组大鼠炎症指标比IL-1β、TNF-α降低,差异有统计学意义(P<0.05),见表4。
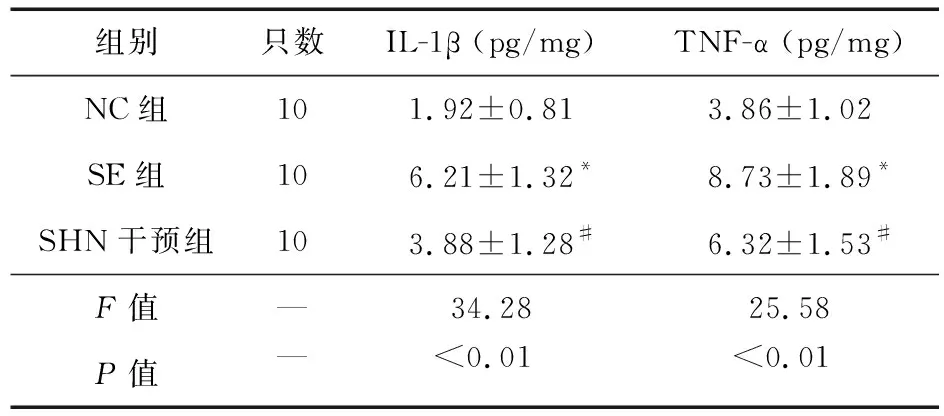
表4 各组大鼠海马组织IL-1β、TNF-α表达比较
2.5 各组大鼠海马组织中Bcl-2、Bax、caspase-3蛋白表达情况 与NC组比较,SE组Bax、caspase-3表达水平及Bax/Bcl-2比值升高(P<0.05),Bcl-2降低(P<0.05)与SHN干预组比较,SE组Bax、caspase-3及Bax/Bcl-2比值降低(P<0.05),Bcl-2升高(P<0.05)。见图1。

图1 各组大鼠海马组织中Bcl-2、Bax、caspase-3蛋白表达水平
3 讨论
癫痫患者人数约占全球人口的5%,其中中国约有1 000万癫痫患者,已经给家庭和社区造成沉重的精神和经济负担,但癫痫的发病原因及具体机制目前尚不清楚,外伤性脑损伤、脑出血、颅内感染、脑肿瘤、大脑皮质异常等导致癫痫[12],神经元异常放电、氧化应激、神经免疫调节失衡是癫痫发病的重要机制。目前基础研究及临床研究也报道,氧化应激、炎性因子及炎症反应参与了癫痫的发病过程[13-14]。相关研究证实,氢不仅在抗氧化、抗炎、抗肿瘤等方面发挥重要作用,而且具有神经系统保护作用。有学者在帕金森病、新生儿缺血缺氧性脑病及脑外伤等动物模型中发现氢具有脑保护作用[15-16]。目前氢分子医学已成为一个新的研究热点,其生物抗氧化作用具有如下优点:①氢还原性弱,氢选择性抗氧化的基础是只与活性强和毒性强的活性氧反应;②人即使呼吸高压氢也无明显不良反应;③氢与自由基反应产物为水,可通过呼吸排出体外;④氢的制备容易,价格低廉[17]。但氢对癫痫的治疗作用鲜有报道,因此,本实验探讨了SHN干预对癫痫大鼠脑保护作用及其可能的机制。
本实验通过Morris 水迷宫实验证实癫痫持续状态可使大鼠寻找平台潜伏期延长,空间探索试验中SE大鼠在平台隐藏象限的停留时间缩短,提示学习记忆能力下降,与文献报道是一致的[18]。SHN干预后,SE组大鼠这一现象得到明显改善,结果提示,SHN能改善癫痫持续状态大鼠的认知功能。研究提示,大脑学习能力与海马区功能密切相关[19],因此,本研究进一步对海马组织的氧化还原指标及炎症指标进行分析。
SOD 是一种肽链大分子金属酶,GSH-Px是一种过氧化物分解酶,CAT是一种催化过氧化氢分解成氧和水的酶,这3种酶的作用均是减少自由基的产生,减少脂质过氧化及其代谢产物对机体的损害。MDA是一种氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的代谢产物[20-21],其含量可以估计脑组织中氧自由基水平和脂质过氧化反应的强弱。本研究显示,与SE组比较,SHN干预组SOD、GSH-Px、CAT升高,MDA降低,表明SHN可抑制海马组织的氧化应激反应,保护海马细胞,进而减轻大鼠认知功能损害。癫痫的发生发展与免疫调节和炎症密切相关[13],IL-1β是急性应激反应和损伤中的重要炎症因子,增加IL-1β在大脑中的水平,可能会增加脑组织的炎症,引起惊厥[22]。TNF-α是一种促炎因子,但很少在正常脑组织中表达,然而在各种中枢神经系统疾病中,TNF-α水平迅速提升,可能与TNF-α改变了突触 α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体的分子化学剂量,同时增加兴奋性突触的活动有关[23]。本研究结果提示,SHN可降低SE组大鼠IL-1β、TNF-α的水平,达到缓解炎症反应、保护海马细胞的作用。Bcl-2家族蛋白是细胞凋亡过程中的关键调节分子,其中Bcl-2蛋白和Bax蛋白相互拮抗,在中枢神经元凋亡中起关键调节作用,Bax/Bcl-2比值已成为检测凋亡的重要指标[24];caspase-3蛋白是凋亡的最终执行者,为凋亡过程中最重要的蛋白酶和多种凋亡途径的共同下游效应部分[25]。本研究Western blot结果提示:大鼠癫痫发作后细胞凋亡水平升高,SHN干预能够降低SE组大鼠caspase-3活性和Bax/Bcl-2表达水平的上调,缓解海马神经元的凋亡,改善SE大鼠的氧化应激及炎性反应。结果表明,中枢神经元的凋亡在癫痫的发生及发展中是相关的。
总之,SHN干预可改善癫痫后大鼠认知功能障碍、氧化应激及炎性反应,其机制可能与氢分子作用于Bcl-2、Bax、caspase-3凋亡通路有关,也可能与Bcl-2、Bax、caspase-3之外的调控机制相关,对其机制的研究将是下一步研究的重点。本实验为预防或者抗癫痫新型药物的研制提供新思路。
参考文献:
[1] Yang K,Su J,Lang Y,et al.Contradictory imaging and EEG results in resection surgery of bitemporal lobe epilepsy:a case report[J].Exp Ther Med,2014,7(3):731-733.
[2] Kerr EN,Blackwell MC.Near-transfer effects following working memory intervention (Cogmed) in children with symptomatic epilepsy:an open randomized clinical trial[J].Epilepsia,2015,56(11):1784-1792.
[3] Cramer JA.Reflections on a career in epilepsy:an unplanned journey[J].Epilepsy Behav,2016,57(Pt A):217-219.
[4] 刘朝巍,张涛,杨卓.氧化应激损伤线粒体参与癫痫病理过程[J].中国病理生理杂志,2008,24(1):198-200.
[5] Xie N,Wang C,Wu C,et al.Erratum to:mdivi-1 protects epileptic hippocampal neurons from apoptosis via inhibiting oxidative stress and endoplasmic reticulum stress in vitro[J].Neurochem Res,2016,41(9):2501-2502.
[6] Liu Z,Geng W,Jiang C,et al.Hydrogen-rich saline inhibits tobacco smoke-induced chronic obstructive pulmonary disease by alleviating airway inflammation and mucus hypersecretion in rats[J].Exp Biol Med (Maywood),2017,242(15):1534-1541.
[7] Lin CP,Chuang WC,Lu FJ,et al.Anti-oxidant and anti-inflammatory effects of hydrogen-rich water alleviate ethanol-induced fatty liver in mice[J].World J Gastroenterol,2017,23(27):4920-4934.
[8] Ji X,Liu W,Xie K,et al.Beneficial effects of hydrogen gas in a rat model of traumatic brain injury via reducing oxidative stress[J].Brain Res,2010,1354:196-205.
[9] Sun Q,Kang Z,Cai J,et al.Hydrogen-rich saline protects myocardium against ischemia/reperfusion injury in rats[J].Exp Biol Med (Maywood),2009,234(10):1212-1219.
[10]Hu K,Zhang C,Long L,et al.Expression profile of microRNAs in rat hippocampus following lithium-pilocarpine-induced status epilepticus[J].Neurosci Lett,2011,488(3):252-257.
[11]Racine RJ.Modification of seizure activity by electrical stimulation.II.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[12]Wang X,Zhang C,Wang Y,et al.Prognostic factors for seizure outcome in patients with MRI-negative temporal lobe epilepsy:a meta-analysis and systematic review[J].Seizure,2016,38:54-62.
[13]Friedman A,Dingledine R.Molecular cascades that mediate the influence of inflammation on epilepsy[J].Epilepsia,2011,52(Suppl 3):33-39.
[14]Xiang J,Jiang Y.Regulation of Cu-Zn superoxide dismutase on SCN2A in SH-SY5Y cells as a potential therapy for temporal lobe epilepsy[J].Mol Med Rep,2014,9(1):16-22.
[15]Wang ZJ,Wu J,Guo W,et al.Atherosclerosis and the hydrogen sulfide signaling pathway-therapeutic approaches to disease prevention[J].Cell Physiol Biochem,2017,42(3):859-875.
[16]Yoritaka A,Abe T,Ohtsuka C,et al.A randomized double-blind multi-center trial of hydrogen water for Parkinson′s disease:protocol and baseline characteristics[J].BMC Neurol,2016,16:66.
[17]Wu MJ,Chen M,Sang S,et al.Protective effects of hydrogen rich water on the intestinal ischemia/reperfusion injury due to intestinal intussusception in a rat model[J].Med Gas Res,2017,7(2):101-106.
[18]Kong Q,Min X,Sun R,et al.Effects of pharmacological treatments on hippocampal NCAM1 and ERK2 expression in epileptic rats with cognitive dysfunction[J].Oncol Lett,2016,12(3):1783-1791.
[19]Redish AD,Touretzky DS.The role of the hippocampus in solving the Morris water maze[J].Neural Comput,1998,10(1):73-111.
[20]卢斌,陈永,姜绪平.消化道肿瘤患者血清中活性氧、超氧化物歧化酶和谷胱甘肽过氧化物酶的活性测定[J].中国医学创新,2010,7(28):9-10.
[21]Luna B,Bhatia S,Yoo C,et al.Bayesian network and mechanistic hierarchical structure modeling of increased likelihood of developing intractable childhood epilepsy from the combined effect of mtDNA variants,oxidative damage,and copy number[J].J Mol Neurosci,2014,54(4):752-766.
[22]Dundar NO,Aktekin B,Ekinci NC,et al.Interleukin-1β secretion in hippocampal sclerosis patients with mesial temporal lobe epilepsy[J].Neurol Int,2013,5(3):e17.
[23]Corcoran C,Connor TJ,O′Keane V,et al.The effects of vagus nerve stimulation on pro- and anti-inflammatory cytokines in humans:a preliminary report[J].Neuroimmunomodulation,2005,12(5):307-309.
[24]任玉伟,宿华威.Bcl-2基因家族研究进展[J].大连医科大学学报,2015,37(2):202-205.
[25]Huang Y,Wu X,Guo J,et al.Myocyte-specific enhancer binding factor 2A expression is downregulated during temporal lobe epilepsy[J].Int J Neurosci,2016,126(9):786-796.
