罗格列酮对大鼠酒精性肝炎的保护作用
2018-06-29揭英锡邓艳红陈小淑陈泳珊徐泽曦王朝聪朱晓琴
揭英锡 ,邓艳红 ,陈小淑 ,陈泳珊 ,徐泽曦 ,王朝聪 ,朱晓琴
1.广州医科大学第二临床学院麻醉学系,广东广州 511436;2.广州医科大学基础学院机能实验中心,广东广州 511436
近年来酒桌文化盛行,酒精性肝炎(Alcoholic Hepatitis,AH)发病率逐渐上升[1],已成为继病毒性肝炎后的第二大肝脏疾病,严重危害人们的健康[2]。目前对于AH,常规的治疗方法包括戒酒、营养支持和药物干预[3]。文献表明[4],罗格列酮(Rosiglitazone,RSG)在诸多器官的急慢性炎性病变中发挥着一定的抗炎作用,但是罗格列酮对于酒精性肝炎的保护作用,尚没有相关文献报道。因此,开展酒精性肝炎中罗格列酮对肝脏的保护作用的科学研究,具有一定的现实意义。20只SD雌性大鼠造模6周(2017年7—8月),该文在此基础上,报道关于罗格列酮对酒精性肝炎保护作用的实验研究结果。
1 材料与方法
1.1 实验药物
盐酸罗格列酮胶囊(国药准字H20052455),醋酸泼尼松片 (国药准字H44020682),北京二锅头酒,大鼠MDA ELISA试剂盒,包埋液。
1.2 动物分组与模型制备
成年SD雌性大鼠 20只,体重200~250 g,随机分为正常组、酒精肝模型组、阳性对照组、罗格列酮处理组(n=5)。具体分组情况如下:正常组自由进食饮水,其余组均采用灌胃法联合酒精饮料自由饮用法构建大鼠慢性酒精性肝炎模型[5]。灌胃白酒6 mL/(kg·d),其酒精体积分数依次为30%、35%、40%、45%,每周递增,在体积分数为45%时持续3周;自由饮用法酒精体积分数依次为15%、20%、25%、30%,每周递增,在体积分数为30%时持续3周。每日灌胃白酒6 h后,酒精肝模型组、阳性对照组、罗格列酮处理组分别灌胃生理盐水 1.0 mg/(kg·d)、泼尼松[6]0.5 mg/(kg·d)、罗格列酮 1.0 mg/(kg·d)。6周后取大鼠血清及肝脏进行相关指标的检测。
1.3 模型制备成功的判定指标
与正常组比较,酒精肝模型组大鼠血清中ALT、AST、MDA含量显著升高,肝脏指数明显增大,肝脏切片观察可见肝细胞脂肪样变及炎症细胞浸润;阳性对照组与罗格列酮处理组大鼠各项检测指标较酒精肝模型组有显著差异[7]。
1.4 样本提取与指标检测
1.4.1 血清检测 6周后,大鼠称重(禁食12 h),10%水合氯醛3 mL/kg腹腔注射。大鼠麻醉后,取下腔静脉血 4~6 mL,室温静置 1.5 h,离心提取血清,-80℃冰箱保存,送医院检测ALT、AST含量。按照试剂盒方法检测血清MDA含量。
1.4.2 肝脏指数测量取新鲜肝脏置于PBS-20%蔗糖溶液泡洗数次,滤纸吸干表面溶液,肝脏称重记录数据,计算肝脏指数。
1.5 肝组织形态学观察
取新鲜肝脏,肝叶纵切5 mm,包埋液包埋,置于-20℃缓冻,次日取出置于-80℃保存,制备冰冻切片,HE染色,光镜观察。
1.6 统计方法
应用SPSS 13.0统计学软件分析数据,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计意义。
2 结果
2.1 血清ALT、AST含量变化
测定各组大鼠血清ALT、AST含量,与正常组比较,其余 3 组 ALT、AST 含量明显升高(P<0.05);与酒精肝模型组比较,罗格列酮处理组及阳性对照组ALT、AST 含量明显下降(P<0.05);罗格列酮处理组与阳性对照组ALT、AST含量差异无统计学意义(P>0.05)。 见表 1。
表 1 各组大鼠血清 ALT、AST 含量比较[(±s),U/L]

表 1 各组大鼠血清 ALT、AST 含量比较[(±s),U/L]
注:与正常组比较,aP<0.05;与酒精肝模型组比较,bP<0.05;与阳性对照组比较,cP>0.05。
组别ALT AST罗格列酮处理组(n=5)阳性对照组(n=5)酒精肝模型组(n=5)正常组(n=5)(59.0±10.0)abc(47.0±8.0)ab(85.5±10.5)24.5±3.5(97.5±10.5)abc(91.5±18.5)ab(179.0±37.0)a 60.0±12.0
2.2 血清MDA含量变化
测定各组大鼠血清MDA含量,与正常组比较,其余3组MDA含量明显升高(P<0.05);与酒精肝模型组比较,罗格列酮处理组及阳性对照组MDA含量明显下降 (P<0.05);罗格列酮处理组与阳性对照组MDA含量差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清MDA含量比[(±s),nmol/L]

表2 各组大鼠血清MDA含量比[(±s),nmol/L]
注:与正常组比较,aP<0.05;与酒精肝模型组比较,bP<0.05;与阳性对照组比较,cP>0.05。
组别MDA罗格列酮处理组(n=5)阳性对照组(n=5)酒精肝模型组(n=5)正常组(n=5)(122.6±24.4)abc(122.7±22.6)ab(225.7±21.5)a 82.5±7.5
2.3 肝组织形态学观察
2.3.1 肉眼观 正常组大鼠肝脏被膜光滑,呈红褐色,明亮有光泽。酒精肝模型组大鼠肝脏体积明显增大,包膜紧张,边缘圆钝,颜色浅黄,与周围组织有黏连,切面油腻,无光泽。罗格列酮处理组和阳性对照组肝脏变化介于正常组与酒精肝模型组之间,切面无明显油腻感,尚有光泽。各组大鼠肝脏指数比较见表3。
表3 各组大鼠肝脏指数比较[(±s),%]

表3 各组大鼠肝脏指数比较[(±s),%]
注:与正常组比较,aP<0.05;与酒精肝模型组比较,bP<0.05;与阳性对照组比较,cP>0.05。
组别肝脏指数罗格列酮处理组(n=5)阳性对照组(n=5)酒精肝模型组(n=5)正常组(n=5)(2.44±0.12)abc(2.41±0.05)ab(2.99±0.12)a 2.09±0.16
2.3.2 HE染色 正常组大鼠肝细胞以中央静脉为中心呈放射状排列,细胞形态正常,小叶结构正常(图1A)。酒精肝模型组肝细胞肿胀、点状坏死及炎症细胞浸润(图1B)。罗格列酮处理组(图1C)和阳性对照组(图1D)肝细胞轻度肿胀及脂肪样变,但无明显肝细胞坏死及炎症细胞浸润。各组大鼠形态观察见图1(HE 染色)。
3 讨论
长期大量饮酒是导致酒精性肝炎的主要原因,目前多数认为其发病机制与氧化应激有关。乙醇进入机体后,经肝脏代谢产生大量乙醛、自由基等氧化物,消耗大量抗氧化因子[8]。当抗氧化因子不能及时清除氧化物时,肝细胞膜就会发生脂质过氧化反应[9],引起肝细胞炎症,导致肝细胞肿胀、脂肪变性、坏死及炎症细胞浸润,甚至纤维化[10]。
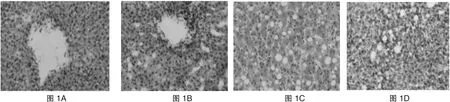
图1 HE染色下4组大鼠形态观察
该实验检测ALT、AST、MDA血清学指标,其依据为:①MDA是脂质过氧化反应的主要终产物,其含量多少能直接反映机体脂质过氧化损伤的程度[11]。②当肝细胞发生变性、坏死等损害时,细胞膜通透性增加,导致血清中ALT、AST含量升高。所以,ALT、AST是目前临床上最常用的肝损伤诊断指标[12]。按联合法造模6周,取血清检测ALT、AST、MDA含量,肝脏切片观察。形态学结果提示该实验造模成功,给予酒精的组别均出现不同程度肝实质损伤,与酒精肝模型组比较,罗格列酮处理组肝组织损伤减轻。生化结果显示,罗格列酮处理组血清ALT、AST、MDA的含量低于酒精肝模型组。综上可得,罗格列酮处理组脂质过氧化反应程度及肝功能损伤程度低于酒精肝模型组。
罗格列酮属于PPAR-γ激动剂,而PPAR-γ通路可以通过调节脂质代谢、氧化应激和炎症因子的产生影响器官发病过程。急性胰腺炎所致肝损伤、心肌炎等同为器官炎症,罗格列酮处理后可减轻损伤。陆贝等[13]通过对急性胰腺炎大鼠肝损伤的研究发现,罗格列酮可能通过抑制NF-κB信号传导通路的活性,下调下游促炎细胞因子水平,从而减轻急性胰腺炎过程中的肝细胞损伤。李戈等[14]通过研究小鼠自身免疫性心肌炎发现,罗格列酮可以明显减轻小鼠实验性自身免疫性心肌炎病情,抑制心肌炎症反应,罗格列酮的这种作用可能是通过减少IL-17的表达实现的。酒精性肝炎造模过程中给予罗格列酮,该组氧化指标MDA(122.6±24.4)nmol/L含量低于酒精肝模型组 MDA(225.7±21.5)nmol/L含量,说明该组脂质过氧化反应程度减轻。结合生化及形态学结果,对比陆贝、李戈等研究,我们推测罗格列酮可能通过激活PPAR-γ通路后抑制肝细胞氧化应激反应及减少炎症因子的产生,从而起到了肝细胞保护的作用。
综上所述,该实验说明PPAR-γ通路与抗氧化应激存在联系,这为酒精性肝炎的药物研究提供一个新思路,希望有更多的PPAR-γ激动剂被应用到酒精性肝炎的药物研究中。该课题第二阶段的研究会侧重于罗格列酮抗氧化应激的具体机制,结合该次实验指标,增加 SOD、GSH、GSH-Px、T-AOC 等指标的检测;同时,罗格列酮对酒精性肝炎的保护作用与NF-κB信号传导通路是否有关,有待深入研究,实验过程中可以检测IL-1、IL-6、IL-17等炎症指标水平以及利用免疫组化法观察NF-κB在酒精性肝炎发生发展过程中的变化。
[1]刘国涛,朱玉翠,张涛.酒精性肝病研究进展[J].世界华人消化杂志,2017,25(15):1382-1388.
[2]张洁,虞朝辉.酒精性肝病的流行病学与自然史[J].现代医药卫生,2017,33(1):3-6.
[3]孔维宗,王迎春.酒精性肝病的治疗进展[J].现代医药卫生,2017,33(1):15-17.
[4]付鹏,周宁,李文宏.噻唑烷二酮类药物的药理作用概况[J].亚太传统药,2010,6(7):176-178.
[5]郭美仙,杨毅雯.三叶悬钩子对大鼠酒精性肝炎保护作用[J].大理学院学报,2014,13(10):1-4.
[6]史家欣,李家树.糖皮质激素抗炎作用机制的研究进展[J].实用医学杂志,2014,30(6):983-984.
[7]马阮昕,王晓东,江晓妹.自拟解酒护肝汤对酒精性肝炎模型大鼠的保护作用[J].环球中医药,2017,10(8):809-812.
[8]邱萍,李相,孔德松.酒精性肝病发病机制研究的新进展[J].中国药理学通报,2014,30(2):160-163.
[9]李园园,华艳芳,周俊英.酒精性肝病发病机制[J].临床荟萃,2016,31(7):723-726.
[10]Lavallare VJ,Bonnafous S,Patouraux S,et al.Serum markers of hepatocyte death and apoptosis are noninvasive biomarkers of severe fibrosis in patients with alcoholic liver disease[J].Plos One,2011,6(3):7599.
[11]陈柚伶,魏嵋,汪静.葛黄颗粒对酒精性肝病大鼠抗氧化应激及调节脂质代谢的作用机制[J].西南医科大学学报,2017,40(1):43-47.
[12]姜浩,戈宏炎.酒精性肝病的研究进展[J].世界最新医学信息文摘,2015,15(85):50-54.
[13]陆贝,于源泉,殷俊杰,等.NF-κB/TLR4信号通路在急性胰腺炎大鼠肝损伤中的表达及PPAR-γ激动剂的保护作用[J].中国现代医生,2016,54(33):30-33.
[14]李戈,徐登成,李少华.罗格列酮通过抑制IL-17表达改善自身免疫性心肌炎小鼠心肌损伤[J].中国免疫学杂志,2015(31):932-935.
