抗松针褐斑病湿地松组培再生植株抗病性测定
2018-06-29程方叶建仁
程方,叶建仁
(1.南京林业大学 南方现代林业协同创新中心,江苏 南京 210037; 2 广东省惠州市惠城区生态公益林管理站,广东 惠州 516001)
松针褐斑病(Lecanostictaacicola)是一种重要的国内森林植物检疫对象,在我国湿地松Pinuselliottii林中普遍发生,严重影响了湿地松的推广应用。叶建仁 等[1]在福建官庄林场建立了抗病种子园,但是抗性种子产量有限,为加速湿地松优良材料的推广进程,该研究小组通过器官发生获得移栽成活的再生植株[2-3]。植物的性状表现是基因型和环境综合作用的结果,经过人工培养的再生植株可能会出现变异,子代组培苗是否具有母株的优良抗病性,需要在组培苗生长后期进行抗病性测定。人工接种孢子悬浮液测定湿地松抗病性,需要组培再生植株移至温室盆里或田间苗圃,而毒素检测,快捷方便;若用松针褐斑病菌毒素处理瓶内组培苗测定抗病性的结果与室外人工接种孢子悬浮液测定的结果具有相关性,则可以在瓶内测定组培苗抗病性,及时淘汰不良无性系,将会大大缩短抗病选育的时间。作者通过测定湿地松组培苗3个培育阶段抗病性,确定湿地松组培苗间的抗病性差异以及3个阶段的测定结果是否具有相关性,以期为更早期筛选出湿地松组培苗优良抗病无性系提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 供试湿地松和松针褐斑病菌 南京林业大学抗病育种实验室的瓶内抗病组培苗32#3、8#11、8#2、8#40,普通组培苗;温室湿地松抗病组培苗32#3、32#7,普通组培苗针叶;2008年3月移栽到南京林业大学南大山苗圃的湿地松组培苗和实生苗。湿地松组培苗均来自湿地松器官发生植株再生体系。南京林业大学森林病理研究组提供松针褐斑病菌。
1.1.2 松针褐斑病菌毒素 采用程方 等[4]的制备方法制备松针褐斑病菌毒素。
1.1.3 松针褐斑病菌孢子悬浮液 将松针褐斑病菌恒温25 ℃下培养16~20 d,用2%蔗糖-灭菌水洗下分生孢子,经两层粗纱布滤去杂物,用血球计数板调节孢子悬浮液浓度至3×107个/mL 备用。
1.2 试验方法
1.2.1 松针褐斑病菌毒素生测瓶内组培苗 采用程方 等[4]的毒素生测方法处理湿地松瓶内32#3、8#11、8#2、8#40和普通组培苗,每处理3个重复,每个重复10株苗。以培养基表面含不接菌的小麦浸提液转接普通组培苗为对照。
1.2.2 松针褐斑病菌毒素生测温室组培苗针叶 采用程方 等[4]的毒素生测方法处理湿地松温室32#3、32#7和一年生普通组培苗针叶,每处理3个重复,每个重复15根针叶。以不接菌的小麦浸提液接种普通组培苗针叶为对照。
1.2.3 苗圃组培苗人工接种松针褐斑病菌孢子悬浮液 用喷雾器将制备好的浓度为3×107个/mL的松针褐斑病菌孢子悬浮液均匀喷在所选植株上,至针叶开始有水流动为止;然后盖上塑料薄膜,间歇向袋中喷清水保湿降温5 d,防止中午温度过高,在接种植株上方搭建荫棚。以2%蔗糖无菌水为对照。每个处理3个重复,每个重复3~4株苗。接种45 d统计感病率和感病指数。孢子悬浮液滴于凹面载玻片上分别置于苗圃薄膜棚内和室温下,统计孢子萌发率分别约为32%和27%。
1.3 感病率和感病指数统计 每天观察组培苗及针叶的发病情况;当针叶开始发病、普遍发病时,统计各无性系的感病指数和感病率。湿地松组培苗感病分级标准[5]见表1,针叶感病分级标准[6]见表2。试验结果数据采用Excel整理、SPSS软件分析。
感病指数=∑(各级别代表值×该级别株数)×100/总株数×发病最重级代表数值
感病率(%)=(感病株数/接种株数)×100

表1 湿地松组培苗感病分级标准

表2 针叶感病分级标准
2 结果与分析
2.1 湿地松瓶内组培苗的抗病性比较
2.1.1 不同家系间的抗病性比较 供试湿地松组培苗不同家系间抗病性差异显著,抗病性强弱依次为8#,32#,普通组培苗。普通组培苗的感病率和感病指数均明显高于两个抗病家系,其中8#家系抗病性又明显高于32#。感病率在4,7 d时,不同家系间差异分别都显著(图1)。
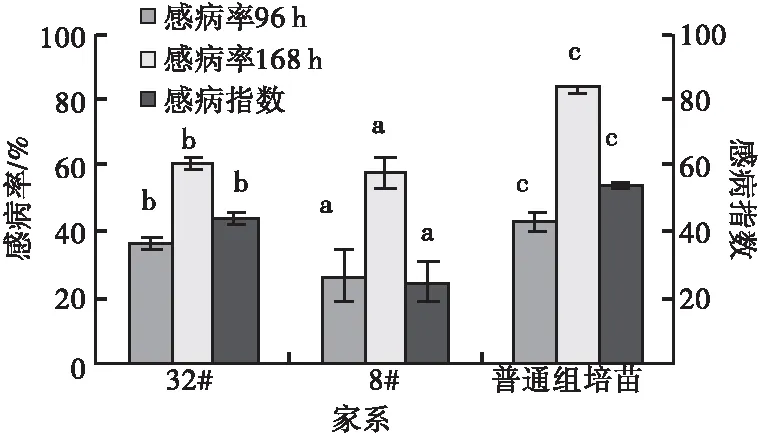
图1 松针褐斑病菌毒素处理湿地松瓶内组培苗后的感病指数和感病率比较
2.1.2 同一家系不同无性系间的抗病性比较 湿地松瓶内组培苗同一家系不同无性系对毒素的反应差异明显,不同无性系的抗病性差异显著。8#的3个无性系中,8#40抗性最强,感病指数仅为15,明显低于8#11的感病指数30,比8#2的感病指数低12.5。8#40在7 d时感病率为50%,比最高值8#11的感病率低了12.5%,尽管8#2和8#11在初期的感病率差异不显著,但是在7 d时8#40、8#2、8#11的感病指数和感病率之间差异均分别显著(P<0.05)(图2)。

图2 松针褐斑病原菌毒素处理湿地松瓶内组培苗后同一家系的感病指数和感病率比较
2.1.3 所测无性系的抗病性比较 湿地松瓶内组培苗经松针褐斑病菌毒素处理后,4个抗病无性系均比普通组培苗抗病性强,其中8#40抗性最强,第7天统计的感病指数仅为15,感病率也低于普通组培苗33.33%,各无性系抗病性强弱依次为8#40,8#2,8#11,32#3,普通湿地松组培苗(图3,4,5)。

图3 松针褐斑病菌毒素处理湿地松瓶内组培苗后的感病指数和感病率比较

图4 松针褐斑病菌毒素处理湿地松瓶内组培苗前

图5 松针褐斑病菌毒素处理湿地松瓶内组培苗第7天
2.2 湿地松温室组培苗不同无性系的抗病性比较 松针褐斑病菌毒素处理湿地松温室组培苗针叶4 d时,32#7和32#3的感病率差异不显著,但在7 d时,32#7感病率比32#3低30%,且都明显高于普通组培苗,可见抗病性都显著高于普通组培苗(图6)。抗病性由强到弱为32#7,32#3,普通组培苗。
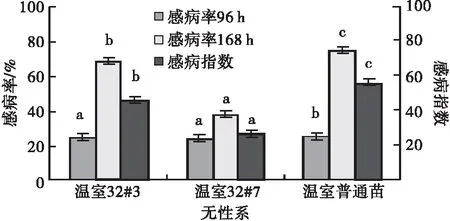
图6 松针褐斑病菌毒素处理温室湿地松组培苗针叶后不同无性系的感病率和感病指数
2.3 苗圃湿地松组培苗的抗病性比较
2.3.1 普通组培苗不同代数间的抗病性比较 人工接种松针褐斑病菌孢子悬浮液20 d时,普通组培苗1~3代有2株发现病斑,4~6代有2株发病,有1株发病较重,7~9代有2株发病。接种45 d时,普通组培苗4~6代、1~3代均有1株基部发病严重,但是新叶未发病。普通组培苗1~3代、4~6代都对松针褐斑病孢子入侵反应迅速,但是4~6代在后期抗病性比1~3代强,感病指数及感病率都明显低于1~3代和7~9代;7~9代尽管前期反应慢,但后期感病迅速,感病率达到了100%,感病指数也高达55.6,明显高于1~3代和4~6代。由此可知,普通组培苗4~6代的抗病性大于1~3代,大于7~9代(图7,8)。
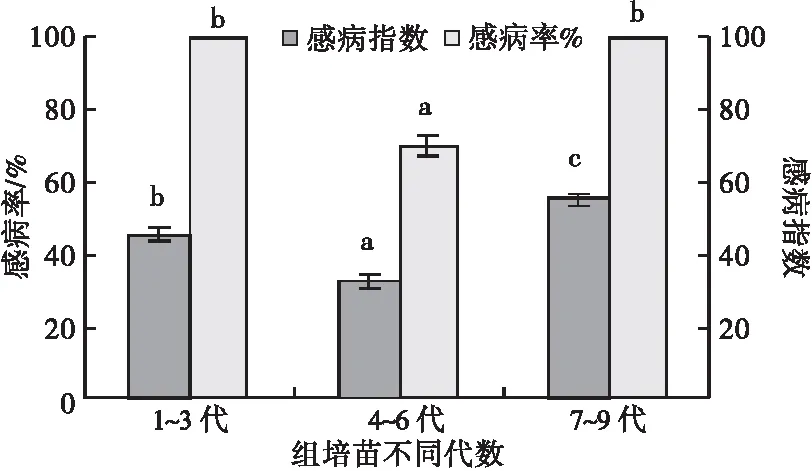
图7 苗圃普通湿地松组培苗不同代数间的感病指数和感病率比较

图8 苗圃湿地松普通组培苗人工接种孢子悬浮液45 d不同代数的感病情况
2.3.2 组培苗与实生苗间的抗病性比较 人工接种松针褐斑病菌孢子悬浮液20 d时,8#、32#家系实生苗没有表现出症状,普通实生苗个别有病斑,有2株苗各有1个病斑;45 d时,实生苗无论是抗病的还是普通的,感病率均较高,32#家系实生苗有6株严重感病,8#家系实生苗和普通实生苗分别有3株感病严重;说明实生苗在接种前期比较耐病,发病比组培苗慢,但是在后期抗病性却不及组培苗。同期组培苗的抗病性大于实生苗,8#、32#、普通实生苗的感病率均达到了100%,而普通组培苗只有70%。抗病家系的组培苗与其他家系差异显著,感病率明显低于其他家系,仅为25%。就感病指数分析,实生苗抗病性显著低于8#抗病家系组培苗和普通组培苗(图9,10)。各家系的抗病性强弱依次为8#组培苗,普通组培苗,8#实生苗,普通实生苗,32#实生苗。
2.3.3 组培苗同一家系不同无性系的抗病性比较 人工接种松针褐斑病菌孢子悬浮液20 d时,8#8有1株有少许病斑,8#4有2株有少许病斑。同一家系不同无性系间抗病性差异显著,接种45 d时,8#4只有3株感病,8#4的其它植株均未感病或感病很轻,感病率仅为12.5%,感病指数也仅为3.1,属于高抗无性系。8#8感病指数和感病率显著高于8#4,但也分别仅为9.38、37.5%,两者的抗病性都强于普通组培苗(图11,12)。
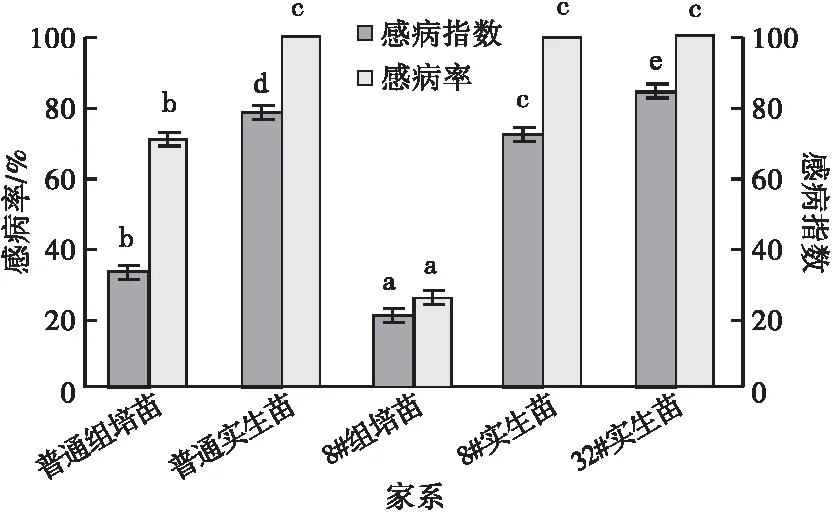
图9 苗圃湿地松组培苗与实生苗的感病指数和感病率比较

图10人工接种松针褐斑病菌孢子悬浮液45d时苗圃湿地松组培苗与实生苗的感病情况
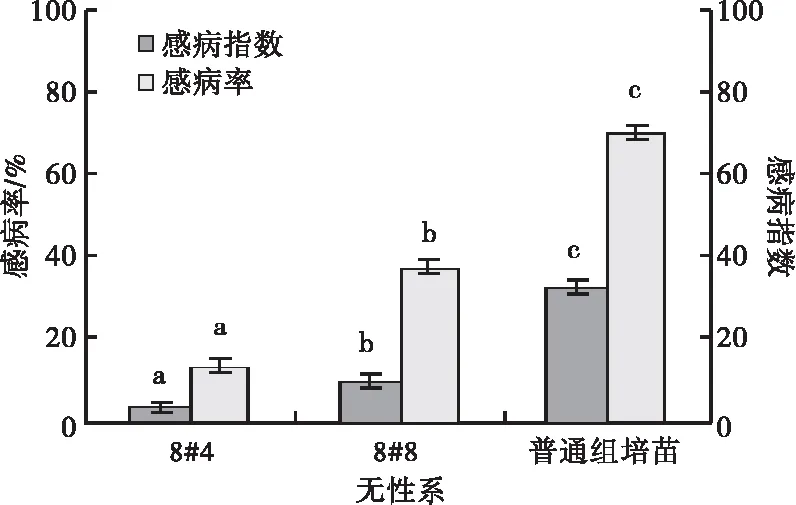
图11 苗圃湿地松组培苗不同无性系的感病指数和感病率比较

图12 人工接种松针褐斑病菌孢子悬浮液45 d湿地松不同无性系的感病情况
2.4 瓶内组培苗与温室苗圃组培苗抗病性测定结果的相关性 以瓶内湿地松组培苗毒素处理的感病指数为X,以温室湿地松组培苗针叶感病指数为Y1,通过对CK、普通组培苗、32#3的感病指数进行单元回归分析,得回归方程:Y1=1.049X+0.105 5,r2=0.999 7。以瓶内毒素处理的感病指数为X,以苗圃感病指数为Y2,通过对CK、普通组培苗、8#的感病指数进行单元回归分析,得回归方程:Y2=0.593 2X+2.124 8,r2=0.958 8。说明瓶内组培苗的抗病性测定结果在一定程度上与室外的测定结果相关。
3 结论与讨论
强化抗病育种是发展集约人工林的迫切需要,把育种目标转移到降低营林成本的抗性育种和材质改良方面,保证人工林的生物学稳定性,真正实现高产、优质和高效[7]。抗病家系子代能否像亲本那样表现出高度的抗病性还得经子代抗病性测定才能确定。为准确评价某一材料的抗性,不仅要用将来大批量造林地区的菌系接种该材料,而且接种用菌系的取样也要充分[7]。本研究的结果与安会翠 等[5]的研究结果一致,不同家系的抗病性差异显著,同一家系不同无性系的抗病性差异也显著,组培苗代数不同抗病性也存在差异。蒋继宏 等[8]用松针褐斑病菌致病毒素处理不同抗性湿地松无性系针叶的结果与人工接种病原菌的结果存在高度相关,14种松树的抗病性测定也基本上能表达它们原来的抗病性。曾义[9]用病原菌孢子人工接种和毒素粗提液生测的方法测定湿地松不同无性系的抗病性,两种测定结果高度相关(相关系数0.8),说明用毒素进
行抗病性筛选有一定可靠性。在瓶内测定抗病性低的32#3,温室针叶测定结果抗性也低,在瓶内测定抗病性强的8#2与戴培培[10]在温室测定的结果,及本研究苗圃测定的结果一致,抗病性较强。通过单元回归分析表明湿地松组培苗在瓶内与温室、苗圃进行抗病性测定具有一定的相关性,相关系数r2分别为0.999 7和0.958 8,但是由于试验材料有限,数据有限,因而只能说在一定程度上可以用瓶内抗病性测定替代室外抗病性测定,要得到更为精确地相关性分析,还需要进行更多无性系的回归分析试验。
参考文献:
[1] 叶建仁,韩正敏,李传道,等.湿地松抗褐斑病无性系种子园营建技术研究[J ].南京林业大学学报(自然科学版,1991,15(2):23-29.
[2] 何月秋.湿地松抗病家系组培繁殖技术研究[D].南京:南京林业大学,2003.
[3] 朱丽华,张艺,吴小芹.湿地松的组织培养及植株再生[J].南京林业大学学报(自然科学版),2004,28(6):47-51.
[4] 程方,叶建仁,刘戈,等.松针褐斑病菌毒素处理后湿地松组培苗PAL、PPO、SOD活性变化研究[J].林业科学研究,2012,25(4):521-525.
[5] 安会翠,叶建仁,吴小芹,等.湿地松子代组培苗对松针褐斑病的抗性测定[J].南京林业大学学报(自然科学版),2012,36(3):9-12.
[6] 黄向东,易正凡.松针褐斑病接种试验研究[J].湖南林业科技,1998,25(3):17-19.
[7] 马常耕.国际林木抗病育种的基本经验[J].世界林业研究,1995(4):14-21.
[8] 蒋继宏,李传道.湿地松对松针褐斑病的抗性测定[J].南京林业大学学报(自然科学版),1995,19(3):37-41.
[9] 曾义.湿地松抗松针褐斑病子代抗病性的研究[D].南京:南京林业大学,2000.
[10]戴培培.湿地松组培快繁体系优化及再生植株性状表现[D].南京:南京林业大学,2008.
