盐度胁迫对大竹蛏成活率与抗氧化酶活性的影响
2018-06-29陈爱华吴杨平姚国兴
张 雨, 陈爱华, 曹 奕, 吴杨平, 姚国兴, 王 超,2
(1.江苏省海洋水产研究所,南通 226007;2.连云港市海洋与渔业发展促进中心,连云港 222044)
盐度作为水环境的一个重要理化因子,与水生动物的生长发育、渗透调节、繁殖孵化、能量代谢、免疫防御等生理过程密切相关[1-3]。当生物受到盐度的胁迫时,机体会产生一系列的生理应激反应[4],进而引发具有氧化性的活性氧ROS的瞬间过量产生[5]。对机体自身产生包括破坏细胞膜结构,降解DNA等的损害[6]。超氧化物歧化酶(SOD)具有特殊的生理活性,是生物体内清除自由基的首要物质。它可对抗与阻断自由基氧化过程中留下的有害成分对细胞造成的损害,并及时修复受损细胞[7]。过氧化氢是氧化酶催化的氧化还原反应中产生的细胞毒性物质,会对机体造成损害,过氧化氢酶(CAT)能够催化过氧化氢分解为水和氧气,可对细胞起保护作用,使机体免受过氧化氢的危害,是防御系统的关键酶之一[8-9]。SOD和CAT是机体防御过氧化损害系统中的两个关键酶,其能有效地消除活性氧,防止细胞膜系统过氧化作用的发生。抗氧化防御系统的成分可由于氧化污染的胁迫而发生改变,抗氧化酶的活性可能会发生增加或抑制两种应激改变,一方面取决于遭受胁迫的强度和时间,另一方面与遭受胁迫的生物种类的敏感性有关[10]。许多研究表明当生物受到不利因素胁迫时,其自身的抗氧化酶活性会发生显著变化[11-13]。
大竹蛏(SolengrandisDunker) 隶属瓣鳃纲,异齿亚纲,帘蛤目,竹蛏科,竹蛏属,广泛分布于我国沿海各地,生活在潮下带至-20 m水深的浅海区,是我国重要的经济贝类。近年来,关于大竹蛏在生物学[14-15]、环境因子对稚贝影响[16]、滤水率[17]、分子生物学[18-19]以及大规模生产性人工繁育技术[20]等方面的基础研究已有相关报道。但关于盐度胁迫下大竹蛏体内生理响应机制的研究目前尚不多见。本研究分析了大竹蛏在不同盐度胁迫下的存活状况以及不同盐度对抗氧化酶活力的影响,探索大竹蛏对低盐的耐受范围,以期丰富大竹蛏的生理生态学基础理论,为大竹蛏养殖技术研究提供基础数据和理论依据。
1 材料与方法
1.1 实验材料
本实验所用大竹蛏为江苏省南通吕四海域自然群体,平均壳长为(68.28±2.46) mm。实验前暂养于江苏省海洋水产研究所吕四基地,暂养海水盐度为28。暂养期间,持续微充气,每天换水1 次,换水量为养殖水体的1/2,以湛江叉鞭金藻(Dicrateriazhanjiang)、亚心形扁藻(Platymonassubcordiformis)和绿色巴夫藻(Pavlovaviridis)为主要饵料进行投喂,每日投喂2次,投喂间隔12 h。
1.2 实验设计
实验于2016年5月在江苏省海洋水产研究所吕四基地进行。实验设置盐度为10、16、22、28、34、40和46共7个盐度梯度 ,各盐度海水由自来水加盐卤配制而成。实验期间水温保持在18.8~21.4 ℃,pH值7.8~8.6,水中溶解氧6.2~7.2 mg·L-1。每个盐度梯度处理设置3个平行。实验在70 cm×60 cm×50 cm 的塑料水槽中进行,每个水槽放50个大竹蛏,塑料槽预先铺有15 cm厚的海沙。大竹蛏暂养后直接转到已配好预设盐度的塑料槽中,实验期间的养殖管理与暂养期间一致,实验开始阶段各组投喂量相同,随后根据各组稚贝生长和数量的变化进行适当调整,以保持水体藻细胞密度一致。实验开始后分别于3 h、6 h、12 h、24 h、48 h和96 h 记录各组大竹蛏行为、体征和存活情况,并在各采样时间点于每组中随机取出4个,用于抗氧化酶的测定。
1.3 样品处理与酶活性测定
将大竹蛏去壳取其鳃丝、外套膜和肝胰腺,经预冷的磷酸盐缓冲液(PBS: 氯化钠8.0 g,氯化钾0.2 g,磷酸氢二钠2.9 g,磷酸二氢钾0.2 g,蒸馏水1 000 mL,pH 7.2)涮洗后,于-80 ℃冻存。待所有样品取完后,统一化冻,用于酶活测定。采集的组织化冻后剪碎,加入其组织重量9倍的PBS,用匀浆器冰浴研磨匀浆。鳃丝和外套膜匀浆液于4 ℃ 3 500 r·min-1条件下离心10 min,取上清;肝胰腺匀浆液于4 ℃ 3 500 r·min-1条件下离心10 min,上清液再于4 ℃ 8 000 r·min-1条件下离心10 min,取中层液(上层为油脂,下层为组织碎片液);用于抗氧化酶活性测定。
酶活性均采用南京建成试剂盒检测,相应操作参照说明书进行。SOD 活性单位定义为每毫克组织蛋白在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为1个活性单位;CAT 活性单位定义为每毫克组织蛋白每秒钟分解1 μmol 的H2O2的量为一个活性单位。组织蛋白含量的测定采用考马斯亮蓝G-250 法(Bradford,1976),以牛血清白蛋白为标准蛋白绘制标准曲线,根据组织蛋白的OD590 nm的吸光值和标准曲线,计算出组织蛋白的含量(mg·mL-1)。
1.4 存活率的计算
在实验开始后分别计算3 h、6 h、12 h、24 h、48 h和96 h时各个试验组的存活率,存活率=存活个体/个体总数×100 %。大竹蛏死亡界定:用针刺激大竹蛏足部,1 min内无反应即视为死亡。
1.5 数据分析
文中数据均以平均值±标准差(Mean±SD)表示,用Excel 2003作图。使用SPSS 17.0进行统计分析,采用单因素方差(ANOVA)分析显著性,使用LSD检验,显著水平为P<0.05。
2 结果与分析
2.1 不同盐度胁迫下大竹蛏的反应
盐度为46时,大竹蛏在3 h内不潜沙,体色发黑,足僵直呈伸展状态,处于一种近乎麻痹状态,不活泼;6 h开始出现死亡,24 h全部死亡。盐度为40时,大竹蛏不活跃,体色发黑,足僵直呈伸展状态,96 h出现死亡。盐度为22~34时,大竹蛏实验期间无异常。盐度为16时,大竹蛏在实验开始阶段,无明显异常,随着实验的进行,3 h后大竹蛏蛏体潜沙较浅而有半截暴露在水中,至96 h时出现死亡个体,死亡的个体壳张开,足自然伸展,软体部分呈水肿状,有别于高盐胁迫下死亡个体的体征。盐度为10时,大竹蛏在实验开始阶段即表现出不适应,不潜沙,足呈伸展状态,极度不活泼。3 h至12 h,大量大竹蛏不潜沙,至24 h时出现死亡。死亡的个体壳张开,足自然伸展,软体部分呈水肿状。48 h出现大量死亡,96 h全部死亡。
2.2 不同盐度胁迫下大竹蛏存活率的情况
由图1可见,盐度为10时,大竹蛏24 h存活率为(94.74±5.27)%,48 h存活率仅为(20±5.77)%,96 h则全部死亡。盐度为16时,大竹蛏96 h出现死亡,存活率为(86.67±3.34)%。盐度为22~34时,大竹蛏96 h内存活率为100%。盐度为40时,大竹蛏96 h出现死亡,存活率为(76.67±8.81)%。盐度为46时,大竹蛏12 h开始出现死亡,存活率为(80.95±10.91)%,至24 h已全部死亡,存活率为0。可见适合大竹蛏存活的海水盐度在22~34。
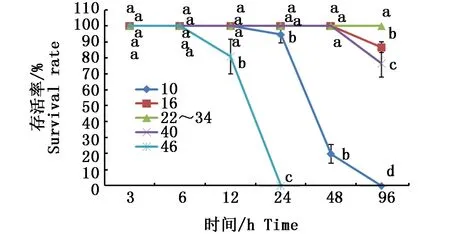
图1 各盐度下大竹蛏的存活率情况Fig. 1 The survival of Solen grandis under different salinity stresses注:同一采样时间点字母不同表示处理间差异显著(P<0.05)Note:Different letters at the same time mean significant differences among different salinity treatments (P<0.05)
2.3 各盐度下大竹蛏的不同组织的过氧化氢酶(CAT)活力
由图2可见,盐度为16时,大竹蛏外套膜、鳃、肝胰腺组织中CAT活力在0-6 h无显著变化,6 h时各组织的CAT活力均有显著升高,其中肝胰腺的CAT活力为(15.84±2.13) U·mg-1prot,外套膜的CAT活力为(6.7±0.84) U·mg-1prot,鳃的CAT活力为(1.05±0.27) U·mg-1prot。而后,各组织的CAT活力渐渐降至平稳水平。盐度为22时,CAT活力3 h出现了峰值。肝胰脏的CAT活力为(8.54±1.34) U·mg-1prot,外套膜的CAT活力为(6.26±0.88) U·mg-1prot,鳃的CAT活力为(2.83±0.46) U·mg-1prot。12 h后,各组织CAT活力渐渐降至平稳水平。盐度28时,大竹蛏96 h各组织CAT活力基本维持稳定。盐度34时,大竹蛏96 h各组织CAT活力有小幅波动,在3 h和24 h出现小的峰值,其它时间中基本维持稳定。盐度为40时,大竹蛏各组织CAT活力在3 h时达到峰值,其中肝胰腺的CAT活力为(12.59±2.24) U·mg-1prot,外套膜的CAT活力为(14.66±3.21) U·mg-1prot,鳃的CAT活力为(1.88±0.17) U·mg-1prot。96 h各组织CAT活力渐渐降低,其中肝胰脏的CAT活力为(3.82±0.33) U·mg-1prot,外套膜的CAT活力为(3.04±0.51) U·mg-1prot,鳃的CAT活力为(0.40±0.13) U·mg-1prot,远低于正常水平。
对不同组织CAT活力进行比较,发现各盐度试验组的CAT活力以肝胰腺最高,外套膜次之,鳃最低。盐度为16的试验组中,肝胰腺的CAT活力显著高于其它组织(P<0.05),外套膜48 h前的CAT活力显著高于鳃(P<0.05),48 h后则无显著性差异。而在其它试验组中,鳃的CAT活力均显著低于其它组织(P<0.05),而外套膜的CAT活力则与肝胰腺相近,在盐度为40试验组3 h CAT活力出现了高于肝胰脏的情况。
2.4 各盐度下大竹蛏的不同组织的超氧化物歧化酶(SOD)活力
各盐度下大竹蛏不同组织的超氧化物歧化酶(SOD)活力的变化情况见图3。盐度为16时,大竹蛏的SOD活力在实验过程中变化幅度较大。3 h和12 h时,SOD活力均较其它时间有明显降低,24 h至96 h则稳定在较高水平。盐度为22时,大竹蛏SOD活力变化平缓,6 h和24 h时有小幅下降,其它时间维持稳定水平。盐度为28时,大竹蛏96 h内各组织SOD活力基本维持稳定。盐度为34时,大竹蛏SOD活力12 h达到最高值,其中肝胰腺的SOD活力为(63.80±10.32) U·mg-1prot,外套膜的SOD活力为(44.63±8.36) U·mg-1prot,鳃的SOD活力为(17.72±6.14) U·mg-1prot,12 h至24 h SOD活性维持在较高水平,48 h至96 hSOD活性则接近初始水平。盐度为40时,3 h时SOD活性迅速升高出现峰值。肝胰腺的SOD活力为(57.09±13.34) U·mg-1prot,外套膜的SOD活力为(36.90±8.62) U·mg-1prot,鳃的SOD活力为(16.14±6.23) U·mg-1prot,随后显著降低,至96 h时,肝胰腺的SOD活力为(10.63±2.91) U·mg-1prot,外套膜的SOD活力为(12.71±2.64) U·mg-1prot,鳃的SOD活力为(4.92±0.98) U·mg-1prot,达到最低。
对不同组织的SOD活力进行比较分析,发现各盐度试验组的SOD活力高低排序同CAT活性排序结果一样,即肝胰腺﹥外套膜﹥鳃。在不同盐度试验组中,鳃的SOD活力均显著低于其它组织(P<0.05),而外套膜的SOD活力虽略低于肝胰腺,但并无显著性差异(P﹥0.05)。
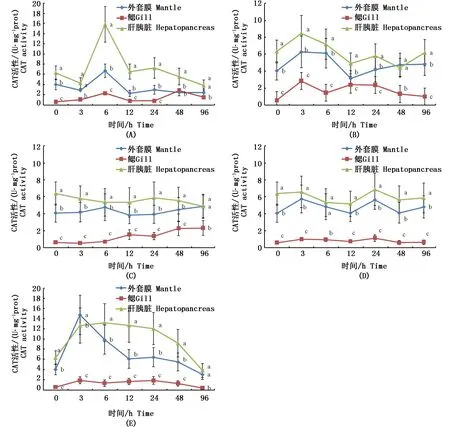
图2 各盐度下大竹蛏的CAT活性变化Fig. 2 CAT activity dynamics under different salinity stresses注:(A)盐度16下CAT; (B)盐度22下CAT; (C)盐度28下CAT; (D)盐度34下CAT (E)盐度40下CAT;同一采样时间点字母不同表示处理间差异显著(P<0.05)Note: (A) CAT activity under salinity 16; (B) CAT activity under salinity 22; (C) CAT activity under salinity 28; (D) CAT activity under salinity 34; (E) CAT activity under salinity 40; Different letters at the same time mean significant differences among different salinity treatments (P<0.05)
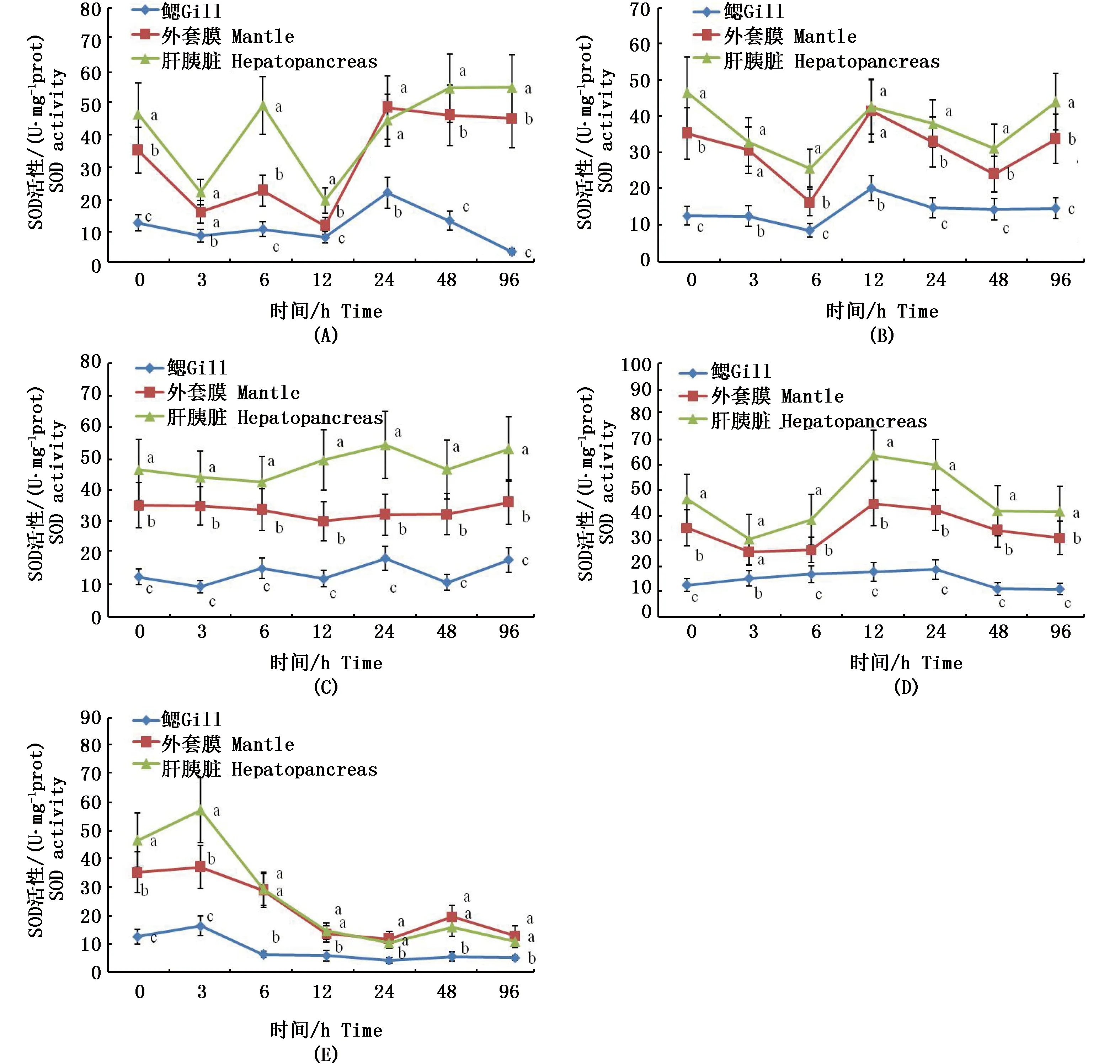
图3 各盐度下大竹蛏的SOD活性变化Fig. 3 SOD activity dynamics under different salinity stresses注:(A)盐度16下SOD; (B)盐度22下SOD; (C)盐度28下SOD; (D)盐度34下SOD; (E)盐度40下SOD;同一采样时间点字母不同表示处理间差异显著(P<0.05)Note: (A) SOD activity under salinity 16; (B) SOD activity under salinity 22; (C) SOD activity under salinity 28; (D) SOD activity under salinity 34; (E) SOD activity under salinity 40; Different letters at the same time mean significant differences among different salinity treatments (P<0.05)
3 讨论
3.1 大竹蛏对盐度耐受性
盐度对贝类的生理代谢活动有着重要影响。当环境盐度超过其所适应的范围时,机体会进行调节。当盐度胁迫超过贝类自身生理调节所能承受的范围时,其生理活动就会出现紊乱,进而死亡[21]。自然界的大竹蛏生活在潮下带至水深20 m的浅海区,生活区域的海水环境受到雨水、河口淡水冲击小,海水的盐度相对稳定,使得大竹蛏对盐度适应范围窄,属于窄盐性贝类。综合本实验结果可见,大竹蛏较适宜的盐度范围约为 22~34。这与陈爱华等[16]的研究结果基本一致,接近海洋贝类墨西哥湾扇贝(Argopectenirradiansconcentricus)的23.6~35.7[22],施獭蛤(Lutrariasieboldii)稚贝的19.8~33.8[23],有别于河口贝类文蛤(Meretrixmeretrix)的7.3~38.7[24]。本实验显示,当大竹蛏受到低盐胁迫时,其不潜沙或潜沙浅,蛏体松弛,足呈伸展态,活跃度低;解剖死亡的大竹蛏时,发现肝胰腺肿大,色泽发白,体内组织液增多。当大竹蛏受到高盐胁迫时,其不潜沙体色发黑,足僵直而呈伸展态,处于一种近乎麻痹状态,活跃度低;解剖死亡大竹蛏时,发现软体部分收缩,肝胰腺色泽变深。
本研究表明大竹蛏属于窄盐性贝类,对低盐和高盐均存在不适应性。一般情况下,大竹蛏的养殖环境遭遇盐度突然升高的可能性小,而遭遇低盐的可能性较大。因为多雨易引起海水盐度的大幅度波动,特别是暴雨季节,短时间内大量淡水的注入导致海水盐度迅速下降,可能造成稚贝大量死亡。因此,在大竹蛏育苗过程中要密切关注盐度变化情况,遇到连续雨天时要提前蓄水。在大竹蛏养殖池塘选址时,应选择盐度较稳定的区域以减少盐度变化给大竹蛏养殖造成的损失。
3.2 不同盐度对大竹蛏抗氧化酶的影响
已有研究表明,肝胰腺是贝类免疫的主要功能器官,贝类外套膜分泌的粘液亦有抑制和杀灭病原体的作用[25],鳃在贝类受到外界盐度胁迫时并具有重要调节作用,而抗氧化酶在生物体的自我保护系统中起着至关重要的作用,在免疫系统中也极为重要。
许多研究表明,生物在遇到不利因素胁迫时,抗氧化酶的活性可能会发生增加或抑制两种应激改变。李子牛等[26]在研究青蛤(Cyclinasinensis)在不同盐度海水中SOD和CAT活性的变化情况时发现,青蛤受盐度胁迫时其抗氧化酶的波动基本于胁迫后的24 h内完成,青蛤对低盐胁迫的耐受性高于高盐环境;盐度高于35时青蛤抗氧化酶波动剧烈,其活性水平反应免疫系统的活动情况。庄平等[27]以点篮子鱼(Siganusguttatus)为对象,研究其在盐度胁迫下SOD、CAT的活性变化趋势,发现受到盐度胁迫后酶活性均呈现出不同程度的先升高后降低的变化趋势。郑萍萍等[28]探索了三疣梭子蟹(Portumustrituberculatus)在高盐和低盐胁迫下免疫系统的变化情况。结果表明,在短时的高盐和低盐胁迫下SOD和CAT活力均随时间呈现有升有降的变化趋势。姜令绪等[29]在探讨盐度、温度、金属离子等环境因子胁迫对甲壳类动物的抗氧化酶活力的影响时发现酶活力与取样时间、胁迫强度等因素均有相关关系。
本研究表明,盐度为28的实验组CAT、SOD活性趋于平缓,变化起伏小,说明在该盐度下,机体的生理活动正常,不需要免疫系统进行过多的调节。盐度为16时,CAT活力在6 h出现峰值,这可能与机体免疫系统在低盐胁迫时进行应答有关;SOD活性则波动较大,96 h时仍维持在较高水平;大竹蛏在盐度为16时,96 h出现死亡。表明盐度16已超出其自身所能调节的范围,生理活动处于紊乱状态,进而出现死亡。盐度为40时,CAT、SOD活性在3 h时出现升高,说明此时大竹蛏免疫系统对高盐胁迫做出反应,然后两种酶活力慢慢降低,至96 h时降至低于初始水平,说明胁迫强度过大时,会抑制免疫酶活力。不同组织的抗氧化酶活性比较结果表明,各盐度下大竹蛏CAT及SOD活性均为肝胰腺﹥外套膜﹥鳃。这也验证了肝胰腺在贝类免疫中起着主要作用。除盐度为16时肝胰腺的CAT活力显著高于外套膜 (P<0.05)外,其它盐度下外套膜的CAT及SOD活力与肝胰腺相比虽略低,但并未出现显著性差异(P﹥0.05)。这说明随着盐度的升高,外套膜在贝类免疫调节过程中所起的作用得到了显著的加强。
参考文献:
[1] PECHENIK J A, BERARD R, KERR L. Effects of reduced salinity on survival, growth, reproductive success, and energetics of the euryhaline polychaete Capitella sp. I[J]. Journal of Experimental Marine Biology & Ecology, 2000, 254(1): 19-35.
[2] TALBOT T D, LAWRENCE J M. The effect of salinity on respiration, excretion, regeneration and production in Ophiophragmus filograneus, (Echinodermata: Ophiuroidea)[J]. Journal of Experimental Marine Biology & Ecology, 2002, 275(1): 1-14.
[3] 王桂忠,林淑君,林琼武,等.盐度对锯缘青蟹幼体存活与生长发育的影响[J].水产学报,1998,22(1):89-92.
WANG G Z, LIN S J, LIN Q W,etal. Effects of salinity on survival and development of the mud crabscyllaserrata[J]. Journal of Fisheries of China, 1998, 22(1):89-92.
[4] CHOI C Y, AN K W, AN M I. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder (Paralichthysolivaceus)[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 2008, 149(3): 330-337.
[5] HOLMBLAD T, SÖDERHLL K. Cell adhesion molecules and antioxidative enzymes in a crustacean, possible role in immunity[J]. Aquaculture, 1999, 172(1): 111-123.
[6] XING J, LIN T, ZHAN W. Variations of enzyme activities in the haemocytes of scallopChlamysfarreriafter infection with the acute virus necrobiotic virus (AVNV)[J]. Fish & Shellfish Immunology, 2008, 25(6): 847-852.
[7] MCCORD J M, FRIDOVICH I. Superoxide dismutase an enzymic function for erythrocuprein(hemocuprein)[J]. Journal of Biological Chemistry, 1969, 244(22): 6049-6055.
[8] 张坤生,田荟琳.过氧化氢酶的功能及研究[J].食品科技,2007,32(1):8-11.
ZHANG K S, TIAN H L. Research and function of catalase in organism[J]. Food Science and Technology,2007,32(1):8-11.
[9] 方允中,李文杰.自由基与酶[M].北京:科学出版社,1989:267-271.
FANG Y Z, LI W J. Free radicals and enzyme[M].Beijing: Science Press,1989:267-271.
[10] 童 燕.盐度、pH和捕捞胁迫对施氏鲟(Acipenserschrenckii)生理生化影响的初步研究[D].上海:华东师范大学,2007.
TONG Y. The study on physiological and biochemical responds ofAcipenserschrenckiito the stresses of ambient salinity,pH and capture[D]. Shanghai: East China Normal University,2007.
[11] PIPE R K, COLES J A. Environmental contaminants influencing immune function in marine bivalve molluscs[J]. Fish & Shellfish Immunology, 1995, 5(95): 581-595.
[12] 马洪明,刘晓伟,麦康森,等.盐度突降对栉孔扇贝(Chlamysfarreri)抗病力指标的影响[J].高技术通讯,2006,16(7):746-751.
MA H M, LIU X W, MAI K S,etal. Effects of abrupt salinity decline on anti-disease ability of scallopChlamysfarreri[J]. Chinese High Technology Letters, 2006, 16(7):746-751.
[13] YU J H, SONG J H, CHOI M C,etal. Effects of water temperature change on immune function in surf clams,Mactraveneriformis(Bivalvia: Mactridae)[J]. Journal of Invertebrate Pathology, 2009, 102(1): 30-35.
[14] 肖国强,柴雪良,邵艳卿,等.大竹蛏的繁殖生物学[J].海洋科学,2009,33(10):21-25.
XIAO G Q, CHAI X L, SHAO Y Q,etal. The reproductive biology ofSolengrandisDunker[J].Marine Sciences,2009,33(10):21-25.
[15] 吴杨平,陈爱华,姚国兴,等.大竹蛏生物学特性的初步研究[J].水产科学,2011,30(12):764-767.
WU Y P, CHEN A H, YAO G X,etal. Biological characteristics ofSolengrandisDunker[J]. Fisheries Science,2011,30(12):764-767.
[16] 陈爱华,张志伟,姚国兴,等.环境因子对大竹蛏稚贝生长及存活的影响[J].上海海洋大学学报,2008,17 (5):559-563.
CHEN A H, ZHANG Z W, YAO G X,etal. The influence of different environmental factors on the growth and survival rate of juvenile of bamboo clamSolengrandis[J].Journal of Shanghai Fisheries University,2008,17(5):559-563.
[17] 吴杨平,陈爱华,姚国兴,等.大竹蛏稚贝滤水率的研究[J].海洋科学,2011,35(1):6-9,43.
WU Y P, CHEN A H, YAO G X,etal. The filtration rate of juvenileSolengrandisDunker[J].Marine Sciences,2011,35(1):6-9,43.
[18] 张志伟,陈爱华,张志勇,等.大竹蛏5个野生群体遗传多样性的微卫星分析[J].中国水产科学,2015(4):740-748.
ZHANG Z W, CHEN A H, ZHANG Z Y,etal. Microsatellite analysis of genetic diversity of five wild populations ofSolengrandis(Dunker). [J].Journal of Fishery Sciences of China , 2015(4):740-748.
[19] 曹 奕,吴洪喜,陈爱华,等.我国沿海大竹蛏(Solengrandis)野生群体及增殖放流群体遗传多样性的ISSR分析[J].海洋与湖沼,2015,46(6):1398-1404.
CAO Y, WU H X, CHEN A H,etal. ISSR analysis on genetic diversity of stock and wildSolengrandispopulations along coastal areas of China[J].Oceanol Et Limnologia Sinica,2015,46(6):1398-1404.
[20] 陈爱华,姚国兴,张志伟.大竹蛏生产性人工繁育试验[J].海洋渔业,2009,31(1):66-72.
CHEN A H, YAO G X, ZHANG Z W,etal. Studies on artificial propagation ofSolengrandisDunker in pilot scale[J].Marine Fisheries,2009,31(1):66-72.
[21] 尤仲杰,陆彤霞,马 斌,等.盐度对墨西哥湾扇贝幼虫和稚贝生长存活的影响[J].动物学杂志,2003,38(3):58-60.
YOU Z J, LU T X, MA B,etal. Effect of seawater salinity on the growth and survival ofArgopectenirradiansconcentricuslarvae and juveniles[J].Chinese Journal of Zoology, 2003,38(3):58-60.
[22] 刘志刚,刘建勇,王 辉,等. 墨西哥湾扇贝稚贝盐度适应性的研究[J].湛江海洋大学学报,2006,26(6):12-16.
LIU Z G, LIU J Y, WANG H,etal. Study on adaptability of juveniles ofArgopectenirradiansconcentricusSay to salinity[J]. Journal of Zhanjiang Ocean University, 2006,26(6):12-16.
[23] 尚 攀,刘志刚,冯小龙.盐度对施獭蛤稚贝存活及生长的影响[J].广东海洋大学学报,2014,34(4):45-49.
SHANG P, LIU Z G, FENG X L,etal. Study on juveniles ofLutrariasieboldii′s adaptability to salinity[J]. Journal of Guangdong Ocean University,2014,34(4):45-49.
[24] 曹伏君,刘志刚,罗正杰.海水盐度、温度对文蛤稚贝生长及存活的影响[J].应用生态学报 ,2009,20(10):2545-2550.
CAO F J, LIU Z G, LUO Z J. Effects of seawater temperature and salinity on growth and survival of juvenileMeretrixmeretrixLinnaeus[J]. Chinese Journal of Applied Ecology,2009,20(10):2545-2550.
[25] 梁建光,王宜艳,孙虎山.栉孔扇贝外套膜过氧化物酶和酚氧化酶的电镜细胞化学研究[J].鲁东大学学报:自然科学版,2007,23(1) :80-83.
LIANG J G, WANG Y Y, SUN H S. The electron microscopic cytochemistry study of peroxidase and phenoloxidase in the muntle ofChlamysfarreri[J]. Ludong University Joumal (Natural Science Edition),2007,23(1):80-83.
[26] 李子牛,林听听,么宗利,等.盐度对青蛤抗氧化酶活性及生长的影响[J].生态学杂志,2012,31(10):2625-2630.
LI Z N ,LIN T T,YAO Z L,etal. Effects of water salinity on the antioxidant enzyme activities and growth of clamCyclinasinensis[J]. Chinese Journal of Ecology,2012,31(10):2625-2630.
[27] 庄 平,王 妤,章龙珍,等. 盐度骤降对点篮子鱼存活率及肝脏抗氧化酶活性的影响[J]. 复旦学报:自然科学版,2011,50(3):366-372.
ZHUANG P, WANG Y, ZHANG L Z,etal. The effects of ambient salinity decrement on survival and the activity of antioxidant enzymes in livers ofSiganusguttatus[J]. Journal of Fudan University (Natural Science),2011,50(3):366-372.
[28] 郑萍萍,王春琳,宋微微,等.盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J].水产科学,2010,11(29):634-638.
ZHENG P P, WANG C L, SONG W W,etal. Effect of salinity stress on serum non-specific immune factrors in swimming crabPortunustrituberculatus. [J]. Fishries Science, 2010, 11 (29):634-638.
[29] 姜令绪.环境因子对甲壳动物免疫力和抗氧化酶活力的影响[D].青岛:中国海洋大学,2004.
JIANG L X. Effects of environmental factors on the immune activity and antioxidant enzyme activity[D]. Qingdao: China Ocean University, 2004.
