缢蛏快长选育系早期生长性状的遗传参数估计
2018-06-29薛宝宝李炼星李家乐牛东红沈和定
李 浩, 薛宝宝, 李炼星, 李家乐, 牛东红, 沈和定
(上海海洋大学,省部共建水产种质资源发掘与利用教育部重点实验室,水产科学国家级实验教学示范中心,水产动物遗传育种中心上海市协同创新中心,上海 201306)
缢蛏(Sinonovaculaconstricta)俗称蛏子、泥蛏或蜻,属于软体动物门,双壳纲,竹蛏科,缢蛏属,在我国沿海各地均有分布,属于广温广盐性海产双壳类(Bivalvia),其味道鲜美、营养价值高、生长快、产量高,具有重要的经济价值[1-3]。缢蛏人工育苗始于上世纪九十年代初,亲贝多来自频繁的近亲繁殖,未经遗传改良。频繁的近交导致其存活率、生长速度、抗病力等性状下降[4]。随着沿海经济的高速发展,滩涂养殖环境污染日趋严重。在内外因素的双重压力下,亟需对缢蛏群体进行遗传改良。运用选择、杂交等遗传育种方式,培育具有生长快、抗逆性强、成活率高等优良性状的养殖新品系,已经成为缢蛏人工养殖业的迫切需求。用不同育种方式的结合,增加优良性状和性效应在后代中的比例,从而达到快速改良性状的目的,在贝类遗传改良中已经取得一定成效。如:罗会等[5]对三亚、越南、深圳3个群体的合浦珠母贝(Pinctadafucafa)进行完全双列杂交,获得具有生长优势的杂交组合;葛建龙等[6]以长牡蛎(Crassostreagigas)壳金品系为基础群体,对其生长性状(壳高)进行定向育种,选择组壳高均大于对照组,通过群体选育与选择育种方式选育的“东优一号”杂色鲍(Halioticdiversicolor),在生长速率、存活率等方面均表现出显著性优势[7];在相同养殖条件下,通过对不同养殖群体的海湾扇贝(Argopectaensirradians)进行杂交并结合群体选育技术培育的扇贝“渤海红”,一龄贝平均体质量显著提高[8]。本实验室从2008年9月起一直以2.063的选择强度对浙江乐清群体进行连续选择获得缢蛏快长选育系,其在壳长、存活率等生长性状均显著大于未经选择逐年繁殖的乐清群体(P<0.05)[9],为评估缢蛏快长选育新品系选择性状(壳长)稳定遗传能力,对其进行遗传参数估计。
遗传力是反映性状遗传能力大小的重要参数,在育种值估计、选择指数确定、选择反应预测、选择方法比较以及育种规划决策等方面都起着十分重要的作用[10]。目前,对海湾扇贝[11]、长牡蛎[12]、紫贻贝(Mytilusedulis)[13]、马氏珠母贝[14]、九孔鲍(Haliotisdiversicoloraquatili)[15]、虾夷扇贝(Patinopectenyessoensis)[16]、文蛤(Meretrixmeretrix)[17]等贝类都有关于遗传参数估计的报道,而尚未见缢蛏生长性状遗传参数估计的研究。因此,本实验以缢蛏快长选育系成熟个体为亲贝,通过平衡巢氏设计建立7个半同胞和14个全同胞家系,利用二因素系统分组的方差分析以及协方差分析对缢蛏快长选育系幼贝60日龄、90日龄和150日龄早期生长性状进行遗传估计,旨在为缢蛏快长选育系保种以及快长性状进一步改良提供理论依据与技术指导。
1 材料与方法
1.1 实验设计
亲贝来源于本实验室培育的缢蛏快长选育系个体。选取300个贝壳完整无损伤、体质强壮、性腺发育良好的个体进行室内人工催产。在亲贝产卵排精时,挑选7个雄性和14个雌性个体,分别放入不同的烧杯中,待各个亲贝排完精卵后,采用COMSTOCK等[18]建立的巢氏交配设计,按一雄配两雌的交配方式,将适量精卵倒入盛有过滤海水600 L的白桶中混合均匀完成受精,共构建缢蛏选育系群体的7个半同胞家系和14个全同胞家系。
1.2 幼虫、稚贝及幼贝培育
受精卵经过约24 h孵化,消化系统发育完成,以湛江叉鞭金藻(Dicrateriazhanjiangensis)为开口饵料进行投喂,1 d后投喂湛江叉鞭金藻与牟氏角毛藻(Chaeroeerosmoelleri)的混合藻液,具体投喂量视幼虫肠胃饱满和食物消化情况而定。受精后约15d左右由浮游幼虫转变为底栖生活的稚贝,及时投放底质,为附着的稚贝提供必需的生活条件,同时投喂牟氏角毛藻(Chaeroeerosmoelleri)、亚心型扁藻(Platymonassubcordiformis)及假微型海链藻(Thalassiosirapseudonana)的混合藻液,投喂量视稚贝肠胃饱满和食物消化情况而定。为保证环境对幼虫及稚贝培育阶段影响的一致性,各个家系的水温、海水密度、pH等环境条件保持一致。稚贝经过50 d室内白桶培育,综合饵料供应、换水量、稚贝生长等情况,由室内白桶培育转为室外土池培育。在2亩大小的土池中,整理成长14 m、宽1 m的蛏埕,并将其分成14块1 m2的小蛏埕,按相同的密度将稚贝均匀撒于埕田,同时在每个埕田上铺设隔离网以防止各个家系混合。60日龄、90日龄和150日龄时,从每个家系随机选取30个个体,测量各个家系壳长(SL)、壳高(SH),精确到0.01 mm。
1.3 数据分析
壳长、壳高数据的方差分析及协方差分析使用 SPSS 22.0软件的一般线性模型(General line model,GLM)。数据分析前对所有参数进行正态化检验(Kolmogorov-Smirnov)。双因素系统分组的方差分析及协方差分析的数学模型为:
Yijk=μ+si+dij+eijk
式中,Yijk表示某性状第K个个体的生长指标,μ表示总体均值,si表示第i个雄性效应,dij表示第i个雄性内第j个个体的雌性效应,eijk表示随机误差变量。全同胞资料表型变量的方差组成如表1所示,全同胞资料表型变量间协方差组成如表2所示。
1.4 遗传参数计算
根据全同胞资料作两因素系统分组方差分析,可得到3个遗传力的估计值[19],即:
hS2=4σS2/(σS2+σD2+σe2)
hD2=4σD2/(σS2+σD2+σe2)
hSD2=2(σS2+σD2)/(σS2+σD2+σe2)
式中,hS2、hD2、hSD2分别为父系半同胞、母系半同胞和全同胞估计的狭义遗传力,σS2、σD2、σe2分别为父系半同胞、母系半同胞和全同胞个体间方差。
遗传相关系数由以下公式计算:
rS=σxy(S)/(σx(S)·σy(S))
rD=σxy(D)/(σx(D)·σy(D))
式中,rS、rD、r(S+D)分别为父系半同胞、母系半同胞和全同胞个体间估计的遗传相关,由于后两个估计值受显性效应和母体效应影响较大,相比之下第一个估计值较为无偏,因此,采用第一个公式计算性状间的遗传相关系数作为结果[20]。
表型相关的计算公式为:
rP=σxy(P)/(σx(P)·σy(P))
2 结果与分析
2.1 缢蛏幼贝不同日龄不同性状生长参数
60日龄、90日龄及150日龄缢蛏幼贝不同生长性状参数见表3。缢蛏幼贝不同日龄壳长、壳高变异系数范围为0.098~0.519,两性状参数变异系数随时间延长具有相同的递减趋势;其中壳高的变异的变异范围为0.192~0.519,相对于壳长的变异范围0.098~0.329较大,说明相同环境条件下,壳高相对壳长具有更大的选择潜力。
2.2 不同日龄缢蛏幼贝生长性状方差分析与协方差分析
不同日龄缢蛏幼贝生长性状的方差分析和协方差分析见表4和表5。结果表明, 60 日龄、90 日龄及150 日龄缢蛏壳长与壳高两性状的雄间方差和雄内雌间方差的F检验均具有极显著性差异(P<0.01);不同日龄壳长与壳高的雄间协方差和雄内雌间协方差均存在极显著性差异(P<0.01)。这些结果具有统计学意义,可以进行缢蛏生长性状遗传参数估计。

表1 全同胞家系表型变量组成的方差分析Tab.1 Variance analysis for components of phenotypic variation of full-sib families
注:s为雄性亲本数,d为每一个雄性亲本所配雌性亲本数,k为每一个雌性亲本的后代个数,σS2为父系半同胞方差,σD2为母系半同胞方差,σe2为全同胞个体间方差
Note:sis the number of sires;dis the number of dams;kis the number of progenies of every dam;σS2is the variance for sire half-sibs;σD2is the variance for dam half-sibs;σe2is the variance for the full-sibs

表2 全同胞家系表型变量组成的协方差分析Tab.2 Covariance analysis for components of phenotypic variation of full-sib families
注:s为雄性亲本数,d为每一个雄性亲本所配雌性亲本数,k为每一个雌性亲本的后代个数,covS(x,y)为父系半同胞协方差,covD(x,y)为母系全同胞协方差,cove(x,y)为后代全同胞个体间协方差
Note:sis the number of sires;dis the number of dams; k is the number of progenies of every dam,covS(x,y) is the covariance of sire half-sibs,covD(x,y) is the covariance of dam half-sibs,cove(x,y) is the covariance of full-sibs
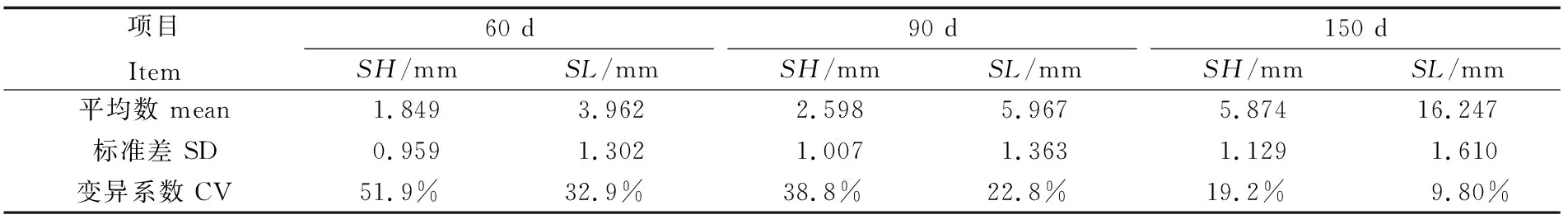
表3 缢蛏幼贝不同日龄壳长、壳高生长参数Tab.3 Shell length and shell height of S. constricta at spat stage of different ages
注:变异系数为标准差与平均数的比值
Note: Coefficient of variation is the ratio of standard deviation to mean
2.3 表型变量的原因方差组分和表型变量间的协方差组分
缢蛏幼贝不同日龄壳长与壳高的方差分析以及两者之间的协方差分析按照构成表型变量原因的组分进行分解,获得表型变量原因方差组分和协方差组分(表6,表7)。方差和协方差均具有来自父系半同胞、母系半同胞、全同胞个体间三个因素的方差组分和协方差组分。由于母性效应和显性效应的存在,母系半同胞方差以及协方差均大于父系半同胞,因此,采用父系半同胞相关法获得的遗传力估计值可以作为不同日龄缢蛏幼贝生长性状遗传力的无偏估计值。
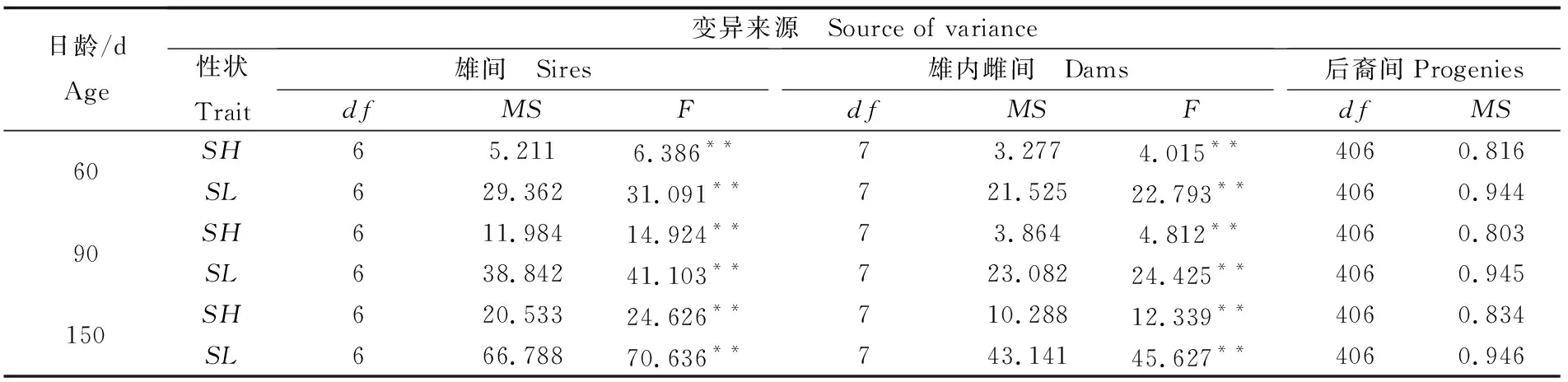
表4 缢蛏幼贝不同日龄生长性状表型变量组成的方差分析Tab.4 Variance analysis for components of phenotypic variation of S. constricta at spat stage of different ages
注:SL为壳长,SH为壳高,df为自由度,MS为均方,F为均方比,**表示组间F检验差异性极显著 (P<0.01)
Note:SLmeans shell length,SHmeans shell height,dfmeans degree of freedom,MSmeans mean square,Fmeans F-value.**indicates that the differences between groups have statistical significances(P<0.01)

表5 缢蛏幼贝不同日龄生长性状表型变量组成的协方差分析Tab.5 Covariance analysis for components of phenotypic variation of growth traits in S. constricta at spat stage of different ages
注:df为自由度,MP为均积,F为均积比,**表示组间F检验差异性极显著 (P<0.01)
Note:dfmeans degree of freedom,MPmeans mean product,Fmeans F-value.**indicates that the differences between groups have statistical significances(P<0.01)

表6 缢蛏幼贝不同日龄表型变量原因的方差组分Tab.6 Causal components of phenotypic variance of S. constricta at spat stage of different ages
注:SH为壳高,SL为壳长
Note:SHmeans shell height,SLmeans shell length
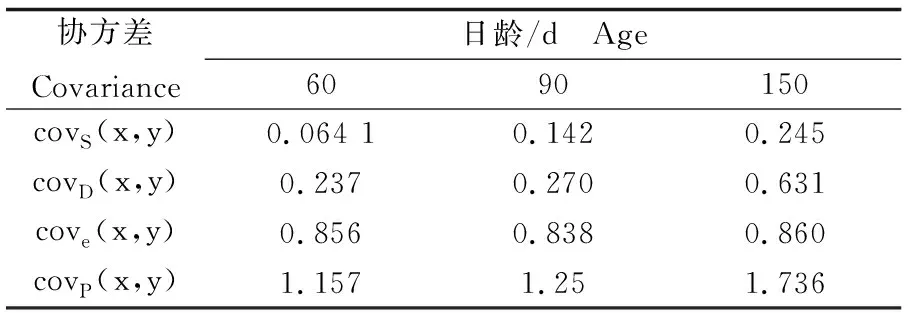
表7 缢蛏幼贝不同日龄表型变量原因协方差组分Tab.7 Components of phenotypic variance of S. constricta at spat stage of different ages
2.4 不同日龄缢蛏幼贝生长性状的遗传力估计
根据表6父系半同胞、母系半同胞和全同胞组分的方差组分,对不同日龄缢蛏幼贝生长性状的遗传力进行估计(表8),60日龄和150日龄幼体的壳长和壳高以及90日龄幼体的壳长遗传力估计值中,母系半同胞遗传力估计值最大,全同胞遗传力估计值次之,父系半同胞遗传力估计值最小。90日龄幼体壳高遗传力估计值中,父系半同胞遗传力估计值最大,全同胞遗传力估计值次之,母系半同胞最小。 60日龄缢蛏幼贝壳长和壳高遗传力分别为0.139~0.353、0.298~1.558;90日龄缢蛏贝体壳长和壳高遗传力分别为0.392~0.519、0.541~1.517;150日龄缢蛏幼贝壳长和壳高遗传力分别为0.518~0.955、0.574~2.049。
2.5 不同日龄缢蛏幼贝生长性状间表型相关和遗传相关估计
根据表6和表7中父系半同胞方差组分和协方差组分以及表型方差组分和协方差组分估计60日龄、90日龄和150日龄缢蛏壳长-壳高遗传相关和表型相关(表9),遗传相关系数分别为0.980、0.755、0.942,表型相关系数分别为0.910、0.882、0.912,均为正相关(P<0.05)。
3 讨论
3.1 缢蛏幼贝不同日龄生长性状遗传力的估算依据
遗传力是选择改良性状时的重要遗传参数,是进行育种目标取舍、个体遗传评定以及选择指数计算的重要依据[21],在数量遗传学中起着十分重要的作用。采取合适的方法对遗传力进行无偏估计,保证其结果的准确性,对遗传育种工作具有重要意义。遗传力估计的方法有回归法、全同胞(或半同胞)相关法和利用群体选育法估计。由于具备半同胞数量多、生活环境相似、估算结果准确等优点,国内外广泛使用全同胞(或半同胞)相关法进行遗传力估计。NEWKIRK[22]估计6日龄和16日龄美洲牡蛎(Crassostreavirginica)幼虫的半同胞遗传力分别为0.39和0.50,全同胞遗传力分别为0.51和0.60;LOOSE[23]估计美洲牡蛎7 日龄、14日龄和21日龄幼虫壳长的半同胞遗传力分别为0.44、0.40和0.55;利用巢式平衡设计,邓岳文[24]估计皱纹盘鲍(Haliotisdiscushannai)10日龄、20日龄和30日龄壳长的半同胞遗传力为0.232~0.365、全同胞遗传力为0.175~0.747;利用全同胞组内相关法,宋传文等[25]估计紫贻贝2、3、5、6月龄幼体的壳高和壳长半同胞遗传力分别为0.29~0.87和0.27~0.87,全同胞遗传力分别为1.52~1.62和1.36~1.65;郑怀平[26]利用巢式平衡设计估计了“中科红”海湾扇贝在1日龄、10日龄和40日龄时壳长和壳高的半同胞遗传力分别为0.439~0.639和0.433~0.539,全同胞遗传力分别为0.325~0.432和0.268~0.433。本实验对缢蛏快长选育系60日龄、90日龄和150日龄壳长、壳高遗传力进行估计,其中60日龄、150日龄幼贝壳长和壳高的遗传力估计以及90日龄幼贝壳长的遗传力估计中,母系半同胞遗传力最大,全同胞次之,父系半同胞最小;而在90日龄壳高遗传力估计中,父系半同胞遗传力最大、全同胞次之、母系半同胞最小,以上结果表明以半同胞或者全同胞资料为基础估计的遗传力存在差异。一般认为,基于全同胞资料和母系半同胞资料估计的遗传力,未能剔除显性效应和母性效应[27-28],所以相比之下较真实值偏高。但是在90日龄幼贝壳高遗传力估计中,父系半同胞遗传力估计值(0.519)大于母系半同胞遗传力估计值(0.392),可能是因为在连续的选择育种过程中,实验所用亲贝之间具有一定的亲缘关系,父系间生长性状差异增加,而每一个父本下的母系间生长性状差异下降,从而导致父系半同胞遗传力估计值大于母系半同胞。KANIS等[29]发现虹鳟(Oncorhynchusmykiss)母系效应显著影响母系半同胞遗传力估计;“中科2号”海湾扇贝1日龄幼贝壳长的遗传估计中,父系半同胞方差组分1.761大于母系半同胞方差组分1.655,鉴于父系半同胞未受母性效应影响,采用父系半同胞对遗传力进行估计更为合理[30]。同样运用父系半同胞组内相关法,本实验计算出60日龄、90日龄和150日龄缢蛏快长选育系幼贝壳长和壳高的遗传力分别为0.298~0.574和0.139~0.519。根据张沅等[31]把h2<0.15划为低遗传力,0.15

表8 缢蛏幼贝不同日龄生长性状的遗传力Tab.8 The narrow sense heritabilities of different growth traits of S. constricta at spat stage of different ages

表9 缢蛏幼贝不同日龄生长性状间的遗传相关和表型相关Tab.9 Genetic and phenotypic correlations of growth traits of S. constricta at spat stage of different ages
3.2 双壳类幼贝不同生长性状间的遗传相关及表型相关
生物在长期的进化演变过程中,基因连锁和基因多效性引起了遗传相关。在遗传育种实践中,优良性状的选育可以采取直接选择的方式获得,但对于一些无法通过直接方式进行选择而获得的性状,可以利用较高的遗传相关通过间接方式获得[20]。协方差分析将方差分析与线性相关结合起来,对性状间相互关联的变异程度进行度量,是数量遗传学中重要的组成部分。本实验研究60日龄、90日龄和150日龄缢蛏快长选育系幼贝壳长与壳高之间表型相关与遗传相关,继得到缢蛏快长选育系幼贝3个日龄的壳长-壳高表型相关为0.882~0.912,与缢蛏稚贝时期壳长-壳高的表型相关0.861~0.971[32]基本一致;壳长-壳高的遗传相关系数为0.755~0.980,为显著性正相关(P<0.05)。因此,直接或间接以壳长或壳高作为选择标准进行选育,均能达到较好改良缢蛏快长选育群体生长性状的效果。长牡蛎幼体不同生长时期壳长-壳高的遗传相关随着生长进行逐渐降低[12],马氏珠母贝早期生长性状的遗传相关随着日龄的增大而逐渐降低[33],而缢蛏快长选育系幼贝3个日龄壳长-壳高遗传相关分别为0.980、0.755、0.942,呈现先降低后升高的趋势,出现这一现象的原因可能是同一性状在不同环境条件下遗传相关可能存在比较大的差异[10],缢蛏幼贝由室内人工养殖移入室外土池养殖,生活环境的改变造成遗传相关产生较大变异,从而出现90日龄壳长-壳高遗传相关降低幅度较大。鉴于遗传相关随个体生长变化而变化的趋势,缢蛏快长选育系群体的选育宜在缢蛏幼体早期进行,以壳长或者壳高为指标,均能不同程度的提高缢蛏个体的生长性状。
参考文献:
[1] 刘 博,邵艳卿,滕爽爽,等.缢蛏(SinonovaculaconstrictaLamarck) EST-SSR分布特征[J]. 海洋与湖沼,2012,43(1):132-137.
LIU B, SHAO Y Q, TENG S S,etal. Characterization,development and utilization of EST-derived microsatellites inSinonovaculaconstricta[J]. Oceanologia Et Limnologia Sinica,2012,43(1):132-137.
[2] 吕昊泽,刘 健,陈锦辉,等. 盐度对缢蛏超氧化物歧化酶和过氧化氢酶活性的影响[J]. 海洋渔业,2013,35(4):474-478.
LV H Z, LIU J, CHEN J H,etal. Effects of salinity on activities of SOD and CAT inhepatopancreas ofSinonovaculaconstricta[J]. Marine Fisheries,2013,35(4):474-478.
[3] 刘广丰,陈 慧,沈和定,等. 不同微藻对缢蛏稚贝摄食和生长的影响[J]. 上海海洋大学学报,2009,36(1):44-47.
LIU G F, CHEN H, SHEN H D,etal. Effects of different microalgae on ingestion and growth of juvenile razor clamSinonovaculaconstricta[J]. Journal of Shanghai Ocean University,2009,36(1):44-47.
[4] 王兴强,曹 梅,阎斌伦. 缢蛏(SinonovaculaconstrictaLamarck)养殖期间发病原因及防治对策[J]. 现代渔业信息, 2006, 21(5):13-16.
WANG X Q, CAO M, YAN B L. Analysis of diseases cause and prevention measures infarming ofSinonovaculaconstricta(Lamarck)[J]. Modern Fisheries Information,2006,21(5):13-16.
[5] 罗 会,刘金锁,黄桂菊,等. 合浦珠母贝完全双列杂交组合生长性状比较[J]. 海洋渔业,2016,38(6):645-652.
LUO H, LIU J S, HUANG G J,etal. Comparison of growth traits inPinctadafucataforcompletediallel crosses groups[J]. Marine Fisheries,2016,38(6):645-652.
[6] 葛建龙,李琪,于 红,等. 长牡蛎壳金选育群体生长性状的选择效应[J]. 水产学报,2016,40(4):612-617.
GE J L, LI Q, YU H,etal. Selection response in mass selection of golden shell Pacific oyster (Crassostreagigas)[J]. Journal of Fisheries of China,2016,40(4):612-617.
[7] 游伟伟,骆 轩,王德祥,等.“东优 1 号”杂色鲍及其亲本群体的形态特征和养殖性能比较[J]. 水产学报,2010,34(12):1837-1843.
YOU W W, LUO X, WANG D X,etal. Comparisons of morphological characteristics and grow-out performancein new variety”Dongyou No.1”and its parental populations of small abaloneHaliotisdiversicolor[J]. Journal of Fisheries of China,2010,34(12):1837-1843.
[8] 王春德,刘 博,马 斌,等. 扇贝“渤海红”[J]. 中国水产,2016(8):72-77.
WANG C D, LIU B, MA B,etal.Argopectenirradians“Bohaihong”[J].China Fisheries,2016(8):72-77.
[9] 李炼星,李 浩,杜文俊,等. 缢蛏选育系F5的生长优势比较及育种效应分析[J]. 中国水产科学,2017,24(1):50-56.
LI L X, LI H, DU W J,etal. Growth comparison and selective breeding of a fifth-generation selected line ofSinonovaculaconstricta[J]. Journal of Fishery Sciences of China,2017,24(1):50-56.
[10] FALCONER D S, MACKAY T F C. 数量遗传学导论第4版[M]. 北京:中国农业科技出版社,2000.
FALCONER D S,MACKAY T F C. Introduction to quantitative genetics(4th edition)[M]. Beijing:Chinese Agriculture Press,2000.
[11] CRENSHAW J W, HEFFERNAN P B, WALKER R L. Effects of growth out density on heritability of growth rate in the northern quahogMercenariamercenaria(Linnnaaeus,1758)[J]. Journal of Shellfish Research,1996(15):341-344.
[12] 王庆志,李 琪,刘士凯,等. 长牡蛎幼体生长性状的遗传力及其相关性分析[J]. 中国水产科学,2009,16(5):736-743.
WANG Q Z, LI Q, LIU S K,etal. Estimates of heritabilities and genetic correlations for growth inCrassostreagigaslarvae[J]. Journal of Fishery Sciences of China,2009,16(5):736-743.
[13] MALLET A L, FREEMAN K R,DICKIE L M. The genetics of production characters in the blue musselMytilusedulis. I. A preliminary analysis[J]. Aquaculture,1986,57(1-4):133-140.
[14] 邓岳文,符 韶,杜晓东,等. 马氏珠母贝选系F2早期选择反应和现实遗传力估计[J]. 广东海洋大学学报,2008,28(4):27-29.
DENG Y W, FU S, DU X D,etal. Response to selection and realized heritability for early growth in the second-generation selected line of pearl oysterPinctadamartensii[J]. Journal of Guangzhou Ocean University,2008,28(4):27-29.
[15] 胡志国,刘建勇,蒋 湘,等. 九孔鲍生长性状的遗传力及其相关性分析[J]. 广州大学海洋学报,2014,34(1):54-59.
HUO Z G, LIU J Y, JIANG X,etal. Estimates of Heritabilities and Genetic Correlations for Growth inHaliotisdiversicolorsupertexta[J]. Journal of Guangzhou Ocean University,2014,34(1):54-59.
[16] LIANG J, ZHANG G, ZHENG H. Divergent selection and realized heritability for growth in the Japanese scallop,PatinopectenyessoensisJay[J]. Aquaculture Research,2010,41(9):1315-1321.
[17] 梁冰冰,王鸿霞. 文蛤早期发育阶段生长形状遗传参数的估计[J]. 海洋科学,2016,40(3):40-46.
LIANG B B, WANG H X. Genetic parameter estimation for growth traits in the early life history ofMeretrixmeretrix[J]. Marine Science,2016,40(3):40-46.
[18] COMSTOCK R E, ROBINSON H F. Estimation of average dominance of genes [M]// GOWEN J W. Heterosis. Ames,IA:Iowa State College Press,1952:494-516.
[19] 顾万春. 统计遗传学[M]. 北京: 科学出版社,2006:282-314.
GU W C. Statistical Genetics[M]. Beijing: Science Press,2006:282-314.
[20] 盛志廉,陈瑶生. 数量遗传学[M]. 北京: 科学出版社,2001.
SHENG Z L, CHEN Y S. Quantitative Genetics[M]. Beijing: Science Press,2001.
[21] 栾 生,孔 杰,张天时,等. 基于表型值和育种值的中国对虾生长,抗逆性状相关分析[J]. 海洋水产研究,2008,29(3):14-20.
LUAN S, KONG J, ZHANG T S,etal. Phenotype and breeding value based correlation analyses of growth andstress-resistance traits inFenneropenaeuschinensis[J]. Marine Fisheries research,2008,29(3):14-20.
[22] NEWKIRK G F. Interaction of genotype and salinity in larvae of the oysterCrassostreavirginica[J]. Marine Biology,1978(48):227-234.
[23] LOOSE E. Influence of heredity on larvae and spat growth inCrassostreavirginica[J]. Proc. World Maricult.Soc.,1978(9):101-108.
[24] 邓岳文. 皱纹盘鲍数量性状遗传与育种[D]. 青岛:中国科学院海洋研究所,2005.
DENG Y W. Studies on quantitative genetics and breeding of Pacific abalone[D]. Qingdao:Institute of Oceandogy,Chinese Academy of Sciences,2005.
[25] 宋传文,闫喜武,桑士田,等. 紫贻贝生长性状的遗传力估计[J]. 水产学报,2013,37(2):201-206.
SONG C W, YAN X W, SANG S T,etal. Estimates for the heritability of growth ofMytilusedulis[J]. Journal of Fisheries of China,2013,37(2):201-206.
[26] 郑怀平. 海湾扇贝两个养殖群体数量性状及壳色遗传学研究[D]. 青岛:中国科学院海洋研究所,2007.
ZHENG H P. Genetic studies of quantitative traits and shell colors in two hatchery stocks of the Bay scallop,Argopectenirradiansirradians[D]. Qingdao:Institute of Oceandogy,Chinese Academy of Sciences,2007.
[27] JONES R,BATES J A,INNES D J,etal. Quantitative genetic analysis of growth in larval scallops(Placopectenmagellanicus)[J]. Marine Biology,1996,124(4):671-677.
[28] SHERIDAN A K. Genetic improvement of oyster production-a critique[J]. Aquaculture,1997,153(3):165-179.
[29] KANIS G, REFSTIE T, GJEDREM T. A genetic analysis of eg, alevin and fry mortality in salmon (Salmosalar), sea trout (Salmotrutta) and rainbow trout (Salmogairdneri)[J]. Aquaculture,1976(8):259-268.
[30] 张守都,李 莉,张国范,等. “中科 2 号”海湾扇贝(Argopectenirradians)幼虫期壳长遗传力的估计[J]. 海洋科学,2016,40(7):54-59.
ZHANG S D,LI L,ZHANG G F,etal. Heritability of larval shell length for Zhongke No. 2 bay scallop (Argopectenirradians)[J].Marine Science,2016,40(7):54-59.
[31] 张 沅. 家畜育种学[M]. 北京:中国农业出版社,2001:37-38.
ZHANG Y. Domestic Animal Breeding[M]. Beijing:Chinese Agriculture Press,2001:37-38.
[32] 李 多,杜文俊,牛东红,等. 缢蛏家系早期生长表现比较[J]. 中国海洋大学学报,2015,45(10):36-41.
LI D,DU W J,NIU D H,etal. Comparison of early growth performance among families ofSinonovaculaconstricta[J]. Periodical of Ocean University of China,2015,45(10):36-41.
[33] 陶后全,吴灶和,白 成,等. 马氏珠母贝早期生长性状的遗传参数估计[J]. 广东海洋大学学报,2014,34(3):10-16.
TAO H Q,WU D H,BAI C,etal. Heritability Estimates for Growth Straits in the Earlier Larva Stage of Pinctada martensii[J]. Journal of Guangdong Ocean University,2014,34(3):10-16.
