人工饲养条件下额外投喂海蜇对银鲳生长及代谢酶活性的影响
2018-06-29赵家兴张晨捷高权新彭士明施兆鸿
赵家兴, 张晨捷, 高权新, 彭士明, 施兆鸿
(1. 中国水产科学研究院东海水产研究所,农业部东海渔业资源开发利用重点实验室,上海 200090; 2. 上海海洋大学水产与生命学院,上海 201306)
银鲳(Pampusargenteus),属鲈形目(Perciformes),鲳科(Stromateidae),鲳属,广泛分布于黄渤海、东海和南海各海区[1],其营养丰富、味道鲜美且无肌间刺,故深受人们喜爱。海蜇(Rhopilemaesculentum)是一种胶质状的浮游动物,体内水分含量极大,海蜇干物质中含有多种必需氨基酸、胶原蛋白、长链多不饱和脂肪酸、奇数碳脂肪酸、糖胺聚糖等生物活性物质[2-4]。目前已知的可摄食水母的鱼类约有一百余种,其中鲳亚目为摄食水母的代表性鱼类,重点以水母为食,对水母具有明显的摄食偏好,其它鱼类主要以部分或者阶段性摄食水母为主[5-6]。已有的研究表明,在银鲳的食物来源中,水母占有较大的比重[7],通过对银鲳多年的养殖生产研究,也已证实银鲳对海蜇等水母表现出明显的摄食偏好(优先、争抢摄食)。现有大量针对银鲳生理、生态学及食性等的研究[7-13],以及针对海蜇营养成分、生态分布、生物活性物质等相关研究[14-18],同时也有银鲳摄食水母的相关报道[19]。然而,银鲳是如何应对海蜇这一高水分、胶状质食物的吸收,其代谢机制方面目前尚未有相关报道。
本实验通过比较分析在人工饲养条件下额外投喂海蜇对银鲳生长、机体组织中主要蛋白和脂类代谢酶活性的影响,以期从机体代谢水平的角度分析银鲳偏好摄食水母的生理基础,为进一步深入揭示银鲳偏好摄食水母的生理机制提供参考依据。
1 材料与方法
1.1 实验材料
实验所用银鲳为人工培育获得的种苗, 选取大小规格相近的银鲳幼鱼为实验对象,平均质量为(6.02 ±1.24)g。实验期间正常投喂所用饲料为自制浆状料(林兼配合饲料∶虾片∶α-淀粉∶鱼油∶复合多维与矿物质=60∶20∶9∶9∶2)
实验用海蜇购自宁德富发水产有限公司,培育期间以卤虫为饵料,培育至伞径2~3 cm后进行投喂实验。
1.2 饲养管理
本实验于2016年6-8月在中国水产科学研究院东海水产研究所福鼎研究中心内的12 m3室内水泥池中进行(6 m3水体),实验周期60 d,期间投喂自制浆状饲料,投喂时放置在饵料台上,每天6∶00、17∶00投喂两次。在此基础上,设置不同额外投喂海蜇频率,分别设定对照组及4个试验组(每次在17∶00投喂约银鲳体质量10%鲜活海蜇,1次/d、1次/3 d、1次/6 d、1次/12 d,各组间额外投喂海蜇频率为唯一变量),上述5组实验投喂组依次标记为O组、A组、B组、C组和D组,每组设置3个平行,每个平行中放置80尾银鲳。采用自然光照周期,养殖用水为沉淀、砂滤后的海水(必要时采取控温措施),水温25~32 ℃,盐度25~30,溶解氧>7 mg·L-1。养殖期间,养殖水体理化指标保持相对稳定,各实验环境保持相同。
1.3 样品采集
分别在实验进行36 d、60 d进行采样。取样前,实验鱼24 h禁食,随机挑选体表无损伤、鳞片完整、活力良好银鲳,每个平行3尾鱼,冷休克法麻醉称量体质量、叉长。无菌注射器自尾静脉取血,采血后,将血液4 ℃静置24 h后,2 500 r·min-1离心10 min取血清。在碎冰上解剖取两侧肌肉和肝组织,-80 ℃保存待测。
1.4 指标检测
成活率(Survival rate,SR, %)=100×(初始尾数-死亡尾数)/初始尾数
增重率(Weight gain rate,WGR, %)=100×[末重(g)-初重(g)]/初重(g)
特定生长率(Specific growth rate,SGR, %/d)=100×[ln末重(g)-ln初重(g)]/饲养天数(d)
血清和肝脏组织中谷丙转氨酶(GPT)与谷草转氨酶 (GOT)的测定方法采用赖氏法,血清中酶活性单位为U·L-1,肝脏中酶活性单位U·gprot-1。
肝脏中谷氨酸脱氢酶 (GDH)采用Elisa 测定试剂盒进行测定,活性单位为ng·mgprot-1。
血清、肝脏和肌肉组织中脂蛋白酯酶 (LPL)的测定方法为比色法,血清中活性单位为U·mL-1,肝脏与肌肉中活性单位为U·mgprot-1。
血清、肝脏和肌肉中脂肪酸合成酶 (FAS)的测定方法为紫外分光光度法,血清中活性单位为ng·mL-1,肝脏与肌肉中活性单位为ng·mgprot-1。
本实验所用试剂盒购自南京建成生物工程研究所,按照试剂盒说明书进行操作。
1.5 统计分析
利用 SPSS 20.0 软件分别对不同实验组实验数据对银鲳各项指标数据进行统计与分析,采用 Duncan 氏法对各组数据进行多重比较,P<0.05为存在显著性差异。用t检验检测36 d取样和60 d取样数据,P<0.05为存在显著性差异。数据均用平均值±标准差( x ± SD)表示。
2 结果与分析
2.1 额外投喂海蜇对银鲳生长性能的影响
在为期60 d的养殖实验中,其生长性能由表1所示。实验各组银鲳存活率均在85%以上,且各组间无显著性差异。36 d与60 d的增重率和特定生长率变化趋势相同,在高频率组均表现出了升高趋势,A组、B组显著高于D组,但C组、D组和O组3组之间并无显著差异。
2.2 额外投喂海蜇对银鲳组织中蛋白代谢相关酶活性的影响
2.2.1 对血清、肝脏组织中GOT和GPT活性影响
实验各组中银鲳样品血清、肝脏组织中 GPT 和 GOT 活性如表 1 所示。由表1可知,不论是36 d时还是 60 d时,额外投喂海蜇的频率对银鲳血清和肝脏组织中 GPT 和 GOT 活性的影响均不显著(P>0.05)。在各组中血清和和肝脏组织中 36 d和 60 d GPT 和 GOT 活性之间都没有显著差异(P>0.05)。

表1 实验各组银鲳生长性能Tab.1 Growth performance of each group
注:同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)
Note: Values in the same row with the same small letter superscripts or no letter superscripts mean no significant difference(P>0.05), with different small letter superscripts mean significant differences (P<0.05)

表2 实验各组银鲳血清、肝脏组织中GPT和GOT活性Tab.2 GPT and GOT activities in serum and liver of each group
2.2.2 对肝脏GDH活性影响
如图1所示,在36 d和60 d时,肝脏GDH活性在高频率组(A组和B组)整体上表现出升高的趋势。在36 d时,B组肝脏GDH活性显著高于C组和O组(P< 0.05),但A组、C组、D组和O组4组间并无显著差异(P>0.05)。60 d时,A组GDH活性最高,C组GDH活性最低,二者之间存在显著差异(P<0.05);B、D、O 3组间无显著差异(P>0.05)。
2.3 额外投喂海蜇对银鲳组织中脂类代谢相关酶活性的影响
2.3.1 对血清、肝脏和肌肉LPL活性影响
由表2可知,36 d时,A组3种组织中LPL活性最高,但各组银鲳3种组织中LPL活性均无显著性差异(P>0.05)。60 d时,A组血清中LPL活性显著高于其它组(P<0.05),且随着额外投喂海蜇频率的降低呈下降趋势,但差异不显著(P>0.05)。各组中,仅A组血清中36 d LPL活性与60 d有显著差异(P<0.05)。

图1 实验各组银鲳肝脏GDH活性Fig.1 GDH activities in liver of each group注:数据柱标注不同小写字母表示36 d时各组间存在显著差异(P<0.05),不同大写字母表示60 d时各组间存在显著差异(P<0.05)Note: Colurmns with different small letters indicate significant differences among groups for 36 d (P<0.05), with different capital letters indicate significant differences among groups for 60 d (P<0.05)
2.3.2 对血清、肝脏和肌肉FAS活性影响
如图2所示, 36 d时,各组银鲳血清、肝脏和肌肉中FAS活性差异不显著(P>0.05)。当实验进行到60 d时,血清FAS活性各组银鲳差异不显著(P>0.05);而肝脏中FAS活性A、B组显著高于C、D组(P<0.05),虽高于O组但无显著差异(P>0.05);肌肉中的FAS活性摄食海蜇的试验组(A组、B组、C组和D组)银鲳显著高于对照组 (P<0.05),同时,D组肌肉中FAS活性也显著高于其它组(P<0.05)。
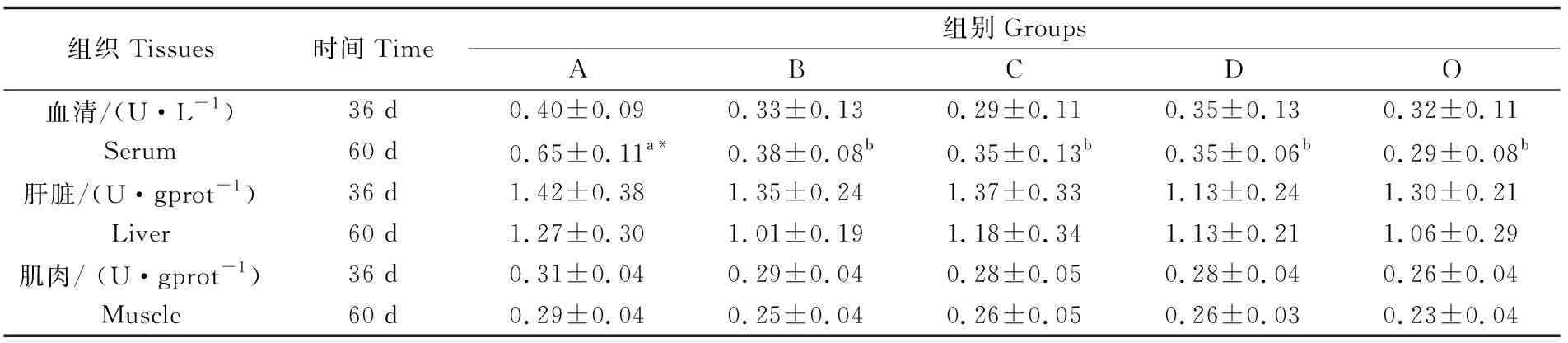
表3 实验各组银鲳血清、肝脏和肌肉组织LPL活性Tab.3 LPL activities in serum, liver and muscle of each group
注:同行数据上标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),*表示36 d与60 d存在显著差异(P<0.05)
Note: Values in the same row with the same small letter superscripts or no letter superscripts mean no significant difference(P>0.05), with different small letter superscripts mean significant differences (P<0.05),*indicates significant differences between 36 d and 60 d(P<0.05)

图2 实验各组银鲳血清、肝脏和肌肉组织FAS活性Fig.2 FAS activities in serum, liver and muscle of each group注:数据柱标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)Note: Columns with the same small letter superscripts or no letter superscripts mean no significant difference(P>0.05), with different small letter superscripts mean significant differences (P<0.05)
3 讨论
3.1 额外投喂海蜇对银鲳生长性能的影响
由于海蜇触手中富含海蜇毒素,过量的海蜇毒素会导致鱼体生理机能受损,甚至死亡[5],本研究结果显示各组间成活率均在85%以上,且各组间并无显著性差异,表明本实验条件下的海蜇投喂量并未对银鲳产生毒素效应。在银鲳养殖中,海蜇可以作为一种优良的辅助食物[19],通过本实验发现,36 d与60 d的增重率和特定生长率变化趋势相同,在高频率额外投喂海蜇组表现出了一定的升高趋势,这说明额外投喂海蜇可在一定程度上提高银鲳的生长性能。海蜇各组织水分均在93%以上[2],本实验条件下额外添加海蜇对各实验饲料中主要常量营养物质的含量影响不大,因此,究竟是海蜇体内哪些微量营养元素对提高银鲳生长性能发挥了作用,后续还需进一步的验证分析。
3.2 额外投喂海蜇对银鲳组织中蛋白代谢相关酶活性的影响
3.2.1 对血清、肝脏组织中GOT和GPT的影响
GPT和GOT为氨基酸代谢过程中不可缺少的转氨酶。GPT(GOT)在 α-酮戊二酸与丙氨酸(天冬氨酸)生成谷氨酸与丙酮酸(草酰乙酸)反应中起转氨基作用[20],GPT和GOT活性变化可以从侧面反映肝细胞损伤。水母类生物的一个显著生物学特征是大多具有刺细胞,含有水母毒素。本实验中,在36 d和60 d时,各试验组银鲳摄食海蜇后与未摄食海蜇的对照组相比,血清和肝脏中GPT和GOT含量并无显著差异。这进一步佐证银鲳摄食海蜇并不会对机体,特别是肝脏和心脏,造成负面影响。GPT和GOT作为转氨酶,其活性反映了机体氨基酸的代谢强度,在机体蛋白质代谢中起着重要作用[21]。已有在大黄鱼(Pseudosciaenacrocear)[22]、斜带石斑鱼(Epinepheluscoioides)[23]等实验表明,当饲料蛋白浓度改变时鱼肝脏GPT和GOT活性也随之改变。本研究结果显示,高频率额外投喂海蜇银鲳肝脏GPT和GOT活性相比较低频率组和对照组均表现出一定的升高趋势,表明额外投喂海蜇可在一定程度上促进银鲳氨基酸代谢,利于其机体的代谢平衡。
3.2.2 海蜇投喂频率对肝脏GDH活性影响

3.3 额外投喂海蜇对银鲳组织中脂类代谢相关酶活性的影响
3.3.1 海蜇投喂频率对银鲳血清、肝脏和肌肉 LPL 活性影响
LPL是动物脂质转运、沉积和新陈代谢的关键酶,能够使动物机体内甘油三酯降解为甘油和游离的脂肪酸,供机体组织储存、利用[28]。LPL活性的高低表明动物机体脂质代谢水平[29]。本研究结果表明,最高频率组(A组)银鲳血清、肝脏与肌肉中LPL活性均为最高,且在60 d时血清LPL活性在额外投喂海蜇组均表现出了一定的升高趋势。表明额外投喂海蜇可在一定程度上促进银鲳对脂质营养的消化吸收。本实验结果中,在最高频率组,36 d与60 d血清LPL活性存在明显差异,表明随着长时间高频率的额外海蜇摄入可提高银鲳血清LPL活性,增强机体脂代谢强度,但短时间内这种作用效果可能不明显。
3.3.2海蜇投喂频率对银鲳血清、肝脏和肌肉FAS活性影响
FAS为内源性脂肪酸合成过程的关键酶,FAS活性大小是衡量鱼体脂肪沉积的重要参数[30],而不同动物的器官和组织中的活性、反应时间和作用机理并不相同[31]。当饲料成分改变时,鱼类体内的FAS活性也适应其变化随之改变,通常需要几周的时间改变FAS活性以适应饲料的改变[32]。本实验中,36 d时各组银鲳3个组织的 FAS活性无显著差别,到实验进行 60 d时,肝脏和肌肉中FAS活性出现明显差异,也印证了上述观点。此外,已有研究证明,鱼类体内FAS活性不仅受摄食中蛋白和脂肪水平影响,还受到脂肪酸成分和其它微量营养元素影响[31,33]。本研究结果显示,60 d时,高频率投喂组肝脏脂FAS活性显著高于低频率投喂组,同时,肌肉组织中,额外投喂海蜇试验组FAS活性均显著高于对照组。额外投喂海蜇对银鲳FAS活性的影响是由海蜇体内的哪些成分所致,还需进一步进行验证。
4 小结
本研究结果得出,人工饲养条件下额外投喂海蜇可在一定程度上提高银鲳的生长性能,组织中蛋白代谢相关酶活性(GPT、GOT和GDH)及脂类代谢相关酶活性(LPL、FAS)在高频率额外投喂海蜇组均呈现出了一定的升高趋势,增强了银鲳体内氨基酸和脂肪酸的代谢效率,从代谢层面提升了银鲳的环境适应能力。通过本实验也进一步证实了海蜇可作为一种人工养殖银鲳比较理想的天然饵料,有助于增强银鲳环境适应能力。本实验条件下, 在银鲳人工养殖过程中,基于生长性能与机体代谢指标的分析,每3天额外投喂一次海蜇较为适宜。
参考文献:
[1] 刘 静, 李春生, 李显森. 中国鲳属鱼类的分类研究[J]. 海洋科学集刊, 2002(44):240-252.
LIU J, LI C S, LI X S. Studies on Chinese pomfret fishes of the genusPampus[J]. Studia Marina Sinica, 2002(44): 240-252.
[2] 张玉莹, 柴彦萍, 秦 磊, 等. 海蜇不同组织营养组成分析及评价[J]. 食品科学, 2017, 38(2):133-138.
ZHANG Y Y, CHAI Y P, QIN L,etal. Analysis and evaluation of the nutrient compositions in different tissues of jellyfish (RhopilemaesculentumKishinouye) [J]. Food Science, 2017, 38(2): 133-138.
[3] 金晓石, 吴红棉, 钟 敏, 等. 海蜇糖胺聚糖提取、纯化及其降血脂作用研究[J].中国海洋药物, 2007, 26(4):41-44.
JIN X S, WU H M, ZHONG M,etal. Study on the extraction and purification of glycosaminoglycans fromRhopilemaesculentaKishinouye and its anti-hyperlipidemia effects [J]. Chinese Journal of Marine Drugs, 2007, 26(4):41-44.
[4] 任国艳, 李八方, 赵 雪, 等. 海蜇头糖蛋白清除自由基活性及构效关系的初步研究[J]. 中国海洋药物, 2008, 27(4):24-29.
REN G Y, LI B F, ZHAO X,etal. Study on the free radical scavenging activities and structure function relationships of glycoprotein from jellyfish (RhopilemaesculentumKishinouye) oral arms [J]. Chinese Journal of Marine Drugs, 2008, 27(4):24-29.
[5] ARAI M N. Predation on pelagic coelenterates: a review [J]. Journal of the Marine Biological Association of the United Kingdom, 2005, 85(3):523-536.
[6] PURCELL J E. Jellyfish and ctenophore blooms coincide with human proliferations and environmental perturbations [J]. Annual Review of Marine Science, 2012, 4(1): 209-235.
[7] 彭士明, 施兆鸿, 尹 飞, 等. 利用碳氮稳定同位素技术分析东海银鲳食性[J]. 生态学杂志, 2011, 30(7):1565-1569.
PENG S M, SHI Z H, YIN F,etal. Feeding habits of silver pomfret (Pampusargenteus) in East China Sea based on stable isotope techniques [J]. Chinese Journal of Ecology. 2011, 30(7):1565-1569.
[8] 徐善良, 王丹丽, 徐继林, 等. 东海银鲳(Pampusargenteus)、灰鲳(Pampuscinereus)和中国鲳(Pampussinensis)肌肉主要营养成分分析与评价[J]. 海洋与湖沼, 2012, 43(4):775-782.
XU S L, WANG D L, XU J L,etal. Analysis and evaluation of nutritional components in muscle ofPampusargenteus,P.cinereusandP.sinensisfrom the East China Sea [J]. Oceanologia Et Limnologia Sinca, 2012, 43(4):775-782.
[9] 赵 峰, 庄 平, 施兆鸿, 等. 银鲳4野生群体肌肉营养成分的比较分析与评价[J]. 动物学杂志, 2009, 44(5):117-123.
ZHAO F, ZHUANG P, SHI Z H,etal. A comparative analysis and evaluation of nutritional components in muscle ofPampusargenteusfrom four wild populations [J]. Chinese Journal of Zoology, 2009, 44(5):117-123.
[10] 李建生, 胡 芬, 严利平. 东海区银鲳资源合理利用的研究[J]. 自然资源学报, 2014, 29(8):1420-1429.
LI J S, HU F, YAN L P. Study on the rational utilization ofPampusargenteusresources in the East China Sea region [J]. Journal of Natural Resources, 2014, 29(8):1420-1429.
[11] HUANG X X, YIN Y Q, SHI Z H,etal. Lipid content and fatty acid composition in wild-caught silver pomfret (Pampusargenteus) brood stocks: Effects on gonad development [J]. Aquaculture, 2010, 310(1-2): 192-199.
[12] ZHAO F, ZHUANG P, SONG C,etal. Amino acid and fatty acid compositions and nutritional quality of muscle in the pomfret, Pampus punctatissimus [J]. Food Chemistry, 2010, 118(2): 224-227.
[13] PENG S M, GAO Q X, SHI Z H,etal. Effect of dietary n-3 LC-PUFAs on plasma vitellogenin, sex steroids, and ovarian steroidogenesis during vitellogenesis in female silver pomfret (Pampusargenteus) brood stock [J]. Aquaculture, 2015(444): 93-98.
[14] 王煦松, 杨祺福, 孙 睿, 等. 海蜇伞部不溶性胶原纤维及酶促溶性胶原蛋白的热稳定性对比研究[J]. 现代食品科技, 2016, 32(6):110-117.
WANG X S, YANG Q F, SUN R,etal. Thermal stability of insoluble collagen fibrils and pepsin-solubilized collagen fromRhopilemaesculentumKishinouye umbrellas [J]. Modern Food Science and Technology, 2016, 32(6):110-117.
[15] 孙 明, 王 彬, 李玉龙, 等. 基于碳氮稳定同位素技术研究辽东湾海蜇的食性和营养级[J]. 应用生态学报, 2016, 27(4):1103-1108.
SUN M, WANG S, LI Y L,etal. Feeding habitats and trophic levels ofRhopilemaesculentumKishinouye in Liaodong Bay based on analyzing carbon and nitrogen stable isotopes [J]. Chinese Journal of Applied Ecology, 2016, 27(4): 1103-1108.
[16] 石晓梅, 孙美玲, 车丽辉, 等. 海蜇生殖腺酶解肽的抗氧化活性和ACE抑制活性研究[J]. 食品工业科技, 2016, 37(1):66-70, 75.
SHI X M, SUN M L, CHE L H,etal. Antioxidative and ACE-inhibitory activity of enzymatic hydrolysates of jellyfishRhopilemaesculentumKishinouye gonad [J]. Science and Technology of Food Industry, 2016, 37(1):66-70, 75.
[17] KHONG N M H, YUSOFF F M, JAMILAH B,etal. Nutritional composition and total collagen content of three commercially important edible jellyfish[J]. Food Chemistry, 2016(196): 953-960.
[18] PUSTLAUL W, PAUL B, GELINSKY M,etal. Jellyfish collagen and alginate: Combined marine materials for superior chondrogenesis of hMSC[J]. Materials Science & Engineering C, 2016(64): 190.
[19] LIU C S, CHEN S Q, ZHUANG Z M. Potential of utilizing jellyfish as food in culturingPampusargenteusjuveniles [J]. Hydrobiologia, 2015, 754(1): 189-200.
[20] 周顺伍, 邹思湘, 姜涌明, 等. 动物生物化学(第三版)[M]. 北京:中国农业出版社, 2003: 156-175.
ZHOU S W, ZOU S X, JIANG Y M,etal. Animal biochemistry (Third edition) [M]. Beijing: China Agriculture Press, 2003: 156-175.
[21] 刘 勇. 蛋白质对幼建鲤生长性能、消化功能和蛋白质代谢的影响[D]. 雅安:四川农业大学, 2008.
LIU Y. Effects of protein levels on growth performance, digestive functions and protein metabolism of juvenile Jian carp (Cyprinuscarpio) [D]. Ya’an: Sichuan Agricultural University, 2008.
[22] 孙瑞健, 张文兵, 徐 玮, 等. 饲料蛋白质水平与投喂频率对大黄鱼生长、体组成及蛋白质代谢的影响[J]. 水生生物学报, 2013, 37(2):281-289.
SUN R J, ZHANG W B, XU W,etal. Effects of dietary protein level and feeding frequency on the growth performance body composition and protein metabolism of juvenile large yellow croakers,Pseudosciaenacrocear[J]. Acta Hydrobiologica Sinica, 2013, 37(2):281-289.
[23] 黄 岩, 李 建, 王学习, 等. 饲料中不同蛋白质和淀粉水平对斜带石斑鱼生长性能和肝脏相关代谢酶活性的影响[J]. 水产学报, 2017, 41(5):746-756.
HUANG Y, LI J, WANG X X,etal. Effects of different dietary protein and starch levels on the growth and liver metabolism of grouper (Epinepheluscoioides) [J]. Journal of Fisheries of China, 2017, 41(5):746-756.
[24] 刘 臻. 不同倍性鲫鲤蛋白质代谢相关基因的克隆与表达研究[D]. 长沙:湖南师范大学, 2012.
LIU Z. Protein metabolism-related gene cloning and expression in different ploidy cyprinids [D]. Changsha: Hunan Normal University, 2012.
[25] 李 彬, 梁旭方, 刘立维, 等. 饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响[J]. 水生生物学报, 2014, 38(2):233-240.
LI B, LIANG X F, LIU L W,etal. Effects of dietary protein levels on growth, feed utilization and the enzymes activity on nitrogen metabolism of grass carp (Ctenopharyngodonidellus) [J]. Acta Hydrobiologica Sinica, 2014, 38(2):233-240.
[26] 尚晓迪, 罗 莉, 文 华, 等. 草鱼幼鱼对异亮氨酸的需要量[J]. 水产学报, 2009, 33(5):813-822.
SHANG X D, LUO L, WEN H,etal. Study on isoleucine requirement for juvenile grass carp,Cenopharyngodonidellus[J]. Journal of Fisheries of China, 2009, 33(5):813-822.
[27] 文 华, 高 文, 罗 莉, 等. 草鱼幼鱼的饲料苏氨酸需要量[J]. 中国水产科学, 2009, 16(2):238-247.
WEN H, GAO W, LUO L,etal. Determination of dietary threonine requirement for juvenile grass carp,Ctenopharyngodonidella[J]. Journal of Fishery Sciences of China, 2009, 16(2):238-247.
[28] FAULCONNIER Y, BONNET M, BOCQUIER F,etal. Effects of photoperiod and feeding level on adipose tissue and muscle lipoprotein lipase activity and mRNA level in dry non-pregnant sheep [J]. British Journal of Nutrition, 2001, 85(3):299-306.
[29] 黄英俏, 杨连玉. 脂蛋白脂酶研究进展[J]. 动物医学进展, 2010, 31(3):86-89.
HUANG Y Q, YANG L Y. Progress on lipoprotein lipase [J]. Progress in Veterinary Medicine, 2010, 31(3):86-89.
[30] 丛林梅, 王蔚芳, 高淳仁, 等. 配合饲料和冰鲜太平洋玉筋鱼对珍珠龙胆石斑鱼幼鱼生长、抗氧化和脂质代谢的影响[J]. 水产学报, 2016, 40(9):1398-1407.
CONG L M, WANG W F, GAO C R,etal. Effects of compound diet and fresh frozen Ammodytes personatus on growth, antioxidant ability and lipid metabolism of hybrid grouper (Epinephelusfuscoguttatus♀ ×Epinepheluslanceolatus♂) juveniles [J]. Journal of Fisheries of China, 2016, 40(9):1398-1407.
[31] 韩光明. 饲料脂肪水平对吉富罗非鱼生长、体脂沉积、脂肪酸组成及脂肪酸合成酶的影响[D]. 南京:南京农业大学, 2009.
HAN G M. Effects of dietary lipid levels on growth, fat deposition, fatty acid profiles and fatty acid synthase of gift strain nile tilapla,Oreochromisniloticus[D]. Nanjing: Nanjing Agricultural University, 2009.
[32] LIN H, ROMSOS D R, TACK P I,etal. Effects of fasting and feeding various diets on hepatic lipogenic enzyme activities in coho salmon Oncorhynchus kisutch [J]. Journal of Nutrition, 1977, 107(8):1477-1483
[33] 蒋左玉, 姚俊杰, 安 苗, 等. 葡萄糖、维生素C浸泡对普安银鲫胚胎发育中乙酰辅酶A羧化酶、脂肪酸合成酶及肉毒碱棕榈酰转移酶Ⅰ活性的影响[J]. 动物营养学报, 2014, 26(11):3510-3516.
JIANG Z Y, YAO J J, AN M,etal. Effects of glucose and vitamin C inhabitation on activities of acetyl-coA carboxylase,fatty acid synthase and carnitine PalmitoyltransferasesⅠduring embryo development ofCarassiusauratusgibelio[J]. Chinese Journal of Animal Nutrition, 2014,26(11):3510-3516.
