二甲双胍对宫颈癌Hela细胞的体外抗肿瘤作用
2018-06-28唐庄艳赫东芸盛敏佳齐延新王立岩
唐庄艳,赫东芸,盛敏佳,齐延新,王立岩*
(1.吉林大学中日联谊医院 妇产科,吉林 长春130033;2.中国科学院长春应用化学研究所)
宫颈癌是一种常见的妇科恶性肿瘤,目前宫颈细胞学检查及HPV检测可以早期发现宫颈癌,显著降低宫颈癌的发病率及死亡率。但是我国是世界人口第一的国家,其发病率和死亡率居高不下,仅2015年,在我国就有13万多的新发病例和5万多的死亡病例[1-3]而晚期宫颈癌及复发性宫颈癌患者的5年生存率仅为10-20%[4]。目前手术联合经典的化疗方案常作为一线治疗方案,但是用药过程中,比如铂类,会出现骨髓抑制等严重副反应[5-7]。而耐药性的出现会导致肿瘤复发和进一步恶化。因此,我们需要新的化疗增敏剂治疗宫颈癌。二甲双胍是作为胰岛素的增敏剂,是一种公认的治疗2型糖尿病的有效药物,近年来,研究[7]表明,二甲双胍与经典的化疗药物联合应用可以增强化疗药物的敏感性,从而有益于肿瘤的治疗。比如二甲双胍联合紫杉醇和顺铂联合用药对卵巢癌[8]和食管癌[9]的抗增殖作用,比单独应用化疗药物要明显增强,但在国内二甲双胍对宫颈癌体外抗肿瘤作用研究甚少,故本文在体外通过不同浓度的二甲双胍培养宫颈癌Hela细胞,探讨其细胞增殖及抗肿瘤机制,以及进一步探讨二甲双胍联合卡铂是否对宫颈癌Hela细胞的增殖抑制有协同作用。
1 材料与方法
1.1细胞株和主要试剂本实验采用的宫颈癌Hela细胞由中国科学院长春应用化学研究所提供。胎牛血清和MTT购自上海拜力生物科技有限公司,二甲双胍原药粉剂、胰蛋白酶和碘化丙啶购自美国SIGMA公司,DMED培养基、双抗购自美国GIBCO公司,二甲亚砜(DMSO)购自上海源叶生物科技有限公司,吖啶橙/溴化乙啶(AO/EB)购自北京索莱宝生物科技有限公司。
1.2细胞复苏和细胞培养从液氮中取出宫颈癌Hela细胞株冻存管,用常规的方法复苏宫颈癌Hela细胞,将宫颈癌Hela细胞加入含有10%胎牛血清的DMEMF复合培养基中,于37℃、5%CO2培养箱中静置培养。根据细胞生长速度适时更换培养基,待细胞融合度达80-90%时,用含0.02%EDTA的0.25%胰蛋白酶对贴壁的宫颈癌Hela细胞进行消化,按1∶2进行传代或者接种培养。取对数期生长期的细胞用于实验。
1.3MTT法检测二甲双胍抑制宫颈癌细胞的体外增殖能力取处于对数生长期的宫颈癌细胞常规消化、离心、重悬,制成单细胞悬液,按照1×104个细胞/孔接种于96孔培养板,每孔100 μl,置于37℃、5%CO2培养箱中培养过夜,使细胞贴壁。24 h后,加入含不同浓度的二甲双胍0、0.01、0.5、1、5、10、20 mmol/L的复合培养基100 μl,每个实验组设置4个复孔,继续培养24、48、72 h后,每孔加入MTT(5 mg/mL)20 μl,继续常规培养4 h后,小心吸去上清并加入150 μl DMSO溶液,震荡混匀使形成的结晶物完全溶解。将96孔培养板置入酶标仪中,检测各孔在490 nm波长处的吸光度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.4荧光显微镜下计算细胞凋亡数按1.3中的方法处理细胞后,按照5×105个细胞/孔接种于6孔培养板,每孔1 ml,置于37℃、5%CO2培养箱中培养过夜,使细胞贴壁。第2日加入不同浓度的二甲双胍0.01、0.5、1、5、10、20 mmol/L的复合培养基1 ml,培养24 h后,常规消化收获作用后的细胞;3 000 rpm室温离心5 min,弃上清;用500 μl PBS重悬细胞,3 000 rpm室温离心5 min,弃上清;重复3次上述洗涤过程;用100 μl PBS重悬细胞,加入4 μl AO和4 μl EB,震荡混匀;在载玻片上滴加5 μl上述细胞悬液,加盖玻片驱尽气泡;在荧光显微镜下观察200个细胞并计数,分别计数活细胞(VN),核染色质着绿色并呈正常结构;早期凋亡细胞(VA)核染色质着绿色呈固缩状或碎裂状;晚期凋亡细胞(NVA),核染色质着橘红色呈固缩状或碎裂状;坏死细胞(NVN),核染色质着橘红色呈正常结构;每个实验组重复3次。凋亡比例=[(VA+NVA)/(AVN+VA+NVA+NVN)]×100%;破膜比例=[(NVA+NVN)/(AVN+VA+NVA+NVN)]×100%。
1.5流式细胞仪检测细胞周期按1.4中的方法用不同浓度二甲双胍(0、1、5 mmol/L)培养宫颈癌Hela细胞48 h后,常规消化收获作用后的细胞,PBS洗涤细胞2次,1 000 rpm离心5 min,吸弃PBS后,用70%乙醇重悬细胞,固定过夜,第2日1 000 rpm离心5 min,吸弃固定液。PBS洗涤细胞1次,800 μl PBS 重悬细胞,加入100 μl碘化丙锭溶液和100 μl RNA 酶A,37℃避光孵育30 min。流式细胞仪上机检测分析,分析各细胞周期的比例。
1.6MTT法检测二甲双胍联合卡铂对宫颈癌Hela细胞增殖抑制率按1.3中的方法处理细胞后,常规培养24 h后,加入含0 mmol/L、1.0 mmol/L及5.0 mmol/L 浓度的二甲双胍和0 mg/L、25 mg/L、50 mg/L的卡铂复合培养基各100 μl,每个实验组设置4个复孔,继续培养24 h后,每孔加入MTT(5 mg/mL)20 μl,继续常规培养4 h后,吸去上清并加入150 μl DMSO溶液,震荡混匀使形成的结晶物完全溶解。将96孔培养板置入酶标仪中,检测各孔在490 nm波长处的吸光度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.7统计学处理采用SPSS 19.0软件进行统计学分析,结果以“均数±标准差”表示,根据实验设计采用t检验进行比较,P<0.05表示有统计学意义。
2 结果
2.1MTT法检测不同浓度二甲双胍对宫颈癌Hela细胞的抗肿瘤作用
随着二甲双胍浓度的增加及作用时间的延长,其对宫颈癌Hela细胞的抑制作用逐渐增强,呈现明显的浓度依赖性和时间依赖性。作用24 h,当二甲双胍浓度>0.5 mmol/L,与1.0、5.0、10、20 mmol/L组宫颈癌Hela细胞的增殖抑制率比较,差异具有统计学意义(P<0.05),当二甲双胍浓度≤0.5 mmol/L,0.5 mmol/L与0.01 mmol/L组宫颈癌Hela细胞的增殖抑制率比较无统计学差异(P>0.05);作用48 h,当二甲双胍浓度>0.5 mmol/L,与1.0、5.0、10、20 mmol/L组宫颈癌Hela细胞的增殖抑制率比较,差异具有统计学意义(P<0.05),当二甲双胍浓度≤0.5 mmol/L,0.5 mmol/L与0.01 mmol/L组宫颈癌Hela细胞的增殖抑制率比较无统计学差异(P>0.05);作用72 h,随着二甲双胍浓度的增加,细胞增殖抑制率明显上升,各组浓度组差异具有统计学意义(P<0.05)。当二甲双胍浓度=0.01 mmol/L时,与作用24 h比较,作用72 h宫颈癌Hela细胞的增殖抑制率升高,差异具有统计学意义(P<0.05)。当二甲双胍浓度>0.5 mmol/L,与24 h比较,随着作用时间的延长,宫颈癌Hela细胞的增殖抑制率增加,差异具有统计学意义(P<0.05),见图1。
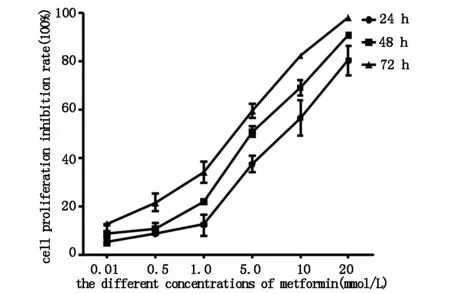
图1 MTT法检测各组宫颈癌Hela细胞的增殖抑制情况
2.2二甲双胍诱导宫颈癌Hela细胞凋亡
AO/EB染色可根据细胞着色及染色质的形态区分出早期凋亡细胞(VA)、晚期凋亡细(NVA)、活细胞(VN)和坏死细胞(NVN),随着实验组二甲双胍药物浓度的增加,其凋亡率逐渐增加(如表1),分别是4.0%、8.1%、11.0%、14.5%、30.0%、42.5%、55.0%,差异具有统计学意义(P<0.05)。

表1 不同浓度二甲双胍对宫颈癌Hela细胞的凋亡影响
2.3二甲双胍对宫颈癌Hela细胞细胞周期的影响
流式细胞术检测发现,与对照组相比,二甲双胍培养宫颈癌Hela细胞48小时后,随着二甲双胍的浓度增加,G0/G1期细胞比例上升,S期比例下降,差异具有统计学意义(P<0.05),而G2/M期细胞比例无明显差异(P>0.05),表明二甲双胍通过诱导宫颈癌Hela细胞G0/G1期阻滞而发挥增殖抑制作用的(图2)。
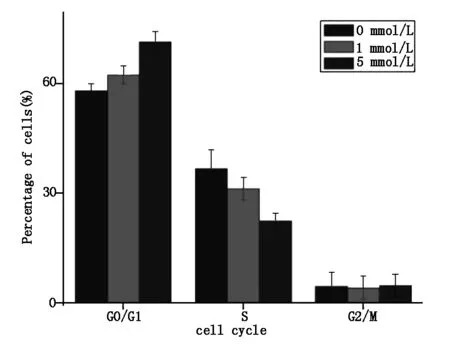
图2 二甲双胍作用宫颈癌Hela细胞的细胞周期
2.4MTT法检测二甲双胍联合卡铂对宫颈癌Hela细胞的增殖抑制作用
宫颈癌Hela细胞经不同浓度的二甲双胍联合卡铂的复合培养基培养24 h后,采用MTT法检测各组细胞增殖抑制率,结果显示:二甲双胍联合卡铂用药组的细胞增殖抑制率明显高于单独卡铂用药组,差异具有统计学意义(P<0.05)。在卡铂浓度一定的情况下,随着二甲双胍浓度的增加,宫颈癌Hela细胞的增殖抑制率也明显增加(P<0.05),即5 mmol/L二甲双胍联合卡铂用药组的细胞增殖抑制率明显高于1 mmol/L二甲双胍联合卡铂用药组的细胞增殖抑制率,差异具有统计学意义(P<0.05,如图3)。
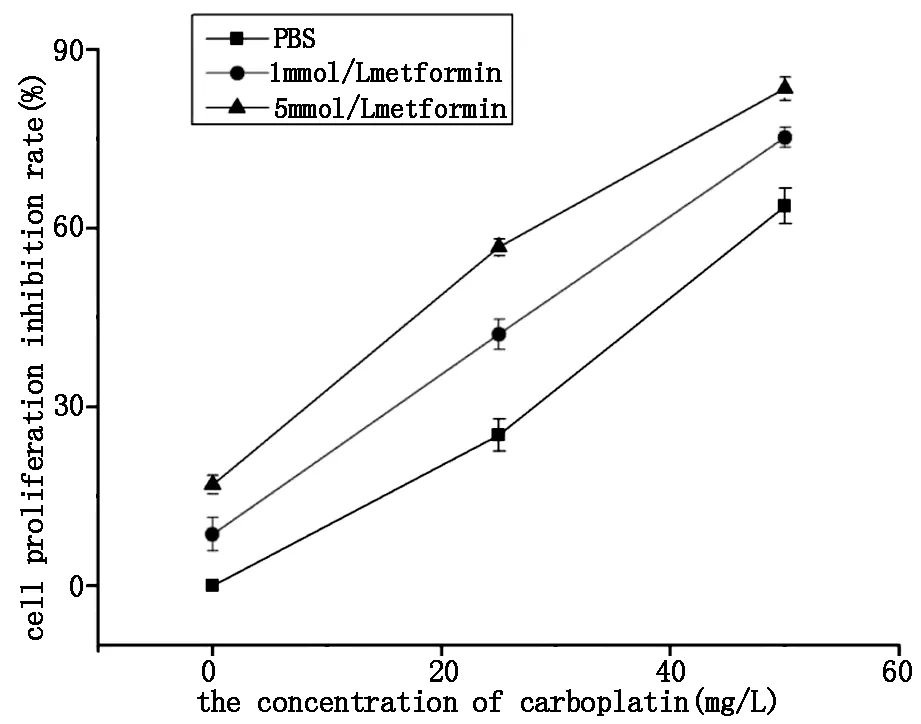
图3 二甲双胍联合卡铂对宫颈癌Hela细胞的增殖抑制作用
3 讨论
近年来,随着宫颈癌患病人数的上升,目前宫颈癌治疗过程中所面临的巨大挑战是化疗耐药和化疗敏感性差,因此,需要我们寻找新的抗肿瘤药物。而在过去的几年中,二甲双胍因其抗癌作用引起了更多的关注[10,11,12,13]。二甲双胍因其疗效确切,成本低,不良反应少,已成为治疗2型糖尿病的一线药物[14,15]。最近的流行病学研究表明,接受二甲双胍治疗的糖尿病患者癌症发病率和死亡率比未接受二甲双胍治疗明显降低[16,17]。而且从体外和体内研究中获得的越来越多的证据表明二甲双胍对许多类型的癌细胞有直接抗增殖作用,其IC50值约为50 mM[18],其中包括口腔鳞状细胞癌[19]、卵巢癌[20]、乳腺癌[21]、胃癌[22]等。本实验二甲双胍对宫颈癌Hela细胞体外研究可以发现,二甲双胍对宫颈癌Hela细胞的增殖抑制作用呈现浓度依赖性和时间依赖性,这说明二甲双胍对宫颈癌具有抗肿瘤作用。
近两年报道,PI3K/Akt/mTOR信号通路在癌细胞的生长,代谢,存活和运动中发挥着核心作用,使其成为抗肿瘤药物开发的有吸引力的靶点,抑制该途径的信号传导可减少细胞增殖和增加细胞死亡[23]。在子宫内膜癌细胞中,二甲双胍通过抑制mTOR信号途径诱导G1期阻滞并引起细胞凋亡[24]。此外,二甲双胍通过抑制PI3K / Akt / mTOR信号通路的表达,发挥对宫颈癌的保护作用,目前正在探索针对多种癌症类型的作用机制:作为间接(即胰岛素依赖性)和直接(即非胰岛素依赖性)[25]。最近报道指出二甲双胍作用宫颈癌细胞会导致p53蛋白表达增加,然后增强其下游靶基因Bax和p21的转录,而二甲双胍诱导的p53上调是通过AMPK-mTOR信号通路[26]。例如,二甲双胍和奈非那韦的联合用作用于宫颈癌细胞,可以上调p53及其下游产物p21的表达,因此它们联合用药对p53和p21表达具有协同作用,起到对抑制宫颈癌细胞DNA复制和DNA损伤的作用,从而协同诱导细胞凋亡和细胞周期阻滞的作用[27]。
值得注意的是,Xiao等人发现二甲双胍在宫颈癌细胞中的作用依赖于完整的LKB1[28]。这可能是临床相关的,因为20%的子宫颈癌有LKB1突变[29]。在宫颈癌的体外研究中发现的二甲双胍作用的新分子机制包括靶向Wnt /β-连环蛋白信号传导[30],抑制FOXM1信号传导[31]以及抑制血红素加氧酶-1表达,它们能使宫颈癌细胞对紫杉醇敏感[32]。此外,最近的研究表明,具有线粒体DNA基因突变的癌细胞系对二甲双胍的敏感性增加[33]。这样使得二甲双胍能够对具有线粒体DNA基因突变的宫颈癌细胞发挥更好的抗肿瘤作用。
综上所述,一方面二甲双胍能够在体外能够抑制宫颈癌Hela的增殖,诱导细胞凋亡和细胞周期阻滞,另一方面二甲双胍与卡铂联合应用能够增强卡铂对宫颈癌Hela细胞的增殖抑制作用,说明二甲双胍能增加化疗药物的敏感性,这为以后二甲双胍在临床治疗宫颈癌方面提供理论基础和实践价值。
参考文献:
[1]Lees B F,Erickson B K,Huh W K.Cervical cancer screening:evidence behind the guidelines[J].Am J Obstet Gynecol,2016,214:438.
[2]Crafton S M,Salani R.Beyond Chemotherapy:An Overview and Review of Targeted Therapy in Cervical Cancer[J].Clin Ther,2016,38,449.
[3]Beavis A L,Levinson K L.Preventing Cervical Cancer in the United States:Barriers and Resolutions for HPV Vaccination[J].Front Oncol,2016,6:19.
[4]Kurtz JE,Hardy-Bessard AC,Deslandres M,et al.Cetuximab,topotecan and cisplatin for the treatment of advanced cervical cancer:A phase II GINECO trial[J].Gynecol Oncol,2009,113:16.
[5]Huang L,Liao LM,Liu A W,et al.Analysis of the impact of platinum-based combination chemotherapy in small cell cervical carcinoma:a multicenter retrospective study in Chinese patients[J].BMC Cancer,2014,14:1.
[6]Holman L L,Ren Y,Westin S N.Status epilepticus associated with platinum chemotherapy in a patient with cervical cancer:a case report[J].BMC Cancer,2015,15:728.
[7]Angioli R,Plotti F,Aloisi A,et al.A randomized controlled trial comparing four versus six courses of adjuvant platinum-based chemotherapy in locally advanced cervical cancer patients previously treated with neo-adjuvant chemotherapy plus radical surgery[J].Gynecol Oncol,2015,139:433.
[8]Jian-Hong Dang,Zhi-Jun Jin.Metformin in combination with cisplatin inhibits cell viability and induces apoptosis of human ovarian cancer cells by inactivating ERK 1/2[J].Oncol Lett,2017,14(6):7557.
[9]Feng Wang,Xianfei Ding,Tao Wang.Metformin inhibited esophageal squamous cell carcinoma proliferation in vitro and in vivo and enhanced the anti-cancer effect of cisplatin[J].PLoS One,2017,12(4):e0174276.
[10]Zarogoulidis P,Lampaki S,Turner JF,et al.mTOR pathway:A current,up-to-date mini-review (Review) [J].Oncol Lett,2014,8:2367.
[11]Nair V,Sreevalsan S,Basha R,et al.Mechanism of Metformin-dependent Inhibition of Mammalian Target of Rapamycin(mTOR) and Ras Activity in Pancreatic:Role of Specificity Protein(Sp) Transcription Factor[J].J Biol Chem,2014,289:27692.
[12]Pérez-Revuelta BI,Hettich MM,Ciociaro A,et al.Metformin lowers Ser-129 phosphorylated α-synuclein levels via mTOR-dependent protein phosphatase 2A activation[J].Cell Death Dis,2014,5:e1209.
[13]Fujihara S,Kato K,Morishita A,et al.Antidiabetic drug metformin inhibits esophageal adenocarcinoma cell proliferation in vitro and in vivo[J].Int J Oncol,2015,46:2172.
[14]Leone A,Di Gennaro E,Bruzzese F,et al.New perspective for an old antidiabetic drug:metformin as anticancer agent[J].Cancer Treat Res,2014,159:355.
[15]Kato K,Gong J,Iwama H,et al.The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo[J].Mol Cancer Ther,2012,11:549.
[16]Dowling R J O,Niraula S,Stambolic V,et al.J.Metformin in cancer:translational challenges[J].J Mol Endocrinol,2012,48:R31.
[17]Chen XW,Li C,He TT,et al.Metformin inhibits prostate cancer cell proliferation,migration,and tumor growth through upregulation of PEDF expression[J].Cancer Biol Ther,2016,17:507.
[18]Heckman-Stoddard B M,Gandini S,Puntoni M,et al.Repurposing old drugs to chemoprevention:the case of metformin[J].Semin Oncol,2016,43:123.
[19]Chang-Han Chen,Hsin-Ting Tsai,Hui-Ching Chuang.Metformin disrupts malignant behavior of oral squamous cell carcinoma via a novel signaling involving Late SV40 factor/Aurora-A,Sci Rep,2017,7:1358.
[20]Jianjun Han,Weiya Z.Wysham,et al.Increased efficacy of metformin corresponds to differential metabolic effects in the ovarian tumors from obese versus lean mice[J].Oncotarget,2017,8(67):110965.
[21]Gerald Davies,Liubov Lobanova,Wojciech Dawicki.Metformin inhibits the development,and promotes the resensitization,of treatment-resistant breast cancer[J].PLoS One,2017,12(12):e0187191.
[22]Kato K,Gong J,Iwawa H,et al.The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo[J].Mol Cancer Ther,2012,11:549.
[23]Cantrell L A,Zhou CX,Mendivil A,et al.Metformin is a potent inhibitor of endometrial cancer cell proliferation-implications for a novel treatment strategy[J].Gynecol Oncol,2010,116:92 .
[24]Stewart Z A ,Pietenpol J A.p53 Signaling and cell cycle checkpoints[J].Chem Res Toxicol,2001,14:243.
[25]Gong J,Shen J,Mita M,et al.The expanding role of metformin in cancer:an update on antitumor mechanisms and clinical development[J].Target Oncol,2016,11:447.
[26]Li PY,Zhao M,Yang XH,et al.p53 is required for metformin-induced growth inhibition,senescence and apoptosis in breast cancer cells[J].Biochem Biophys Res Commun,2015,464,1267.
[27]Xia,Ruihong Chen.Combining metformin and nelfinavir exhibits synergistic effects against the growth of human cervical cancer cells and xenograft in nude mice[J].Sci Rep,2017,7:43373.
[28]Xiao X,He Q,Lu C,et al.Metformin impairs the growth of liver kinase B1-intact cervical cancer cells[J].Gynecol Oncol,2012,127:249.
[29]Wingo SN,Gallardo TD,Akbay EA,et al.Somatic LKB1 mutations promote cervical cancer progression[J].PLoS One,2009,4:e5137.
[30]Kwan HT,Chan DW,Cai PC,et al.AMPK activators suppress cervical cancer cell growth through inhibition of DVL3 mediated Wnt/beta-catenin signaling activity[J].PLoS One,2013,8:e53597.
[31] Yung MM,Chan DW,Liu VW,et al.Activation of AMPK inhibits cervical cancer cell growth through AKT/FOXO3a/FOXM1 signaling cascade[J].BMC Cancer,2013.
[32]Do MT,Kim HG,Khanal T,et al.Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways[J].Toxicol Appl Pharmacol,2013,271:229.
[33]Birsoy K,Possemato R,Lorbeer FK,et al.Metabolic determinants of cancer cell sensitivity to glucose limitation and biguanides[J].Nature,2014,508:108.
