尿微量白蛋白及尿α1-微球蛋白对严重脓毒症患者急性肾损伤早期诊断价值
2018-06-28臧学峰古旭云边伟帅
臧学峰,古旭云,赵 磊,刘 平,盛 博,边伟帅,陈 炜
(首都医科大学附属北京世纪坛医院 重症医学科,北京100038)
急性肾损伤(Acute kidney injury,AKI)是严重脓毒症较为常见的并发症,在脓毒症休克患者中高达70%[1],而且AKI 是导致脓毒症患者死亡的独立危险因素[2],及早识别并加强对脓毒症患者AKI的防治对于改善患者预后具有重要意义。目前无论是2004年ADQI的RIFLE标准、2007年AKIN的改良定义及分期系统,还是2012年KDIGO的AKI指南定义的诊断和分期标准,均采用血肌酐水平以及尿量这两个指标作为定义的参考,而此两指标是肾脏损伤的相对晚期指标和临床表现,探索稳定、可靠、具有早期诊断价值的标记物仍然是临床面临的一项重要难题。尿微量白蛋白(Urine microalbumin,UmAlb)和尿α1-微球蛋白(Urine α1-microglobulin,Uα1-MG)对于肾小管和肾小球损伤具有较好的相关性,但其对于脓毒症造成的AKI是否具有诊断价值目前尚无定论。本研究旨在探讨入ICU时存在低血压等高危因素的脓毒症患者24 h内留取晨尿测定的UmAlb和Uα1-MG对AKI的诊断价值。
1 资料与方法
1.1病例选择本研究采用回顾性临床研究方法,选择 2015年1月至2017年12月收入我科的有低血压的脓毒症患者,均符合2012年国际脓毒症定义会议所制定的严重脓毒症诊断标准。采用2012年《KDIGO急性肾损伤临床实践指南》的诊断标准,符合AKI诊断标准的患者纳入本研究,其中血肌酐基准值以近1年内医疗记录最近的一次为准。制定排除标准:入住时间<24 h;既往由各种不同原因导致的慢性肾脏疾病;尿路梗阻;快速进展性肾小球肾炎、免疫系统疾病;尿路感染。本研究符合医学伦理学标准,并经医院伦理委员会批准,所有检查获得患者及家属知情同意。
1.2观察指标收集研究对象的性别、年龄等一般资料,患者明确诊断后24 h内留取8 h晨尿送检尿微量白蛋白、尿α1-球蛋白水平。调取患者入院后72 h内血肌酐、BUN、血乳酸和APACHE-II评分最高值。
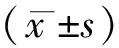
2 结果
2.1基本情况
本研究共纳入符合条件病例84例,男68例,女16例,年龄59-94岁,平均(77.55±8.49)岁;APACHEⅡ评分(22.83±4.53)分;脓毒性休克患者40例(47.6%),符合AKI病例48例(人群发病率57.14%),28天死亡36例(病死率为42.86%)。
2.2AKI组和非AKI组患者观察指标对比
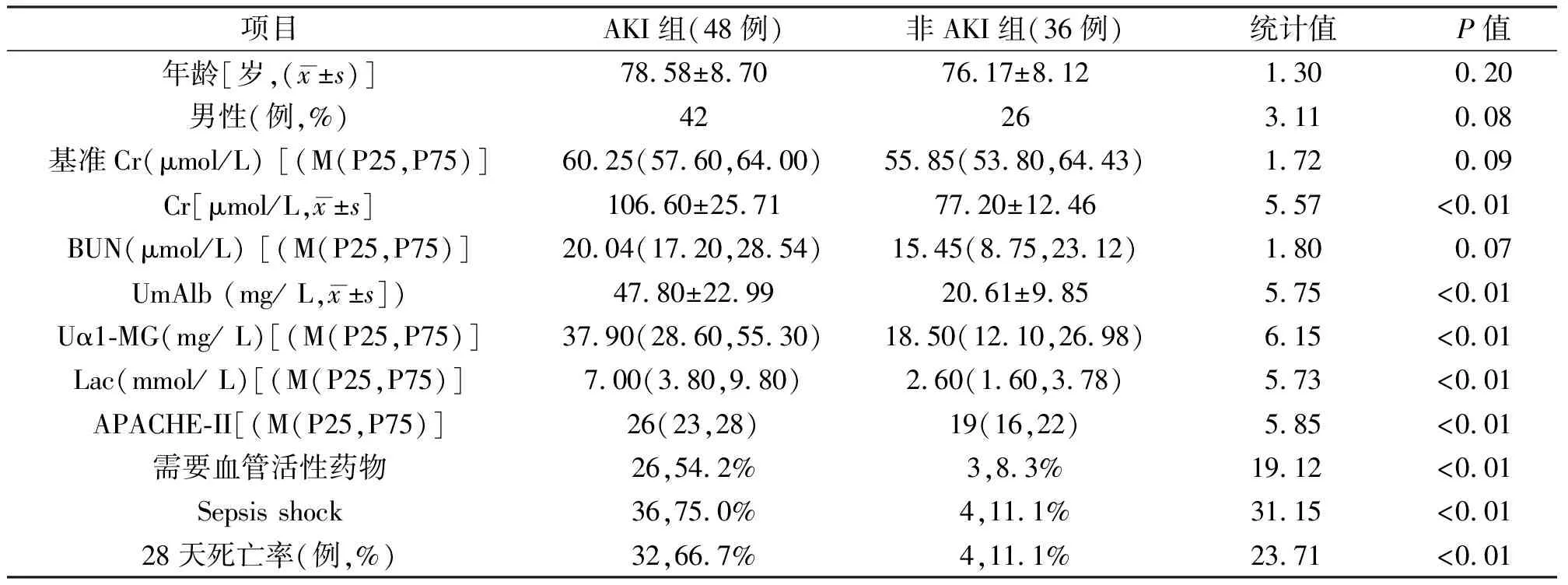
表1 AKI组和非AKI组患者观察指标对比
AKI组和非AKI组对比(见表1),两组间在Cr、BUN、UmAlb、Uα1-MG、Lac、APACHE-II评分等方面,以及是否需要血管活性药物、是否为脓毒性休克和28天转归方面均有统计学差异(P<0.05)。
2.3UmAlb、Uα1-MG及其他各项指标对AKI的诊断价值
对上述具有统计学差异的各项指标绘制受试者曲线,结果如图1和表2所示,UmAlb、Uα1-MG、lac、Cr和APACHE-II评分对于AKI的诊断均具有一定价值。其中UmAlb预测AKI的AUC为0.89,约登指数最大的最佳诊断界值为29.70 mg/L,阳性似然比为14.63,阴性似然比为0.20;Uα1-MG预测AKI的AUC为0.89,约登指数最大的最佳诊断界值为21.70 mg/L,阳性似然比为3.45,阴性似然比为0.06。两者相比,UmAlb具有更佳的阴性似然比。而与Cr相比,Cr的AUC仅为0.82,低于UmAlb、Uα1-MG和APACHE-II。
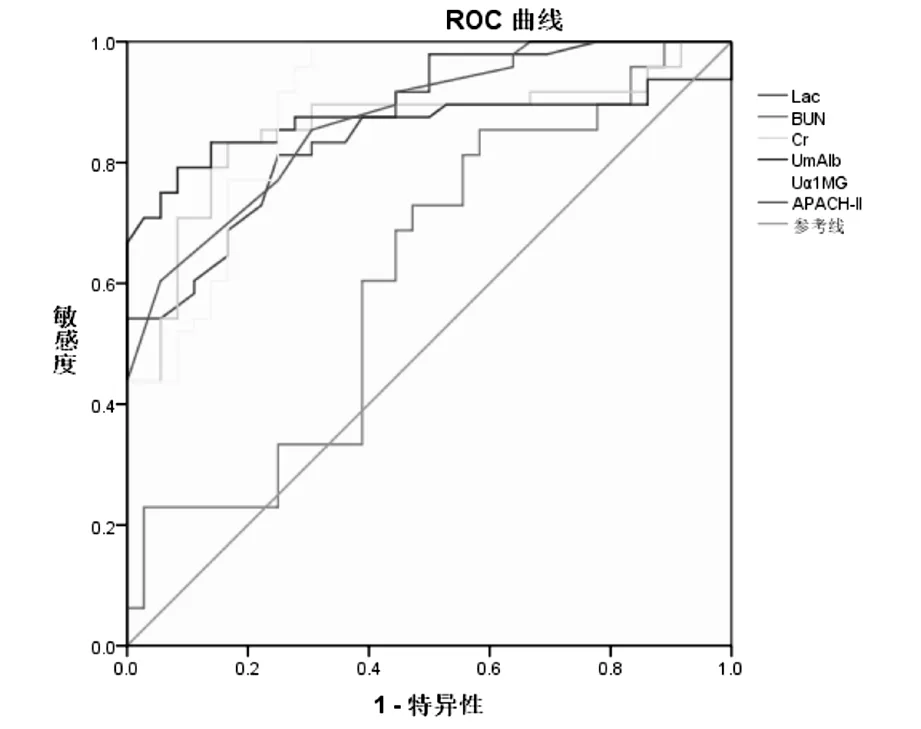
图1 UmAlb、Uα1-MG对AKI诊断的ROC分析
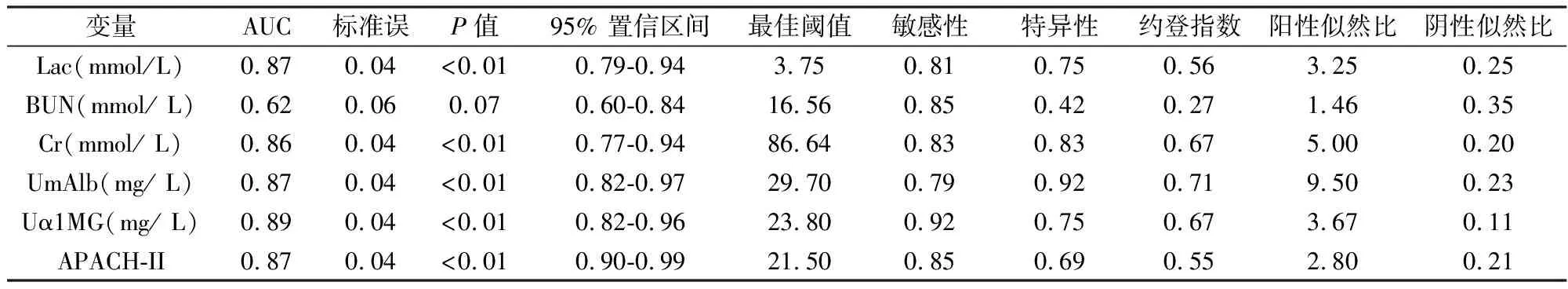
变量AUC标准误P值95% 置信区间最佳阈值敏感性特异性约登指数阳性似然比阴性似然比Lac(mmol/L)0.87 0.04 <0.01 0.79-0.943.75 0.81 0.75 0.56 3.25 0.25 BUN(mmol/ L)0.62 0.06 0.070.60-0.8416.56 0.85 0.42 0.27 1.46 0.35 Cr(mmol/ L)0.86 0.04 <0.010.77-0.9486.64 0.83 0.83 0.67 5.00 0.20 UmAlb(mg/ L)0.87 0.04 <0.010.82-0.9729.70 0.79 0.92 0.71 9.50 0.23 Uα1MG(mg/ L)0.89 0.04 <0.010.82-0.9623.80 0.92 0.75 0.67 3.67 0.11 APACH-II0.870.04 <0.010.90-0.9921.50 0.85 0.69 0.55 2.80 0.21
注:AUC,曲线下面积;Lac,乳酸;BUN,血清尿素氮;Cr,血肌酐;UmAlb,尿微量白蛋白;Uα1MG,尿α1-微球蛋白;APACH-II,急性生理学与慢性健康状况评分系统Ⅱ。
3 讨论
Hoste等进行的AKI全球流行病调查(AKI-EPI)研究结果显示危重病患者AKI的发生率高达57.3%[3],而AKI是影响患者危重患者短期和长期死亡率的独立危险因素[2]。因此如何早期识别脓毒症诱发的AKI,并且及早干预成为临床救治的关键点。当前的AKI的定义/分型主要是根据血肌酐(Scr)以及尿量(UO)的变化来确定AKI的发生,实际上,这两个指标反映的是肾功能受损后的结果,而不是肾损伤的过程[4]。而且血肌酐水平升高往往发生在48-72 h[5],而对于早期诊断价值较低。虽然目前对于脓毒症诱发的AKI相关病理生理学机制研究尚不清楚,但多数研究认为近端肾小管上皮细胞死亡和微血管内皮损伤是AKI最常见的原因,通常由缺血性、毒性、败血症或阻塞性损伤所致[6]。目前在脓毒症相关 AKI早期识别方面比较有发展前景的生物学标志物主要有中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、白细胞介素 -18(IL-18)和胰岛素样生长蛋白结合因子7(IGFBP7) 和金属蛋白酶组织抑制剂 -2(TIMP-2)[7]。其中NGAL反映的是近端肾小管损伤相关蛋白;IL-18提示的炎症损伤;IGFBP7和TIMP-2则与DNA 损伤后的 G1 期细胞周期阻滞相关[8,9]。虽然众多生物标记物在早期诊断AKI和预测透析需求方面显示出来较高的潜力。但对于有AKI风险(定义为少尿持续至少6 h)的患者,也有研究显示一系列的生物标记物作为AKI的预测因子,与血清肌酐相比,并无优势[10],可能与测量的时机,缺乏金标准以及临床的实用性等有一定相关性。目前仍需要进一步积极探索有效的早期诊断标记物。
UmAlb是反映肾小球疾病和损伤的一个非常灵敏的指标;而Uα1-MG被认为是近端肾小管功能轻微损害的敏感指标,当近端小管重吸收率从99.95%下降至99.85 % 就可使其排泄量增加3倍。尿液中上述蛋白的检测具有便利、患者损伤小、依从性高等特点,但由于临床认识以及相关普及等方面的限制,目前并未被临床用于脓毒症相关性急性肾损伤的早期检测。本研究探讨了入院24 h内留取晨尿中的微量白蛋白以及α1微球蛋白水平对临床诊断急性肾损伤患者的相关性。研究选取了合并低血压表现的脓毒症患者,而脓毒症和低血容量正是AKI发病的最常见原因[3],因此在入选患者中AKI的发病率相对较高,达到了57.14%,与AKI-EPI研究结果相似。在一般情况方面,AKI组和AKI组在年龄、性别以及基准Cr方面均无统计学差异,显示两组具有较好的可比性。而AKI组的APACHE-II评分比非AKI组明显升高,并且需要血管活性药物和诊断脓毒性休克的患者数量也更多,提示合并AKI的脓毒症患者往往病情相对较重。在AKI组中检测的Cr、UmAlb、Uα1-MG、Lac均较非AKI组明显升高(P<0.05)。进一步的ROC分析提示仅有UmAlb、Uα1-MG、lac、Cr和APACHE-II评分对于AKI的诊断均具有一定价值,其中UmAlb、Uα1-MG预测AKI的AUC均为0.89,对脓毒症相关性急性肾损伤具有较高的诊断价值,高于Cr对于AKI的诊断价值。薛莉等人研究[11]显示AKI患者的UmAlb、Uβ2-MG水平均明显高于对照组,且与AKI病情严重程度呈现了较好的相关性,对AKI具有较高的诊断价值。这与我们的研究结果相似。但凌聪等人[12]的研究显示UmAlb和Uβ2-MG在AKI和非AKI组中并无统计学差异,考虑其一是患者入选标准有差异,本研究均以入院时存在低血压的脓毒症患者为入组标准,病情相对较重;其二是标本采集时间差异,本研究以入院24 h内留取晨尿送检,相较于入院6 h以内的标本可基本除外膀胱内残余尿量影响,可能更具可靠性。
本研究结果显示,在临床常用的早期反映肾小球和肾小管损伤的尿标记物UmAlb和Uα1-MG对伴有严重脓毒症患者AKI的诊断具有一定的临床诊断意义。该项目的检测为早期准确判断脓毒症引起的AKI提供了一定的实验依据,对提高严重脓毒症AKI早期诊断和及早发现AKI提供新的思路。由于本研究入选病例数量相对较少,未能对AKI进行分层,故无法细致的探讨UmAlb和Uα1-MG与AKI病情严重程度的相关性,仍存在一定的局限性。有待后续的大量临床病例积累以进一步探索其预测价值。
综上所述,入住ICU时合并低血压的脓毒症患者24 h内留取晨尿检测的UmAlb、Uα1-MG对AKI的早期诊断具有一定诊断价值,较72 h内最高的Cr值具有更高的诊断价值。
参考文献:
[1]Bagshaw SM,George C,Bellomo R.Early acute kidney injury and sepsis:a multicentre evaluation[J].Crit Care,2008,12(2):R47.
[2]Joannidis M,Druml W,Forni LG,et al.Prevention of acute kidney injury and protection of renal function inthe intensive care unit:update 2017:Expert opinion of the Working Group on Prevention,AKI section,European Society of Intensive Care Medicine[J].Intensive Care Med,2017,43:730.
[3]Hoste E A J,Bagshaw S M,Bellomo R,et al.Epidemiology of acute kidney injury in critically ill patients:the multinational AKI-EPI study[J].Intensive Care Medicine,2015,41(8):1411.
[4]Schetz M,Schortgen F.Ten shortcomings of the current definition of AKI[J].Intensive Care Medicine,2017,43(6):1.
[5]Mehta R L,Chertow G M.Acute renal failure definitions and classification:time for change?[J].Journal of the American Society of Nephrology Jasn,2003,14(8):2178.
[6]Kumar S.Cellular and molecular pathways of renal repair after acute kidney injury[J].Kidney International,2018,93(1):27.
[7]龙 盘,何丽洁.急性肾损伤生物学标记物的研究进展[J].山东医药,2016,56(9):93.
[8]Bellomo R,Kellum J A,Ronco C,et al.Acute kidney injury in sepsis[J].Intensive Care Medicine,2017(3):1.
[9]Kashani K,Cheungpasitporn W,Ronco C.Biomarkers of acute kidney injury:the pathway from discovery to clinical adoption[J].Clinical Chemistry & Laboratory Medicine,2017,55(8):1074.
[10]Schetz M,Schneider A.Focus on acute kidney injury[J].Intensive Care Medicine,2017,43(9):1421.
[11]薛 莉,周玉莲,蒲姝陶,等.血清胱抑素C、尿微量白蛋白及β2-微球蛋白检测对急性肾损伤诊断及预后的意义[J].蚌埠医学院学报,2017,42(8):1114.
[12]凌 聪,薛 亮,李小悦.脓毒症相关急性肾损伤的早期监测指标[J].中国当代医药,2016,23(6):115.
