腹腔镜胃旁路术后血清瘦素、脂联素变化与胰岛素抵抗的关系
2018-06-27郭晓博刘昕伟高宏凯
郭晓博,韩 辉,苗 山,张 冶,刘昕伟,高宏凯
腹腔镜Roux-en-Y胃旁路术(laparoscopic Roux-en-Y,LRYGB)对肥胖症和2型糖尿病(type 2 diabetes mellitus,T2DM)有确切的治疗作用[1,2],手术的降糖机制与胰岛素抵抗的改善有关,但具体机制尚未完全清楚,该研究方向也是目前代谢外科的研究重点。体内脂肪组织异常蓄积是肥胖相关疾病的病理本质,也是T2DM的独立危险因素[3,4]。研究表明,脂肪组织是一个高度活跃的内分泌组织和重要的代谢组织,分泌瘦素、脂联素等脂肪因子,而瘦素、脂联素通路是调控胰岛素抵抗的主要代谢途径[5,6]。肥胖状态下,脂肪因子代谢紊乱,造成了胰岛素抵抗,导致T2DM的发生和发展[7-9]。因此,提出假设:LRYGB术后有助于减轻体内脂肪组织的蓄积,重建瘦素、脂联素的代谢平衡,是胰岛素抵抗缓解的机制。本研究选取肥胖症伴T2DM患者,实施LRYGB,观察术后血清瘦素、脂联素水平变化,探讨术后胰岛素抵抗改善与血清瘦素、脂联素变化的关系,为临床诊治提供依据。
1 对象与方法
1.1 对象 回顾性分析2011-03至2012-02武警总医院普通外科行腹腔镜胃旁路手术的肥胖症伴T2DM患者的临床资料。纳入标准及排除标准均参照《中国肥胖和T2DM外科治疗指南(2014)》[10]。纳入标准:(1)BMI 28~35 kg/m2的T2DM经生活方式和药物治疗难以控制血糖且至少符合额外的2个代谢综合征组分或存在合并症;(2)BMI 30~34.9 kg/m2T2DM经生活方式和药物治疗难以控制血糖,尤其具有心血管风险因素时,均建议积极考虑代谢手术治疗;(3)患者手术治疗均得到我院伦理委员会的同意,术前行风险评估,告知术中、术后可能发生的情况,患者及家属签署麻醉、手术知情同意书。排除标准:(1)全身状况差,难以耐受手术的患者;(2)胰岛B细胞功能已基本丧失,C肽水平低下或糖负荷下C肽释放曲线低平的T2DM患者;(3)妊娠糖尿病及某些特殊类型糖尿病。符合要求共入选52例,平均年龄(43.5±11.9)岁,平均 BMI 28~35 kg/m2。52例中有16例口服降糖药物治疗,15例应用胰岛素治疗,12例口服药物+胰岛素联合治疗,9例未经系统治疗。建立患者档案资料,做好术后随访工作,登记入档,患者基本情况(表1)。

表1 52例2型糖尿病患者术前基本资料 (n)
1.2 方法 (1)术前准备:优化术前血糖,包括健康饮食方案、体育活动、药物治疗;糖化血红蛋白降至6.5%~7.0%,血糖水平控制在8 mmol左右,尿糖(-),尿酮体(-)[10]。(2)LRYGB手术方法:建立气腹,脐部穿刺孔置入30° 腹腔镜,分别于两侧锁骨中线、腋前线的相应位置放置5 mm和10 mm Trocar共4个,于剑突下左侧置入肝叶拉钩,超声刀直视下游离胃大弯和胃小弯,腹腔镜下直线切割闭合器离断胃底,保留大小约为原胃10%的近端胃小囊,辨别Treitz韧带。在距Treitz韧带以远100 cm处切断空肠,将近端胃与远段空肠断端行结肠前端侧吻合,再将近段空肠断端与远端小肠在距胃肠吻合口以远100~150 cm处行侧侧吻合,以此重建消化道。(3)术后给予抗生素预防感染、常规营养支持、补充液体维持电解质平衡。
1.3 评价指标 术前、术后1、3、6、12个月检测血清瘦素、脂联素(均采用ELISA检测法)、HbA1c、TG、CH和BMI ,并行OGTT和胰岛素释放试验。
1.4 疗效评价 糖尿病治愈标准参照文献[11]。(1) 显效:FPG<7 mmol/L,2 h PG<10 mmol/L,HbA1c<7%,无需使用降糖药物;(2) 好转:FPG、2 h PG值较术前下降50%;或HbA1c下降值≥1%;或减少50%降糖药物使用剂量;或可停用胰岛素,仅用口服降糖药即可维持血糖达标;(3) 未愈:FPG无变化或下降值<50%,或HbA1c下降值<1%,需增加糖尿病药物种类,需增加药物剂量。肥胖症治愈标准参照国际生命科学学会中国肥胖问题工作组定义肥胖症诊断标准,选择BMI<25 kg/m2作为肥胖症治愈标准。

2 结 果
2.1 术后一般情况 52例均成功完成手术,无中转开腹,术中出血量为(25.0±11.1)ml,手术时间为(78±14)min。术后无吻合口出血、梗阻,吻合口漏等手术并发症。2例女性患者术后出现胃肠功能紊乱,经非手术治疗后痊愈,住院时间为(11±2)d。术后随访12个月,无失访病例。
2.2 人体测量学变化 术后随访12个月,肥胖者治愈率67.3%。与术前BMI(31.8±2.3)kg/m2比较,术后6个月最低,与术前比较,术后不同时间点均有统计学意义(P<0.05)。术前腰臀比(0.96±0.06),逐渐下降至术后6个月(0.89±0.05),与术前比较,术后3、6、9个月比较均差异有统计学意义(P<0.05,表2)。
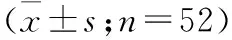
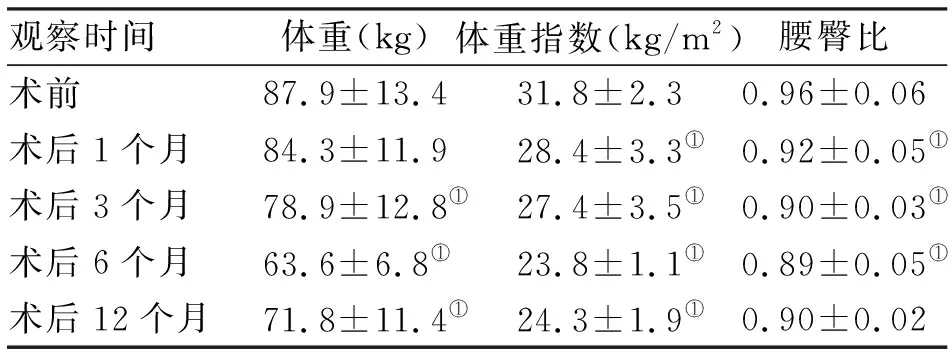
观察时间体重(kg)体重指数(kg/m2)腰臀比术前87.9±13.431.8±2.30.96±0.06术后1个月84.3±11.928.4±3.3①0.92±0.05①术后3个月78.9±12.8①27.4±3.5①0.90±0.03①术后6个月63.6±6.8①23.8±1.1①0.89±0.05①术后12个月71.8±11.4①24.3±1.9①0.90±0.02
注:与术前相比,①P<0.05
2.3 血脂变化 与术前TG值(3.50±1.46) mmol/L相比,术后12个月TG值(1.14±0.38) mmol/L 下降明显,差异有统计学意义(P<0.05);术后CH值呈逐渐下降趋势,术后12个月CH值与术前CH(5.14±1.18)mmol/L相比,差异有统计学意义(P<0.05,表3)。
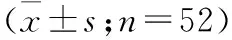

观察时间TG(mmol/L)CH(mmol/L)术前3.50±1.465.14±1.18术后1个月2.71±1.08①4.51±0.98①术后3个月1.69±0.40①4.03±1.23①术后6个月1.72±0.71①3.70±0.88①术后12个月1.14±0.38①4.01±0.49①
注:与术前相比,①P<0.05
2.4 糖代谢及胰岛素功能变化 术后12个月的血糖,达标率为86.5%。 与术前FPG值相比,术后逐渐下降,术后6个月最低,与术前相比术后各时间点均明显下降,差异有统计学意义;与术前HbA1c相比,术后12个月差异有统计学意义(P<0.05)。与术前2 hPG相比,术后各时间点均有所降低,差异有统计学意义(P<0.05,表4)。与术前FIns值相比,术后呈逐渐下降趋势,术后12个月达到最低,差异有统计学意义; HOMA-IR与术前相比,术后12个月HOMA-IR下降,差异有统计学意义(P<0.05,表4)。
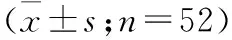
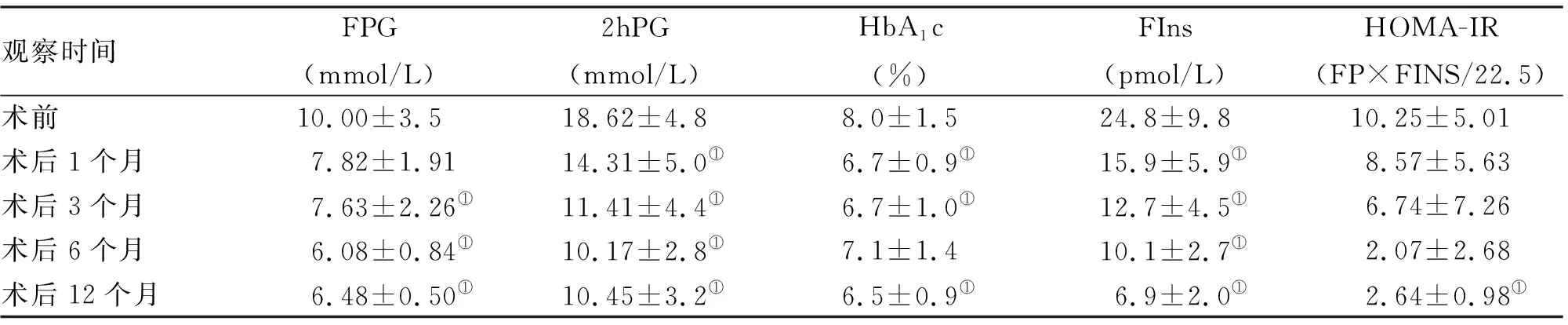
观察时间FPG(mmol/L)2hPG(mmol/L)HbA1c(%)FIns(pmol/L)HOMA-IR(FP×FINS/22.5)术前10.00±3.518.62±4.88.0±1.524.8±9.810.25±5.01术后1个月7.82±1.9114.31±5.0①6.7±0.9①15.9±5.9①8.57±5.63术后3个月7.63±2.26①11.41±4.4①6.7±1.0①12.7±4.5①6.74±7.26术后6个月6.08±0.84①10.17±2.8①7.1±1.410.1±2.7①2.07±2.68术后12个月6.48±0.50①10.45±3.2①6.5±0.9①6.9±2.0①2.64±0.98①
注:与术前相比,①P<0.05
2.5 瘦素及血清脂联素变化 与术前空腹瘦素[(20.60±4.30)ng/ml]相比,术后空腹瘦素值明显下降至术后12个月[ (5.63±2.91)ng/ml,P=0.005]。与术前空腹脂联素水平[(4.34±2.63) μg/ml]相比,术后空腹脂联素水平下降至术后3个月[(2.94±1.18)μg/ml],而后升高至术后12个月[(7.37±2.81)μg/ml,P=0.028]。
3 讨 论
脂肪细胞分泌多种具有生物活性的脂肪因子,参与调节葡萄糖代谢、胰岛素及能量代谢[9]。减重术后体重减轻的核心是脂肪细胞总量的减少。本研究发现,LRYGB术后12个月随访期内患者BMI明显下降,同时TG及CH明显改善,表明在体重下降的同时脂肪细胞功能也发生了明显改变。BMI、腰臀比、FPG及2 hPG 等统计数据在术后6个月最低,术后12个月稍有上升,考虑与术后进食,残余胃囊的扩大有关,需进一步加强糖尿病饮食教育,引导健康正确的生活方式[12]。
瘦素是来源于脂肪组织的蛋白质激素, 具有抑制食欲、减少能量摄入、提高机体代谢率、减少脂肪堆积的生物学作用。肥胖症患者脂肪堆积,脂肪细胞分泌增多,外周血液瘦素水平升高 ,但由于中枢传导信号受阻,导致生理剂量的瘦素产生低于正常的生理效应,即瘦素抵抗[13]。一方面高水平瘦素通过促进脂肪细胞的分解,使游离脂肪酸浓度升高而干扰肌肉对胰岛素的敏感性。另一方面,瘦素能削弱胰岛素的生物效应,即胰岛素抵抗的发生。脂联素是一种脂源性的血浆蛋白,对胰岛素具有正向调节作用,高脂联素水平有助于增强胰岛素敏感性、拮抗胰岛素抵抗[14]。肥胖状态下,患者脂肪容量增大而脂联素血浆浓度反而下降,拮抗胰岛素抵抗作用减弱,胰岛素敏感性降低。本研究发现,LRYGB术后瘦素的表达与IR变化呈同向趋势,而脂联素的表达变化与IR呈反向趋势。
病理状态下,脂肪因子代谢紊乱主要表现是瘦素抵抗和脂联素表达的下调。这也是胰岛素抵抗的病理机制。手术重建了脂肪因子的稳态:瘦素抵抗减轻,脂联素表达上调。其改善IR的可能机制是,瘦素抵抗减轻,中枢瘦素受体对瘦素的敏感性增强,食欲减退、促进脂肪分解、增加能量代谢,促进肝脏、骨骼肌对葡萄糖的摄取,同时对胰腺的控制减弱,对胰岛β细胞作用减少[15],直接促进胰腺合成和分泌胰岛素,而胰岛素作用是促进血脂的降低,导致胰岛素抵抗的减轻。脂联素水平升高,抑制肝糖原的输出作用增强,同时增加机体摄取与氧化脂质,加强骨骼肌细胞内脂肪酸转运和氧化,导致脂肪燃烧及能量的释放增加,同时促进脂质向脂肪细胞聚集,使肝脏骨骼肌免受脂质浸润,从而降低血脂水平,增强肝脏和骨骼肌的胰岛素敏感性,抑制胰岛素抵抗。
综上所述,肥胖症、T2DM患者均普遍存在脂联素水平降低和瘦素抵抗。LRYGB术后血清脂联素水平的升高及瘦素抵抗的降低,重建瘦素和脂联素的代谢平衡,改善了胰岛素抵抗,从而达到改善血糖水平的目的。因此,LRYGB对肥胖症伴T2DM患者有确切的治疗作用,脂联素升高及瘦素抵抗的改善是手术治疗糖尿病的机制之一。
【参考文献】
[1] Fried M, Ribaric G, Buchwald J N,etal. Metabolic surgery for the treatment of type 2 diabetes in patients with BMI<35 kg/m2:an integrative review of early studies[J]. Obes Surg, 2010,20(6):776-790.
[2] Proczko M M, Stefaniak T, Kaska L,etal. Early resuilt of roux-en-Y gastric by-pass on regulation of diabetes type 2 in patients with BMI above and below 35kg/m2[J]. Pol praegl Chir, 2011, 83(2): 81-86.
[3] Enriori P J , Evans A E , Sinnayah P,etal. Diet-induced obesiyt causes severe but reversible leptin resistance in arcuate melanocortin neurons [J]. Cell Metab, 2007, 5(6):181-194.
[4] Knobler H, Benderly M, Boyko V,etal. Adiponectin and the development of diabetes in patients with coronary artery disease and impaired fasting lucose[J].Eur J Endocrinol, 2006, 154(1): 87-92.
[5] Bettina M, Jeffrey F H, Alex M D,etal. Recombinant human leptin treatment does not improve insulin action in obese subjects with type 2 diabetes[J]. Diabete, 2011, (60): 1474-1477.
[6] 高宏凯,贾元利,吴致委,等.中国超重肥胖与非肥胖2型糖尿病患者胃转流术后疗效与治疗作用的随访观察[J].中国糖尿病杂志,2012,20(3):248-253.
[7] Rubino F.Is type 2 diabetes an operable intestinal disease? A provocative yet reasonable hypothesis[J]. Diabetes Care,2008,(31):290-296.
[8] Scherer P E.Adiposetissue:from lipid storage compartment to endocrine organ s[J]. Diabete 2006,55(6):1537-1545.
[9] Mingrone G, Panunzi S, Gaetano A,etal. Bariatric surgery versus conventional medical therapy for type 2 diabetes[J]. NEJM,2012,366(17):1577-1585.
[10] 中国医师协会外科医师分会肥胖和糖尿病外科医师委员会.中国肥胖和2型糖尿病外科治疗指南(2014)[J].中国实用外科杂志,2014,34(11):1005-1006.
[11] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南[M]. 北京:北京大学医学出版社,2010:26-29.
[12] 郝婉婷,高宏凯. 2型糖尿病伴肥胖患者血糖管理过程中情感体验的质性研究[J]. 医学与哲学,2015,36(8B):87-88
[13] German P J, E wisse B, Thaler P J,etal. Leptin deficiency causes insulin resistance induced by uncontrolled diabetes[J]. American Diabetes Association,2010, 59(7): 1626.
[14] Schauer P R, Kashyap SR, Wolski K,etal.Bariatric surgery versus intensive medical therapy in obese patients with diabetes[J].NEJM,2012,366(17):1567-1576.
[15] Qin J,Cui Y,Zhao X,etal.Identification of the shiga toxin-producing escherichia coli 0104:H4 strain responsible for a food poisoning outbreak in Germany by PCR [J]. Clin Microbiol, 2011,49 (9): 3439-3440.
