糖胁迫下鲁氏接合酵母的代谢指纹分析
2018-06-26韩晓江徐志娇岳田利魏建平袁亚宏
韩晓江,徐志娇,岳田利,牛 晨,魏建平,蔡 瑞*,袁亚宏*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
鲁氏接合酵母(Zygosaccharomyces rouxii)是一类能够在高渗透压培养条件下(高糖或高盐环境中)生长的酵母菌。鲁氏接合酵母在pH值为1.5~7.5的范围内均可以生长,最适生长的pH值为3.0~4.0。在温度为15~35 ℃的范围内能够生长,最适生长的温度为25~30 ℃[1]。鲁氏接合酵母可以用来生产发酵食品,也存在于高糖食品中,在合适条件下能够引起高糖食品腐败变质。由于高糖环境对高渗酵母生长具有抑制作用,高渗酵母污染高糖食品后生长比较缓慢,但是贮存温度的快速变化会导致高糖食品表面生成冷凝水,从而降低糖浓度,加速高渗酵母在高糖食品表面的生长[2]。
目前对鲁氏接合酵母的研究主要集中在两个方面:一是高渗酵母耐高渗机理的研究,代谢通路以及基因分子;二是高渗酵母发酵的应用,对食品的危害以及控制方面等。郑聃等[3]研究得出酿酒酵母和鲁氏接合酵母细胞内积累的海藻糖含量均随着NaCl浓度的升高而递增,2 种酵母菌胞内甘油含量均随胁迫盐浓度的增加而上升,在0.9 mol/L NaCl胁迫下胞内甘油含量均达到最高值,当NaCl浓度大于0.9 mol/L时胞内甘油含量均有所下降。Tikam等[4]研究发现在盐和糖条件下,鲁氏接合酵母产生甘油和阿拉伯糖醇,如果糖用作应激剂而不是盐,则D-阿拉伯糖醇高度产生和积累,而甘油浓度保持不变。Hosono[5]研究发现在15 g/100 mL NaCl溶液条件下,相对于基本培养基,细胞膜脂肪酸C16∶1、C18∶1含量增加,C18∶0、C18∶2含量减少,脂肪酸不饱和度降低,麦角甾醇含量增加了2.9 倍,麦角甾醇对磷脂比率增加了5 倍。Guo Hong等[6]对不同糖度条件下鲁氏接合酵母细胞总蛋白进行了研究,发现168 个蛋白点不同,鉴定出47 个蛋白点,这些蛋白参与糖代谢、能量代谢、氨基酸代谢等。Wei Yonghua等[7]利用基因组改组获得高度耐盐的鲁氏接合酵母突变株,其在盐条件下增强ZrGPD1转录并降低ZrFPS1的转录,研究发现鲁氏接合酵母在盐条件下都依赖甘油生产的感应和抑制促进甘油通过质膜扩散。此外,对鲁氏接合酵母的应用方面也有所研究,利用鲁氏接合酵母发酵生产中间代谢产物以及酿造酱油等。Taing等[8]研究发现,30%葡萄糖、初始pH 5.0和25 ℃培养温度时,鲁氏接合酵母发酵产生的苹果酸和琥珀酸量最大。吴雅男[9]研究在不同酱油酿造工艺中分别添加鲁氏接合酵母S和S3-2并考察其风味物质变化,实验结果表明,添加酵母组检测到的风味物质的种类和含量均多于空白组,说明添加鲁氏接合酵母对酱油的酿造其风味物质有着重要作用。在含糖量较高的果汁中,较低的水分活度能够抑制腐败菌和致病菌的生长[10],但高渗酵母能够继续生长,从而对果汁的品质造成一定的影响。主要包括以下3 个方面:1)高渗酵母为适应高渗环境,代谢一些相容性物质,如生成强烈的酒精等令人不愉快气味,引起果汁浑浊,颜色加深,在果汁表面形成菌膜或在果汁底部形成白色沉淀,破坏果汁的感官风味并降低其营养价值[11];2)高渗酵母代谢过程中产生CO2等气体,会引起胀袋胀气,从而使果汁发生腐败,危害消费者健康[12];3)高渗酵母生长过程中会代谢掉糖类等固形物质,使果汁中的固形物含量降低,果汁中溶质的溶解性发生变化,从而使水分活度升高,致使腐败菌生长,导致产品质量不合格,造成企业损失。
近年来,很多学者从鲁氏接合酵母产生的甘油、海藻糖,细胞壁、细胞膜以及蛋白质方面研究鲁氏接合酵母耐高渗的机理,尚鲜有从鲁氏接合酵母在糖质量分数80%的高渗培养条件下所产生的细胞外、胞内全物质进行研究的报道。本研究采用顶空固相微萃取法和气相色谱-质谱技术联用对鲁氏接合酵母胞外物质检测分析,利用硅烷化衍生-气相色谱-质谱联用技术对鲁氏接合酵母胞内物质检测分析,可见分光光度计测定酵母生长OD值,采用主成分分析(principal components analysis,PCA)、正交偏最小二乘方判别分析(partial least squares discriminant analysis,PLS-DA)模型进行得分分析,对其物质差异性分析,为研究鲁氏接合酵母耐高糖渗透压提供理论依据;对酵母胞内外代谢指纹分析,从物质成分角度阐述鲁氏接合酵母耐高渗;此外,本研究对高糖环境下食品受到鲁氏接合酵母污染的检测及其污染控制都有重要的意义。
1 材料与方法
1.1 材料与试剂
鲁氏接合酵母1130、酿酒酵母2#(Saccharomyces cerevisiae)均由西北农林科技大学食品学院健康食品制造与安全控制工程实验室提供。
葡萄糖、蛋白胨、酵母浸粉(均为分析纯)北京奥博星生物技术有限责任公司;甲基盐酸盐、N-甲基-N-三甲基硅烷三氟乙酰胺(N-methyl-N-(trimethylsilyl)trifluoroacetamide,MSTFA) 上海源叶生物有限公司;3-辛醇(气相色谱标准品,纯度>98%) 日本东京化成工业株式会社;吡啶 天津市科密欧化学试剂有限公司;氯化钠(分析纯) 四川西陇化工有限公司。
1.2 仪器与设备
HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;YXQ-LS-70A型立式压力蒸汽灭菌器上海博迅实业有限公司医疗设备厂;UV-1700紫外-可见分光光度计、120150-T230L气相色谱-质谱联用仪 日本岛津公司;MD200-1氮吹仪 杭州奥盛仪器有限公司;YT-CJ-2ND型超净工作台 北京亚泰科隆仪器技术有限公司;ZWY-240恒温培养振荡器 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 菌种的活化与培养
将保存在甘油管的鲁氏接合酵母1130、酿酒酵母2#自然条件下解冻后,置于灭菌后的YPD培养基中进行活化,于28 ℃、120 r/min摇床中培养24 h。取第1代活化的种子液以2%的接种量接种于灭菌完成的YPD液体培养基中,28 ℃、120 r/min摇床中进行培养,待菌液浓度达到108CFU/mL后,作为种子液待用。分别配制糖质量分数2%(基本培养条件)、80%(高渗培养条件)的YPD培养基,鲁氏接合酵母接种量2%分别接种于2%(记为Z1)、80%(记为Z2)糖的YPD培养基中,酿酒酵母以2%接种量接种于2%糖(记为S1)的YPD培养基中,于28 ℃、120 r/min摇床中进行培养。期间定时取样测OD值,并取对数期样品进行实验。
1.3.2 酵母生长情况分析
根据王虎玄等[11]对鲁氏接合酵母生长的研究,采用YPD平板涂布稀释法进行计数,取样采用紫外分光光度计在600 nm波长下测定OD值,重复3 次,取平均值。
1.3.3 胞外物质的测定
1.3.3.1 样品制备与前处理
根据宋江等[13]测定方法进行改进。YPD培养基培养的菌液生长到对数期时,取4 mL于10 mL离心管中10 000 r/min离心10 min,上清液转移至固相萃取样品瓶中,每个样品瓶中加入1.2 g氯化钠、3 μL质量浓度为3.267 mg/L的3-辛醇溶液,上机测定。
1.3.3.2 色谱条件
色谱柱:DB-17MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);采用自动进样,进样口温度250 ℃,载气为He,流速1.8 mL/min,不分流进样。程序升温:起始温度40 ℃,保持3 min后以4 ℃/min的速度升温至120 ℃,再以6 ℃/min的速度升温至240 ℃,保持9 min。
1.3.3.3 质谱条件
电子电离源,电子能量为70 eV,离子源温度为230 ℃,接口温度为230 ℃,质量扫描范围m/z 35~500。
1.3.4 胞内物质的测定
1.3.4.1 胞内物质的淬灭与提取
根据Kim等[14]测定方法进行改进。菌液培养至对数期,取5 mL菌液缓慢加入到含20 mL预冷(-20 ℃)淬灭试剂(体积分数60%甲醇溶液)的50 mL离心管中,于-20 ℃淬灭30 min,4 ℃、10 000 r/min离心5 min,取出倒掉上清液,用5 mL清洗剂进行清洗2 次,离心5 min,去上清液。2.5 mL无水甲醇(-40 ℃)重悬酵母泥,冷冻3 次,离心5 min,吸取上清液,再加2.5 mL无水甲醇(-40 ℃),涡旋30 s,离心5 min,合并两次上清液,氮气吹干。
1.3.4.2 胞内物质的衍生
离心管中淬灭、提取的胞内物经氮气吹干后,向每个离心管中加入100 μL含20 mg/mL甲基盐酸盐的吡啶溶液,30 ℃水浴2 h,进行污化反应。反应结束后,再向每个样品中加入100 μL的MSTFA溶液,37 ℃水浴反应30 min,过0.22 μm滤膜,上机测定。
1.3.4.3 色谱条件
色谱柱:DB-17MS毛细管色谱柱(60 m×0.25 mm,0.25 μm);采用自动进样,进样口温度270 ℃,载气为He,不分流进样,进样体积1 μL,程序升温:起始温度150 ℃,保持2 min,以5 ℃/min的速度升温至270 ℃,保持24 min。
1.3.4.4 质谱条件
电子电离源,电子能量为70 eV,离子源温度为250 ℃,接口温度为280 ℃,质量扫描范围m/z 80~500。
1.3.5 定性与定量
气相色谱-质谱测定的图谱,根据保留时间、NIST14质谱数据库和相似度对检测出的各个物质进行匹配,相似度大于80的物质作为检测出物质成分进行定性分析。胞外物质成分根据加入的3-辛醇含量,计算检测出的各个物质含量,重复取平均值。

1.4 数据处理
数据用Excel软件处理,SIMCA-P软件对各物质做PCA模型、PLS-DA模型分析。
2 结果与分析
2.1 鲁氏接合酵母、酿酒酵母生长期间OD值变化
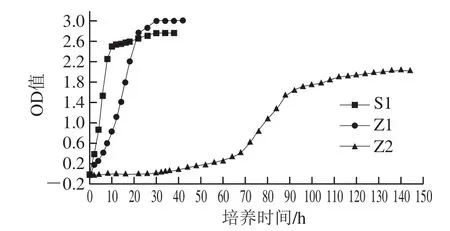
图1 酵母生长期间OD值变化Fig.1 Changes in OD value during yeast growth
由图1可知,Z2的适应期时间基本在45 h,这与王虎玄等[11]研究的温度与pH值条件对鲁氏接合酵母生长影响的研究适应趋势基本一致,在80%高糖质量分数条件下,鲁氏接合酵母为了适应高渗环境,会改变细胞组成以及产生相容性物质抵御高渗环境带来的冲击。此研究中,渗透压较高,适应时间在45 h左右,Z2在45~70 h处于缓慢生长,70~100 h生长速率较快,此时期也处于对数时期,后期生长变慢趋于稳定。S1、Z1的适应时间较短,S1在12 h后对数期就结束,生长较慢趋于稳定,Z1的适应时间比S1长2 h,在24 h后生长变慢趋于稳定,但到稳定期时Z1比S1的OD值高,可以达到3.01,而S1趋于稳定时OD值为2.78,Z2达到稳定期时OD值为2.01。
2.2 胞外物质成分分析
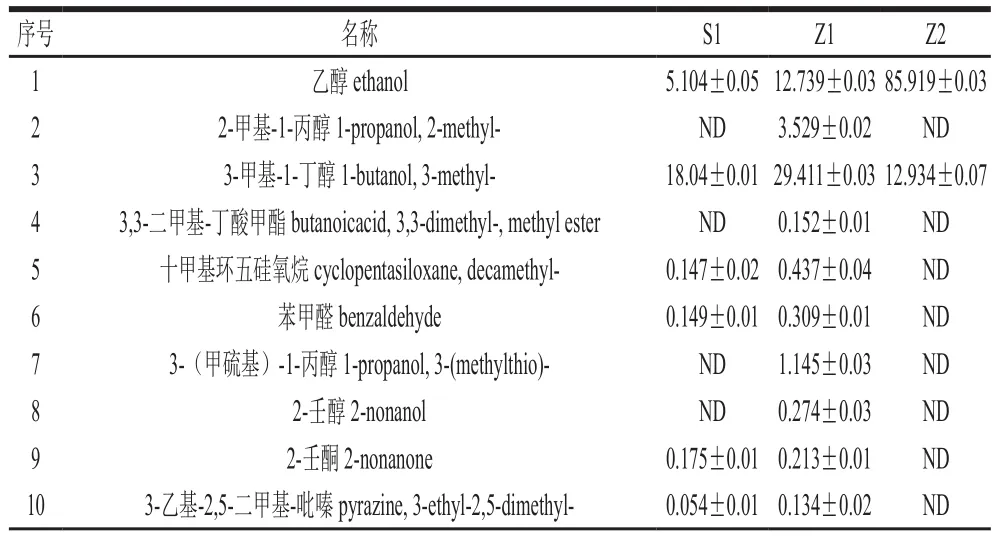
表1 S1、Z1、Z2发酵胞外物质成分及其质量浓度Table1 Concentrations of extracellular compounds from Z. rouxii and S. cerevisiae mg/L
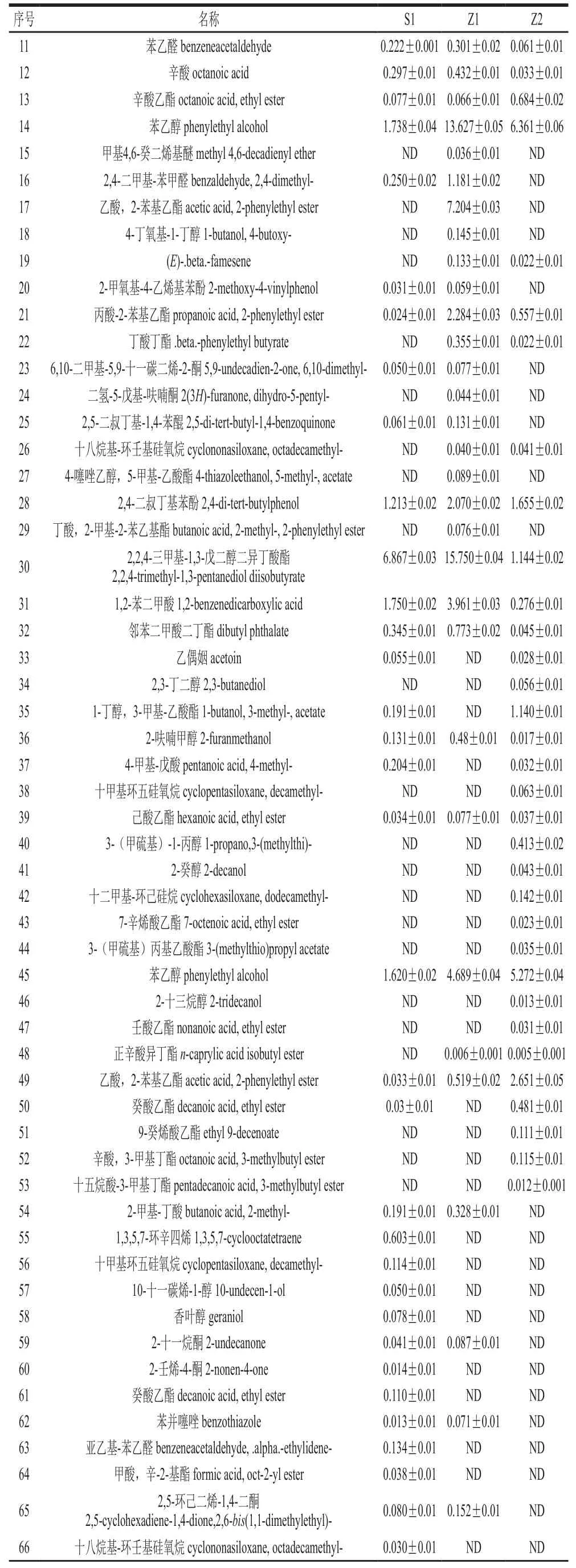
续表1 mg/L

续表1 mg/L
如表1所示,Z2共36 种,其中醇类9 种,酯类16 种,酸类3 种,无酮类物质;Z1共47 种,其中醇类9 种,酯类12 种,酸类5 种,酮类6 种;S1共45 种,其中醇类9 种,酯类10 种,酸类5 种,酮类6 种。在Z2以醇类、酯类居多,与Z1、S1比较没有产生酮类化合物。
2.3 胞外物质的PCA
根据已有报道[15-16]利用PCA、PLS-DA模型对检测物质的分析,采用无监督的PCA模型对S1、Z1、Z2胞外物质分析,见图2。

图2 S1、Z1、Z2发酵胞外物质PCA图Fig.2 PCA score plot of extracellular substances from Z. rouxii and S. cerevisiae
软件自动对数据进行模型拟合分析,共获得2 个主成分,R2X=0.881,Q2=0.702。由图2可以观察到,S1、Z1、Z2分别分布在PCA得分图不同的区域,显示S1、Z1、Z2具有显著差异。一般来说R2X值大于0.4表示该模型可靠,此研究中PCA的R2X=0.881,因此当前PCA模型能可靠地用于解释S1、Z1、Z2样本之间的差异性。
2.4 胞外物质的PLS-DA分析
采用有监督的PLS-DA模型对S1、Z1、Z2胞外物质进行更进一步分析[17-20],见图3。并通过PLS-DA模型VIP(variable importance in the projection)值(阈值>1)寻找它们之间的差异物质,PLS-DA模型主成分的VIP值如图4所示。
从图3可以观察到,S1、Z1、Z2在得分图可以完全分开,R2=0.996 7,Q2=0.980 7,两者都接近1,说明所建模型可信度高,Z1、Z2在得分图完全分开,说明80%糖的高渗透压与2%糖条件下鲁氏接合酵母生长所产生的物质有显著差异;S1、Z1是在2%糖条件下生长的不同菌种,两者也可以分开,说明不同的菌种也有显著差异。Z2能够在高渗透压下生长,为了筛选出受高糖渗透压影响的标志性代谢物,选取VIP值大于1的差异变量,并是Z2产生的物质,43、44、46、53、51、40和41号物质,即7-辛烯酸乙酯、3-(甲硫基)丙基乙酸酯、2-十三烷醇、十五烷酸-3-甲基丁酯、9-癸烯酸乙酯、3-(甲硫基)-1-丙醇、2-癸醇7 种物质,同时这些醇类、酯类也赋予了特殊的气味和风味。在高渗培养条件下,为了适应高渗环境,鲁氏接合酵母会产生一些特殊的物质来抵御高渗环境,主要是醇类物质,此研究检测出3 种醇类物质。

图3 S1、Z1、Z2发酵胞外物质PLS-DA图Fig.3 PLS-DA score plot of extracellular substances from Z. rouxii and S. cerevisiae
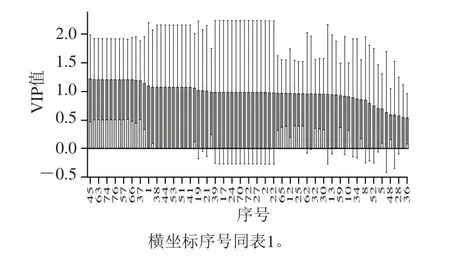
图4 PLS-DA模型主成分的VIP值Fig.4 VIP values of principal components in the PLS-DA model
2.5 胞内物质成分分析
对Z1、Z2培养至对数期的菌液淬灭、提取、硅烷化衍生后,气相色谱-质谱联用上机测样,根据NIST 14质谱数据库对各物质进行匹配,进行定性分析,挑选匹配度大于80的物质,其分类及百分比见表2,Z1、Z2各物质成分见表3。
鲁氏接合酵母为了适应高渗环境,会产生一些相容性物质使细胞能够适应高渗透压环境,生长时期、碳源、氮源不同,产生的物质种类和含量也会有差别[21],主要是一些醇类、糖类物质,还会有酮类物质。由表2可以看出,Z2与Z1相比较,物质数量减少,醇类物质增加了2 种,但百分占比较Z1低,酸类物质百分占比无太大变化;酯类物质Z2比Z1物质少了6 种,百分占比降低至13.72%,降低幅度较大,这也说明鲁氏接合酵母实际运用中,在基本的葡萄糖含量条件下产生的酯类种类含量较高,在酱油生产中,鲁氏接合酵母能够产生较多的风味物质[22];糖类种类及含量增加,鲁氏接合酵母为了适应高糖环境,会产生海藻糖、中间代谢的麦芽糖及其他糖类物质,来抵御外界的高渗环境,产生的糖类物质促进了鲁氏接合酵母在高糖环境下的生长,同时氨基酸百分占比增加。研究结果表明,Z2产生的醇类、糖类、氨基酸类物质是主要增加的物质,Tikam等[4]综述的鲁氏接合酵母对食品中糖胁迫下的反应会使酵母细胞产生甘油等醇类、海藻糖等糖类以及代谢物变化,与本研究相似。表3中Z1、Z2产生的相同物质有23 种,Bubnova等[23]研究鲁氏接合酵母耐盐调节方式中,检测到甘油、海藻糖的含量是动态变化的,但一直存在鲁氏接合酵母生长中,在本研究Z1、Z2产生的不同物质中,也检测到甘油、海藻糖。产生的麦芽糖也在一定程度上促进鲁氏接合酵母耐高渗,以麦芽糖为底物,海藻糖在海藻糖合成酶催化下以TreS途径进行生物合成[24],本研究Z2产生的麦芽糖说明海藻糖在高糖环境下是以TreS途径合成的海藻糖。Z1、Z2都检测到角鲨烯,说明两者都在生长过程生成了角鲨烯,但在不同物质中,Z1检测到了胆固醇,而Z2检测到的是羊毛固醇,鲨烯可以与固醇载体蛋白接合,经加氧酶、环化酶催化反应,生成羊毛固醇,再经一系列氧化、脱羧、还原步骤,生成胆固醇,Z1产生了胆固醇,说明此反应链完整;Z2只产生了羊毛固醇,研究表明,在高糖条件下,胆固醇反应链被切断或者还没到胆固醇的合成这一步骤,也有可能羊毛固醇这一物质能够抵御高渗环境,羊毛固醇在此反应链中积累,而不再进行下一步反应。Z1产生了尿素、戊二胺、丁二胺等含氮物质,Z2并没有产生含氮的化合物,高糖渗透环境下鲁氏接合酵母对氮的代谢有所减弱,说明高糖影响了氮代谢。酪氨酸脱氨基可以参与延胡索酸的合成,赖氨酸参与乙酰CoA的合成,半胱氨酸参与丙酮酸的合成,说明在高糖环境下产生的这些氨基酸间接影响了鲁氏接合酵母耐高渗,此外,景天庚酮糖、木糖醇、D-木糖、D-半乳糖也可参与碳水化合物的代谢[25-30]。

表2 Z1、Z2胞内物质种类Table2 Classes of intracellular materials from Z. rouxii

表3 Z1、Z2胞内物质成分Table3 Comparison of intracellular materials from Z. rouxii under two culture conditions
3 结 论
在高糖渗透压下,鲁氏接合酵母Z2适应期达45 h,菌体呈对数生长,生长100 h后趋向稳定,但生长稳定后,其OD值低于基本培养条件下的OD值。
采用固相微萃取,通过气相色谱-质谱检测酵母胞外物质,高渗培养条件下鲁氏接合酵母共有36 种;基本培养条件下鲁氏接合酵母共有47 种;基本培养条件培养酿酒酵母共45 种。得到高渗培养条件下鲁氏接合酵母的特征性物质为7-辛烯酸乙酯、3-(甲硫基)丙基乙酸酯、2-十三烷醇、十五烷酸-3-甲基丁酯、9-癸烯酸乙酯、3-(甲硫基)-1-丙醇、2-癸醇。
采用硅烷化衍生处理,气相色谱-质谱检测酵母胞内物质,高糖渗透压与基本培养条件下鲁氏接合酵母产生了27 种不同的物质,没有产生含氮化合物,氮代谢受到了影响,此外这些物质参与糖代谢、能量代谢,其中海藻糖在高糖环境下是以TreS途径合成的海藻糖。本研究为后续研究鲁氏接合酵母耐高糖渗透压提供了理论依据,对鲁氏接合酵母的检测以及控制都有重要的意义,对于产生的差异性物质诱导基因的形成和其耐高渗机理还需进一步研究。
[1] 白静, 岳田利, 王虎玄, 等. 射频加热杀灭浓缩苹果汁中鲁氏接合酵母的工艺优化[J]. 农业工程学报, 2016, 32(2)∶ 273-279.DOI∶10.11975/j.issn.1002-6819.2016.02.039.
[2] 李国良. 浓缩苹果汁中耐高渗酵母的检测与控制技术[D]. 杨凌∶ 西北农林科技大学, 2012.
[3] 郑聃, 付畅, 戴绍军, 等. 盐胁迫下酿酒酵母和鲁氏酵母渗透调节方式的对比与分析[J]. 哈尔滨师范大学自然科学学报, 2007, 23(2)∶91-95.
[4] TIKAM C D, LISA S, PAOLO G. Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii[J].International Journal of Food Microbiology, 2014,185∶ 140-157.DOI∶10.1016/j.ijfoodmicro.2014.05.015.
[5] HOSONO K. Effect of salt stress on lipid composition and membrane fluidity of the salttolerant yeast Zygosaccharomyces rouxii[J].Journal of General and Applied Microbiology, 1992, 138(1)∶ 91-96.DOI∶10.1099/00221287-138-1-91.
[6] GUO H, NIU C, LIU B, et al. Protein abundance changes of Zygosaccharomyces rouxii in different sugar concentrations[J].International Journal of Food Microbiology, 2016, 233∶ 44-51.DOI∶10.1016/j.ijfoodmicro.2016.05.003.
[7] WEI Y H, WANG C, WANG M, et al. Comparative analysis of salttolerant gene HOG1 in a Zygosaccharomyces rouxii mutant strain and its parent strain[J]. Journal of the Science of Food & Agriculture,2013, 93(11)∶ 2765-2770. DOI∶10.1002/jsfa.6096.
[8] TAING O, TAING K. Production of malic and succinic acids by sugartolerant yeast Zygosaccharomyces rouxii[J]. European Food Research &Technology, 2007, 224(3)∶ 343-347. DOI∶10.1007/s00217-006-0323-z.
[9] 吴雅男. 酱油鲁氏酵母S、S3-2关键风味代谢物对比研究[D]. 天津∶天津科技大学, 2015.
[10] SPERBER W, DOYLE M P. Compendium of the microbiological spoilage of foods and beverages[M]. Springer, 2009. DOI∶10.1007/978-1-4419-0826-1.
[11] 王虎玄, 胡仲秋, 牛晨, 等. 糖度与酸度对鲁氏接合酵母生长的影响[J]. 农业机械学报, 2015, 46(10)∶ 279-284. DOI∶10.6041/j.issn.1000-1298.2015.10.037.
[12] MARTORELL P, STRATFORD M, STEELS H, et al. Physiological characterization of spoilage strains of Zygosaccharomyces bailii, and Zygosaccharomyces rouxii, isolated from high sugar environments[J].International Journal of Food Microbiology, 2007, 114(2)∶ 234-242.DOI∶10.1016/j.ijfoodmicro.2006.09.014.
[13] 宋江. 酱油酿造用鲁氏接合酵母菌的生长及其产香气成分研究[D].长沙∶ 湖南农业大学, 2013.
[14] KIM S, KIM J, SONG J H, et al. Elucidation of ethanol tolerance mechanisms in Saccharomyces cerevisiae by global metabolite profiling[J]. Biotechnology Journal, 2016, 11(9)∶ 1221-1229.DOI∶10.1002/biot.201500613.
[15] 孙茂成. 保加利亚乳杆菌代谢组学样品的前处理研究[D]. 哈尔滨∶东北农业大学, 2013.
[16] 练荣伟. 代谢物对微生物调控作用的色谱-质谱联用分析[D]. 大连∶大连工业大学, 2013.
[17] CUI F X, ZHANG R M, LIU H Q, et al. Metabolic responses to Lactobacillus plantarum, contamination or bacteriophage treatment in Saccharomyces cerevisiae, using a GC-MS-based metabolomics approach[J]. World Journal of Microbiology and Biotechnology, 2015,31(12)∶ 2003-2013. DOI∶10.1007/s11274-015-1949-4.
[18] HARADA R, YUZUKI M, ITO K, et al. Influence of yeast and lactic acid bacterium on the constituent profile of soy sauce during fermentation[J]. Journal of Bioscience & Bioengineering, 2017,123(2)∶ 203-208. DOI∶10.1016/j.jbiosc.2016.08.010.
[19] ZHAO J, DAI X, LIU X, et al. Comparison of aroma compounds in naturally fermented and inoculated Chinese soybean pastes by GC-MS and GC-olfactometry analysis[J]. Food Control, 2011, 22(6)∶ 1008-1013. DOI∶10.1016/j.foodcont.2010.11.023.
[20] QI W, GUO H L, WANG C L, et al. Comparative study on fermentation performance in the genome shuff l ed Candida versatilis and wild-type salt tolerant yeast strain[J]. Journal of the Science of Food & Agriculture, 2016, 97(1)∶ 284-290.
[21] 徐莹, 姜维, 何晓霞. 耐盐性鲁氏酵母的研究进展[J]. 中国酿造,2009, 28(10)∶ 1-4. DOI∶10.3969/j.issn.0254-5071.2009.10.001.
[22] 王聪, 王檬, 赫景钰, 等. 酱油酿造风味菌株T酵母耐盐机理的初步研究[J]. 中国酿造, 2015, 34(2)∶ 26-30. DOI∶10.11882/j.issn.0254-5071.2015.02.006.
[23] BUBNOVA M, ZEMANCIKOVA J, SYCHROVA H. Osmotolerant yeast species differ in basic physiological parameters and in tolerance of non-osmotic stresses[J]. Yeast, 2014, 31(8)∶ 309-321. DOI∶10.1002/yea.3024.
[24] 王继花. 盐胁迫下酿酒酵母生理生化特性的研究[D]. 大连∶ 大连工业大学, 2008.
[25] TOMASZEWSKA L, RYWINSKA A, GLADKOWSKI W.Production of erythritol and mannitol by Yarrowia lipolytica yeast in media containing glycerol[J]. Journal of Industrial Microbiology &Biotechnology, 2012, 39(9)∶ 1333-1343. DOI∶10.1007/s10295-012-1145-6.
[26] 杨阳, 邓岳, 刘彦希, 等. 一株酱油中耐盐酵母Meyerozyma guilliermondii的分离鉴定及其挥发性香气成分分析[J]. 中国测试,2016, 42(11)∶ 55-59. DOI∶10.11857/j.issn.1674-5124.2016.11.012.
[27] 张继冉, 方芳, 陈坚, 等. 鲁氏接合酵母对酱油中氨基甲酸乙酯前体物的代谢[J]. 微生物学报, 2016, 56(6)∶ 956-963. DOI∶10.13343/j.cnki.wsxb.20150394.
[28] 谢梦琴. 盐胁迫下鲁氏接合酵母产MAP酶条件优化与其耐盐机理的研究[D]. 长沙∶ 湖南农业大学, 2014.
[29] 闫美. 高耐盐酱油酵母的选育及其在酱油酿造中的应用[D]. 武汉∶湖北工业大学, 2014.
[30] 王伟伟, 唐鸿志, 许平. 嗜盐菌耐盐机制相关基因的研究进展[J].微生物学通报, 2015, 42(3)∶ 550-558. DOI∶10.13344/j.microbiol.china.140528.
