高效液相色谱-串联质谱法检测鲜冻肉中违禁注水药物
2018-06-26李志刚马燕红李莹莹郭文萍
李志刚,任 南,马燕红*,李莹莹,郭文萍
(中国肉类食品综合研究中心,北京 100068)
注水肉[1]是少数不法商贩在利益的驱动下,在宰前或宰后对牲畜人为地采用注射器、压力泵等工具,对猪、牛、羊等注入一定量的水分,以此增加酮体的质量[2-3]。不洁净的水进入肌体会引起体细胞膨胀性的破裂,导致蛋白质流失,降低的肉的品质;注水后易造成病原微生物的污染,不仅使肉的营养成分受到破坏,而且还将产生大量的细菌毒素,甚至引入非肉源性污染物[4],食用后会对食用者的身体造成伤害[5-8]。
目前仅依据水分含量是否超过GB 5009.3—2016《食品中水分的测定》判定是否为注水肉。但畜禽肉类水分含量是一个很复杂的问题,水分含量受饲养方式、肉的部位、宰杀方式、销售形式等因素影响[9]。前人采用感官判别法、试纸法[10-11]、近红外法[12-13]、低场核磁共振法[14-15]、传感器法[16]等鉴别注水肉。但目前仍无可行的注水肉判别方法。
畜肉注水通常是活体注入,利用机械泵等强行向动物体内灌水,此时由于外部的刺激,动物体就会由于疼痛而产生应激反应,在这种条件下宰杀的畜肉会出现如白肌肉等品质较差的肉,大大影响肉的销售质量。为了提高肉的质量,确保肉的感官状态良好,同时躲避监管及处罚,不法商贩对注水方式进行改良,在注水的同时,为猪、牛、羊等注射一些保水药物和消炎药物,便于肌肉蓄积大量水分,并缓解其疼痛感。目前报道的用于猪肉保水剂的药物有阿托品、东莨菪碱、山莨菪碱、利多卡因、普鲁卡因和沙丁胺醇等[17-18]。残留的药物毒性较大,会引起如反应迟顿、精神衰颓、昏迷、口干、瞳孔放大等症状[19-21]。该种作案手法不但隐蔽,而且大大改善了畜肉保水的效果,也降低了被查处的风险,同时也增加了监管的难度。
畜肉中保水剂药物的检测方法较少,也未有任何相关的检测标准。国内外关于这类药物的检测也多见于医学领域[22-25]。所用的方法有气相色谱法、液相色谱-质谱联用法等[17,26-28]。为了严厉打击非法作案手段,加强畜肉屠宰、销售的监管,建立一种畜肉中阿托品、利多卡因、普鲁卡因、山莨菪碱、东莨菪碱、沙丁胺醇等药物准确、便捷的检测方法是非常必要且迫切的。
1 材料与方法
1.1 材料与试剂
阿托品、利多卡因、普鲁卡因、山莨菪碱、东莨菪碱、沙丁胺醇标准品(纯度≥98%),甲醇、乙腈(均为色谱纯) 上海安谱实验科技股份有限公司;磷酸二氢钾(分析纯) 国药集团化学试剂有限公司;水为一级水。
1.2 仪器与设备
1260超高效液相色谱-6470串联四极杆质谱仪 美国Agilent公司;S-100涡旋仪、SR-IIw振荡器 日本Taiyo公司;离心机 日本Hitachi公司;Milli-Q纯水仪 美国Millipore公司;Oasis HLB固相萃取柱 沃特世科技(上海)有限公司;固相萃取柱活化流程:甲醇+三级水活化;三级水淋洗,甲醇接收。
1.3 方法
1.3.1 溶液配制
标准溶液:分别准确称取各标准品10.0 mg,用甲醇配制成100 mg/L的标准储备液,4 ℃冷藏保存。
混合标准溶液:分别吸取各标准溶液适量,用甲醇配制成混合标准溶液。
标准工作溶液:用时将上述混合标准溶液用水逐级稀释为标准工作溶液,临用现配。
1.3.2 提取
称取试料5 g(精确至0.01 g)于50 mL具塞离心管中,加入10 mL 0.1 mol/L磷酸盐缓冲溶液,加盖后涡旋2 min,再用振荡器振荡10 min,以10 000 r/min离心10 min,上清液倒入25 mL容量瓶中。于残渣中再加入10 mL 0.1 mol/L磷酸盐缓冲溶液,同法操作,合并两次上清液。用0.1 mol/L磷酸盐缓冲溶液定容至刻线。
1.3.3 净化
取上清液5 mL至HLB小柱,以小于3 mL/min通过Oasis HLB小柱后,用5 mL水淋洗,弃去全部流出液,在65 kPa的负压下,减压抽干1 min,最后用5 mL甲醇洗脱,收集洗脱液,氮气吹干,加入1.00 mL甲酸-水(1∶99,V/V)溶液,涡旋0.5 min,过0.45 μm滤膜,供测定。
1.3.4 仪器条件
色谱条件:色谱柱:ZORBAX Eclipse Plus C18(2.1 mm×50 mm,1.8 μm);柱温:30 ℃;进样体积:5 μL;流动相A:甲酸-水(1∶99,V/V)溶液;流动相B:乙腈;流速:0.40 mL/min。洗脱梯度见表1。

表1 梯度洗脱程序Table1 Gradient elution program

表2 6 种药物的多反应监测质谱参数Table2 Mass spectrometric parameters in MRM mode for 6 drugs
质谱条件:电喷雾(electrospray ionization,ESI)离子源:正离子模式;毛细管电压:3 500 V;干燥气流速:8 L/min;喷针气压力:35 psi;喷嘴电压:500 V;干燥气温度:300 ℃;鞘气流速:11 L/min;鞘气温度:350 ℃;多反应监测参数见表2。
2 结果与分析
2.1 液相色谱及质谱条件的优化
6 种目标化合物的结构式如图1所示。6 个化合物均为弱极性化合物,在C18柱上有较好的保留。利多卡因、普鲁卡因和沙丁胺醇均含氨基,容易得到带正电荷的基团,在正模式下灵敏度较高,因此选取正ESI模式检测;在ESI+模式下,通过直接进样法,优化各化合物的质谱条件,确定各物质的母离子的质量数。实验结果发现:在ESI+模式下,化合物得到[M+H]+准分子离子峰,以此作为它们的母离子。在此基础上,选择两个丰度较高的子离子,并优化去簇电压和碰撞能量,最终选定定量分析的条件,结果见表2,6 种化合物定量离子流图见图2。
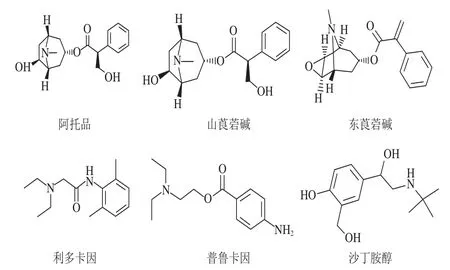
图1 目标化合物的结构式Fig.1 Structures of the target compounds
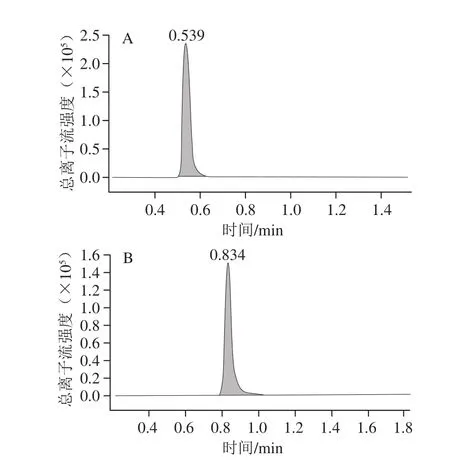

图2 6 种化合物定量离子流图Fig.2 MRM chromatograms of quantitative ion pairs for 6 compounds
2.2 提取条件优化
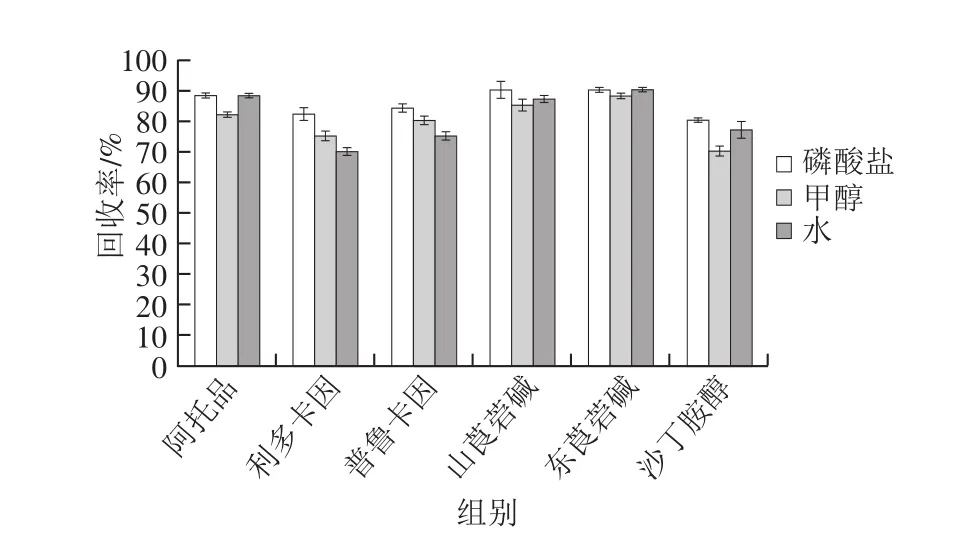
图3 提取剂对回收率的影响(n=3)Fig.3 Effect of extraction solvents on the recoveries (n = 3)
阿托品、山莨菪碱、东莨菪碱等含有活泼的羟基和酯基,普鲁卡因、利多卡因和沙丁胺醇为氨基化合物,均极易溶于甲醇和水。对比了甲醇、水、磷酸盐作提取溶剂,加标量为25 μg/kg时的回收率。图3表明,用磷酸盐缓冲液作提取溶剂时,平均回收率达到85%,故本实验选取磷酸盐缓冲液作为提取溶剂。
2.3 净化条件的选择与优化
由于动物源性食品基质复杂,选用固相萃取柱可以得到较好的净化效果。实验对比了HLB、C18柱、MCX柱对目标化合物的选择性。图4表明,HLB柱子对于磷脂和蛋白有较好的去除效果,对目标化合物(添加量为25 μg/kg)回收率均高于C18柱和MCX柱。

图4 SPE柱对回收率的影响(n=3)Fig.4 Effect of SPE columns on the recoveries (n = 3)
2.4 方法学结果
2.4.1 基质效应
基质效应是由基质中的共提取干扰物与目标化合物竞争电离所致[29],鲜冻肉等肉类由于其脂肪、蛋白含量比较高,在样品提取的过程中会由于这些复杂基质而对结果的检出限及回收率造成影响。因此通过配制空白基质曲线以及溶液标准曲线,根据基质效应来评价鲜冻肉的基质效应大小[30](基质效应/%=(基质匹配标准曲线的斜率/溶剂标准曲线的斜率-1)×100)。
根据评价指标,所得的数值为负值时表示基质效应为抑制,当所得数值为正值时表示基质效应为增强状态。由表3可见,沙丁胺醇、普鲁卡因、山莨菪碱、东莨菪碱、阿托品、利多卡因基质效应分别为12%、11.5%、9.8%、10.2%、10.9%、9.5%,6 种化合物的基质效应都在正的10%左右,因此考察回收率时,应考虑其基质效应。因此本实验通过配制基质标准曲线来扣除基质带来的影响。
2.4.2 线性与检出限和定量限
对6 种化合物质量浓度为0.25~50 μg/L的空白基质曲线进行测定,得到一系列不同质量浓度的色谱图,以响应值为纵坐标,化合物质量浓度为横坐标绘制不同化合物的线性方程以及r值,得到6 种化合物的标准曲线方程。同时根据3 倍信噪比确定6 种化合物的检出限;以10 倍信噪比确定6 种化合物的定量限,见表3。6 种药物在0.25~50 ng/mL范围内线性关系良好,线性相关系数均大于0.99,检出限和定量限分别为0.5 μg/kg和2.0 μg/kg。
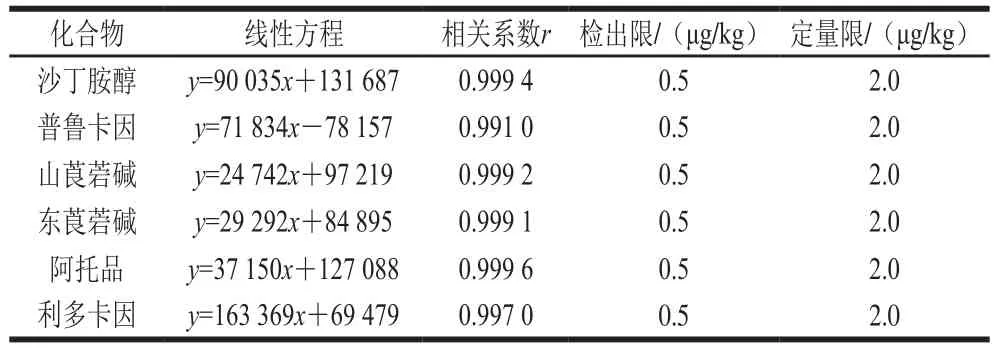
表3 6 种化合物的回归方程、相关系数、检出限、定量限Table3 Regression equations, correlation coeff i cients, LODs and LOQs for 6 drugs
2.4.3 加标回收率和精密度实验结果
称取空白样品6 份,每份5.0 g,分别添加2.0、25、50 µg/kg添加混合标准溶液后按1.3.2节和1.3.3节方法制备后进行测定,结果见表4。从表4可知,6 种物质回收率在78.07%~96.76%之间,相对标准偏差在0.4%~2.1%之间,回收率和精密度均符合实验要求。
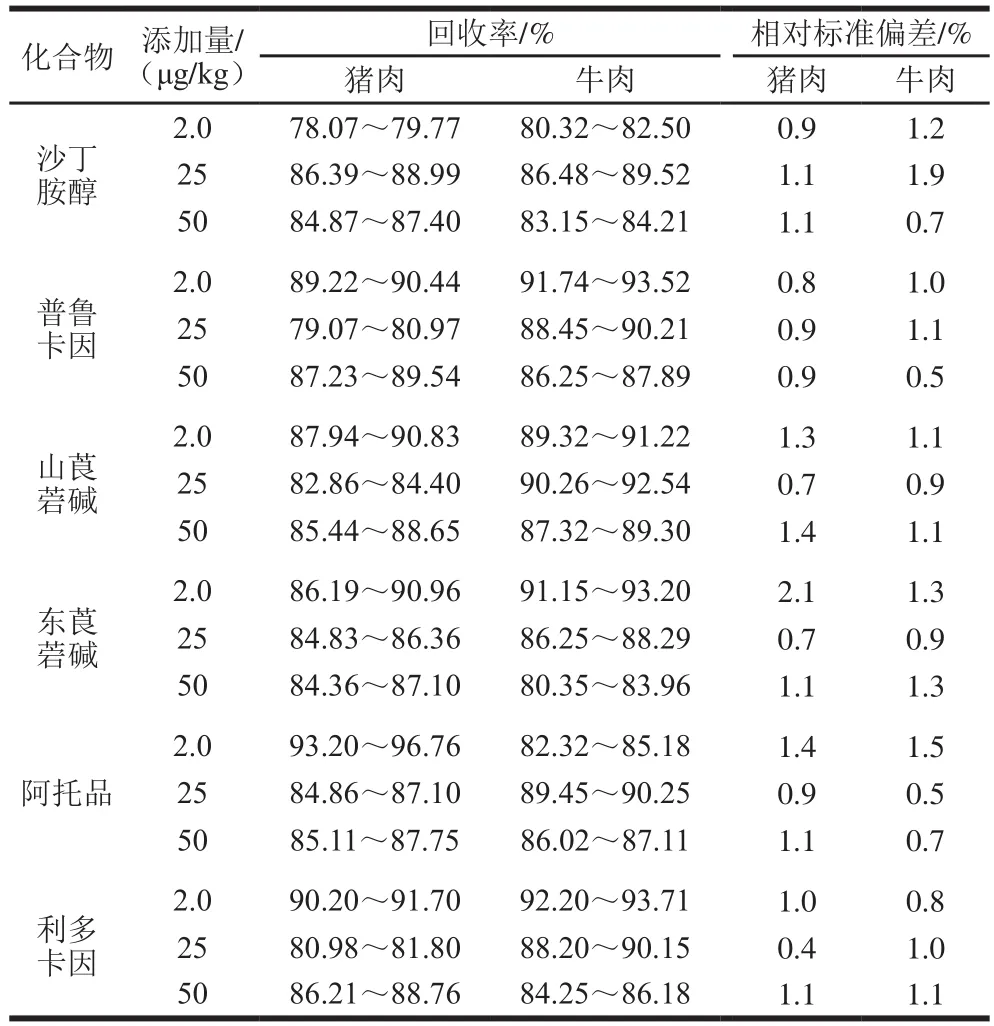
表4 不同基质中加标回收率结果(n=6)Table4 Recoveries of 6 drug spiked to different matrix samples (n= 6)
2.5 实际样品检测结果
采用此方法对市场上购买的60 件畜肉样品进行检测,种类包括牛肉、羊肉、猪肉,结果在1 件牛肉样品中检出普鲁卡因,含量为3.0 μg/kg,其余样品均未检出,同时对该阳性样品按照GB 5009.3—2016进行了水分测定,结果表明该样品水分超标。
3 结 论
本实验用液相色谱-串联质谱法同时测定畜肉中阿托品、山莨菪碱、东莨菪碱、利托卡因、普鲁卡因和沙丁胺醇6 种注水肉中的保水剂,方法简便、快速,最低检出限为0.5 μg/kg。系统的方法学评价结果表明,本方法准确、可靠,适用于畜肉中阿托品、山莨菪碱、东莨菪碱、利托卡因、普鲁卡因和沙丁胺醇的检测。考虑农业部235号公告中阿托品及普鲁卡因的使用要求,本检测方法仅作为注水肉判别的辅助手段,同时可为后续注水肉完善的鉴别方法提供帮助。
[1] 李春业, 姜艳霞, 江丽娜. 牛肉注水方式及鉴别方法[J]. 中国畜禽种业, 2009(9)∶ 31.
[2] 李巧玲, 刘景艳. 市场鲜猪肉掺假状况的调查监测[J]. 食品科学,2004, 25(10)∶ 273-276.
[3] 程灵豪, 王余良, 林绍伟. PSE肉、注水肉、注胶肉的主要危害及检验方法[J]. 浙江畜牧兽医, 2015(3)∶ 13-15. DOI∶10.3969/j.issn.1005-7307.2015.03.005.
[4] 王飒爽, 陈永超, 李文辉. 注水肉的危害及检验方法分析[J]. 现代农业科技, 2007(16)∶ 178-179.
[5] 林荣泉. 畜禽注水肉的特征与卫生检验[J]. 肉类研究, 2001, 15(3)∶38-51.
[6] BERTRAMH C, SCHAFER A, ROSENVOLD K, et al. Physical changes of signif i cance for early mortem water distribution in porcine M. longissimus[J]. Meat Science, 2004, 66(4)∶ 915-924. DOI∶10.1016/S0309-1740(03)00188-8.
[7] 仇国琴, 郭乃勇, 张艳. 注水肉的危害与控制措施[J]. 中国畜牧兽医文摘, 2014, 30(12)∶ 22; 76.
[8] 黄琴, 孙宏文, 陈志刚. “注水肉”泛滥的原因及控制措施[J]. 中国畜牧兽医文摘, 2012, 28(2)∶ 186; 148.
[9] 吴兆良. 猪肉水分限量标准与注水肉判断的研讨[J]. 肉类工业,2013(2)∶ 41-42.
[10] 蒋腾. 如何辨别注水肉[J]. 中国防伪报道, 2016(10)∶ 111-113.
[11] 黄玉萍, 陈桂云, 夏建春, 等. 注水肉无损检测技术现状与发展趋势分析[J]. 农业机械学报, 2015, 46(1)∶ 207-215. DOI∶10.6041/j.issn.1000-1298.2015.01.030.
[12] 郝冬梅, 周亚男, 王玉, 等. 基于可见-近红外光谱与稀疏表示的注水肉识别[J]. 光谱学与光谱分析, 2015, 35(1)∶ 93-98. DOI∶10.3964/j.is sn.1000-0593(2015)01-0093-06.
[13] MAJA P, MARJETA C P, DAJAN S. Predicting pork water-holding capacity with NIR spectroscopy in relation to different reference methods[J]. Journal of Food Engineering, 2010, 98(3)∶ 347-352.DOI∶10.1016/j.jfoodeng.2009.11.022.
[14] 王欣, 王志永, 陈利华, 等. 注水肉糜的低场核磁驰豫特性及判别分析[J]. 现代食品科技, 2016, 32(5)∶ 79-84. DOI∶10.13982/j.mfst.1673-9078.2016.5.013.
[15] GUDJONSDOTTIR M, ARASON S, RUSTAD T. The effects of pre-salting methods on water distribution and protein denaturation of dry salted and rehydrated cod-A low-field NMR study[J].Journal of Food Engineering, 2011, 104(1)∶ 23-29. DOI∶10.1016/j.jfoodeng.2010.11.022.
[16] 郭培源, 王昕琨, 林岩, 等. 基于多传感器信息融合的注水肉检测方法研究[J]. 激光与光电子学进展, 2013(7)∶ 1-7. DOI∶10.3788/LOP50.073002.
[17] 胡兴娟, 吴宁鹏, 孟蕾, 等. 超高效液相色谱-串联质谱法测定猪肉、猪肝及猪尿中的阿托品残留[J]. 中国兽药杂志, 2014, 48(7)∶ 46-49.
[18] 刘谷欲, 潘颖, 陈桂良. 猪血浆中阿托品含量的毛细管气相色谱测定[J]. 中国医药工业杂志, 2003, 34(5)∶ 241-242.
[19] 毛谊平, 任荣军, 吴高芬. 苍术中非法添加硫酸阿托品及氢溴酸东莨菪碱的检测方法[J]. 中国药业, 2010, 19(14)∶ 47-49. DOI∶10.3969/j.issn.1006-4931.2010.14.031.
[20] 韦寿莲, 莫金垣, 郑一宁. 一种简单快速的高效毛细管电泳分离检测山莨菪碱和多沙唑嗪的方法[J]. 分析化学, 2003, 31(2)∶ 225-228.
[21] AZIZI S N, CHAICHI M J, SHAKERI P, et al. Determination of atropine using Mn-doped ZnS quantum dots as novel luminescent sensitizers[J]. Journal of Luminescence, 2013, 144(12)∶ 34-40.DOI∶10.1016/j.jlumin.2013.05.054.
[22] CHEN H P, SAEZ J M, GONZALEZ R R, et al. Simultaneous determination of atropine and scopolamine in buckwheat and related products using modified QuEChERs and liquid chromatography tandam mass spectrometry[J]. Food Chemistry, 2017, 218∶ 173-180.DOI∶10.1016/j.foodchem.2016.09.075.
[23] SRAMSKA P, MACIEJKA A, TOPOLEWSKA A, et al. Isolation of atropine and scopolamine from plant material using liquid-liquid extraction and extrelut columns[J]. Journal of Chromatography B,2017, 1043∶ 202-208. DOI∶10.1016/j.jchromb.2016.09.003.
[24] SAEZ J M, GONZALEZ R R, FRENICH A G, et al. Enantiomeric determination and evaluation of the racemization process of atropine in Solanaceae seeds and contaminated samples by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2016, 1474∶ 79-84. DOI∶10.1016/j.chroma.2016.10.047.
[25] KOZELJ G, PERHARIC L, STANOVNIK L, et al. Simple validated LC-MS/MS method for the determination of atropine and scopolamine in plasma for clinical and forensic toxicological purposes[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 96∶ 197-206.DOI∶10.1016/j.jpba.2014.03.037.
[26] 刘谷歌, 潘颖, 陈桂良. 猪血浆中阿托品含量的毛细管气相色谱测定[J]. 中国医药工业杂志, 2003, 34(5)∶ 132-139. DOI∶10.3969/j.issn.1001-8255.2003.05.014.
[27] 胡兴娟, 吴宁鹏, 董瑞静, 等. UPLC-MS/MS测定4 种兽药制剂中非法添加阿托品的方法研究[J]. 中国兽药杂志, 2014, 48(7)∶ 49-52.
[28] 陈怀侠, 杜鹏, 韩凤梅, 等. 液相色谱-串联质谱法鉴定大鼠血浆中的阿托品及其代谢物[J]. 药物分析杂志, 2006, 26(10)∶ 1369-1372.DOI∶10.16155/j.0254-1793.2006.10.024.
[29] 曹亚飞, 康健, 常巧英, 等. QuEChERS结合液相色谱-串联质谱法快速测定奶酪种多种兽药残留[J]. 色谱, 2015, 33(2)∶ 132-139.DOI∶10.3724/SP.J.1123.2014.10022.
[30] 卜明楠, 石志红, 康健, 等. QuEChERS结合LC-MS/MS同时测定虾肉中72 种兽药残留[J]. 分析测试学报, 2012, 31(5)∶ 552-558.DOI∶10.3969/j.issn.1004-4957.2012.05008.
