大豆分离蛋白与寡糖静电相互作用及复合物乳化性的分析
2018-06-26樊雪静刘红玉迟玉杰
樊雪静,刘红玉*,迟玉杰
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆分离蛋白(soybean protein isolate,SPI)是天然乳化剂可以吸附在油水界面防止液滴的聚集,起到稳定乳状液的作用,常应用于食品加工业。但应用蛋白质作为乳化剂时易受到溶液的pH值、离子强度等外界环境的影响,不利于提高乳状液的稳定性[1]。当pH值达到等电点(约为4.8)时[2],由于静电排斥作用,液面蛋白质吸附层将减少而引起絮凝现象[3]。而酒水饮料大多数呈现酸性,从而限制了SPI在食品行业的应用。
研究表明,带相反电荷的蛋白质与糖类在离子强度较低(0.4 mol/L)的条件下由于静电吸引可以形成静电复合物,改变SPI表面带电情况,使之快速吸附到界面降低界面张力[4],提高乳化能力[5]。Grigoriev等[6]也证实了静电复合物在酸性条件下仍然有较强的功能,因为糖改变了复合物表面电荷与界面层厚度,增加液滴的亲水性和空间排斥力,从而改善乳状液的稳定性,且蛋白质与糖静电复合物的制备过程与糖基化反应相比,更为廉价与便捷,故可广泛应用于生产实践。由于蛋白质和糖在不同的pH值条件下会形成可溶性、液态凝聚性和不溶性3 种类型的复合物,且存在明显的转化区,一般利用浊度法鉴定蛋白质与糖的相互作用关键点pH值,并进行强度分析[7]。目前,利用蛋白质与果胶、卡拉胶、阿拉伯胶等为代表的阴离子多糖的相互作用研究复合物在乳状液中的应用已有一些报道[8-10]。但有关蛋白质与具有生理活性的非还原性寡糖相互作用构建新型食品体系的研究鲜见报道。寡糖(水苏糖和棉子糖)具有调节血脂、增加机体对矿物质的吸收、预防肝损伤、改善过敏性皮炎的功效,常用于保健食品和制药领域[11]。为此,通过控制蛋白质与糖形成复合物的结构,开发新型功能性食品配料,探究蛋白质与阴离子寡糖形成的可溶性静电复合物对蛋白质乳化性的影响,研制具有保健功效的天然乳化剂。
本研究将通过激光共聚焦显微技术、Zeta电位和浊度的测定研究SPI与寡糖(棉子糖和水苏糖)之间的静电复合过程及相行为,阐述其作用机理,确定SPI与寡糖相互作用形成可溶性静电复合物的条件,为蛋白质与寡糖混合体系的复合提供进一步的理论补充;内源荧光色谱法分析得出SPI与寡糖的相互作用程度;研究不同pH值条件下复合体系的乳化性及乳化稳定性。为提高和扩展蛋白质-寡糖体系的功能提供依据,拓宽两者的应用范围。
1 材料与方法
1.1 材料与试剂
SPI、大豆寡糖(纯度>98%) 郑州春信生物科技有限公司;大豆油(食品级) 哈尔滨九三集团;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,分析纯)美国Sigma公司;罗丹明B(分析纯) 天津市致远化学试剂有限公司。
1.2 仪器与设备
ALC-310.3电子分析天平、pHS-3C精密pH计 北京赛多利斯仪器系统有限公司;DK-98-II电热恒温水浴锅天津市泰斯特仪器有限公司;恒温磁力搅拌器 常州国华电器有限公司;BME100L高剪切混合乳化机 启东市长江机电有限公司;721分光光度计 上海元析仪器有限公司;TCS SP2激光共聚焦显微镜 德国Leica公司;F-4500荧光分光光度计 日本日立公司;Nano-ZS粒度电位分析仪 英国Malvern公司;GL-21M离心机上海市离心机械研究所。
1.3 方法
1.3.1 样品溶液的制备
准确称取100 g SPI、7.5 g寡糖分别溶于2 000 mL和1 000 mL蒸馏水中,配制成SPI质量浓度为5 g/100 mL、寡糖质量浓度为0.75 g/100 mL的储液,在室温下磁力搅拌3 h使可溶物充分溶解后放入4 ℃冰箱中水化过夜。取60 mL SPI储液与40 mL寡糖储液充分混合,得到SPI质量浓度为3 g/100 mL、寡糖为0.3 g/100 mL的SPI-寡糖复合溶液。取60 mL SPI储液稀释至100 mL得到3 g/100 mL的SPI溶液。调节SPI溶液、SPI-水苏糖和SPI-棉子糖复合溶液pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,并将样品溶液于90 ℃水浴锅中加热处理0.5 h。加热后剧烈振荡样品并迅速使其冷却至室温,得到不同pH值条件下的样品溶液[12]。
1.3.2 缓冲液的配制
配制0.1 mol/L的pH 3.0~6.0的柠檬酸-磷酸二氢钠缓冲液、pH 7.0~9.0的Tris-HCl缓冲液、pH 10.0的甘氨酸-HCl缓冲液。
1.3.3 Zeta电位的测定
分别取100 μL不同pH值处理的样品溶液用对应pH值缓冲液(0.1 mol/L)稀释50 倍,利用马尔文粒度电位分析仪对溶液中粒子所带电荷量进行测定。
1.3.4 SPI与SPI-寡糖复合体系的微观结构观察
采用激光共聚焦显微镜观测样品溶液的微观结构。采用袁杨[12]的方法,稍作改进。观测前,分别取各样品溶液1 mL稀释6 倍,得到SPI质量浓度为0.5 g/100 mL的样液,然后在新鲜配制的样品溶液中加入20 μL 0.2%的罗丹明B荧光染料,用于标记蛋白质,样品充分混匀。取20 μL样品于载玻片,盖好盖玻片,确保样品中没有起泡,采用×40物镜观测。
1.3.5 浊度的滴定分析
将不同pH值条件下的样品倒入比色皿中,以蒸馏水作空白,利用分光光度计测定样品在600 nm波长处的吸光度。
1.3.6 内源荧光光谱分析
参照Tang Chuanhe等[13]的方法,稍作改进。分别取100 μL不同pH值的样品用对应pH值的缓冲液(0.1 mol/L)稀释5 0 倍,激发波长为2 8 0 n m,发射波长为300~500 nm,狭缝宽度均为5 nm,电压为700 mV。
1.3.7 溶解度的测定
将SPI溶液及SPI-寡糖复合溶液静置数分钟,待沉淀完全后取其上清液10 mL于4 000 r/min离心20 min,吸取5 mL上清液,采用Folin-酚法[14]测定上清液中蛋白质含量,按式(1)计算其溶解度:

1.3.8 乳化性及乳化稳定性的测定
采用Pearce等[15]的方法并稍加改进。取不同pH值条件处理的样品溶液与其1/4体积的大豆油混合,10 000 r/min均质1 min后,分别在均质0、10 min时取样200 μL,用0.1 g/100 mL SDS溶液稀释50 倍,以SDS溶液为空白,测定500 nm波长处的吸光度,以0 min的吸光度(A0)表示乳化性,10 min内的乳化稳定性按式(2)计算:
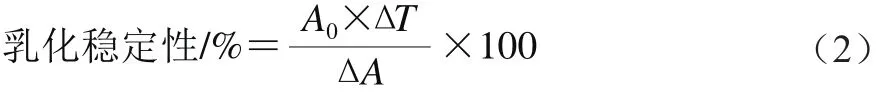
式中:A0为0 min的吸光度;ΔT为时间差/min;ΔA为ΔT内的吸光度差值。
1.4 数据统计
每个样品进行3 次重复实验,通过SPSS 22.0软件对数据进行处理分析,采用Origin 8.0软件作图,显著性水平为P<0.05。
2 结果与分析
2.1 不同pH值条件对复合体系相行为及Zeta电位的影响

表1 不同pH值条件下SPI、SPI-水苏糖、SPI-棉子糖复合溶液相行为Table1 Phase behavior of SPI, and SPI-stachyose and SPI-raf fi nose mixtures as a function of pH
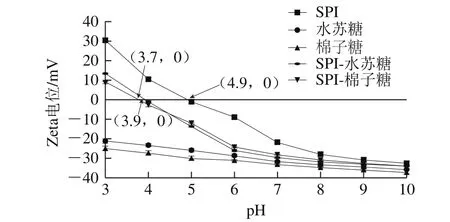
图1 pH值对SPI溶液、SPI-水苏糖、SPI-棉子糖复合溶液Zeta电位的影响Fig.1 Effect of pH on Zeta potential of SPI, and SPI-stachyose and SPI-raff i nose mixed solution
由表1可知,SPI与寡糖复合物水溶液在不同pH值条件下分别表现出澄清、半透明、浑浊、部分相分离和完全相分离5 种相行为。在pH 3.0~10.0范围内,寡糖溶液呈澄清透明状态,较为稳定;SPI溶液则由半透明状态逐渐出现部分相分离,随后至完全相分离(pH 5.0),再逐渐变为半透明状态;SPI-水苏糖、SPI-棉子糖2 种复合溶液同SPI溶液情况类似,但在pH值为4.0时就出现了完全相分离现象。上述结论与袁杨[12]的研究结果类似。
图1则从Zeta电位角度分析了出现上述变化的原因。由静电DLVO胶体溶液理论[16]可知,当Zeta电位升高时,溶液斥力位能增加,分子热运动所需克服的能垒加大,溶液变得稳定,同时Zeta电位还能表征溶液性质。随着pH值从3.0升高至10.0,水苏糖溶液Zeta电位由-21.18 mV降至-35.66 mV,棉子糖溶液Zeta电位由-24.89 mV降至-37.13 mV。即寡糖在广泛的pH值范围内带有强负电荷,静电排斥力有效防止寡糖分子的聚集[12]。SPI属于两性电解质,分子侧链上带有许多极性和非极性基团。随着pH值的升高,SPI溶液的Zeta电位由30.2 mV降至-32.8 mV,等电点为4.9,即当SPI溶液Zeta电位绝对值较小时,SPI分子表面所带的同性电荷较少,分子间静电斥力减少而相互聚集,降低溶液稳定性[17],发生相分离。当pH值由3.0增加至10.0时,SPI-水苏糖复合溶液体系的Zeta电位由13.2 mV降至-32.9 mV,等电点约为3.9;SPI-棉子糖复合溶液体系的Zeta电位由9.83 mV降至-33.98 mV,等电点约为3.7。与SPI溶液相比,2 种复合溶液等电点均降低,且在等电点处均发生相分离。研究表明当体系中SPI与糖类带相反电荷时,会发生静电吸引[18],所以在酸性条件下,带正电的SPI分子与带负电的寡糖可能相互吸引,形成静电复合物从而降低体系的Zeta电位值,且当pH值低于SPI-寡糖复合溶液等电点时,SPI所带的正电荷多于寡糖所带的负电荷,不能完全中和,形成的静电复合物仍带有正电荷,此时体系Zeta电位值为正。当pH值高于SPI-寡糖复合溶液的等电点而小于7.0时,所有溶液均呈负电状态,但SPI-寡糖复合溶液的Zeta电位值仍然明显高于寡糖溶液、低于SPI溶液,说明体系中SPI分子所带的正电荷与寡糖发生静电吸引,但SPI所带正电荷不足以完全中和寡糖所带的负电荷,因此Zeta电位为负值。当pH值大于7.0时,SPI分子表面所带负电荷增多,与寡糖以互相排斥作用增加,不易形成静电复合物[19]。故对于SPI-寡糖混合体系,复合物的形成发生在pH值为3.0~7.0的范围内,当pH值为3.0~5.0时,可能形成凝聚物,出现部分甚至完全相分离,而pH值为6.0~7.0时,可能形成可溶性复合物,呈半透明状态。
2.2 微观结构
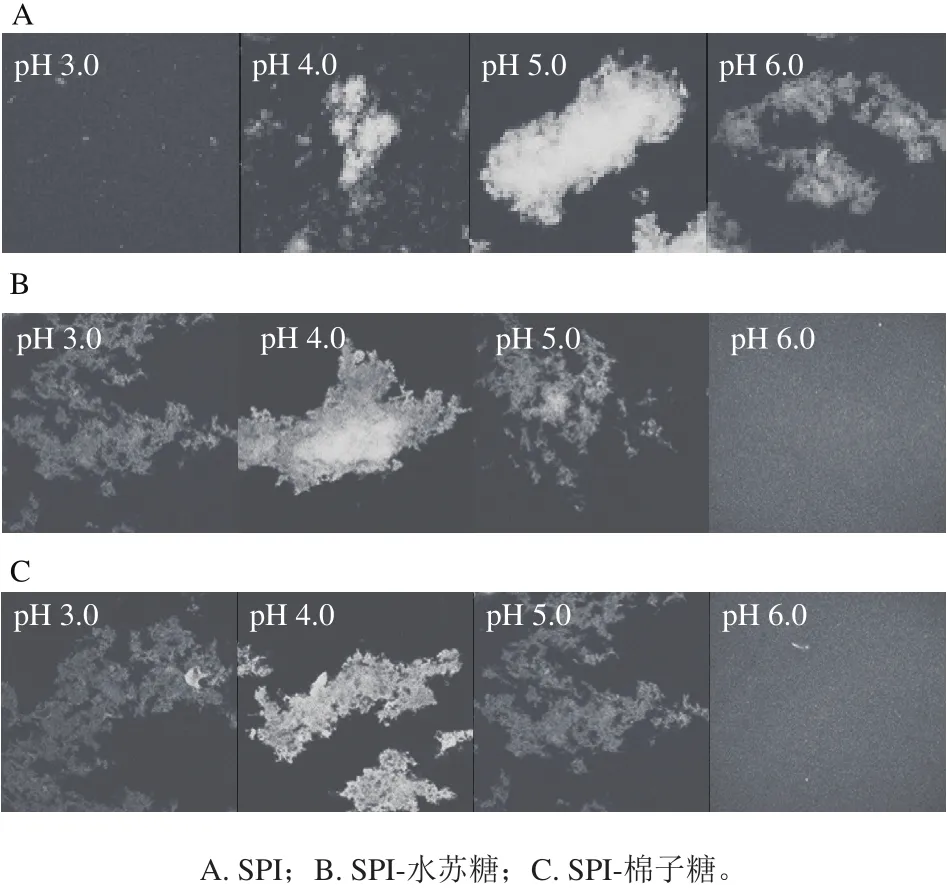
图2 不同pH值条件下SPI、SPI-水苏糖和SPI-棉子糖的微观结构Fig.2 Microstructure of SPI, and SPI-stachyose and SPI-raff i nose complexes as a function of pH
图2 显示在不同pH值条件下,SPI、SPI-寡糖复合溶液的激光共聚焦显微图像。图中发亮区域为罗丹明B所标记的SPI富集区域,黑色区域为寡糖富集区域或水相。由图2可知,在pH 4.0~5.0条件下,SPI分子逐渐出现大范围的聚集,pH 6.0时聚集体开始变小,这是由于SPI在等电点处脱水缩合作用引起的[12]。SPI-水苏糖和SPI-棉子糖复合溶液体系的显微图较为类似,pH 3.0~5.0的范围内出现不同程度的凝聚现象,pH 4.0时聚集程度最大,这是由于寡糖的加入与SPI发生静电相互作用,使得等电点左移,这与图1反映的情况一致。当pH 6.0时,SPI-寡糖复合体系中粒子均匀分散。可以发现,pH值为6.0时SPI-寡糖可以形成可溶性复合物,与相同条件下的SPI溶液相比,复合物能够均匀分散在体系中,即寡糖的加入提高了SPI在偏酸性条件下的溶解性和稳定性。
2.3 SPI-寡糖静电复合过程中浊度的变化
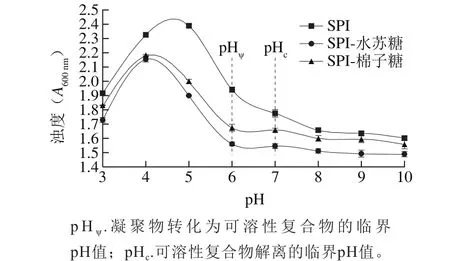
图3 pH值对SPI、SPI-水苏糖、SPI-棉子糖复合溶液浊度的影响Fig.3 Effect of pH on turbidity of SPI, and SPI-stachyose and SPI-raff i nose mixed solutions
浊度是因样品的吸收或颗粒的散射而造成透射光的衰减,可以反映粒子的大小,表征溶液体系中颗粒的聚集程度和稳定性。在蛋白质和糖类的复合体系中,用浊度和Zeta电位相结合分析体系的稳定性[12]及复合物的形成过程[20]。图3反映了不同pH值条件下SPI溶液和SPI-寡糖复合溶液浊度的变化。随着pH值的升高,3 种溶液体系的浊度都呈现先升高再降低的趋势。当pH值为5.0时,SPI溶液浊度为2.390,因接近SPI等电点,SPI发生变性聚集。当pH值继续升高,浊度下降,说明SPI分子逐渐溶解。SPI-水苏糖和SPI-棉子糖复合溶液的浊度有着类似的变化趋势,并且相对比SPI溶液,其浊度的最大值均向酸性pH值偏移,当pH值为4.0时,SPI-水苏糖和SPI-棉子糖溶液的浊度分别呈现最大值为2.155和2.178,由图1可知,在pH 3.5~4.0之间,SPI-水苏糖和SPI-棉子糖复合溶液体系发生了Zeta电位值由正变负的反转,此时SPI-寡糖静电复合物达到电荷中性,由自身结合的趋势,分子间进一步复合形成凝聚物。当pH值继续升高至6.0的过程中,浊度均急剧下降,说明到达临界点pHψ值,聚合物开始解离形成可溶性静电复合物,均匀分散在溶液中;直到pH值达到临界点pHc值,复合物由于SPI与寡糖带有相同的电荷而发生结构上的崩塌[21-22],SPI与寡糖不发生静电相互作用[19]。
2.4 荧光强度的变化

图4 pH值对SPI溶液(A)、SPI-水苏糖复合溶液(B)、SPI-棉子糖复合溶液(C)荧光光谱的影响Fig.4 Effect of pH on fl uorescence spectra of SPI solution (A), SPI-stachyose mixed solution (B), and SPI-raf fi nose mixed solution (C)
应用荧光光谱法研究蛋白质分子与其他小分子等相互作用是较为常用的一种手段,蛋白质分子中的色氨酸(Trp)在受到激发后具有发射较强内源荧光的能力,其他小分子加入后,蛋白质的荧光强度将会发生变化[23]。由图4A所示,随着pH值逐渐升高,SPI溶液的荧光强度呈现先减小后增大的趋势。pH值从3.0升高到5.0的过程中,SPI荧光强度从488降低到94.4,当pH值升高到10.0时,荧光强度增大到861.6。可能是由于pH值为5.0左右时,SPI变性发生聚集,Trp在SPI内部的疏水基团中[24]。当pH值低于等电点时,SPI分子部分聚集,少量的Trp残基处于极性环境中,荧光强度有所增加;高于等电点时,随着pH值的升高,尤其在碱性条件下,SPI肽链展开,越来越多的Try残基暴露,荧光强度增强。由图4B、C可知,当pH值为4.0时,SPI-水苏糖和SPI-棉子糖2 种复合溶液的荧光强度分别为79.92和74.6,远低于SPI溶液的299.8,可能因为SPI与寡糖形成的静电聚合物为内源Try残基提供了疏水环境[25],降低了荧光强度。但随着pH值的逐渐升高,SPI-寡糖复合溶液的荧光强度逐渐增加,越来越接近SPI的荧光强度,可能是因为在碱性条件下SPI分子所带负电荷的增加,与寡糖难以形成静电复合物,这与前人的报道结果类似[26]。
2.5 pH值对复合体系溶解度影响
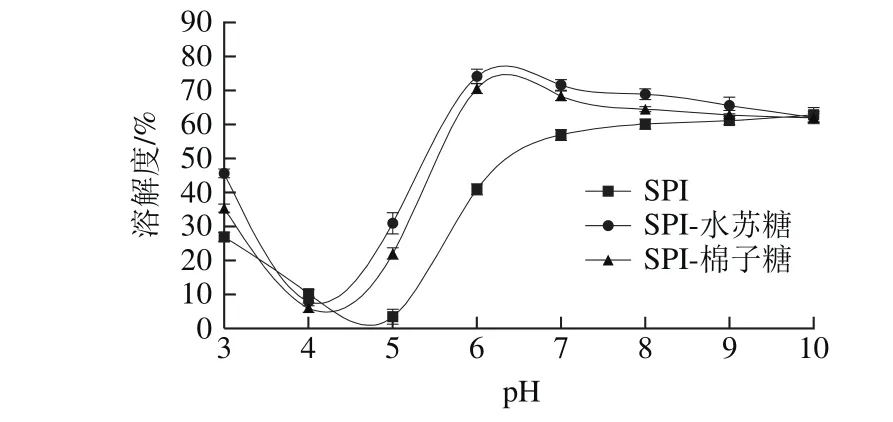
图5 pH值对SPI、SPI-水苏糖、SPI-棉子糖复合溶液溶解度的影响Fig.5 Effect of pH on solubility of SPI, and SPI-stachyose and SPI-raff i nose complexes
SPI的溶解度是其与溶剂相互作用平衡的热力学表现形式,是发挥乳化性的前提。当SPI与糖类物质发生相互作用后,可以在一定程度上改善SPI的部分功能性质。由图5可知,当pH值从3.0升高到5.0时,SPI溶液的溶解度逐渐下降,并在pH 5.0处达到最低,这是因为在等电点附近,SPI分子之间的静电排斥力最小,且SPI与水分子之间的作用力很小[27],因此溶解度最低;随着pH值的升高,SPI分子所带的负电荷增多,分子间的排斥力增大,水化作用增强,且SPI空间结构逐渐展开,伴随其亚基之间二硫键的断裂,溶解度增大[28]。随着pH值的改变,SPI-水苏糖和SPI-棉子糖复合溶液体系的溶解度变化趋势类似,寡糖的引入使得SPI的等电点向左偏移,而且在等电点左右两侧的pH值条件下,复合溶液体系的溶解度均增大,且均大于SPI溶液。当pH值为6.0左右时,SPI-水苏糖和SPI-棉子糖复合溶液的溶解度达到最大,分别为74.1%和70.6%。这可能是由于SPI与寡糖发生静电相互作用形成可溶性复合物,增加了粒子的亲水性,使得复合物分子表面容易形成水化层,另一方面,寡糖的引入从空间上保护了SPI,防止SPI聚集[29],从而增加其溶解度。当pH值继续增大,SPI-寡糖复合溶液的溶解度逐渐降低,与SPI溶解度接近。可能是由于SPI与寡糖的静电相互作用逐渐减弱造成的[19]。
2.6 pH值对复合体系乳化性的影响

图6 pH值对SPI、SPI-水苏糖、SPI-棉子糖复合溶液乳化性的影响Fig.6 Effects of pH values on emulsif i cation of SPI, SPI-stachyose and SPI-raff i nose composite solution
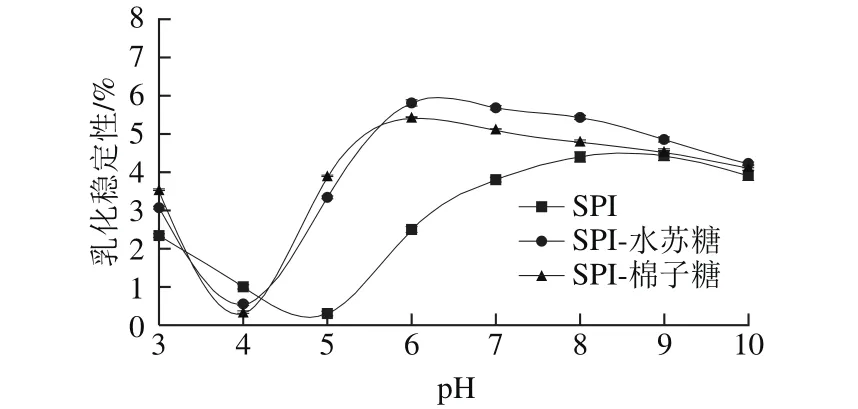
图7 pH值对SPI、SPI-水苏糖、SPI-棉子糖复合溶液乳化稳定性的影响Fig.7 Effect of pH on emulsion stability of SPI, SPI-stachyose and SPI-raff i nose mixed solutions
由图6和图7可知,pH值为SPI等电点4.9时,SPI乳化性和乳化稳定性均最小,离开等电点后,乳化性和乳化稳定性增大。尤其是随着pH值的增加,SPI乳化性和乳化稳定性都显著增加,当pH值为9.0时达到最大值,其乳化性为0.572±0.009,乳化稳定性为(4.42±0.021)%。由于在碱性条件下,受到OH-的影响,羧基去质子化,—COO-增多,电荷排布改变,分子间的静电斥力增加。当pH值为10.0时,乳化性和乳化稳定性均开始下降,可能是由于溶液中的—COO-趋于稳定,乳化性反而有所下降[30]。寡糖与SPI分子静电吸引,使得SPI-水苏糖和SPI-棉子糖静电复合溶液的等电点分别向左偏移至3.7和3.9,因此在pH值为4.0时,复合物不仅溶解度降低,而且乳化性和乳化稳定性也达到最低值。当远离等电点时,乳化性和乳化稳定性均有所提高。当pH值为6.0时,SPI-水苏糖和SPI-棉子糖复合溶液的乳化性达到最大值,分别为0.687±0.021和0.637±0.010;乳化稳定性也均为最大值,分别为(5.81±0.08)%和(5.40±0.06)%。由于在弱酸性条件下,寡糖与SPI形成可溶性静电复合物,亲水性羟基的引入改变了SPI分子表面的亲水亲油平衡值,有利于SPI在乳化过程中在油-水界面重排,降低界面张力,在一定程度上提高了SPI的乳化性;同时由于SPI-寡糖复合物所带的净负电荷增多[31],乳状液中粒子间的排斥作用大于吸引作用,粒子不易聚结,因此乳化稳定性也得以提高[32]。随着pH值的升高,乳化性和乳化稳定性均逐渐降低,且在碱性条件下,复合溶液的乳化性和乳化稳定性逐渐接近于SPI溶液。可能是由于SPI与寡糖的静电相互作用减弱造成的,这与溶解度的变化趋势一致。
3 结 论
通过Zeta电位、激光共聚焦显微镜以及浊度的测定,发现SPI与寡糖可以与水苏糖和棉子糖静电相互作用使得等电点从4.9分别减小到3.7和3.9,并且在酸性条件下可以形成静电复合物,且在pH值为6.0时开始形成可溶性静电复合物。内源荧光光谱扫描发现,当SPI与寡糖发生静电相互作用后,荧光强度降低,且静电相互作用越大降低程度越大。同时发现SPI与寡糖发生静电相互作用形成可溶性复合物后,其溶解度、乳化性和乳化稳定性均相应提高。当pH值为6.0时,SPI-水苏糖和SPI-棉子糖复合溶液的溶解度达到最大,分别为74.1%和70.6%,与SPI相比分别提高了81.17%和72.62%;乳化性分别为0.687±0.021和0.637±0.010,与SPI相比分别提高了50.66%和39.69%;乳化稳定性分别为(5.81±0.08)%和(5.40±0.06)%,与SPI相比分别提高了132.40%和116.00%。综上所述,SPI与寡糖在pH 6.0的条件下较大程度形成可溶性静电复合物,具有良好的溶解性和乳化性质。
[1] DICKINSON E. Flocculation of protein-stabilized oil-in-water emulsions[J]. Colloids Surfaces B∶ Biointerfaces, 2010, 81(1)∶ 130-140. DOI∶10.1016/j.colsurfb.2010.06.033.
[2] HOFLAND G W, DE RIJKE A, THIERING R, et al. Isoelectric precipitation of soybean protein using carbon dioxide as a volatile acid[J]. Journal of Chromatography B∶ Biomedical Sciences and Applications, 2000, 743(1/2)∶ 357-368. DOI∶10.1016/S0378-4347(00)00259-0.
[3] DICKINSON E. Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter, 2008,4(5)∶ 932-942. DOI∶10.1039/B718319D.
[4] KLEIN M, ASERIN A, SVITOV I, et al. Enhanced stabilization of cloudy emulsions with gum Arabic and whey protein isolate[J].Colloids Surfaces B∶ Biointerfaces, 2010, 77(1)∶ 75-81. DOI∶10.1016/j.colsurfb.2010.01.008.
[5] KHALLOUFI S, CORREDIG M, GOFF H D, et al. Flaxseed gums and their adsorption on whey protein-stabilized oil-inwater emulsions[J]. Food Hydrocolloids, 2008, 23(3)∶ 611-618.DOI∶10.1016/j.foodhyd.2008.04.004.
[6] GRIGORIEV D O, MILLER R. Mono- and multilayer covered drops as carriers[J]. Current Opinion in Colloid & Interface Science, 2008,14(1)∶ 48-59. DOI∶10.1016/j.cocis.2008.03.003.
[7] VINAYAHAN T, WILLIAMS P A, PHILLIPS G. Electrostatic interaction and complex formation between gum Arabic and bovine serum albumin[J]. Biomacromolecules, 2012, 11(12)∶ 3367-3374.DOI∶10.1021/bm100486p.
[8] CHO Y H, MCCLEMENTS D J. Theoretical stability maps for guiding preparation of emulsions stabilized by protein-polysaccharide interfacial complexes[J]. Langmuir, 2009, 25(12)∶ 6649-6657.DOI∶10.1021/la8006684.
[9] 熊拯, 黄贵秋. 大豆分离蛋白-阴离子多糖复合体系起泡性能研究[J]. 农业机械, 2011(17)∶ 61-64. DOI∶10.16167/j.cnki.1000-9868.2011.17.018.
[10] 郭兴凤, 熊拯, 王延青, 等. SPI-阴离子多糖复合体系乳化稳定性研究[J]. 河南工业大学学报(自然科学版), 2010, 31(3)∶ 32-34.DOI∶10.16433/j.cnki.issn1673-2383.2010.03.007.
[11] 杨秀芳, 陈梅, 马养民. 大豆低聚糖功能及其应用[J]. 粮食与油脂,2010(5)∶ 8-11. DOI∶10.3969/j.issn.1008-9578.2010.05.003.
[12] 袁杨. 食物蛋白与壳聚糖相互作用及其在食品体系的应用研究[D].广州∶ 华南理工大学, 2014.
[13] TANG C H, YANG X Q, CHEN Z, et al. Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J]. Journal of Food Biochemistry, 2005,29(4)∶ 402-421. DOI∶10.1111/j.1745-4514.2005.00038.x.
[14] MU L X, ZHAO M M, YANG B, et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. Journal of Agricultural & Food Chemistry, 2010, 58(7)∶ 4494-4499.DOI∶10.1021/jf904109d.
[15] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins∶evaluation of a turbidimetric technique[J]. Journal of Agricultural &Food Chemistry, 1978, 26(3)∶ 716-723. DOI∶10.1021/jf60217a041.
[16] SANTANDER-ORTEGA M J, PEULA-GARCIA J M, GOYCOOLEA F M, et al. Chitosan nanocapsules∶ effect of chitosan molecular weight and acetylation degree on electrokinetic behaviour and colloidal stability[J]. Colloids Surfaces B∶ Biointerfaces, 2011, 82(2)∶ 571-580.DOI∶10.1016/j.colsurfb.2010.10.019.
[17] WONG B T, DAY L, AUGUSTIN M A. Deamidated wheat protein-dextran Maillard conjugates∶ effect of size and location of polysaccharide conjugated on steric stabilization of emulsions at acidic pH[J]. Food Hydrocolloids, 2012, 25(6)∶ 1424-1432. DOI∶10.1016/j.foodhyd.2011.01.017.
[18] HERLANT M. Effect of Arabic gum, xanthan gum and orange oil contents on ζ-potential, conductivity, stability, size index and pH of orange beverage emulsion[J]. Colloids & Surfaces A∶ Physicochemical &Engineering Aspects, 2008, 315(1/2/3)∶ 47-56. DOI∶10.1016/j.colsurfa.2007.07.007.
[19] 谢晶晶, 章轶锋, 李玉辉, 等. 大豆分离蛋白与甜菜果胶静电复合过程的研究[J]. 食品工业科技, 2013, 34(13)∶ 58-62. DOI∶10.13386/j.issn1002-0306.2013.13.031.
[20] MEKHLOUFI G, SANCHEZ C, RENARD D, et al. pH-Induced structural transitions during complexation and coacervation of betalactoglobulin and acacia gum[J]. Langmuir, 2015, 21(1)∶ 386-394.DOI∶10.1021/la0486786.
[21] NIU F, SU Y, LIU Y, et al. Ovalbumin-gum arabic interactions∶ effect of pH, temperature, salt, biopolymers ratio and total concentration[J].Colloids and Surfaces B∶ Biointerfaces, 2014, 113(3)∶ 477-482.DOI∶10.1016/j.colsurfb.2013.08.012.
[22] RU Q, WANG Y, LEE J, et al. Turbidity and rheological properties of bovine serum albumin/pectin coacervates∶ effect of salt concentration and initial protein/polysaccharide ratio[J]. Carbohydrate Polymers,2012, 88(3)∶ 838-846. DOI∶10.1016/j.carbpol.2012.01.019.
[23] KIM D, PARK J, KIM J, et al. Flavonoids as mushroom tyrosinase inhibitors∶ a fl uorescence quenching study[J]. Journal of Agricultural &Food Chemistry, 2016, 54(3)∶ 935-941. DOI∶10.1021/jf0521855.
[24] GAUCHE C, BARRETO P L M, BORDIGNON-LUIZ M T.Effect of thermal treatment on whey protein polymerization by transglutaminase∶ implications for functionality in processed dairy foods[J]. LWT-Food Science and Technology, 2010, 43(2)∶ 214-219.DOI∶10.1016/j.lwt.2009.08.009.
[25] 李菊芳. 磷脂-大豆蛋白复合物形成机理及其理化、功能特性研究[D].北京∶ 中国农业大学, 2014.
[26] BATTAL Y B, TOPUZOGULLARI M, MUSTAFAEVA Z. The fl uorescence study of interaction between bovine serum albumin and polyacrylic acid[J]. Journal of Fluorescence, 2009∶ 1-11. DOI∶10.1007/s10895-009-0484-9.
[27] TADPITCHAYANGKOON P, PARK J W, YONGSAWATDIGUL J.Conformational changes and dynamic rheological properties of fish sarcoplasmic proteins treated at various pHs[J]. Food Chemistry, 2010,121(4)∶ 1046-1052. DOI∶10.1016/j.foodchem.2010.01.046.
[28] 魏冬旭, 江连洲, 王辰, 等. pH值对大豆11S球蛋白结构和表面疏水性的影响[J]. 食品科学, 2015, 36(11)∶ 1-5. DOI∶10.7506/spkx1002-6630-201511001.
[29] NIU F, DONG Y, SHEN F, et al. Phase separation behavior and structural analysis of ovalbumin-gum Arabic complex coacervation[J]. Food Hydrocolloids, 2015, 43∶ 1-7. DOI∶10.1016/j.foodhyd.2014.02.009.
[30] 邓塔, 李军生, 阎柳娟, 等. 大豆蛋白乳化性的研究[J]. 食品工业科技, 2013, 34(2)∶ 90-93. DOI∶10.13386/j.issn1002-0306.2013.02.039.
[31] YIN B, DENG W, XU K, et al. Stable nano-sized emulsions produced from soy protein and soy polysaccharide complexes[J]. Journal of Colloid and Interface Science, 2012, 380(1)∶ 51-59. DOI∶10.1016/j.jcis.2012.04.075.
[32] SALMINEN H, WEISS J. Electrostatic adsorption and stability of whey protein-pectin complexes on emulsion interfaces[J].Food Hydrocolloids, 2014, 35(1): 410-419. DOI:10.1016/j.foodhyd.2013.06.020.
