HIV潜伏库治疗策略研究
2018-06-26童玲,薛婧,魏强
童 玲,薛 婧,魏 强
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家卫生和计划生育委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)是人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染机体后引发的全身性疾病。自1983年首次发现HIV以来,人类已与艾滋病抗争30多年。目前全球有超过3530万人感染 HIV,在公共卫生领域,艾滋病逐渐成为一种慢性病[1]。现阶段治疗艾滋病最有效的方法是美国华裔科学家何大一在1996年提出的高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART),该方法是通过联合使用三种或三种以上的抗病毒药物从不同方面抑制病毒的生命周期,俗称“鸡尾酒”疗法。HAART可以有效地减少病毒的复制,阻止HIV病毒在体内传播,将血浆中的病毒RNA抑制在低水平甚至现有方法检测不到的水平,从而延长患者生命,降低疾病死亡率[2]。但是由于HIV潜伏于一些细胞和组织中,形成病毒的潜伏库,HAART并不能有效清除潜伏库中的病毒,一旦停药,病毒便会发生反弹。因此,如何寻找HIV的潜伏库、彻底清除宿主细胞中潜伏的HIV,是近年来艾滋病治疗研究领域的热点问题。
1 HIV潜伏库的形成
了解HIV潜伏库的形成,是研究HIV潜伏库治疗策略的重要前提。静息CD4+T细胞被认为是HIV的主要潜伏细胞,HIV DNA以非整合型和整合型两种形式潜伏在静息CD4+T细胞中[3]。
非整合型HIV DNA前病毒是指HIV DNA未整合进宿主基因组中,其原因可能是在CD4+T 细胞中HIV前病毒整合受到抑制,但在一些细胞因子和相关因素的刺激下可以使CD4+T细胞活化,产生病毒颗粒。但由于这种形式的前病毒并不稳定,半衰期较短,只能持续数周,因此不是HIV潜伏库形成的原因[4]。
整合形式HIV DNA前病毒[3],病毒的DNA已整合入宿主基因组,但是在静息期CD4+T细胞中HIV前病毒的基因表达受到多因素的影响,例如,在转录水平上,某些转录因子在静息CD4+T细胞中的浓度低(NF-κB、NF-AT),或者由于存在大量的抑制因子(YY1、LSF)转录因子活性降低,不能有效地与HIV的LTR结合,发挥转录作用,影响HIV基因转录[5-7]。在翻译水平上,由于静息CD4+T细胞产生的特定微小RNA (miRNA),通过靶向结合mRNA后降解mRNA或抑制mRNA翻译,影响病毒颗粒包装所需蛋白的形成,从而表现为不产生病毒颗粒的潜伏状态[8]。此外,HIV整合位点的染色质环境也影响HIV基因的表达[9]。由于上述多个水平共同影响,静息CD4+T细胞中整合的HIV前病毒的基因表达处于一个较低水平,几乎没有病毒产生或仅有极少量病毒颗粒产生,便于其逃避宿主免疫系统的攻击和抗病毒药物的作用,因此整合型的HIV DNA前病毒十分稳定,半衰期较长,被认为是形成HIV潜伏库的主要原因[10]。
2 HIV的潜伏库
2.1 HIV的潜伏细胞
静息CD4+T细胞是目前最具特征的HIV潜伏感染细胞[5]。静息CD4+T细胞以初始T细胞和记忆性T细胞两种形式存在[11]。在病毒进入细胞后,静息的T细胞中缺乏病毒反转录和进入细胞核的条件,病毒无法完成整个复制周期,这些初始的T细胞最终会转变静息的记忆T细胞[12]。研究发现[13],尽管不同的细胞亚群都能发现整合的HIV DNA,但是大部分存在于中心记忆T细胞(TCM)和过渡期记忆T细胞 (TTM)。其中,TCM是主要的储存库,可以保持长时间低水平的复制;TTM保持自我平衡的增殖状态,成为非常稳定的病毒储存库。
HIV的潜伏库不仅存在于静息期CD4+T细胞,树突状细胞和巨噬细胞[10]也是HIV的潜伏库。尽管只有一小部分(约1%)树突状细胞中有潜伏的HIV DNA,但在合适的刺激条件下它们同样可以被激活,释放病毒颗粒[14]。巨噬细胞通过吞噬受感染的CD4+T细胞后被感染;研究还发现在T细胞不存在的情况下巨噬细胞仍可以被HIV感染,同时病毒还可以自主在巨噬细胞中进行复制[15]。即使进行HAART,感染的巨噬细胞仍然可以持续存在;最重要的是,即使没有T细胞,它们也可以在治疗中断时重新启动和维持感染[16]。不仅如此,感染HIV的巨噬细胞可以通过融合或旁分泌的形式将病毒散播给CD4+T细胞,促进了HIV的潜伏感染和潜伏库的扩大[17-18]。因此,要想达到艾滋病的功能性治愈,HIV潜伏库的治疗必须靶向多种细胞类型。
2.2 HIV的潜伏组织
由于抗逆转录病毒药物物理性质的限制,其无法穿透人体内的生理屏障,组织利用度降低,故在HAART治疗中,这些药物无法到达的组织,成为了HIV的“避难所”[19]。如体内血-脑屏障、血-睾屏障、血-组织屏障的存在,限制了抗逆转录病毒药物进入相应部位发挥作用,因此中枢神经系统和睾丸等组织成为HIV-1潜伏感染的“避难所”[20]。
此外,一些组织因其自身的免疫学特性,成为HIV的“避难所”。人体内仅有2%淋巴细胞分布于血液循环中,其余淋巴细胞广泛分布于淋巴器官和组织中,如脾脏、淋巴结、肠道相关淋巴组织(gut-associated lymphoid tissue GALT)[21-22]。这些部位是HIV复制的主要场所,也可成为停药后病毒反弹的源头。有研究表明[23-24],GALT和淋巴结比外周血单个核细胞(peripheral blood mononuclear cells, PBMC)中感染细胞的比例更高,同时发现在HAART治疗期间,这些淋巴组织的药物浓度低于外周血,淋巴组织中仍然存在持续微量的病毒复制,即使在进行长期药物治疗后这些部位依然有大量的病毒DNA+细胞与病毒RNA+细胞,提示淋巴组织是HIV的主要潜伏部位。
3 HIV的潜伏库的治疗策略
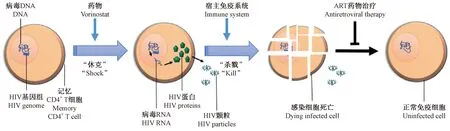
图1 将HIV从潜伏库中激活Fig.1 Activation of HIV from the latent reservoir
随着对HIV潜伏库的认识不断深入,近年来,研究人员提出了多种针对HIV潜伏库的治疗策略。以期缩小乃至彻底清除HIV的潜伏库,达到治愈艾滋病的目的。
3.1 休克和杀戮(Shock and Kill)
由于潜伏感染的静息CD4+T细胞不表达病毒相关蛋白,因此可以逃避宿主免疫系统的清除。如果将这些静息细胞激活,那么它们会为潜伏其中的HIV提供复制条件,启动病毒复制:促进HIV RNA合成,产生HIV相关蛋白并释放病毒颗粒。最终这些激活的细胞会被病毒杀死或者被机体的免疫系统识别并清除。据此,研究者们提出一种新的治疗策略,即利用药物将所有的潜伏感染细胞都激活,再利用机体免疫系统或相关药物将这些细胞杀死,最终达到清除病毒潜伏库的目的。这种治疗策略被称为“Shock and Kill”(图1)[25]。
由于“Shock and Kill”疗法的提出,HIV潜伏库激活剂(HIV latency-reversing agent,LRAs)成为目前研究的热点。LRAs的作用位点靶向HIV基因表达的多个水平[26]:可以作用于转录水平(如TLR激动剂[27-28]、PKC通路调节剂、BRD抑制剂[29]等);也可以作用于组蛋白修饰水平(如组蛋白去乙酰化酶,组蛋白甲基转移酶抑制剂[30]等)。例如,最近Boehm等[31]的研究发现,组蛋白甲基转移酶SMYD2是HIV-1的转录抑制因子,抑制潜伏病毒的基因表达。当敲除SMYD2的基因或使用SMYD2的抑制剂可以激活或唤醒细胞中潜在的HIV-1病毒,因此SMYD2可以作为休克和杀戮策略的治疗靶点。这些LRAs均旨在促进潜伏感染细胞中HIV的基因表达,改变HIV低水平表达状态。通过与抗病毒药物的联用,最终实现“Shock and Kill”。
研究学者还发现一些作用于其他疾病的药物,对潜伏库细胞的激活有很好的效果。GS-9620是吉利德公司生产的一种应用于乙肝药物,它作用于Toll-like receptor 7(TLR7)[32],增加了CD4细胞的复制。由于CD4细胞的增多,潜伏HIV获得更多可感染的细胞,从而激活潜伏的病毒,达到“Shock and Kill”的目的。GS-9620与HAART的联用在动物试验中取得良好的疗效[33]。
尽管目前的艾滋病潜伏库激活药物并不能将所有的潜伏感染病毒通过“Shock and Kill”清除,但它们的应用有效的缩小了HIV潜伏库。
3.2 免疫治疗
免疫系统在病毒潜伏库的建立和维持中发挥重要的作用,因此免疫治疗是HIV治疗策略研究中的重点。激活的CD4+T细胞表面表达多种免疫抑制受体,当其与配体结合以后,激活的CD4+T细胞功能会抑制,变为未激活状态,促进了HIV的潜伏。一种治疗策略是将阻断免疫抑制受体与配体结合,使细胞保持激活状态[34]。程序性死亡受体1(programmed death 1,PD-1),是一种重要的免疫抑制分子,其T cell功能耗竭的标志[35]。PD-1及其配体PDL-1、PDL-2抑制剂在肿瘤领域有着重要作用[36]。由于激活的细胞比静息期的细胞更容易被感染HIV,表达PD-1的激活细胞易转变为潜伏感染的细胞,因此HIV潜伏库的大小,与表达PD-1的CD4细胞数呈正相关[37-38]。综上所述,PD-1抑制剂可以作为药物来干预HIV潜伏库的建立与维持。
在慢性感染中,I型干扰素(IFN-I)一方面会增加CCR5和PD-1的表达、引起炎症反应、改变T细胞稳态、使T细胞功能失调,另一方面高表达的IFN-I会影响机体免疫功能重建[39-42]。因此,阻断IFN信号途径可以加强T细胞恢复并对缩小HIV潜伏库有重要作用[43]。有研究人员证明在慢性HIV感染过程中阻断体内IFN-I信号可以削弱HIV驱动的免疫激活,下调T细胞衰竭标记物的表达,重新恢复特异性的CD8+T细胞的功能,并导致病毒复制水平下降。抗逆转录病毒疗法与IFN-I阻断联合可以加速对病毒的抑制,进一步减少病毒载量,相比于单独使用抗逆转录病毒疗法来说,联合抗逆转录病毒疗法可以重新恢复免疫功能,缩小慢性HIV感染过程中的病毒储存库,延缓抗逆转录病毒治疗后的病毒反弹[44],这表明阻断IFN-I有望成为治疗HIV感染的一种新方法。
白介素-2(IL-2)是免疫系统中的一种细胞因子,能够刺激杀伤性T细胞发挥作用。近日,来自凯斯西储大学医学院的研究人员把IL-2与前期实验中开发的一种靶向作用HIV的工程化单克隆抗体相结合,发现这种新型组合疗法能够减少潜在的HIV[45]。白介素-2能够激活机体的杀伤性T细胞并且激活潜伏状态的HIV;而能够中和HIV的单克隆抗体则是一种特殊的克隆蛋白抗体,其能够结合到HIV表面并且阻断HIV对机体免疫细胞的感染,同时单克隆抗体还能够帮助杀伤性T细胞对HIV感染的细胞实施攻击,让白介素-2更好的发挥作用,使得感染的细胞从潜伏状态开始表达大量病毒。因此,白介素-2组合疗法能够有效降低潜在的HIV病毒库的规模。
治疗性疫苗的研究,也是免疫治疗的一个重要方面[34]。人体内的CD8+的T细胞可以通过选择性杀死产生病毒的细胞达到控制HIV的目的。通过治疗性疫苗激活免疫细胞,增强宿主体内病毒特异性CD8+的T淋巴细胞反应[46],使机体的免疫系统更快速有效的杀死携带病毒的细胞,并且抵御HIV的感染。通过免疫治疗可以调动机体的免疫系统,加强对潜伏感染细胞的清除,从而缩小HIV潜伏库,实现对HIV的有效控制。
3.3 基因治疗
“柏林病人”是全球唯一一例艾滋病治愈患者,他通过移植CCR5特定基因32位碱基缺失的纯合子供体骨髓,体内不再产生新的HIV,实现了艾滋病的治愈[47]。CCR5特定基因32位碱基缺失的人对HIV天然耐受[48],通过骨髓移植,该感染者也获得对HIV耐受的T细胞,该细胞对HIV的复制和感染产生抑制。“柏林病人”的成功提供了艾滋病的治疗新策略,研究者尝试复制这一案例,但目前仍未有成功的病例出现[49]。另外由于该方法费用高昂,并且治疗过程中的药物与射线对人体的免疫系统伤害过大,其临床应用价值不大。
随着基因编辑技术的发展,采用锌指蛋白[50]或CRISPR/Cas9[51],对HIV潜伏的基因位点进行编辑或者利用“柏林病人”的案例,对CCR5基因进行定点切割,从基因水平实现对HIV潜伏库的清除是HIV治疗的又一策略。CRISPR/Cas9基因剪辑技术可以简便高效的改变生物体内的基因,被誉为“基因组编辑的魔术手术刀”。该技术通过RNA做向导,把Cas9酶带到相应的位置,然后用这种酶识别并切割病毒 DNA。HIV基因两端含有长末端重复序列,利用CRISPR/Cas9剪断长重复序列,便可以切除HIV的基因组[52]。研究人员通过该技术有效的清除了体外培养的人类细胞系、艾滋病患者体内取出的T免疫细胞以及转基因小鼠体内的艾滋病病毒[1]。HIV基因易于突变,单靶点基因编辑有可能会出现病毒逃逸现象,研究人员还提出了多靶点基因编辑的新思路,针对HIV转录区和结构区设计了不同的向导RNA,可引导Cas9酶切割目标基因实现多靶点切除,显著增加了HIV的剔除效率。并且这种病毒基因清除方法不影响靶细胞的存活和功能,达到“只杀病毒不杀细胞”的目的[53]。此外,也有学者[54]利用CRISPR/Cas9直接对HIV RNA进行编辑,特异性清除潜伏感染病毒,阻止HIV整合进宿主细胞,阻断HIV的传播。
尽管目前通过基因疗法不能彻底清除感染者体内的艾滋病病毒,但是可以明显降低体内潜伏的病毒。因此,随着基因编辑技术的不断进步,基因疗法将是一种有希望的艾滋病治疗策略。
3.4 其他疗法
对比未经治疗的患者,早期的抗逆病毒治疗(ART)可以有效控制HIV-1的复制,阻止更多的细胞被HIV感染。但其不能影响已经感染的细胞,HIV潜伏库依然会形成[55]。有研究者发现[56],在更早的时间(感染后3 d)给感染SIV的动物注射疫苗,SIV特异性的杀伤细胞会在细胞转变为静止状态前杀死感染细胞,因此阻止HIV潜伏库的形成。这一发现提示我们,早期的ART治疗可能还是不够早。越早的ART治疗越能有效阻止HIV潜伏库的形成。有学者提出预暴露前预防(PrEP),和暴露后预防(PEP)两个概念[34],即在进行可能暴露HIV的危险行为前和暴露HIV后立即服用抗逆转录病毒药物。PrEP和PEP可以有效降低感染艾滋病的危险,在第一个HIV感染细胞出现时就能有效杀死细胞,阻止HIV的潜伏。
如何有效地找到、识别、并且攻击这些病毒“避难所”,彻底清除潜伏的HIV病毒,一直是艾滋病治疗的研究热点,但是研究进展缓慢。近期,研究人员发现CD32 a蛋白可能是HIV潜伏细胞的重要表面标记,通过将荧光标记的HIV将静息期T细胞暴露在荧光显微镜下,然后利用单细胞测序手段,检测其基因表达差异。发现静息期T细胞的表达CD32 a的基因被打开,而未被感染的细胞几乎找不到它。并且,研究人员还发现,在活跃复制HIV病毒的细胞中,这个蛋白的表达却并不显著[57]。因此,CD32 a可能是HIV潜伏细胞的特异性表面标记,可以将潜伏感染细胞与其他细胞区分开。针对CD32 a开展靶标药物设计,可以达到特异性杀死潜伏感染细胞的目的,实现HIV潜伏库的有效清除。
4 小结
针对HIV潜伏库,研究学者所提出的多种治疗策略虽然不能彻底清除HIV潜伏库,但是也在缩小潜伏库,抑制HIV感染等方面具有重要价值,为实现艾滋病的功能性治愈奠定基础。目前,HIV潜伏库的清除仍面临诸多挑战,因此,我们需要探索出一种高效、准确的方法去检测患者体内HIV潜伏库,更加深入的研究HIV潜伏库的形成机制及其特征,以期为艾滋病的临床治疗提供新思路。一旦HIV潜伏库可以被彻底清除,人们有望实现艾滋病的功能性治愈。
参考文献:
