VEGF调控Wnt/β-catenin信号通路对少突胶质前体细胞增殖迁移的影响
2018-06-26孟祥武瞿昌华
孟祥武,陈 娟,黄 淼,瞿昌华,郑 龙
(湖北民族学院附属民大医院神经内科,湖北 恩施 445000)
少突胶质前体细胞(oligodendrocyte precursor cells, OPCs)广泛存在于中枢神经系统中,具有分化为星形胶质细胞和少突胶质细胞的潜能[1]。少突胶质前体细胞属于神经胶质细胞,是除少突胶质细胞、小胶质细胞和星状胶质细胞外的第四种神经胶质细胞[2]。少突胶质前体细胞与中枢神经系统的发育、修复、重建等都具有密切关系[3]。
血管内皮生长因子(VEGF)在脊椎动物的发育过程中发挥调节作用,参与胚胎神经发生及血管形成过程[4]。有研究表明,VEGF能够促进小胶质细胞、星形胶质细胞和皮质神经元的增殖和迁移[5-6]。而VEGF对少突胶质前体细胞的增殖和迁移影响是否同其他神经胶质细胞一样?本研究以少突胶质前体细胞为研究对象,探讨血管内皮生长因子对少突胶质前体细胞增殖和迁移的影响,以期为治疗中枢神经系统疾病提供新思路。
1 材料和方法
1.1 实验动物
12只出生24 h的SPF级C57BL/6J小鼠,雌雄各半,体重8~10 g,购于北京维通利华实验动物有限公司[SCXK(京)2015-0001],饲养于湖北民院附属民大医院动物实验中心[SYXK(鄂)2014-0035],所有实验流程均经动物伦理委员会通过(伦理审查证号:2015-0065)。
1.2 主要试剂及仪器
DMEM培养基、LiCl均购自于美国Sigma;VEGF购自于美国Peprotech;MMP-9单克隆抗体、MMP-2单克隆抗体、β-catenin单克隆抗体、C-myc单克隆抗体、cyclin D1单克隆抗体、GAPDH单克隆抗体、辣根过氧化物标记的二抗均购自于上海研卉生物科技有限公司;酶标仪、CO2培养箱购自于美国Thermo;BCA蛋白浓度检测试剂盒购自于上海酶联生物科技有限公司。
1.3 实验方法
1.3.1少突胶质前体细胞分离及实验分组
少突胶质前体细胞分离方法参照参考文献[7],取出生24 h的SPF级C57BL/6J小鼠,腹腔麻醉以后,无菌状态下取其脑皮质,剪碎后,加入胰蛋白酶消化15 min,1000 r/min离心5 min,弃上清液。在沉淀中加含有20% FBS的DMEM细胞培养液混合后,过筛(70 μm细胞筛),接种到多聚赖氨酸提前包被的细胞瓶中,放在37℃,5% CO2培养箱中培养,每隔72 h更换一次培养液,培养9 d后,将培养瓶放在振荡器上震荡1 h,弃细胞培养液,再加入10 mL新鲜的细胞培养液,放在振荡器上震荡1 h,收集上清液接种到细胞培养瓶中培养1 h。过筛(20 μm细胞筛),吸取细胞悬浮液,1000 r/min,离心10 min,在细胞沉淀中加入细胞培养液混匀后,接种到细胞瓶中培养,分离培养的细胞特异性表达NG2,鉴定为少突胶质前体细胞。取少突胶质前体细胞,用100 ng/mL的VEGF作用于少突胶质前体细胞记为VEGF组,以加入0 ng/mL的VEGF处理后的少突胶质前体细胞记为对照组。
1.3.2MTT检测细胞增殖
取出少突胶质前体细胞,用100 ng/mL的VEGF作用于少突胶质前体细胞记为VEGF组,每孔中加入100 μL的VEGF。每组设置8个复孔,同时设置空白组和对照组,空白组不加细胞,对照组中不加VEGF,其它步骤同VEGF组。放在37℃,5% CO2培养箱中培养48 h后,吸除孔内VEGF,每孔中加入50 μL的MTT溶液(5 mg/mL),放在37℃,5% CO2培养箱中孵育反应4 h。吸除细胞培养液,在细胞中加入DMSO溶液150 μL,震荡反应10 min,待结晶物完全融化后,酶标仪检测每孔的OD值,计算细胞存活率。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)
1.3.3Boyden chamber小室检测细胞迁移
取少突胶质前体细胞,在多聚赖氨酸提前包被好的Boyden chamber小室的上室加入5×104个细胞,在小室的下室加入0 ng/mL、100 ng/mL的VEGF培养液,放在37℃,5% CO2培养箱中培养48 h后,用棉签小心擦掉没有穿过膜的少突胶质前体细胞。用甲醇固定穿膜的细胞20 min。用0.1%的结晶紫染色15 min后,加入PBS洗涤后,随机选取6个视野对迁移的细胞计数,实验重复三次。
1.3.4Western blot检测细胞中MMP-9、MMP-2、β-catenin、C-myc、cyclin D1蛋白水平
少突胶质前体细胞与100 ng/mL的VEGF作用48 h后,在细胞中加裂解液,在冰上裂解20 min后,4℃,10 000 r/min离心15 min,吸取蛋白上清,BCA蛋白浓度检测试剂盒检测提取的蛋白样品浓度。蛋白样品与loading buffer混合煮沸变性后,80 V电压电泳30 min后,待溴酚蓝到达浓缩胶和分离胶边缘时,调整电压至120 V继续电泳。取出蛋白凝胶在300 mA,4℃转膜90 min。经5%脱脂奶粉封闭后(37℃封闭2 h)。加入一抗(500倍稀释),室温下孵育2 h,PBST洗涤后,加二抗(1000倍稀释)孵育过夜。滴加DAB显色液,暗室中曝光,以GAPDH为内参,分析蛋白表达水平。
1.3.5激活Wnt/β-catenin信号通路对细胞增殖迁移影响
少突胶质前体细胞与含有终浓度为20 μmol/L的Wnt/β-catenin信号通路激活剂LiCl作用48 h后,记为激活剂组,以加入0 μmol/L的Wnt/β-catenin信号通路激活剂LiCl作用48 h后的少突胶质前体细胞记为未处理组,检测细胞增殖迁移情况,Western blot检测细胞中MMP-9、MMP-2、β-catenin、C-myc、cyclin D1蛋白水平。
1.4 统计学方法
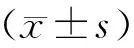
2 结果
2.1 少突胶质前体细胞形态
显微镜下观察分离培养的少突胶质前体细胞呈圆形或者呈球形存在,多数聚集成块状,有典型的双极或者三级突起。(图1)

图1 分离培养的少突胶质前体细胞(×200)Fig.1 Isolation and culture of the oligodendrocyte precursor cells
2.2 细胞增殖结果
少突胶质前体细胞与VEGF作用后,MTT检测48 h的细胞存活率。结果显示,VEGF组细胞存活率明显高于对照组(P< 0.01)。(图2)

注:与对照组比,**P< 0.01。图2 VEGF对少突胶质前体细胞增殖影响结果Note. Compared with the control group,**P< 0.01.Fig.2 Effect of VEGF on the proliferation of the oligodendrocyte precursor cells
2.3 细胞迁移结果
少突胶质前体细胞与VEGF作用后,Boyden chamber小室检测48 h细胞迁移情况。结果显示,VEGF组细胞迁移数目明显高于对照组(P< 0.01)。VEGF组细胞中迁移相关蛋白MMP-2和MMP-9蛋白表达水平明显高于对照组(P< 0.01)。(图3)
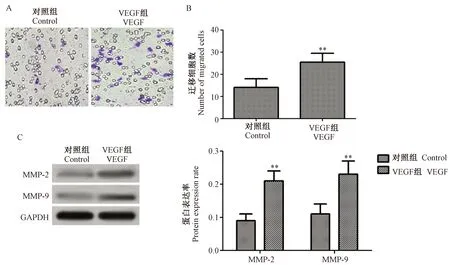
注:(A)迁移结果图;(B)迁移细胞数目;(C)Western blot结果图;(D)蛋白表达率;与对照组比,**P< 0.01。图3 VEGF对少突胶质前体细胞迁移影响结果Note.(A)Migration results map.(B)The number of migrated cells.(C)Western blot results.(D)Protein expression rate. Compared with the control group,**P< 0.01.Fig.3 Effect of VEGF on the migration of oligodendrocyte precursor cells
2.4 VEGF对细胞中β-catenin、C-myc、cyclin D1蛋白表达影响结果
Western blot检测了VEGF作用48 h后的少突胶质前体细胞中Wnt/β-catenin信号通路相关蛋白β-catenin、C-myc、cyclin D1蛋白水平。结果显示,VEGF组细胞中β-catenin、C-myc、cyclin D1蛋白水平均明显高于对照组(P< 0.01)。(图4)

注:(A)Western blot结果图;(B)蛋白表达率;与对照组比,**P< 0.01。图4 VEGF对β-catenin、C-myc、cyclin D1蛋白表达影响结果Note.(A)Western blot results.(B)protein expression rate. Compared with the control group,**P< 0.01.Fig.4 Effect of VEGF on the expression of β-catenin,C-myc and cyclin D1
2.5 激活Wnt/β-catenin信号通路对细胞中β-catenin、C-myc、cyclin D1蛋白表达影响结果
收集Wnt/β-catenin信号通路激活剂LiCl作用后的少突胶质前体细胞,Western blot检测细胞中Wnt/β-catenin信号通路相关蛋白β-catenin、C-myc、cyclin D1蛋白水平。结果显示,激活剂组细胞中β-catenin、C-myc、cyclin D1蛋白水平明显高于未处理组(P< 0.01)。(图5)

注:(A)Western blot结果图;(B)蛋白表达率;与未处理组比,**P< 0.01。图5 激活Wnt/β-catenin信号通路对β-catenin、C-myc、cyclin D1蛋白表达影响结果Note.(A)Western blot results.(B)Protein expression rate. Compared with the untreated group,**P< 0.01.Fig.5 Effect of activation of Wnt/β-catenin signaling pathway on the expression of β-catenin,C-myc,and cyclin D1
2.6 激活Wnt/β-catenin信号通路对细胞增殖迁移影响结果
MTT检测Wnt/β-catenin信号通路激活剂LiCl作用后的少突胶质前体细胞48 h的细胞存活情况,Boyden chamber小室检测48 h细胞迁移情况。结果显示,激活剂组细胞存活率和迁移细胞数目均明显高于未处理组,差异有显著性(P< 0.01)。激活剂组细胞中迁移相关蛋白MMP-2和MMP-9蛋白表达水平明显高于未处理组,差异有显著性(P< 0.01)。(图6)

注:(A)细胞存活率;(B)迁移结果图;(C)迁移细胞数;(D)Western blot结果图;(E)蛋白表达率;与未处理组比,**P< 0.01。图6 激活Wnt/β-catenin信号通路对细胞增殖迁移影响结果Note.(A)Cell survival rate.(B)Migration results map.(C)Number of migrated cells.(D)Western blot results.(E)Protein expression rate. Compared with the untreated group,**P< 0.01.Fig.6 Effect of activation of Wnt/β-catenin signaling pathway on the cell proliferation and migration
3 讨论
少突胶质前体细胞在中枢神经系统疾病的发生过程中发挥重要作用[8]。少突胶质前体细胞能够促进神经系统损伤修复及重建。中枢神经系统髓鞘的生长和少突胶质细胞密不可分,而髓鞘在中枢神经系统损伤修复中发挥积极作用[9-10]。有研究表明,在脱髓鞘病灶四周有许多少突胶质前体细胞存在,这些细胞是从室管膜的下区增殖迁移而来[11-12]。研究少突胶质细胞的增殖和迁移是研究中枢神经系统发育的重要组成部分。
VEGF相对分子量为34~45×103,编码VEGF的基因约为14 kb,该基因含有7内含子和8个外显子[13]。VEGF能够促进血管生长,促进血管内皮细胞的分裂。近年来有研究表明,VEGF能够促进神经元的延伸[14]。用VEGF作用于移植的脑皮层,组织中神经元延伸及神经元存活情况均明显增加[15]。过表达小鼠体内的VEGF,神经干细胞增殖速度增加[16]。VEGF能够在一定程度上逆转缺氧对神经元的损害[17]。背根神经移植实验证明,VEGF还具有促进雪旺细胞的增殖[18]。这些研究结果都表明,VEGF对神经系统具有一定的保护作用。除此之外还发现,VEGF能够促进脊髓损伤小鼠胶质前体细胞的增殖和迁移,对星形胶质细胞的分裂也具有促进作用[19]。本研究中,通过体外分离培养小鼠少突胶质前体细胞,经VEGF作用后,发现细胞增殖和迁移能力均明显增高。这提示,VEGF具有促进少突胶质前体细胞增殖和迁移的作用。
Wnt/β-catenin信号通路在细胞的生长过程中发挥重要作用。Wnt/β-catenin信号通路是一种高度保守的信号通路,在真核生物体内广泛存在。β-连环蛋白(β-catenin)是Wnt/β-catenin信号通路中的效应因子,在信号转导过程中起关键作用[20]。C-myc和cyclin D1是Wnt/β-catenin信号通路中的靶基因[21]。Wnt/β-catenin信号通路激活时,β-catenin、C-myc、cyclin D1表达增多[22]。有研究表明,Wnt/β-catenin信号通路在中枢神经系统中具有保护作用,参与神经系统的发育[23]。VEGF能够通过调控NOTCH、PI3K、ERK信号通路对少突胶质前体细胞的增殖和迁移发挥促进作用[24]。与NOTCH、PI3K、ERK信号通路一样参与细胞生长的Wnt/β-catenin信号通路是否也与少突胶质前体细胞的增殖和迁移有关。本研究中,Western blot检测了与VEGF作用后的少突胶质前体细胞中Wnt/β-catenin信号通路相关蛋白β-catenin、C-myc、cyclin D1蛋白的表达,结果发现,VEGF作用后的少突胶质前体细胞中β-catenin、C-myc、cyclin D1蛋白水平表达上调。进一步用Wnt/β-catenin激活剂处理少突胶质前体细胞,发现细胞的增殖和迁移能力均明显升高。
综上所述,VEGF能够促进少突胶质前体细胞的增殖和迁移,作用机制与Wnt/β-catenin信号通路有关。这为进一步研究中枢神经系统的组成奠定了基础,为治疗中枢神经系统疾病提供了新思路。
