紫茎泽兰提取物对3种杂草的化感胁迫作用
2018-06-23马金虎杨文秀孙亮亮杨小环
马金虎,杨文秀,孙亮亮,陈 皓,赵 倩,杨小环,*
1 山西农业大学园艺学院,太谷 030801 2 山西农业大学农学院,太谷 030801 3 云南农业大学热带作物学院,普洱 665000
紫茎泽兰(Eupatoriumadenophorum)为多年生、丛生状常绿半灌木植物,是一种世界性恶性杂草,生活力强、化感作用强烈[1- 3]。紫茎泽兰植株中富含天然活性物质,其提取物对多种植物具有强烈的化感作用,显著抑制植物的生长发育,有望被开发成植物源除草剂应用于杂草的绿色防控。郑丽等[4]报道,2.5%的紫茎泽兰叶片水提取液显著的抑制细叶苦荬、莎草砖子苗、无芒虎尾草、紫花大翼豆、白三叶等种子萌发和幼苗生长。王亚麒等[5]报道,100 mg/L的紫茎泽兰浸提液对白三叶、黑麦草和紫花苜蓿种子发芽和幼苗生长均有显著的抑制作用。
稗草(Echinochloacrusgalli)、灰绿藜(Chenopodiumglaucum)和反枝苋(Amaranthusretroflexus)分别是禾本科、藜科和苋科杂草中分布最广,危害最为严重的杂草,广泛分布于全国各地,常以优势草种生于农田,危害农作物的生长,特别是稗草,2012年来在我国已经上升为水稻产区第一恶性杂草,影响水稻的产量及品质。多年来,对这3种杂草的防除,多采用人工拔除和使用化学除草剂的方法,不仅耗费大量的人力且大量使用化学除草剂除对生态环境也造成了一定的破坏[6-7]。作者前期研究发现,紫茎泽兰提取物对反枝苋和灰绿藜种子萌发和幼苗生长有显著地抑制作用,对幼苗活性氧代谢水平有明显的影响[8]。但是,紫茎泽兰提取物抑制两种杂草的细胞生理机制还不清楚,紫茎泽兰提取物对稗草是否也有化感作用未见报道。为此,本试验以上述3种主要的田间杂草为研究对象,重点从细胞生理学角度,研究了紫茎泽兰提取物对3种杂草幼苗根和根边缘细胞化感作用的影响,旨在明确紫茎泽兰提取物对3种杂草化感胁迫的生理机制,为紫茎泽兰提取物开发成植物源除草剂应用于3种杂草绿色防控提供理论依据。
1 材料与方法
1.1 试验材料
紫茎泽兰提取物的制备方法:采集紫茎泽兰成熟叶,室温下阴干,粉碎机粉碎,过40目筛,用95%的乙醇浸泡72 h提取3次。浸提液用砂芯抽滤器(微孔滤膜孔径为0.45 μm)过滤,合并浸提液。浸提液用旋转蒸发器经减压浓缩除去大部分乙醇,得到浓稠的提取物。将提取物溶于适量水中制成混悬液,然后用石油醚进行萃取,共萃取5次。萃取物再用旋转蒸发器经减压浓缩后,置低温真空干燥箱中挥发掉石油醚得到紫茎泽兰提取物,4℃低温下避光保存备用。在使用时,称适量紫茎泽兰提取物,先用少量丙酮溶解(每克提取物5 mL丙酮),再配制成不同浓度的提取物水溶液。
供试杂草稗草(Echinochloacrusgalli)、灰绿藜(Chenopodiumglaucum)和反枝苋(Amaranthusretroflexus)的种子均收集于山西农业大学园艺站。
1.2 材料培养和紫茎泽兰提取物处理
挑选均匀饱满的3种杂草种子适量,用0.1% HgCl2消毒5 min,然后用蒸馏水洗去HgCl2残液,再用滤纸吸干种子表面水分。采用纸卷发芽的方法,反枝苋和灰绿藜分别取100粒、稗草取50粒种子均匀摆放在18 cm×25 cm滤纸的中上部,盖上同等大小的滤纸,小心将滤纸卷成纸卷。每4个纸卷用橡皮筋扎为一组(4次重复),置于300 mL烧杯中,进行不同浓度的提取物处理(Extracts treatment,ET),并以蒸馏水处理作为对照。实践中发现,3种杂草种子对ET溶液的胁迫敏感程度不同,尤其是反枝苋,经浓度高于600 mg/L ET处理4天后,有烂苗现象。为便于统计3种杂草种子萌发指标,设定稗草和灰绿藜种子的ET浓度为250、500、750 mg/L和1000 mg/L,而反枝苋种子的ET浓度为150、300、450 mg/L和600 mg/L。将烧杯置于25℃培养箱中,黑暗下进行种子发芽试验,每天统计种子的各项发芽指标,种子萌发生长8 d结束试验。此外,按照相同的方法进行种子萌发,设置对照和一个较高浓度的ET(1000 mg/L)对3种杂草种子进行处理,种子萌发生长至4 d时,取活的幼苗根尖用于根尖电镜扫描样品的制作。
将消毒的双层纱布用橡皮筋固定在500 mL烧杯口上,然后每个杂草品种取200粒消毒的种子置于纱布上,再在种子上覆盖一层滤纸和一层脱脂棉。在脱脂棉上分别均匀滴加15 mL蒸馏水(作为对照)或500、750 mg/L和1000 mg/L的ET,再用保鲜膜封闭。将烧杯置25℃培养箱内,进行幼苗根悬空培养。待3种杂草对照的幼苗根长约20 mm时,进行如下处理:(1)不同杂草每处理挑选50个均匀一致的根尖制备根边缘细胞悬液,用于测定根边缘细胞(RBC)数、活率、凋亡率、黏胶层厚度。(2)不同杂草每处理分别取5个根尖,用刀片切取约10 mm长的根尖用于根尖和根尖原位边缘细胞的显微观察拍照。
同上述幼苗根悬空培养方法,进行3种杂草根悬空培养(不进行ET胁迫),待杂草幼苗根生长至约5 mm时,对杂草根尖每隔1 h喷施蒸馏水(作为对照)或500、750 mg/L和1000 mg/L的ET,连续喷施5次,再生长12 h后切取幼苗根尖,测定其根冠果胶甲基酯酶(PME)活性。
1.3 测定指标与方法
不同杂草种子发芽和幼苗生长指标的统计 按种子检验规程[9]统计各处理的种子发芽率、发芽势(G)=Ga/Gn×100%(Ga:3d发芽种子数;Gn:供试种子数)、发芽指数(GI)= Σ(Gt·Dt-1)(Gt:td 内发芽种子数;Dt:发芽天数)、种子活力指数(VI)=GI×W(W:单株幼苗平均鲜重)、茎长抑制率=(对照茎长-处理茎长)/对照茎长、根长抑制率=(对照根长-处理根长)/对照根长、幼苗鲜重。其中,茎长抑制率、根长抑制率、幼苗鲜重每处理取20株幼苗取平均值。每处理重复4次。
因为n≥6,n-k≥3,根据性质1,|Ei,j|≥2,取边且边(x,y),(x′,y′)∈Ei,j,则在内存在x与x′间的哈密顿路HP,不妨令HP={x,P1,u,P2,x′}.同理,在内存在y与y′间的哈密顿路HP′,取HP′={y,Q1,v,Q2,y′}.下面构造u,v间内不交的路.
根尖电镜扫描样品的制作与观察 参照范华等[10]的方法:切取对照和1000 mg/L ET溶液胁迫处理的根尖大约10 mm,迅速放到3%戊二醛固定液中,0—4℃下固定2 d。用磷酸盐缓冲液(0.1 mol/L, pH=7.2)洗涤3次,每次15 min,依次用30%,50%,70%,80%,90%和95%的乙醇系列脱水(每一梯度脱水15 min),100%的乙醇脱水两次,每次20 min,之后叔丁醇置换。样品用JEOL JFD- 320冷冻干燥,将干燥好的材料用导电胶带粘在样品台上,用JEOL JFC- 1600离子溅射镀膜仪喷镀铂金,喷镀好的材料放入JEOL JEM- 6490 LV扫描电子显微镜下观察拍照。
根边缘细胞(RBC)活性测定及根尖边缘细胞原位观察 RBC活性测定参考胡忠良等[11]的方法。不同杂草,每处理挑选50个均匀一致的根尖,切取5 mm将其浸泡在盛有200 μL蒸馏水的离心管中,振荡器振荡30 s,取出根尖再用50 μL的蒸馏水冲洗两次。收集细胞悬液转入微量注射器(规格1000 μL)挤压3次,使成团的边缘细胞分离开。将细胞悬液4 ℃下 500 r/min离心3 min,弃去部分上清液,获得细胞分散均匀、浓度适宜的细胞悬液备用。取50 μL RBC悬浮液,加入20 μL AO-EB复合染液(AO∶EB= 1∶1),充分混匀,避光染色1 min。取少许悬液,加入血细胞计数板,在Olympus BX 53(U-RFL-T)荧光显微镜(蓝色激发光)下观察记录根边缘细胞总数,活细胞和死细胞数量(活细胞呈现绿色荧光,死细胞呈橘红色或红色荧光)。细胞活率=(活细胞数/总数细胞)×100%。每处理重复5次;每处理切取5个根尖置载玻片上,滴加少量AO-EB复合染液立即在显微镜下观察拍照。
RBC 凋亡率的测定 取50 μL备用的细胞悬液,加入75 μL Hochest- 33258染液,暗处染色5 min,吸取少量悬液,加入血细胞计数板,在紫外UV激发光下观察活细胞与凋亡细胞的形态特征并计数[12]。
RBC 黏胶层厚度的测定 取50 μL备用的细胞悬液,与50 μL的墨水(India ink)混匀染色5 min,取少量混合液滴在载玻片上,盖片,在荧光显微镜下观察测量。RBC的黏胶层厚度测量,不同处理测定10个细胞,每个细胞测3个不同位置取其平均值[13-14]。
根冠果胶甲基酯酶(PME)活性测定 参照胡忠良等[11]的方法。不同杂草,随机剪取不同处理长约5 mm的根尖30个,加入400 μL PME提取液(内含0.2 mol/L Na2HPO4, 0.1 mol/L柠檬酸,1 mol/L NaCl, pH=5.8),冰浴研磨后转移至离心管中,再用400 μL PME提取液清洗研钵1次,合并入离心管中,置于4℃冰箱中,每隔20 min振荡1次,1 h后,4℃ 15000 r/min离心10 min。取300 μL酶液加入4 mL PME底物溶液(内含0.5% w/v果胶,0.05% w/v甲基红,0.2 mol/L NaCl,pH=6.8),37℃水浴2 h,525 nm波长下测定OD值,根据标准曲线计算PME活性,活性单位为μmol H+/根尖数/h。每处理重复3次。
1.4 数据统计及分析
所有数据的统计分析均采用DPS 6.5软件处理,采用Duncan新复极差测验法进行数据差异显著性检验(P< 0.05)。利用Excel 2007进行数据整理和绘图,Adobe Photoshop CS5辅助图片整理。
2 结果与分析
2.1 不同浓度紫茎泽兰提取物对3种杂草种子萌发生长的影响
图1试验结果表明,750 mg/L以上浓度的紫茎泽兰提取物胁迫显著地抑制稗草种子的萌发生长。750 mg/L提取物胁迫处理与其对照比,种子的发芽势、发芽率、活力指数和幼苗鲜重分别降低了24.7%、6.8%、29.4%和31.2%,幼苗茎长抑制率和根长抑制率分别达到44.0%和80.8%;250 mg/L以上浓度提取物胁迫显著地抑制灰绿藜种子的萌发生长。250 mg/L提取物胁迫处理与其对照比种子的发芽势、发芽率、发芽指数、活力指数和幼苗鲜重分别降低了32.5%、20.7%、23.3%、30.2%和5.1%,幼苗茎长抑制率和根长抑制率分别达到12.7%和60.8%;150 mg/L以上浓度提取物胁迫显著地抑制反枝苋种子的萌发生长。150 mg/L提取物胁迫处理与其对照比种子的发芽势和发芽指数分别降低了34.8%和20.2%,幼苗茎长抑制率和根长抑制率分别达到7.8%和23.4%;从图1试验结果综合分析,3种杂草对紫茎泽兰提取物胁迫的敏感程度反枝苋>灰绿藜>稗草。
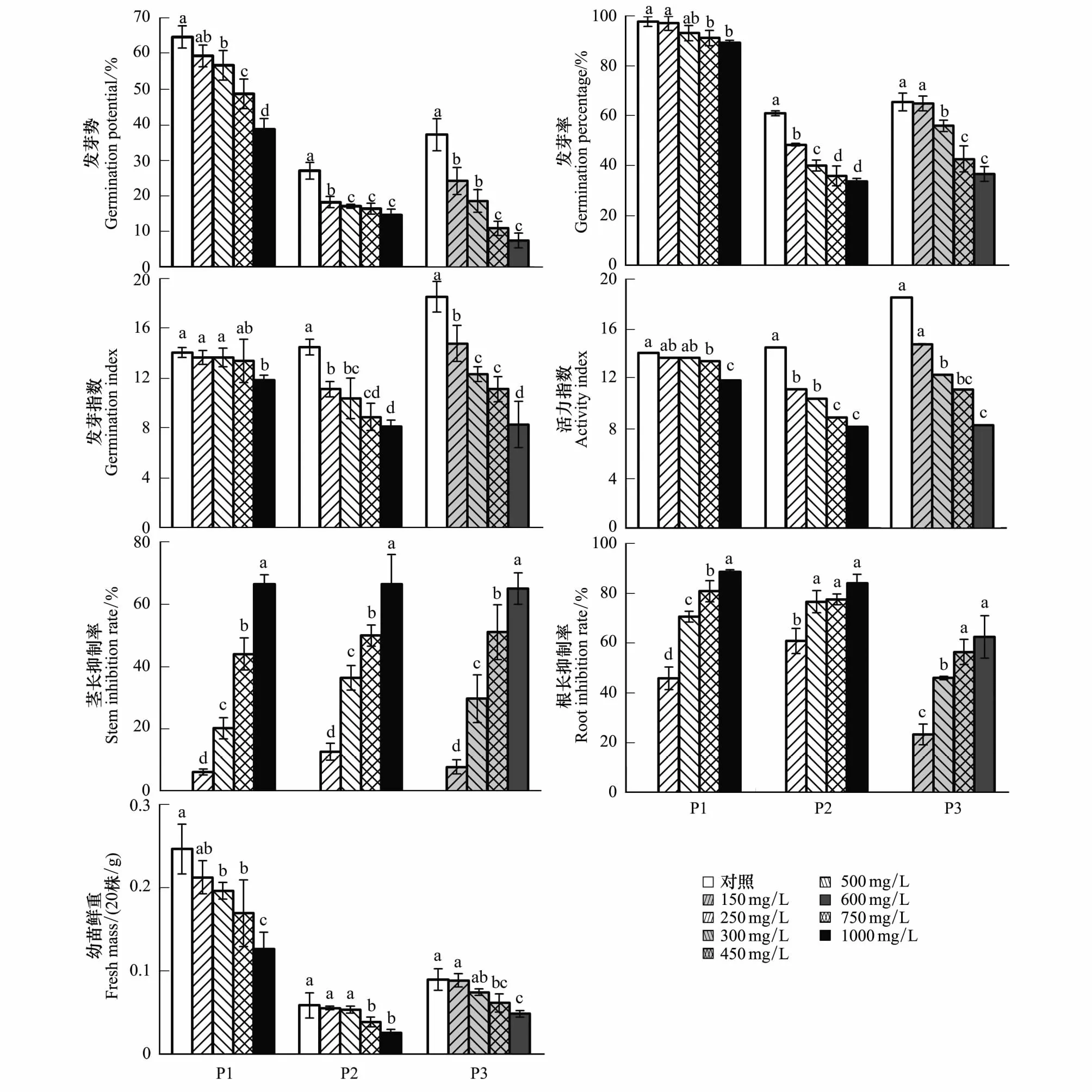
图1 不同浓度紫茎泽兰提取物对杂草种子萌发及幼苗生长的影响Fig.1 Effects of Eupatorium adenophorum extracts of different concentrations on seed germination and seedlings growth of weeds同一品种不同字母表示处理间差异显著(P < 0.05),下同;ET:提取物处理,Extracts treatment;P1:稗草,Echinochloa crusgalli;P2:灰绿藜,Chenopodium glaucum;P3:反枝苋,Amaranthus retroflexus
2.2 紫茎泽兰提取物对3种杂草根尖和根边缘细胞胁迫伤害的形态观察
光学显微镜下(图3),3种杂草对照幼苗根尖均可清晰地观察到根尖周围附着大量活的边缘细胞,根尖结构完整且保持生活力。1000 mg/L紫茎泽兰提取物处理,3种杂草根尖组织和细胞以及根边缘细胞大量被杀死,根边缘细胞数量减少。
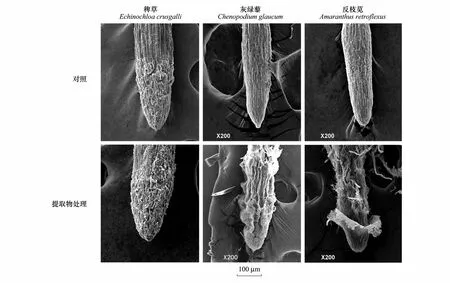
图2 稗草、灰绿藜和反枝苋根尖和根边缘细胞的形态学特征Fig.2 Morphological features of root tips and border cells in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu revealed by SEM
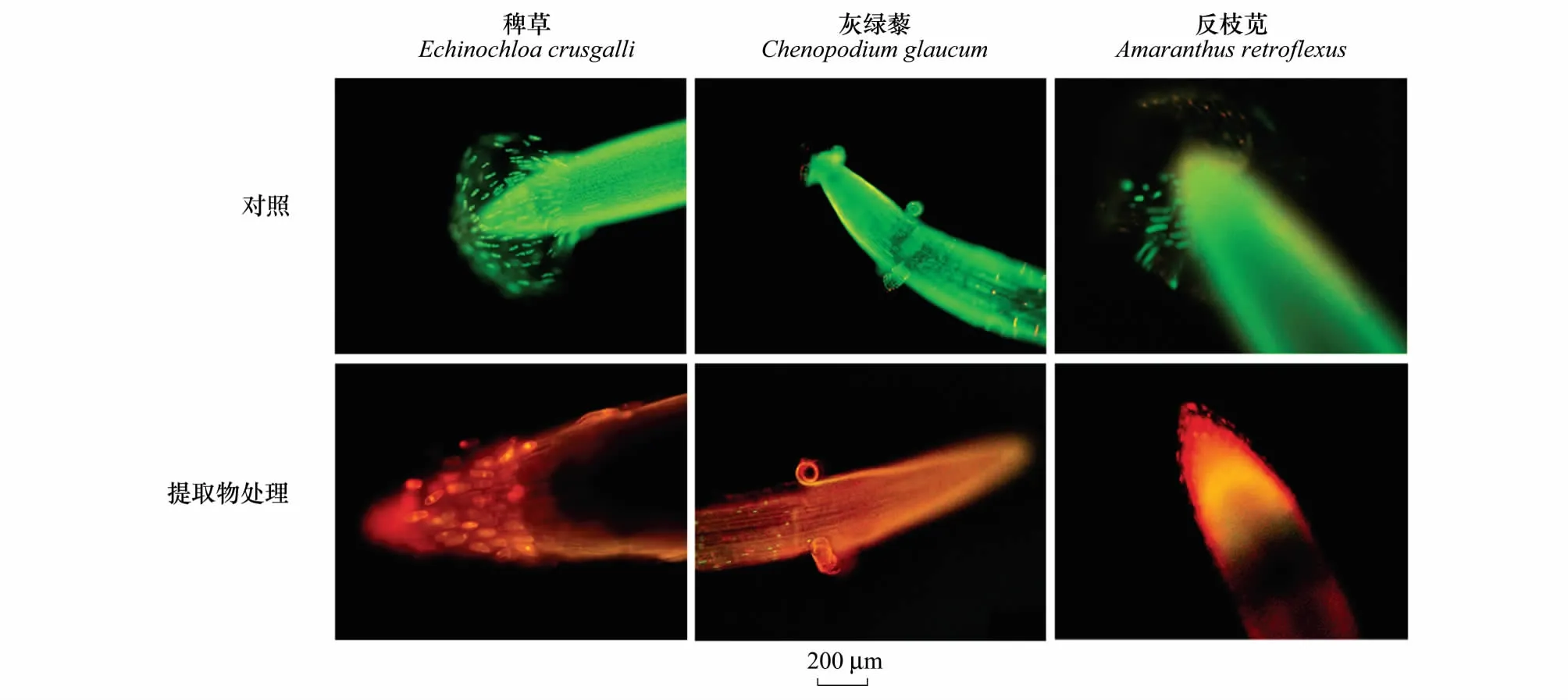
图3 荧光显微镜下稗草、灰绿藜和反枝苋根尖和根边缘细胞的形态学特征Fig.3 Morphological features of root tips and border cells in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu under the fluorescent microscope绿色为活的组织和细胞,红色和橘红色为死的组织和细胞
2.3 不同浓度紫茎泽兰提取物胁迫对3种杂草根边缘细胞数量和活率的影响
光学显微镜下,稗草根边缘细胞的形态大部分呈现梭形、椭圆形或杆状,细胞较小。灰绿藜、反枝苋根边缘细胞多数呈杆形、月牙形或弧形,细胞普遍较大。3种杂草活细胞均呈绿色,死细胞为红色和橘红色(图4)。
试验结果表明(图5),紫茎泽兰提取物处理显著抑制3种杂草RBC的数量,提取物浓度越高抑制作用越强烈。1000 mg/L提取物处理,稗草、灰绿藜、反枝苋RBC数比其对照分别降低了44.5%、48.3%和64.0%(图4A);提取物处理还显著抑制3种杂草RBC的活率。1000 mg/L提取物处理,稗草、灰绿藜和反枝苋的RBC活率分别比其对照降低了92.2%、62.4%和78.6%(图4B)。
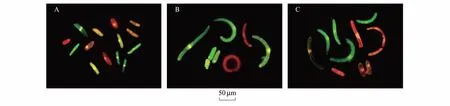
图4 AO-EB 染色的稗草(A)、灰绿藜(B)和反枝苋(C) RBCFig.4 AO-EB stained RBCs of Echinochloa crusgalli (A), Chenopodium glaucum (B) and Amaranthus retroflexu (C)绿色:活细胞;红色和橘红色:死细胞
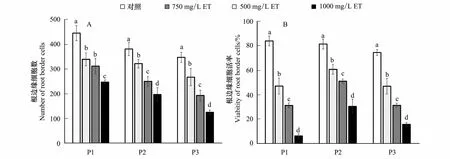
图5 紫茎泽兰提取物对稗草、灰绿藜和反枝苋根系边缘细胞(RBC)数量和活率的影响Fig.5 Effects of Eupatorium adenophorum extracts on the numbers and motilities of RBC in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu
2.4 不同浓度紫茎泽兰提取物胁迫对3种杂草根边缘细胞凋亡率的影响
图6可见,Hoechest- 33258 染色的3种杂草正常根尖RBC颜色呈蓝色且质地均匀一致,细胞核轮廓清晰且呈现较小的蓝色亮斑;出现凋亡现象的RBC颜色不均匀,细胞有片状浅蓝色片段或细胞核呈现弥散状轮廓不规则较大的亮斑。
从图7可以看出,紫茎泽兰提取物处理,随提取物浓度的升高,3种杂草RBC的凋亡率均逐渐增大。500 mg/L提取物处理,反枝苋、灰绿藜、稗草RBC凋亡率分别比其对照升高了115.5%、83.6%和26.7%。1000 mg/L提取物处理,反枝苋、灰绿藜和稗草RBC凋亡率分别达97.1%、91.3%和81.7%。说明,反枝苋RBC对提取物胁迫的耐性相对较弱。

图6 Hoechest- 33258 染色的稗草(A)、灰绿藜(B)和反枝苋(C)的根系边缘细胞(RBC)Fig.6 Hoechest- 33258 stained RBCs of Echinochloa crusgalli (A), Chenopodium glaucum (B) and Amaranthus retroflexu (C)1:正常的 RBC;2:出现凋亡片段的 RBC
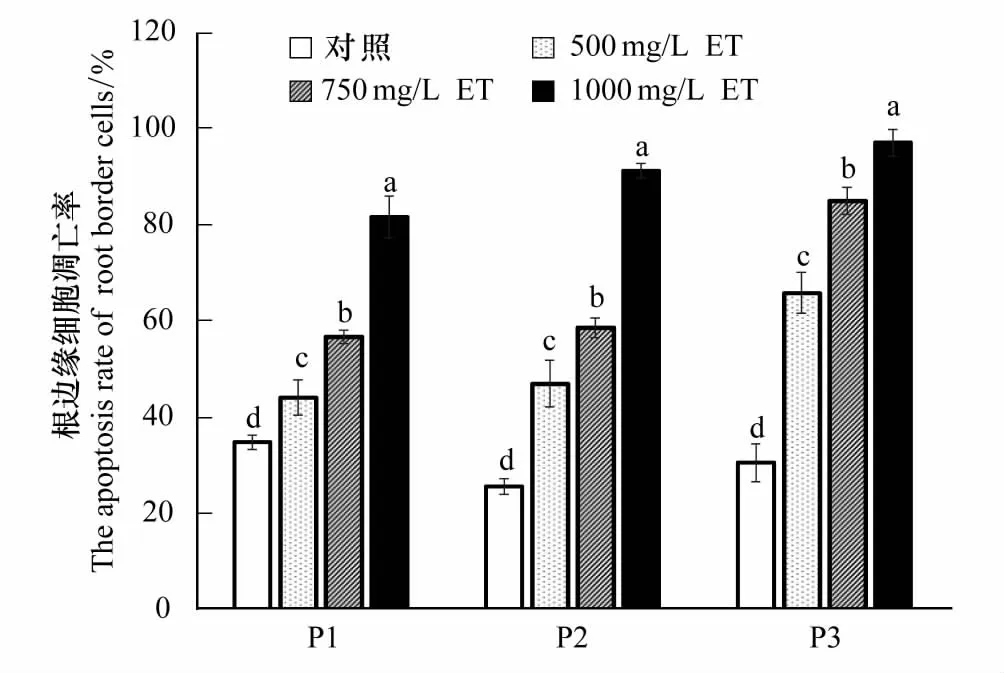
图7 不同浓度紫茎泽兰提取物对稗草、灰绿藜和反枝苋根系边缘细胞(RBC)凋亡率的影响Fig.7 Effects of Eupatorium adenophorum extracts of different concentrations on the apoptosis rates of RBC in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu
2.5 不同浓度紫茎泽兰提取物胁迫对3种杂草根边缘细胞黏胶层厚度的影响
从图8和图9可知,随提取物浓度的升高,3种杂草RBC的黏胶层厚度均逐渐增大。500 mg/L提取物处理,稗草、灰绿藜和反枝苋RBC的黏胶层厚度比其对照分别增加了26.7%、17.4%和20.1%,均达到显著差异。1000 mg/L提取物处理,稗草、灰绿藜和反枝苋RBC的黏胶层厚度比其对照比分别增加了99.0%、65.5%和61.1%。说明,紫茎泽兰提取物诱导杂草RBC黏胶层增厚。
2.6 不同浓度紫茎泽兰提取物胁迫对3种杂草根冠果胶甲基酯酶(PME)活性的影响
从图10可以看出,750 mg/L和1000 mg/L提取物处理,反枝苋PME活性与其对照比分别升高了4.7%和6.1%,均达到显著差异。1000 mg/L提取物处理,灰绿藜PME活性与其对照比升高了5.6%,也达到显著差异。而稗草经500、750 mg/L和1000 mg/L提取物胁迫处理,PME活性与其对照比无明显变化。这可能与其相对耐提取物胁迫有关。
3 讨论
细胞毒性是化感物质作用的一个重要特性[15],化感物质与受体植物细胞表面相互作用,破坏细胞的内部结构,干扰细胞有丝分裂和基因表达,导致受体植物生长发育受阻[15- 17]。从本研究结果看,随着紫茎泽兰提取物处理浓度的升高,3种杂草的发芽率、发芽势、发芽指数、活力指数等逐渐降低,幼苗的茎长抑制率、根长抑制率增大,幼苗鲜重降低。这一结果说明,紫茎泽兰提取物对3种杂草种子萌发生长产生细胞毒性,从而抑制种子的萌发和幼苗生长。Yang等[18]曾报道,紫茎泽兰主效化感物质DTD(泽兰二酮)和HHO(羟基泽兰酮)导致水稻根尖组织混乱,细胞萎缩。本研究中较高浓度的紫茎泽兰提取物处理使稗草根尖发生肿胀变形,灰绿藜根尖抽缩、干瘪,反枝苋根尖组织结构严重被破坏,根尖表层细胞脱落,内层细胞排列混乱(图2),与其结果相类似。因此推测,试验中使用的紫茎泽兰提取物中可能含有DTD和HHO这两种物质,有待对提取物进行进一步的分离、纯化和鉴定并加以证实。
根边缘细胞是从根冠表面脱落下来并聚集在根部周围的一群特化细胞,以前人们普遍认为RBC没有活性[19]。然而进一步的研究表明,多种植物的RBC脱离母体前的存活率超过90%[20]。本研究发现,3种杂草稗草、灰绿藜和反枝苋的RBC的数量和活率存在品种差异,与Cai等[13]的研究结果发现相一致。稗草的RBC数量和脱离根尖后的活细胞较多,而灰绿藜和反枝苋较少,这可能是由于稗草、灰绿藜和反枝苋分属不同的科属原因所致,与其物种自身的特性有关。
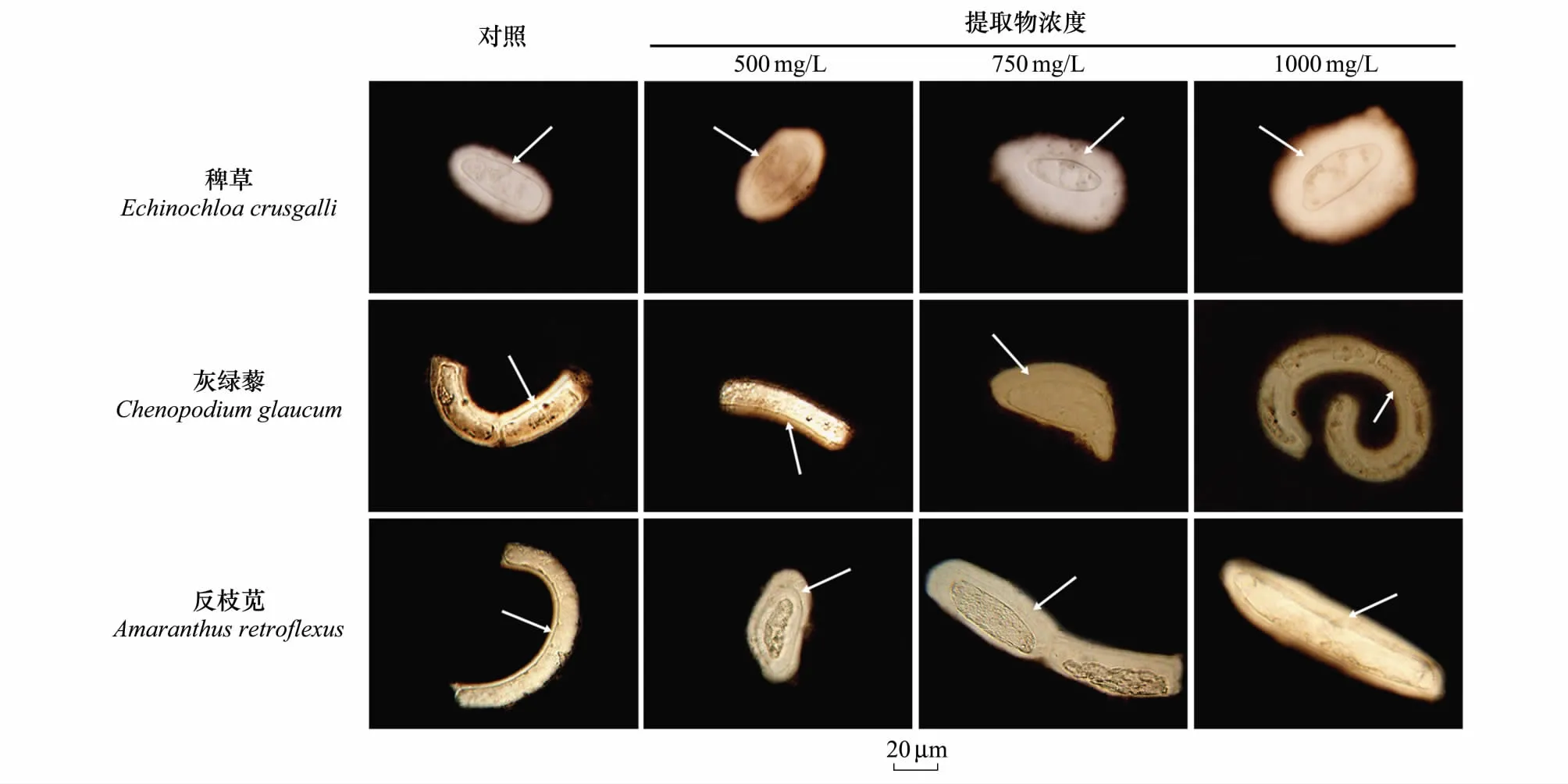
图8 紫茎泽兰提取物处理后稗草、灰绿藜和反枝苋根系边缘细胞(RBC)的黏胶层Fig.8 The mucilage glue layer around RBCs in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu subjected to treatment with Eupatorium adenophorum extracts箭头所指为黏胶层
化感胁迫诱导细胞凋亡,当受到某些高毒性的化感物质胁迫时,受体植物细胞出现细胞凋亡的特征,如细胞核出现弥散现象等[21],严重时可以引起细胞的死亡[12]。本研究发现,紫茎泽兰提取物胁迫,3种杂草根边缘细胞Hoechest- 33258染色后部分细胞有的颜色不均匀,细胞有片状浅蓝色片段,有的细胞细胞核呈现不规则较大的亮斑,出现弥散现象。说明,提取物胁迫诱导细胞凋亡,最终引起细胞死亡。从3种杂草的根边缘细胞AO-EB染色发现,随提取物浓度的升高,3种杂草的根边缘细胞呈现红色或橘黄色细胞的数量在增多,这也直接证明了提取物胁迫,降低了根边缘细胞活率的试验现象。
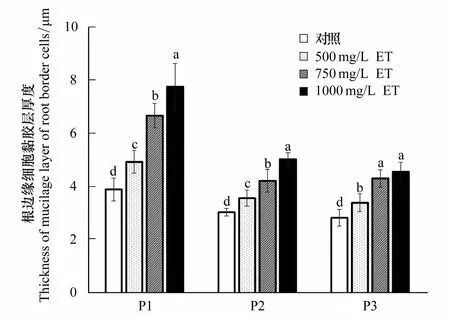
图9 紫茎泽兰提取物对稗草、灰绿藜和反枝苋根系边缘细胞(RBC)黏胶层厚度的影响Fig.9 Effects of Eupatorium adenophorum extracts on the thickness of RBC mucilage glue layers in Echinochloa crusgalli, Chenopodium glaucum, and Amaranthus retroflexu
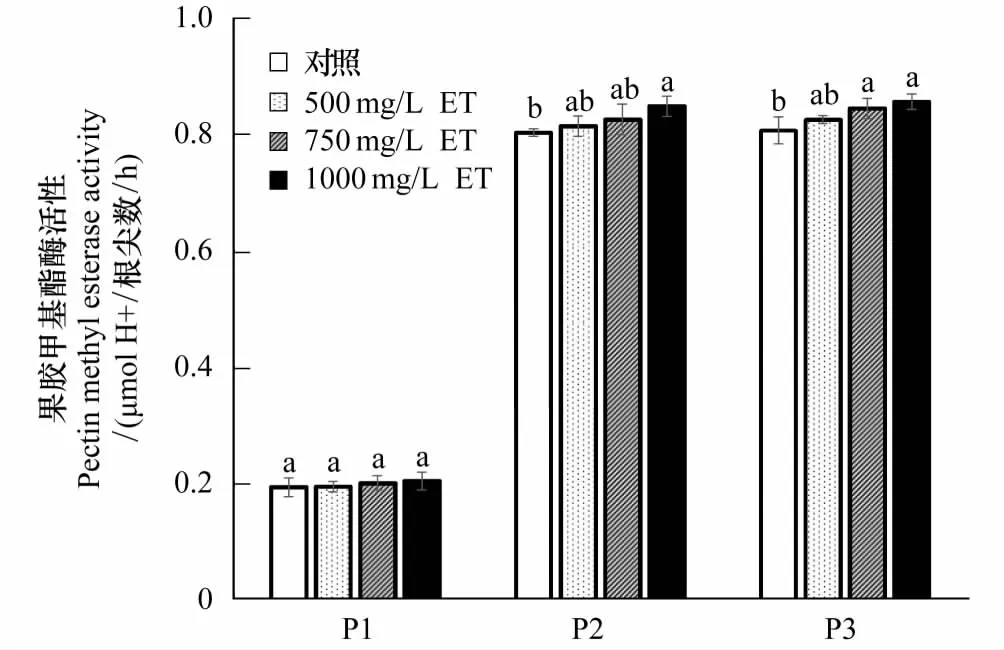
图10 紫茎泽兰提取物对稗草、灰绿藜和反枝苋根冠PME活性的影响Fig.10 Effects of Eupatorium adenophorum extracts on the PME activities of root caps in Echinochloa crusgalli, Chenopodium glaucum and Amaranthus retroflexu
当植物根遭到有毒物质和微生物胁迫时,根系边缘细胞保护植物根尖抵御外界有毒物质和微生物的危害[22]。根边缘细胞从根尖分离后自主进行新陈代谢,向外分泌一系列化学物质包被在边缘细胞的外侧构成黏胶层,对根边缘细胞具有保护作用[23]。当根边缘细胞受到生物或非生物胁迫时迅速向胞外释放多种化学物质,使黏胶层进一步增厚,以吸附或排斥病原体[24],螯合有毒物质[25],缓解胁迫带来的伤害。乔永旭等[21]研究发现,化感物质肉桂酸作用下,黄瓜(CucumissativusL.)根边缘细胞黏胶层增厚,在一定程度上抵御了化感胁迫对根尖的伤害。李安奇等[25]报道,当大豆根边缘细胞受到土荆芥化感物质胁迫时,根边缘细胞周围形成了一些颗粒状物质,可能与螯合化感物质有关。本研究结果表明,紫茎泽兰提取物作用下,3种杂草根边缘细胞黏胶层厚度随提取物浓度的升高而显著增厚。说明,根边缘细胞受到提取物化感胁迫,向外释放了大量的化学物质,以吸附或螯合提取物,阻滞提取物进一步向细胞内渗透。这一现象与豌豆(PisumsativumL.)根边缘细胞受到铝胁迫[26]、玉米根边缘细胞受到铜和土荆芥化感物质胁迫[11,27],出现根边缘细胞黏胶层厚度增厚的现象相类似。由此可见,根边缘细胞黏胶层厚度增加是其应对化感胁迫的一种保护性生理反应。
植物受到外界胁迫时会产生一些应急机制来避免自身受到严重的伤害,例如产生更多的根边缘细胞来抵御胁迫[28]。根边缘细胞的产生速率与果胶甲基酯酶(PME)密切相关,PME通过果胶去甲基化,果胶酸分解,诱导其它果胶酶基因的表达,最终促进根边缘细胞从根冠释放[29]。本研究结果显示,稗草PME活性随提取物浓度的升高无明显的变化,而灰绿藜和反枝苋PME活性呈现随提取物浓度的升高而上升的变化趋势。出现这种结果的原因可能是提取物胁迫诱导杂草通过上调根冠细胞中PME基因的表达,使PME活性升高以促进根边缘细胞的产生。然而,试验中3种杂草PME活性与RBCs数量变化趋势相反,这可能是随提取物浓度的升高,根尖组织受损加剧,产生根边缘细胞的能力不断下降所致。
化感胁迫作用下,PME活性变化还与受体植物对化感胁迫的耐性有密切关系,对化感胁迫敏感的受体植物PME活性变化较强烈[30]。本研究结果显示,随提取物浓度的升高,稗草的PME活性变化不明显,而灰绿藜、反枝苋PME活性较明显,1000 mg/L提取物胁迫时,PME活性与其对照比均达到显著差异。说明,灰绿藜、反枝苋对提取物胁迫比较敏感,而稗草不敏感。这也可从提取物胁迫下3种杂草种子萌发生长指标、提取物对根尖的损伤观察结果中得到印证。
4 结论
紫茎泽兰提取物对稗草、灰绿藜、反枝苋种子萌发生长有较强烈的化感胁迫作用,抑制种子的萌发和幼苗生长。紫茎泽兰化感物质抑制杂草根边缘细胞的产生,诱导边缘细胞发生凋亡,破坏根边缘细胞对根尖的保护系统,化感物质进一步对根尖产生胁迫伤害,破坏根尖的组织结构和细胞结构,使根尖不能发挥正常的运输水分和营养代谢的功能,从而抑制种子的萌发和早期幼苗的生长。紫茎泽兰提取物可开发成植物源除草剂,用于3种杂草的绿色防控。
参考文献(References):
[1] Zhu L, Sun O J, Sang W G, Li Z Y, Ma K P. Predicting the spatial distribution of an invasive plant species(Eupatoriumadenophorum) in China. Landscape Ecology, 2007, 22(8): 1143- 1154.
[2] Zhao X, Zheng G W, Niu X M, Li W Q, Wang F S, Li S H. Terpenes fromEupatoriumadenophorumand their allelopathic effects onArabidopsisseeds germination. Journal of Agricultural and Food Chemistry, 2009, 57(2): 478- 482.
[3] 庄启明, 侯婧, 周东新, 王玉英, 李华民, 曹坳程. 紫茎泽兰化学成分化感作用及生物活性. 北京师范大学学报: 自然科学版, 2008, 44(6): 610- 613.
[4] 郑丽, 冯玉龙. 紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响. 生态学报, 2005, 25(10): 2782- 2787.
[5] 王亚麒, 焦玉洁, 陈丹梅, 袁玲, 黄玥, 吴叶宽, 杜如万. 紫茎泽兰浸提液对牧草种子发芽和幼苗生长的影响. 草业学报, 2016, 25(2): 150- 159.
[6] 林玉锁, 龚瑞忠. 农药环境管理与污染控制. 环境导报, 2000,(3): 4- 6.
[7] 卜元卿, 孔源, 智勇, 王金燕, 单正军. 化学农药对环境的污染及其防控对策建议. 中国农业科技导报, 2014, 16(2): 19- 25.
[8] Ma J H, Xing G F, Yang W X, Ma L L, Gao M, Wang Y G, Han Y H. Inhibitory effects of leachate fromEupatoriumadenophorumon germination and growth ofAmaranthusretroflexusandChenopodiumglaucum. Acta Ecologica Sinica, 2012, 32(1): 50- 56.
[9] 国家技术监督局. GB/T 3543—1995 农作物种子检验规程. 北京: 中国标准出版社, 1995.
[10] 范华, 董宽虎, 方志红, 赵祥. 碱蒿营养器官的扫描电镜观察研究. 激光生物学报, 2010, 19(3): 314- 320.
[11] 胡忠良, 王亚男, 马丹炜, 陈斌, 何亚强, 周健. 玉米根边缘细胞exDNA和胞外蛋白对土荆芥化感胁迫的缓解效应. 中国农业科学, 2015, 48(10): 1962- 1970.
[12] 马春红, 李秀丽, 董文琦, 张红心, 李运朝, 崔四平, 王立安, 贾银锁, 戴志刚. HMC毒素诱导玉米同核C、N细胞质细胞凋亡的荧光显微观察. 中国农业科学, 2011, 44(9): 1823- 1829.
[13] Cai M Z, Zhang S N, Xing C H, Wang F M, Wang N, Zhu L. Developmental characteristics and aluminum resistance of root border cells in rice seedlings. Plant Science, 2011, 180(5): 702- 708.
[14] Qiao Y X, Zhang Y P, Zhang H X, Tian Y Q, Gao L H. Developmental characteristics and cinnamic acid resistance of root border cells in cucumber and figleaf gourd seedlings. Journal of Integrative Agriculture, 2013, 12(11): 2065- 2073.
[15] Babula P, Vanco J, Kohoutkova V, Dankova I, Havel L, Kizek R. Cell signals as markers of cytotoxicity of new complexes of naphthoquinones. Analysis of Biomedical Signals and Images, 2010, 20: 259- 263.
[16] Li Z H, Wang Q, Ruan X, Pan C D, Jiang D A. Phenolics and plant allelopathy. Molecules, 2010, 15(12): 8933- 8952.
[17] 胡琬君, 马丹炜, 王亚男, 张红, 李群. 土荆芥挥发油对蚕豆根尖细胞的化感潜力. 生态学报, 2011, 31(13): 3684- 3690.
[18] Yang G Q, Wan F H, Guo J Y, Liu W X. Cellular and ultrastructural changes in the seedling roots of upland rice(Oryzasativa) under the stress of two allelochemicals fromAgeratinaadenophora. Weed Biology and Management, 2011, 11(3): 152- 159.
[19] Hamamoto L, Hawes M C, Rost T L. The production and release of living root cap border cells is a function of root apical meristem type in dicotyledonous angiosperm plants. Annals of Botany, 2006, 97(5): 917- 923.
[20] 李荣峰, 蔡妙珍, 刘鹏, 梁和, 徐根娣. 植物根边缘细胞的抗逆性研究进展. 广西植物, 2007, 27(3): 497- 502.
[21] 乔永旭. 黄瓜和黑籽南瓜幼苗根系边缘细胞对肉桂酸胁迫的应答差异. 园艺学报, 2015, 42(5): 890- 896.
[22] Iijima M, Barlow P W, Bengough A G. Root cap structure and cell production rates of maize(Zeamays) roots in compacted sand. New Phytologist, 2003, 160(1): 127- 134.
[23] Hawes M C, Gunawardena U, Miyasaka S, Zhao X W. The role of root border cells in plant defense. Trends in Plant Science, 2000, 5(3): 128- 133.
[24] Wen F S, White G J, VanEtten H D, Xiong Z G, Hawes M C. Extracellular DNA is required for root tip resistance to fungal infection. Plant Physiology, 2009, 151(2): 820- 829.
[25] 李安奇, 王亚男, 张红, 汪利沙, 马丹炜. 大豆根边缘细胞对土荆芥组培根分泌物的响应. 生态环境学报, 2012, 21(1): 84- 87.
[26] 冯英明, 喻敏, 温海祥, 张英慧, 萧洪东, 王惠珍, 何丽烂, 梁火娣. 铝对豌豆根边缘细胞存活率和粘胶层厚度的影响. 生态环境, 2005, 14(5): 695- 699.
[27] 刘婷婷, 李锋, 张曦, 施积炎, 陈英旭. 铜离子胁迫下玉米根边缘细胞数量及存活率. 植物生理学报, 2012, 48(7): 669- 675.
[28] 李荣峰, 蔡妙珍, 刘鹏, 徐根娣, 梁和, 周主贵. 边缘细胞对大豆根尖铝毒害的缓解效应. 作物学报, 2008, 34(1): 318- 325.
[29] 何兵, 汪利沙, 王亚男, 张红, 李群, 马丹炜. 土荆芥挥发油对豌豆根边缘细胞的诱导和胁迫作用. 生态环境学报, 2013, 22(6): 991- 995.
[30] 李学文, 李亚林, 杨锦, 吴礼树, 萧洪东, 冯英明, 刘家友, 喻敏. 豌豆不同耐铝品种根尖细胞壁果胶及其甲基酯化度的差异. 植物营养与肥料学报, 2016, 22(3): 729- 735.
