沙枣果总黄酮类化合物的富集研究
2018-06-23张子东张圆圆孟永斌项凤影
张子东 张圆圆 孟永斌 徐 蕾 贾 楠 项凤影 路 祺
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
沙枣林分布在内陆河岸,呈疏林状态,分布面积广泛,仅在额济纳河西河林区的沙枣林将近47平方公里。人造的沙枣林大都分布在新疆、陕西、甘肃、宁夏、青海和内蒙古等地区。沙枣果肉含有多糖、脂肪、蛋白质和维生素等营养成分,可生食或熟食,还可以用做酿酒、醋、果酱、糕点等[1]。此外,沙枣入药在民间已经有悠久历史,主治烧伤、肠炎腹泻、脾胃虚弱、支气管炎等[2]。虽然沙枣极具生态和经济效益,但目前对沙枣的开发和利用也只局限在初级加工阶段,绝大多数的沙枣果资源被废弃,造成了巨大的资源浪费。
近些年来,人们发现黄酮类化合物具有抗氧化[3]、抗癌抗肿瘤[4~5]、抗炎[6]、抗心脑血管疾病[7]、免疫调节[8]、抑菌抗病毒[9]、降血糖降血脂等作用[10],在医药、食品、化妆品等领域具有广泛的应用前景,已成为国内外天然药物开发利用研究的热点。常用的植物黄酮类化合物分离和纯化方法有柱层析、树脂吸附、高效液相色谱等[12~13],其中树脂吸附法具有表面积大、吸附容量大、选择性好、预处理和再生比较容易、解吸条件温和、树脂使用周期长、运行成本较低等优点[14~16],己被广泛用于黄酮类化合物的富集。
本研究采用大孔吸附树脂法对沙枣果总黄酮粗提物进行富集,对不同类型的大孔吸附树脂进行静态和动态实验,从而确定沙枣果总黄酮粗提物最优纯化工艺,为沙枣果总黄酮的综合开发利用提供理论依据。
1 实验材料与仪器
1.1 实验材料
无水乙醇、硝酸铝、氢氧化钠、亚硝酸钠均为分析纯,购于科密欧化学试剂厂;金丝桃苷(标准品),Sigma公司;色谱甲醇(MERK);自制超纯水;D101型、HPD417型、HPD700型、HPD400A型、AB-8型、NKA-Ⅱ型、HPD600型、ADS17型、HPD80型大孔吸附树脂,均购于沧州宝恩公司。
1.2 实验仪器
UV-2550紫外可见分光光度计,购于跃进医疗器械有限公司;匀浆萃取装置,购于飞利浦公司;717型自动进样高效液相色谱仪,包括1525二元泵和2487型紫外光检测器,购于美国WATERS公司;美国迪马色谱柱(4.6 mm×250 mm,5 μm);3K-30型离心机,购于Sigma公司;BS124S电子天平,购于北京赛多利斯有限公司;PHS-3B型pH计,购于精密科学仪器有限公司。
2 实验方法
2.1 沙枣果总黄酮提取
取新鲜的沙枣果10 g,按1∶30(m∶V,g∶mL)比例加入55%乙醇溶液,室温匀浆提取5 min后,3 000 r·min-1离心10 min,取上清液。2次匀浆提取,合并上清液,负压浓缩后60℃干燥得到沙枣果总黄酮。
2.2 总黄酮含量测定
将样品用蒸馏水溶解,稀释一定倍数后,取0.5 mL溶液置于比色管中,加入0.5 mL 5%亚硝酸钠,0.5 mL 10%硝酸铝,4.0 mL 4%氢氧化钠和4.5 mL 95%乙醇,混匀避光静止15 min,在510 nm波长下检定样品溶液的吸光值。
芦丁标准曲线制作:取5 mg芦丁标准品,溶于5 mL甲醇,配置浓度1、0.5、0.25、0.125、0.062 5 mg·mL-1的标准溶液,空白样品以蒸馏水代替样品。通过芦丁标准曲线来计算样品的总黄酮含量,计算公式如下式:
(1)
式中:y代表总黄酮含量(%);c代表样品浓度(mg·mL-1);v代表样品液体总体积(mL);m代表样品质量(mg)[11]。
2.3 大孔树脂处理
大孔树脂按料液比为1∶4(m∶V,g∶mL)用蒸馏水浸泡24 h,过滤后按料液比为1∶4(m∶V,g∶mL)加入75%乙醇浸泡24 h,过滤再用蒸馏水洗涤至无浑浊,并且无醇味为止[17~19]。
2.4 大孔树脂的静态吸附、解吸实验
2.4.1 大孔树脂静态吸附量测定
取不同型号的树脂1.0 g,置于体积为100 mL的锥形瓶中,加入25 mL沙枣果总黄酮溶液,于25℃恒温水浴振荡器中100 r·min-1水浴震荡24 h后,测定锥形瓶内液体总黄酮浓度,大孔树脂吸附量(Q)与吸附率(A)计算公式如下:
(2)
式中:Q代表大孔树脂吸附量(mg·g-1);c0代表静态吸附前总黄酮浓度(mg·mL-1);c1代表静态吸附后总黄酮浓度(mg·mL-1);v代表液体体积(mL);m代表树脂质量(g)。
(3)
式中:A代表吸附率(%);c0代表静态吸附前总黄酮浓度(mg·mL-1);c1代表静态吸附后总黄酮浓度(mg·mL-1)[20]。
2.4.2 大孔树脂静态解吸量测定
将吸附后树脂迅速置于体积为100 mL的锥形瓶中,加入70%乙醇25 mL,25℃,100 r·min-1恒温水浴震荡24 h,测定锥形瓶内总黄酮浓度,解吸率(D)计算公式见式:
(4)
式中:D代表解吸率(%);v代表加入乙醇体积(mL);c代表解吸后锥形瓶中液体总黄酮浓度(mg·mL-1);m代表树脂质量(g);Q代表吸附量(mg·g-1)[21]。
2.5 静态吸附和解吸动力学曲线
2.5.1 静态吸附动力学曲线
分别取1.0 g大孔吸附树脂,置于250 mL锥形瓶中,加入90 mL初始浓度为1.42 mg·mL-1的沙枣果总黄酮提取液,25℃ 100 r·min-1恒温水浴振荡,分别于15、30、45、60、90、120、180、240、300、360 min、24 h测定上清液总黄酮浓度,时间为横坐标,吸附量为纵坐标,绘制大孔树脂对沙枣果总黄酮的静态吸附动力学曲线。
2.5.2 静态解吸动力学曲线
静态吸附完毕的树脂用蒸馏水快速地冲洗,除去大孔树脂表面的残留液体。将树脂置于250 mL锥形瓶中,加入70%乙醇90 mL,25℃ 100 r·min-1恒温水浴震荡,分别于15、30、45、60、90、120、180、240、300、360 min、24 h取样测定上清液总黄酮浓度,时间为横坐标,解吸率为纵坐标,绘制大孔树脂对沙枣果总黄酮的静态解吸动力学曲线。
2.6 大孔树脂动态实验
2.6.1 样品浓度对大孔树脂吸附影响
取大孔树脂6.0 g,采用湿法装柱,将总黄酮浓度分别为0.97、2.43、4.15、6.22 mg·mL-1的样品溶液以2 BV·h-1的流速加入到树脂柱中,每10 mL收集一管流出液,测定吸光度,泄漏点出现后停止实验。
2.6.2 样品流速对大孔树脂吸附影响
称取树脂6.0 g,采用湿法装柱,总黄酮浓度为2.43 mg·mL-1的样品溶液分别以1、2、3 BV·h-1不同流速加入树脂柱中,每10 mL收集一管总黄酮流出液,测定吸光度,泄漏点出现后则停止实验。
2.6.3 洗脱液浓度对大孔树脂解吸影响
总黄酮浓度为2.43 mg·mL-1样品溶液以2 BV·h-1的速率通过树脂柱,达到泄漏点后停止上样,用不同浓度梯度的乙醇溶液进行洗脱,流速为1 BV·h-1,每10 mL收集一管流出液,测定吸光度。绘制40%、50%、60%、70%、80%、90%不同浓度乙醇溶液的洗脱曲线。
2.6.4 洗脱速率对大孔树脂解吸影响
总黄酮浓度为2.43 mg·mL-1样品溶液以2 BV·h-1的速率通过树脂柱,吸附达到泄漏点后,用70%的乙醇溶液洗脱,每10 mL收集一管流出液,测定吸光度,绘制不同流速1、2、3 BV·h-1下的洗脱曲线。
2.7 HPLC分析
色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流速1 mL·min-1,进样量10 μL。流动相:甲醇与0.2%磷酸水溶液比例为45∶55;检测波长360 nm。
标准品的配制:准确称取金丝桃苷标准品5 mg,用甲醇定容至5 mL,配置成浓度1 mg·mL-1的标准储备液,从中取1 mL储备液加入1 mL甲醇,依次稀释成0.5、0.25、0.125、0.062 5、0.031 25 mg·mL-1不同浓度的标准溶液待测。每样重复3次,峰面积取平均值,以标准品浓度为横坐标,峰面积为纵坐标绘制标准曲线。
将沙枣果总黄酮提取液富集前后样品冻干,分别配置成一定浓度,按照上述HPLC液相条件,测定金丝桃苷含量。
2.8 红外光谱分析
将2.0 mg沙枣果总黄酮提取物与200 mg溴化钾(KBr)混匀,经玛瑙研钵研磨后压片,采用美国Nicolet公司的MAGNA-IR560 E.S.P型红外光谱仪(扫描范围4 000~400 cm-1)进行红外光谱测定[22]。
3 结果与讨论
3.1 大孔树脂的筛选
3.1.1 静态实验
由图1可知,在9种大孔树脂中,吸附量和解吸率的乘积最高的3种树脂分别为D101、AB-8和NKA-Ⅱ,所以选择以上3种大孔树脂进行下一步沙枣果总黄酮静态吸附和解吸动力学曲线实验。
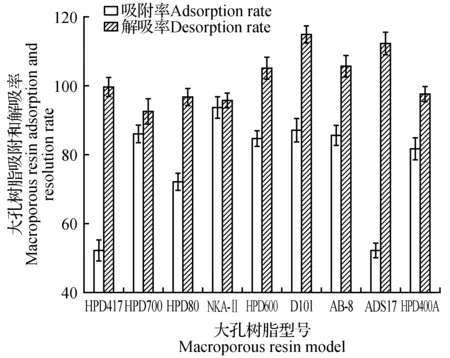
图1 9种大孔吸附树脂对沙枣果总黄酮的静态吸附和解吸结果Fig.1 Adsorption and desorption of nine different macroporous resins on Elaeagnus angustifolia fruit flavones
3.1.2 静态吸附和解吸动力学曲线
由图2可知,AB-8和D101两种大孔树脂均在120 min达到吸附饱和状态,属于快速平衡类型,而NKA-Ⅱ在180 min达到吸附饱和状态,较前两种树脂稍慢一些。由图3可知,AB-8、D101和NKA-Ⅱ均在30 min达到最大解吸状态。综上所述,AB-8型大孔树脂的吸附量和解吸率均较高,且AB-8型大孔树脂的动力学性质较好,所以选择AB-8型树脂进行沙枣果总黄酮的富集。
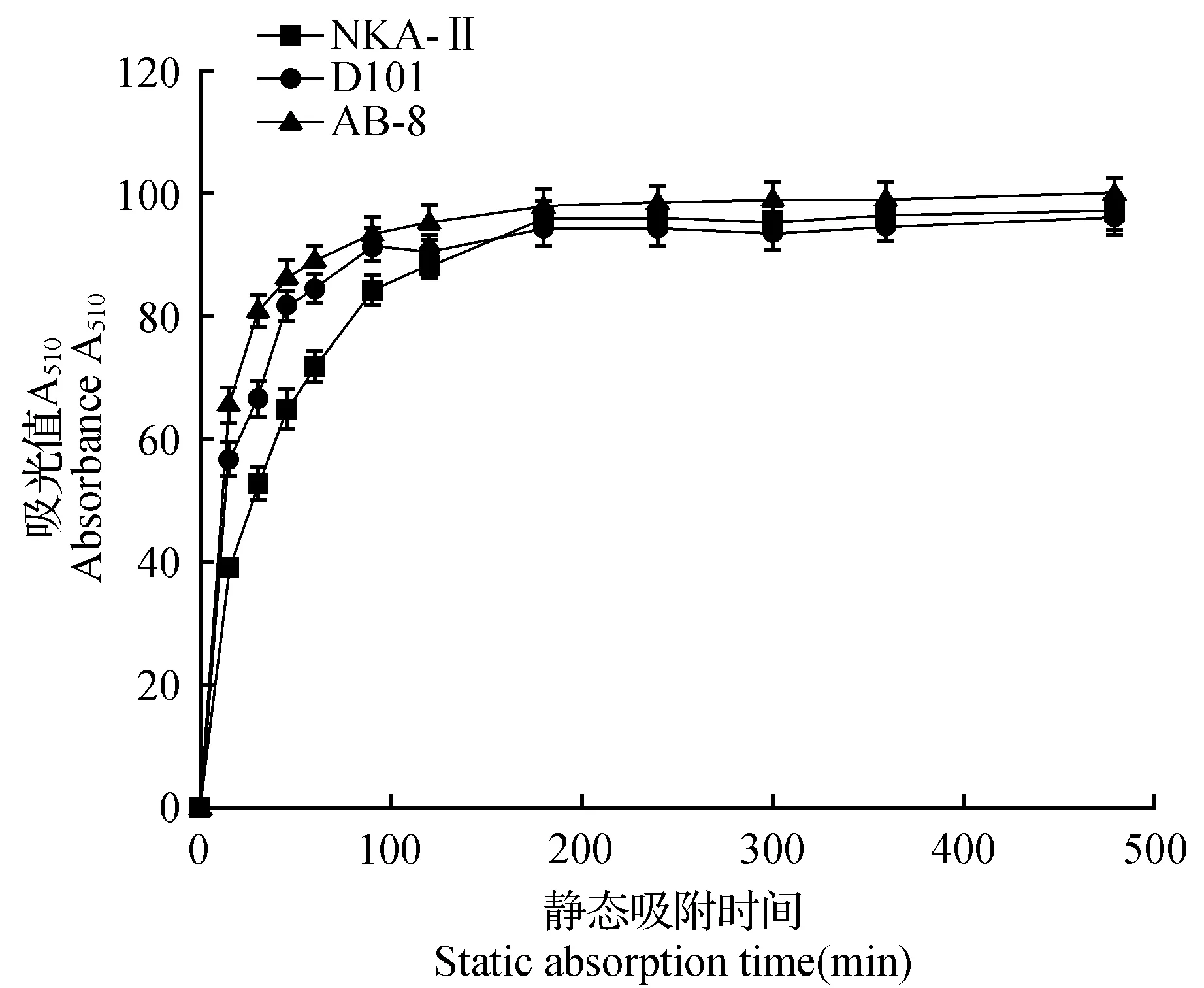
图2 3种大孔树脂吸附动力学曲线Fig.2 Adsorption curves of three kinds of macroporous resin
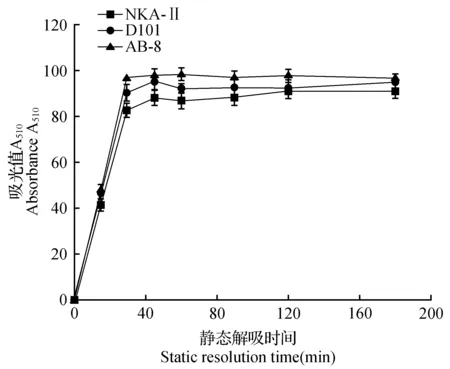
图3 3种大孔树脂解吸动力学曲线Fig.3 Desorption curves of three kinds of macroporous resin
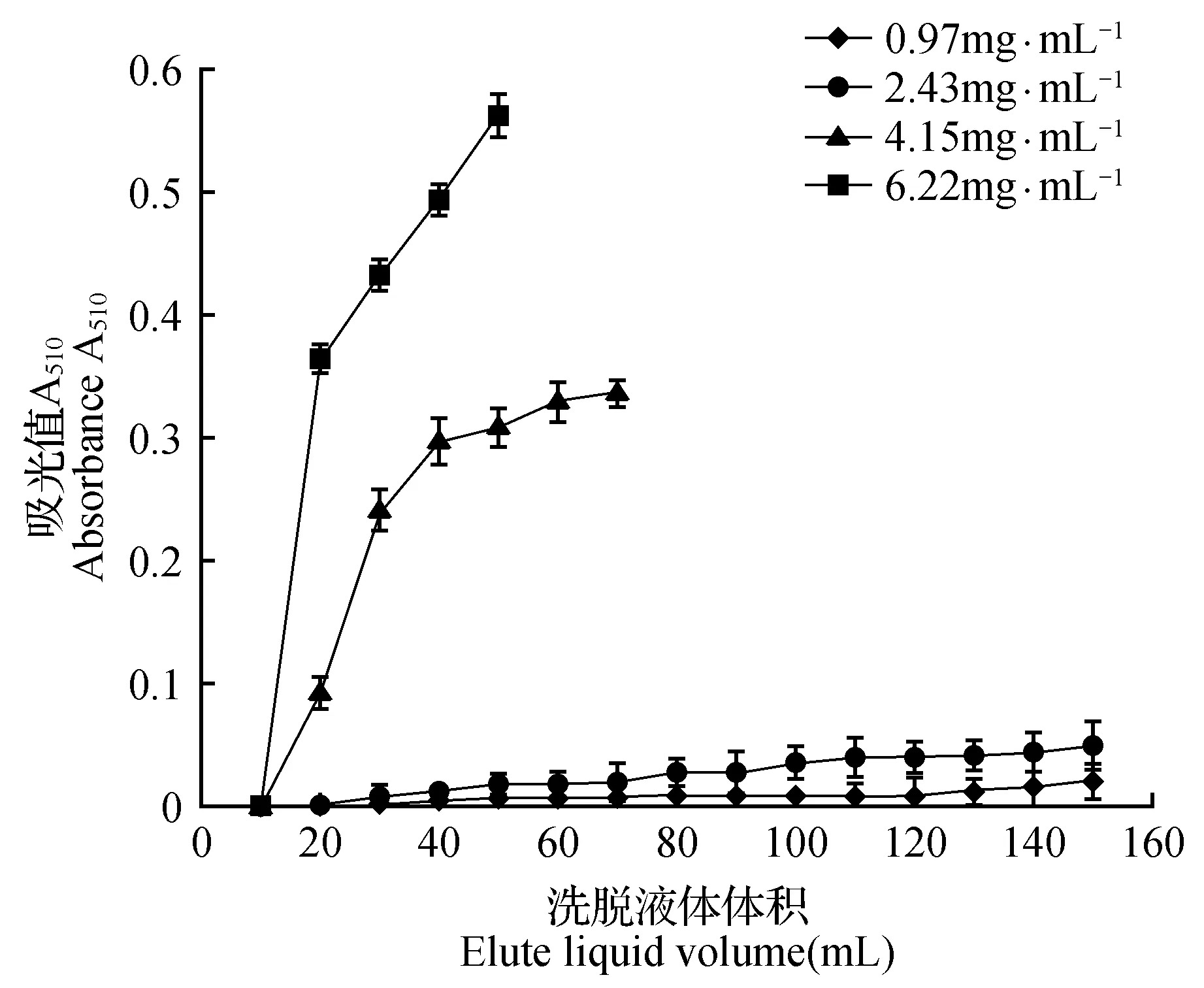
图4 样品浓度对树脂吸附作用的影响Fig.4 Influence of sample concentration on adsorption
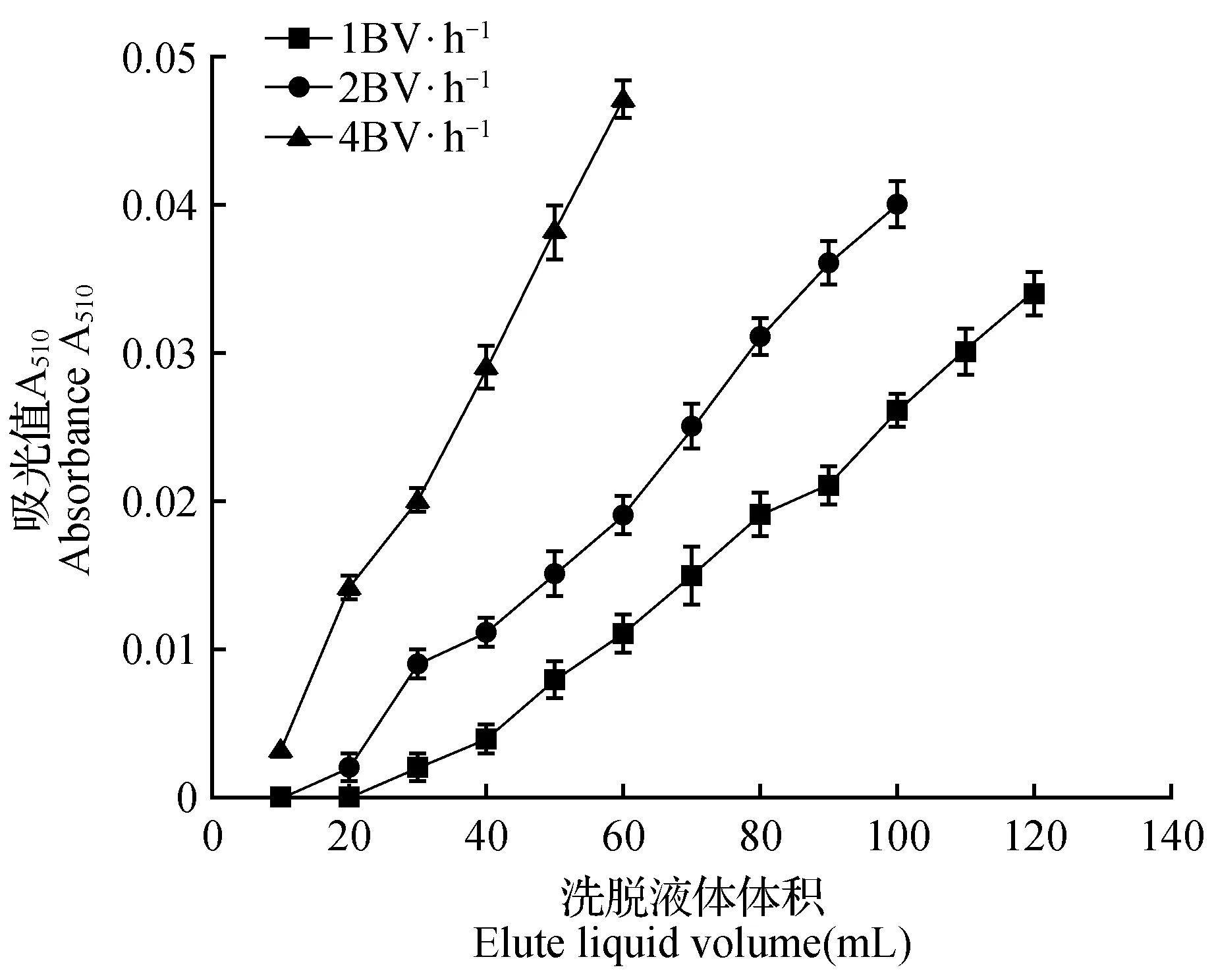
图5 上样流速对树脂吸附作用的影响Fig.5 Influence of sample speed on adsorption
3.2 AB-8型大孔树脂对沙枣果总黄酮的富集条件优化
3.2.1 样品浓度对沙枣果总黄酮的富集影响
由图4可知,样品总黄酮浓度分别为0.97、2.43、4.15、6.22 mg·mL-1到达泄露点时的总体积为130、80、20、10 mL,即逐渐加快。当样品浓度过大时,液体中的有效成分不能高效吸收而流出;当样品浓度过低时,液体中有效成分少,导致树脂未能很好的利用。由此,选择2.43 mg·mL-1比较适宜。
3.2.2 上样速率
由图5可知,上样速率1、2、3 BV·h-1到达泄露点时的体积为110、80、40 mL,即逐渐加快。当上样浓度一定时,上样流速过快,液体与树脂之间接触不充分,导致树脂吸附能力下降;而上样流速过慢,影响处理效率。由此,选择2 BV·h-1比较适宜。
3.2.3 乙醇浓度
由图6可知,洗脱物质大多集中在20~60 mL,当乙醇浓度小于70%时,随着乙醇浓度增加洗脱物质集中程度变高,当乙醇浓度达到70%时达到最大。因此,选择70%乙醇浓度作为洗脱液浓度。
3.2.4 洗脱速率
由图7可知,当洗脱速度为2 BV·h-1时,洗脱的物质最集中。由此,选择2 BV·h-1为洗脱速率。
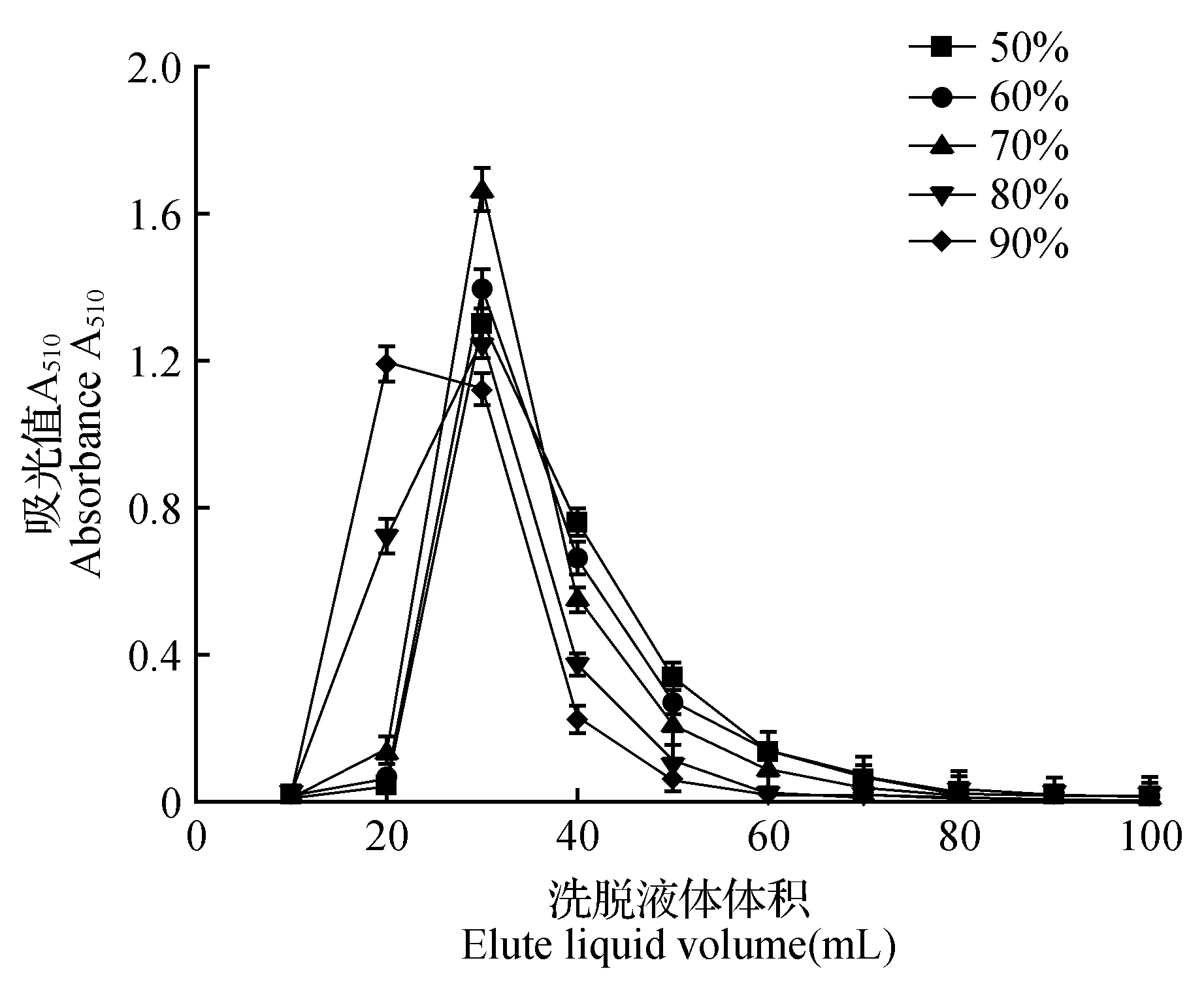
图6 乙醇浓度对树脂解吸作用的影响Fig.6 Influence of ethanol concentration on desorption
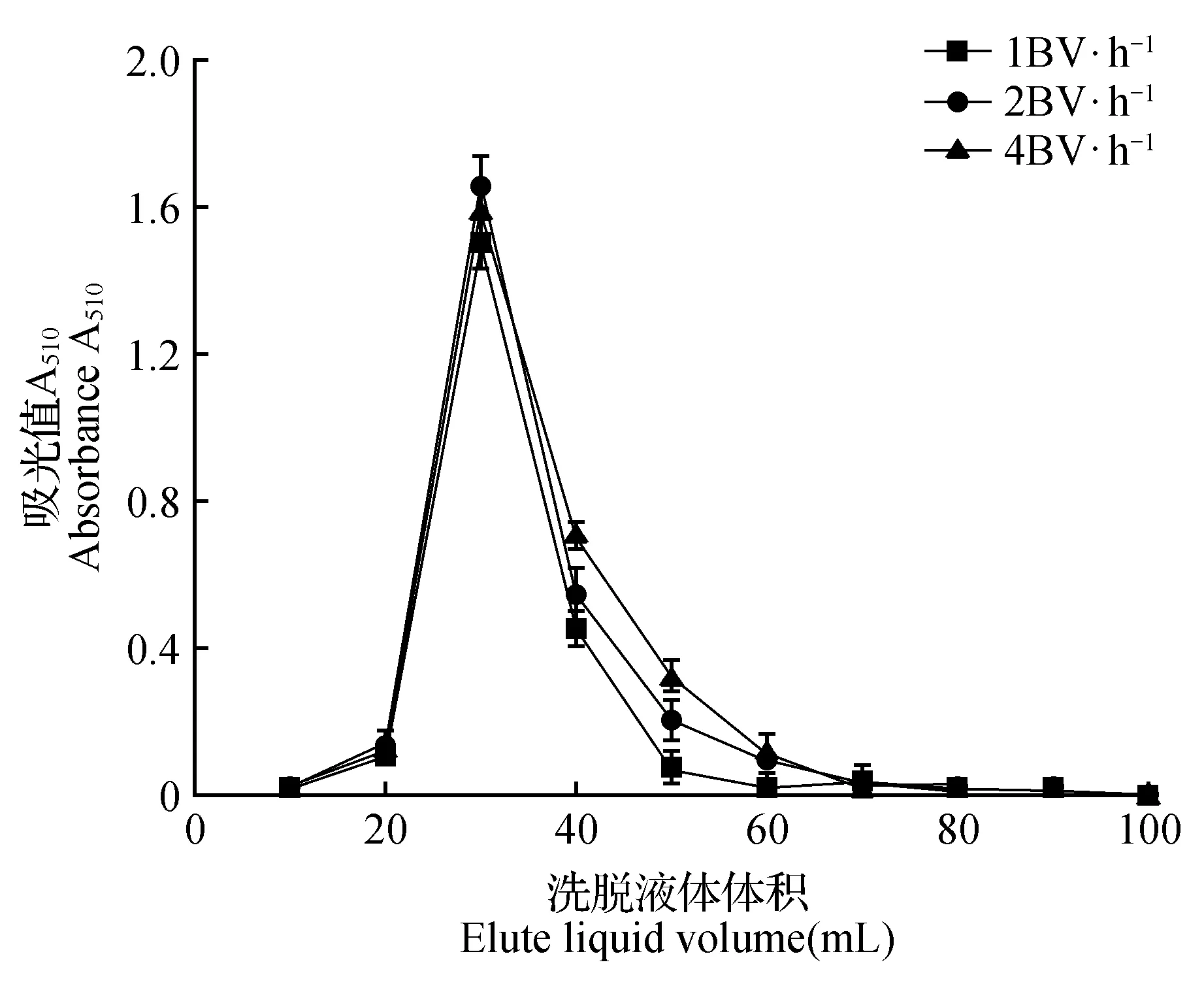
图7 洗脱速率对树脂解吸作用的影响Fig.7 Influence of ethanol speed on desorption
3.3 总黄酮富集前后HPLC比较
由图8可知,金丝桃苷在15.18 min出峰,金丝桃苷标准曲线为y=1.743 9×105x+6 923,其中R2=0.999 4,x代表样品浓度,y代表样品积封面积。在0.031 25~0.5 mg·mL-1相关性良好。
由图9可知,沙枣果总黄酮富集前后样品与金丝桃苷的出峰时间一致,说明沙枣果总黄酮富集前后样品中均含有金丝桃苷类化合物,并且富集后的沙枣果总黄酮纯度明显增加。
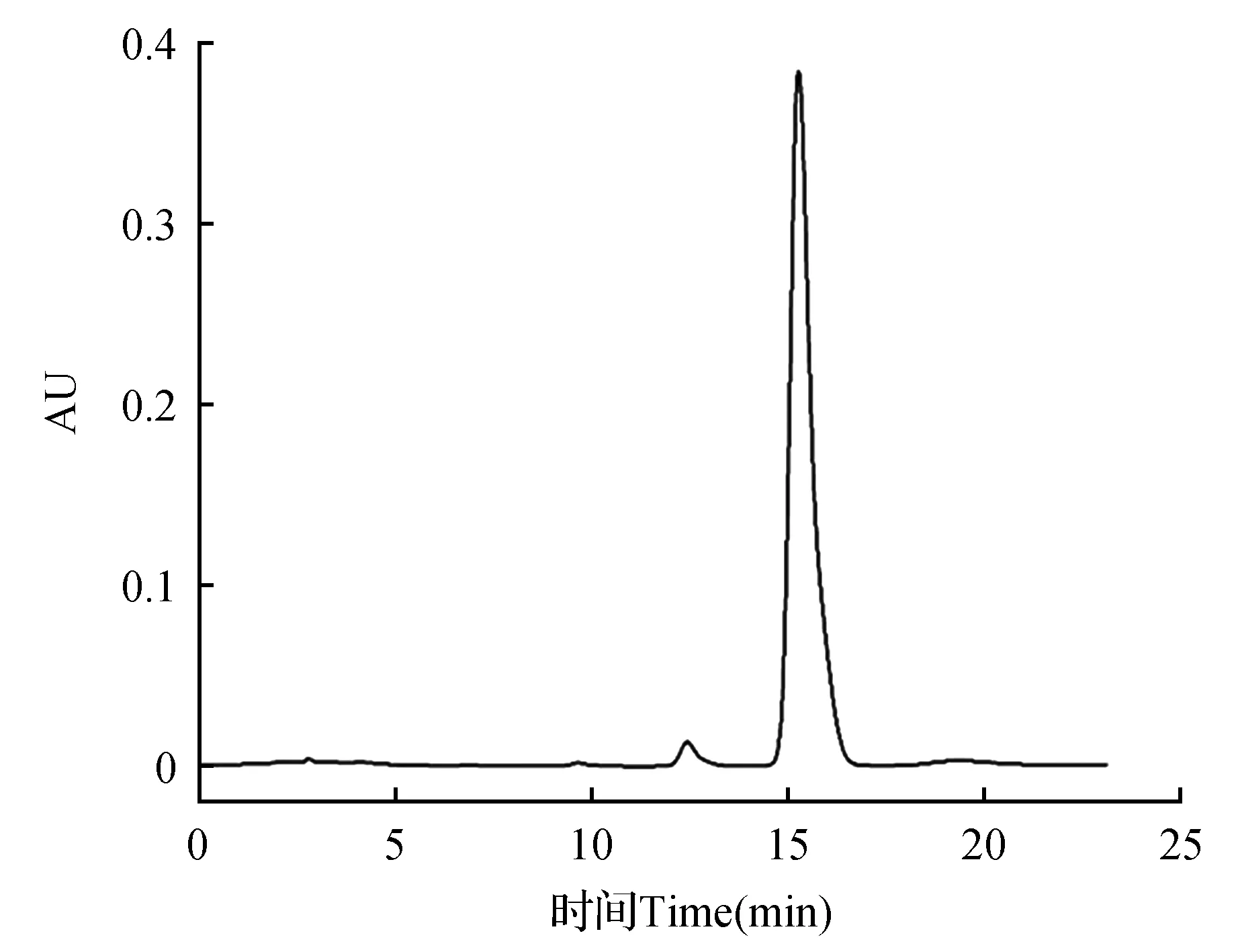
图8 金丝桃苷标品高效液相色谱分析图Fig.8 High performance liquid chromatography of hyperoside standard
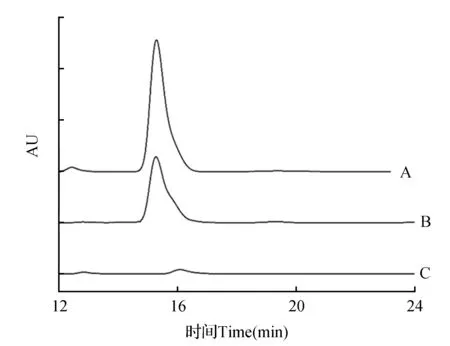
图9 沙枣果总黄酮富集前后样品高效液相色谱分析图 A.金丝桃苷(标准品);B.沙枣果总黄酮富集后样品;C.沙枣果总黄酮富集前样品Fig.9 High performance liquid chromatography of E.angustifolia fruit samples before and after purification A.Hyperoside(standard);B.E.angustifolia flavonoids after enrichment;C.E.angustifolia flavonoids before enrichment
由图10可知,按照以上最优的沙枣果总黄酮富集条件,所得沙枣果总黄酮纯度由富集前的9.73%增加到富集后的49.52%,纯度提高5.09倍;沙枣果总黄酮富集前样品中金丝桃苷的纯度为0.53%,沙枣果富集后样品金丝桃苷纯度为3.07%,比富集前提高5.79倍。
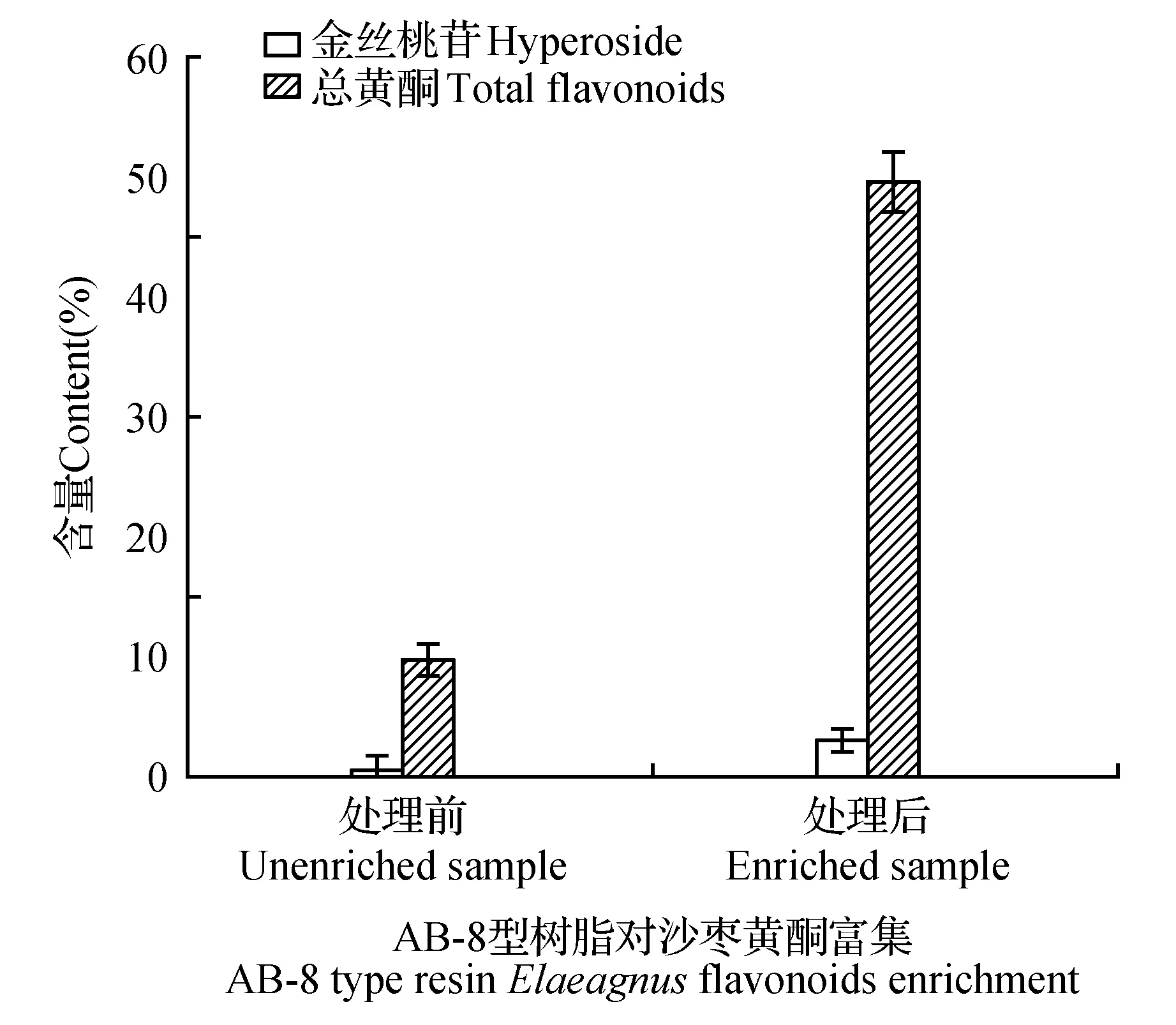
图10 沙枣果总黄酮富集前后总黄酮及金丝桃苷纯度变化Fig.10 The purity comparison of total flavonoids and hyperoside from E.angustifolia fruit before and after purification
3.4 沙枣果总黄酮富集前后结构表征
图11为沙枣果总黄酮富集前样品、富集后样品及金丝桃苷标准品的红外图谱,可以看出有以下特征吸收峰:在3 415 cm-1附近出现O—H的伸缩振动;在3 000~2 800 cm-1范围主要为C—H的伸缩振动,在2 500~1 900 cm-1范围属于叁键和累计双键区,但是沙枣果总黄酮富集前后样品在该波段没有出现峰值。由此可推测,沙枣果总黄酮类化合物不含有反对称伸缩振动的官能团,例如—C≡C—、—C≡N、—C=C=C—、—C=C=O等;1 735.17 cm-1处的吸收峰是由C=O引起;1 518.48 cm-1为芳环振动引起吸收峰;在900~890 cm-1有吸收峰,说明沙枣果总黄酮类化合物中含有β-糖苷键[23~29]。由此,可推断沙枣果总黄酮类化合物是以糖苷类形式成在。
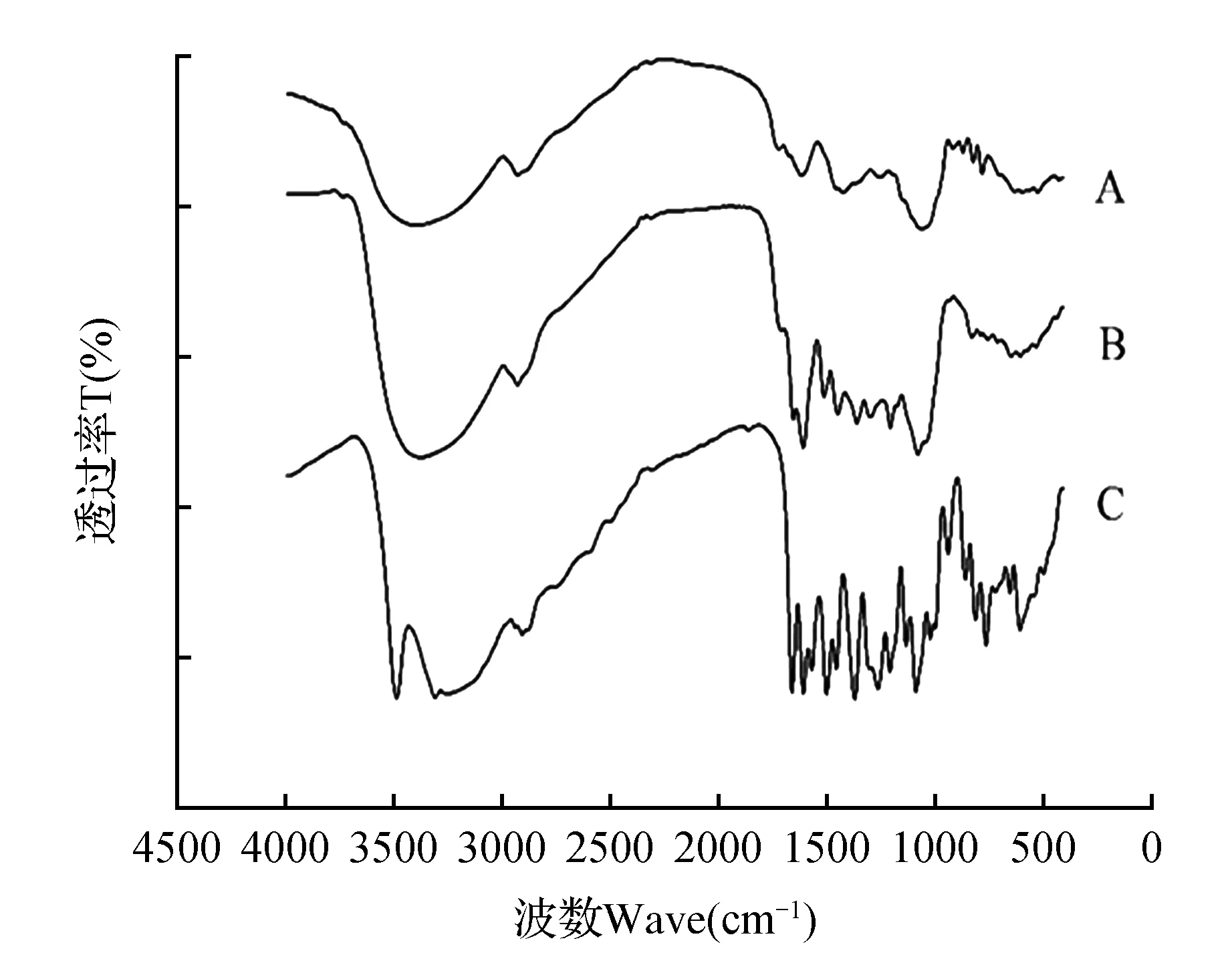
图11 沙枣果总黄酮富集前后样品红外光谱图 A.沙枣果总黄酮富集前样品;B.沙枣果总黄酮富集后样品;C.金丝桃苷(标准品)Fig.11 FTIR of Elaeagnus angustifolia fruit samples before and after purification A.Sample of total flavonoids before enrichment;B.Sample of total flavonoids after enrichment;C.Hyperoside(standard)
4 结论
本研究通过对9种不同型号的大孔树脂进行静态筛选,从中选出3种吸附和解吸效果较好的大孔树脂,分别是AB-8型、D101型、NKA-Ⅱ型。通过对这3种大孔树脂的静态吸附和解吸动力学曲线分析,最终确定AB-8型大孔树脂用于沙枣果总黄酮类化合物的富集;通过AB-8型进行大孔树脂动态实验,确定最优富集条件为样品浓度2.43 mg·mL-1,上样速率2 BV·h-1,乙醇浓度70%,洗脱速率2 BV·h-1,所得到的沙枣果总黄酮纯度由富集前的9.73%增加到富集后的49.52%,纯度提高5.09倍。金丝桃苷含量由富集前的0.53%增加到富集后的3.07%,纯度提高了5.79倍;通过对沙枣果总黄酮富集前后样品的红外结构表征,可以看出沙枣果总黄酮富集前后样品和金丝桃苷标准品均含有黄酮类特征峰。
1.麦合苏木·艾克木,买尔旦·马合木提.新疆沙枣提取物对实验性小鼠腹泻以及小肠推进功能的影响[J].新疆医学,2007,37(3):1-3.
Ai Kemu M,Mahemuti M.Effect of promoting function on experimental diarrhea in mice and intestinal extracts fromElaeagnusangustifoliaof Xinjiang[J].Xinjiang Journal of Traditional Chinese Medicine,2007,37(3):1-3.
2.董世林.植物资源学[M].哈尔滨:东北林业大学出版社,1994:176-186.
Dong S L.Plant resources[M].Harbin:Northeast Forestry University Press,1994:176-186.
3.张彦文.查尔酮类化合物的药理作用和构效关系[J].国外医学:药学分册,1996,23(4):218-223.
Zhang Y W.Pharmacological effects and structure-activity relationship of chalcone compounds[J].Foreign Medical Sciences Section on Pharmacy,1996,23(4):218-223.
4.杜崇民,刘春宇.黄酮类化合物抗肿瘤研究进展[J].中国野生植物资源,2007,26(3):4-7.
Du C M,Liu C Y.Research advance on anti-tumor actions of flavones[J].Chinese Wild Plant Resources,2007,26(3):4-7.
5.鄢春旻.黄酮类化合物抗病毒及抗炎活性研究[D].南京:南京大学,2012.
Yan C M.Antiviral and anti-inflammatory activities of flavonoids[D].Nanjing:Nanjing University,2012.
6.兰真,曾凡骏,曾里,等.生物类黄酮对心血管系统的调节及作用机理[J].现代预防医学,2005,32(6):613-615.
Lan Z,Zeng F J,Zeng L,et al.Adjustive effects and mechanism of bioflavonoids on heart and blood vessel system[J].Modern Preventive Medicine,2005,32(6):613-615.
7.张逸凡,于庆海.淫羊藿总黄酮的免疫调节作用[J].沈阳药科大学学报,1999,16(3):182-184.
Zhang Y F,Yu Q H.The immunoregulatory effect of total flavones epimedium[J].Journal of Shenyang Pharmaceutical University,1999,16(3):182-184.
8.吴家安,安图,张磊,等.中草药抗HIV活性:使用和发展潜力[J].中国药物化学,2001,29(1):69-81.
Wu J A,An T,Zhang L,et al.Anti-HIV activity of Chinese herbs:usage and development potential[J].Chinese Pharmaceutical Chemistry,2001,29(1):69-81.
9.于长青,张东杰,牟光庆,等.麦胚黄酮类提取物对血脂和抗氧化的影响[J].营养学报,2001,23(4):390-392.
Yu C Q,Zhang D J,Mu G Q,et al.Effect of flavonoids extract of wheat germ on serum lipids and antioxidation[J].Acta Nutrimenta Sinica,2001,23(4):390-392.
10.尉芹,王冬梅,马希汉,等.杜仲叶总黄酮含量测定方法研究[J].西北农林科技大学学报:自然科学版,2001,29(5):119-123.
Wei Q,Wang D M,Ma X H,et al.A study on the measurement of flavonoids in the leaves ofEucommiaulmoides[J].Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition,2001,29(5):119-123.
11.贾志申,唐梦成,吴建明.桑叶中黄酮类化合物的含量测定及其对超氧阴离子自由基的清除作用[J].食品化学,1999,64(4):555-559.
Jia Z S,Tang M C,Wu J M.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J].Food Chemistry,1999,64(4):555-559.
12.池汝安,周芳,黄琨,等.S-8型大孔树脂葛根素的吸附研究[J].中国天然药物,2011,9(2):120-125.
Chi R A,Zhou F,Huang K,et al.Adsorption behaviors of puerarin on S-8 macroporous resin[J].Chinese Journal of Natural Medicines,2011,9(2):120-125.
13.Jia G T,Lu X Y.Enrichment and purification of madecassoside and asiaticoside fromCentellaasiaticaextracts with macroporous resins[J].Journal of Chromatography A,2008,1193(1-3):136-141.
14.朱思佳,吕秀阳,何世伟,等.大孔树脂对甘油的静态吸附及其热力学研究[J].化工时刊,2006,20(11):5-7,32.
Zhu S J,Lü X Y,He S W,et al.Study on the static adsorption behaviors and thermodynamic properties of glycerine on macroporous resins[J].Chemical Industry Times,2006,20(11):5-7,32.
15.李云志.元宝枫叶黄酮提取、纯化、分离与结构鉴定的研究[D].成都:四川大学,2005:30-40.
Li Y Z.Extraction,purification,separation and identification of flavonoids in the leaves ofAcertruncatum[D].Chengdu:Sichuan University,2005:30-40.
16.陶海腾,陈晓明,吕飞杰,等.大孔吸附树脂法纯化木薯叶黄酮的初步研究[J].食品工业科技,2009,30(8):192-194.
Tao H T,Chen X M,Lü F J,et al.Primary study on macroporous resin for purification of flavonoids in cassava leaves[J].Science and Technology of Food Industry,2009,30(8):192-194.
17.范婧娴,刘友平,李旻,等.大孔吸附树脂纯化干姜姜酚类成分工艺研究[J].时珍国医国药,2009,20(11):2818-2820.
Fan J X,Liu Y P,Li M,et al.Purification of gingerols from zingibers with macroporous resin[J].Lishizhen Medicine and Materia Medica Research,2009,20(11):2818-2820.
18.吴晓,周礼明,马威,等.大孔树脂纯化沙苑子总黄酮工艺优选[J].辽宁中医药大学学报,2015,17(1):54-57.
Wu X,Zhou L M,Ma W,et al.Optimization of purification technology for total flavonoids from semen astragali complanati by macroporous adsorption resin[J].Journal of Liaoning University of Traditional Chinese Medicine,2015,17(1):54-57.
19.金继曙,都述虎,种明才.用大孔吸附树脂分离白芍总甙[J].中国中药杂志,1994,19(1):31.
Jin J S,Du S H,Zhong M C.Separation of total peony from Daphnia majus using macroporous adsorption resin[J].China Journal of Chinese Materia Medica,1994,19(1):31.
20.安彩贤,李冶姗.大孔吸附树脂分离纯化葛根与山楂叶中总黄酮的研究[J].中成药,2004,26(9):698-701.
An C X,Li Y S.Separation and purification of total flavone from Kudzuvine root and hawthorn leaves by macroporous resin[J].Chinese Traditional Patent Medicine,2004,26(9):698-701.
21.任顺成,丁霄霖.玉米须中总黄酮的提取及树脂精制[J].中草药,2003,34(12):1092-1094.
Ren S C,Ding X L.Extraction of total flavonoids in corn silk and resin refining[J].Chinese Traditional and Herbal Drugs,2003,34(12):1092-1094.
22.胡晖.翻白草总黄酮微波辅助提取与纯化工艺[J].广东农业科学,2010,37(6):145-147.
Hu H.Microwave-assisted extraction and purification of total flavonoids inPotentilladiscolorBunge[J].Guangdong Agricultural Sciences,2010,37(6):145-147.
23.孙素琴,周群,陈建波.中药红外光谱分析与鉴定[M].北京:化学工业出版社,2010:4.
Sun S Q,Zhou Q,Chen J B.Analysis of traditional Chinese medicine by infrared spectroscopy[M].Beijing:Chemical Industry Press,2010:4.
24.Sun S Q,Chen J B,Zhou Q,et al.Application of mid-infrared spectroscopy in the quality control of traditional Chinese medicines[J].Planta Medica,2010,76(17):1987-1996.
25.李志勇,王朝鲁,孙素琴,等.蒙药草乌叶及其提取物化学成分的红外光谱分析[J].中国中药杂志,2011,36(23):3281-3285.
Li Z Y,Wang C L,Sun S Q,et al.Analysis of chemical components inAconitumkusnezoffiileaves and their extracts by infrared spectroscopy[J].China Journal of Chinese Materia Medica,2011,36(23):3281-3285.
26.Zhang Y L,Chen J B,Lei Y,et al.Evaluation of different grades of ginseng using Fourier-transform infrared and two-dimensional infrared correlation spectroscopy[J].Journal of Molecular Structure,2010,974(1-3):94-102.
27.沈秋仙.槲蕨根茎黄酮类物质提取条件的优化[J].丽水学院学报,2005,27(5):64-66.
Shen Q X.Optimization of extracting condition of flavonoids from rhizoma of drynaria rhizoma drynariae[J].Journal of Lishui University,2005,27(5):64-66.
28.马涛,毛红燕,石太渊,等.辽五味子黄酮纯化及定性光谱分析[J].食品与生物技术学报,2012,31(1):101-105.
Ma T,Mao H Y,Shi T Y,et al.Separation purification and spectrum of flavonoids from LiaoSchisandrachinensis[J].Journal of Food Science and Biotechnology,2012,31(1):101-105.
29.赵璇,金素娟,李占军,等.紫心甘薯的利用价值与开发前景[J].河北农业科学,2012,16(5):84-86.
Zhao X,Jin S J,Li Z J,et al.Utility value and development prospect of purple-fleshed sweet potato[J].Journal of Hebei Agricultural Sciences,2012,16(5):84-86.
