杜仲叶片干旱胁迫响应相关差异蛋白的筛选与鉴定
2018-06-23赵欣白伟
赵 欣 白 伟
(1.陕西国际商贸学院医药学院,西安 712046; 2.西安联创生物医药孵化器有限公司,西安 710065)
在干旱与半干旱地区,水资源短缺是影响植物生理生态和生长发育的最主要的逆境胁迫因子,大约50%的农业减产均由干旱所致[1]。1/3的地表面积属于干旱地区,这一数值正在加大,据美国纽约市立大学国家环境预报中心的研究发现,随着环境尾气排放的不断增加,全球气候的变暖,世界干旱地区的面积将至少增加8%[2]。植物为应对干旱环境,植物体内会发生多种生理生化反应,以保持体内稳态。如叶片的光合作用和蒸腾作用,是评价植物耐旱性的两个重要生理生态过程,干旱胁迫下,气孔的开合是调节植物光合速率和蒸腾速率的主要途径[3]。另外,植物可通过提高体内的一些保护酶活性(如SOD、POD、CAT),将体内过多的活性氧加以清除,从而减少因活性氧攻击细胞膜而产生的丙二醛含量;同时,干旱胁迫也会导致细胞内脯氨酸、可溶性糖、可溶性蛋白含量上升,从而使胞内水势降低,保持水分不流失[4~5]。另一方面,植物在分子水平上也会发生一系列反应,以响应干旱胁迫,如干旱相关基因表达水平的变化,导致蛋白质水平发生改变,最终使植物的各个生物学过程与干旱胁迫处理前有所差异,以应对干旱环境[6]。然而,大部分干旱响应相关基因数量十分有限,基因的功能更未得到精确鉴定,植物干旱响应相关的基因信息仍然有限[7]。蛋白质是生命活动的直接执行者,由于从基因到蛋白质,需要经历转录、转录后修饰、翻译、翻译后修饰等过程,导致基因组、转录组与蛋白质组之间存在信息差,从而影响细胞内包括蛋白质周转、蛋白质活性、蛋白质定位等在内的多种重要生物学过程[8]。因此,比较蛋白质组学技术在植物干旱应答机制研究中的广泛应用,可对其分子机制的进行深度解析[8]。
杜仲是中国特有的落叶乔木,属杜仲科杜仲属。杜仲皮和叶干燥以后,可以入药,是一种名贵中药材,同时也是工业橡胶的原料。杜仲在我国分布广泛,由于其主根深、侧根发达、须根系庞大等特点,具有较强的水土保持能力。因此是山区发展经济林的重要树种,同时可以用于绿化和水土保持,特别是陕北黄土丘陵区[9]。当前,对杜仲的研究,主要集中在其药理作用、成分分析、栽培管理等方面,对干旱胁迫下杜仲的生理生化响应机制也有涉及,如干旱胁迫对杜仲叶片光合作用、水饱和亏、过氧化物酶活性等的影响研究[3~5]。但是,对于干旱胁迫下杜仲的分子响应机制研究较少,对于杜仲干旱响应关键蛋白的筛选和鉴定的研究更是鲜有报导。因此,本研究拟对干旱胁迫下的杜仲叶片差异蛋白质组变化进行研究,同时分析干旱胁迫3、6、9、12、15 d以及复水后2 d叶片的光合特征、SOD活性、POD活性、CAT活性、脯氨酸含量、可溶性糖含量、丙二醛含量和水分饱和亏,以了解杜仲响应干旱胁迫的生理生化和分子机制,为利用杜仲的优质抗旱基因提供理论参考。
1 材料与方法
1.1 材料的培养与处理
1.2 生理生化指标测定
1.2.1 叶片水分饱和亏
参照谢寅峰等[10]的方法进行。
1.2.2 光合参数的测定
利用Li-6400便携式光合测定仪(美国LI-COR Biosciences公司),测定不同处理时间下杜仲叶片的净光合速率、蒸腾速率、胞间CO2浓度、气孔导度。光合有效辐射强度设定为1 400 μmol·m-2·s-1,光源为人工光源,使用空气CO2浓度。
1.2.3 保护酶活性测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)酶液的制备和酶活测定参照刘红云等[4]的方法进行。
1.2.4 丙二醛、脯氨酸、可溶性糖含量测定
鉴于此,本研究针对纸浆洗涤过程的特点,充分利用生产过程长期运行积累的工业数据,基于两步神经网络法得到残碱和黑液波美度的预测模型,通过这两大指标构建纸浆洗涤质量评价模型,对工业运行数据进行聚类、模式匹配,构建出优化模式库。以最优生产为目标,对优化模式库进行操作模式寻优,匹配出最优操作模式。通过实验验证该方法能有效预测纸浆洗涤过程的状态参数,达到优化生产的效果。
丙二醛含量测定参照Hodges等[11]的方法进行;脯氨酸含量测定参照Bates等[12]的方法进行;可溶性糖含量测定参照Farhad等[13]的方法进行。
1.3 杜仲叶片蛋白质双向电泳分离、差异蛋白MALDI-TOF-TOF生物质谱鉴定
杜仲叶片总蛋白提取参照Liu等[14]的方法进行,将获得的蛋白干粉溶解于适量的裂解缓冲液(7 mol·L-1尿素,2 mol·L-1硫脲、4% CHAPS、65 mmol·L-1Dithiothreitol(DTT)、微量蛋白质抑制剂)中,置于冰上2 h,然后在4℃,19 000 g·min-1转离心1 h,取上清。采用Liu等[14]的方法对上清液进行蛋白浓度测定。将获得蛋白质样品进行双向电泳分离,并对2-DE胶图进行pdquest 8.0软件分析,找出差异蛋白点,并对差异蛋白进行生物质谱鉴定,操作步骤参考Liu等[14]的方法进行。参考的数据库为NCBI绿色植物库(taxid:33090;336070 protein sequences;20170113),蛋白质评分C.I.%超过95%以上的蛋白质认定为鉴定成功的蛋白。
2 结果与分析
2.1 干旱胁迫对杜仲叶片中生理生化指标的影响
极端干旱环境中的植物,如果长时间得不到水分补偿,会导致长期水分亏缺,从而影响到植物的正常生理代谢活动。因此,水分饱和亏是反应植物对干旱耐受程度的重要指标。研究发现,杜仲叶片水饱和亏随着水分胁迫处理时间的延长而增加,在处理第15 d时,水分饱和亏达到最大值,为55.19%,而复水后的水分饱和亏降为6.93%(表1)。结果表明,杜仲在持续性干旱胁迫下具有一定的自我调节能力。
由表1可以看出,随干旱胁迫胁迫时间的延长,杜仲叶片的光合速率、蒸腾速率、胞间二氧化碳浓度、气孔导度均逐渐降低,特别是在干旱处理第15 d,杜仲叶片的光合速率、蒸腾速率、胞间二氧化碳浓度、气孔导度平均值比对照(0 d)分别降低了86.78%、91.61%、76.00%、94.07%。结果表明,为适应水分亏缺环境,杜仲叶片的蒸腾耗水量显著降低,同时,杜仲叶片的气孔会关闭,使气孔导度显著降低,胞间二氧化碳浓度达不到光合作用所需,从而导致光合速率显著下降,而且干旱胁迫时间越长,影响越大。因此,气孔关闭是影响干旱胁迫下杜仲叶片光合作用和蒸腾作用的主要原因。
SOD、POD、CAT是生物体内清除活性氧等自由基的重要保护酶,与植物耐旱性能呈正相关关系。研究发现,杜仲叶片中SOD、POD、CAT活性随着干旱胁迫时间的延长,出现先上升后下降的趋势,特别是在处理15 d时,3种保护酶活性显著下降,表明持续干旱导致杜仲所受的伤害加重,超出自身耐受能力,并使保护酶活性下降,抗氧化能力减弱。复水后,与干旱处理15 d相比,杜仲叶片的保护酶活性下降。
丙二醛是细胞膜脂质过氧化产物,其含量越高,表明细胞受伤害程度越大。表1结果表明,在干旱处理前期(前6 d),杜仲叶片中丙二醛含量逐渐上升,但是在处理第7~12 d,丙二醛含量呈下降趋势,然而在处理第12天以后,丙二醛含量显著上升。结果表明,干旱处理早期,杜仲叶片细胞膜系统受到损害,为减少伤害,杜仲自身会启动保护酶防御系统, 因而在处理7~12 d时, 叶片丙二醛含量逐渐降低。但是在处理第12 d以后,干旱胁迫程度已经超过杜仲自身的耐受限度,保护酶系统遭到破坏,增强了膜脂质过氧化程度,导致丙二醛含量再次上升。在复水后,杜仲叶片中的丙二醛含量降低至28.73 mmol·g-1,仍维持在较高水平,表明持续性干旱胁迫已对杜仲造成不可修复的损伤。
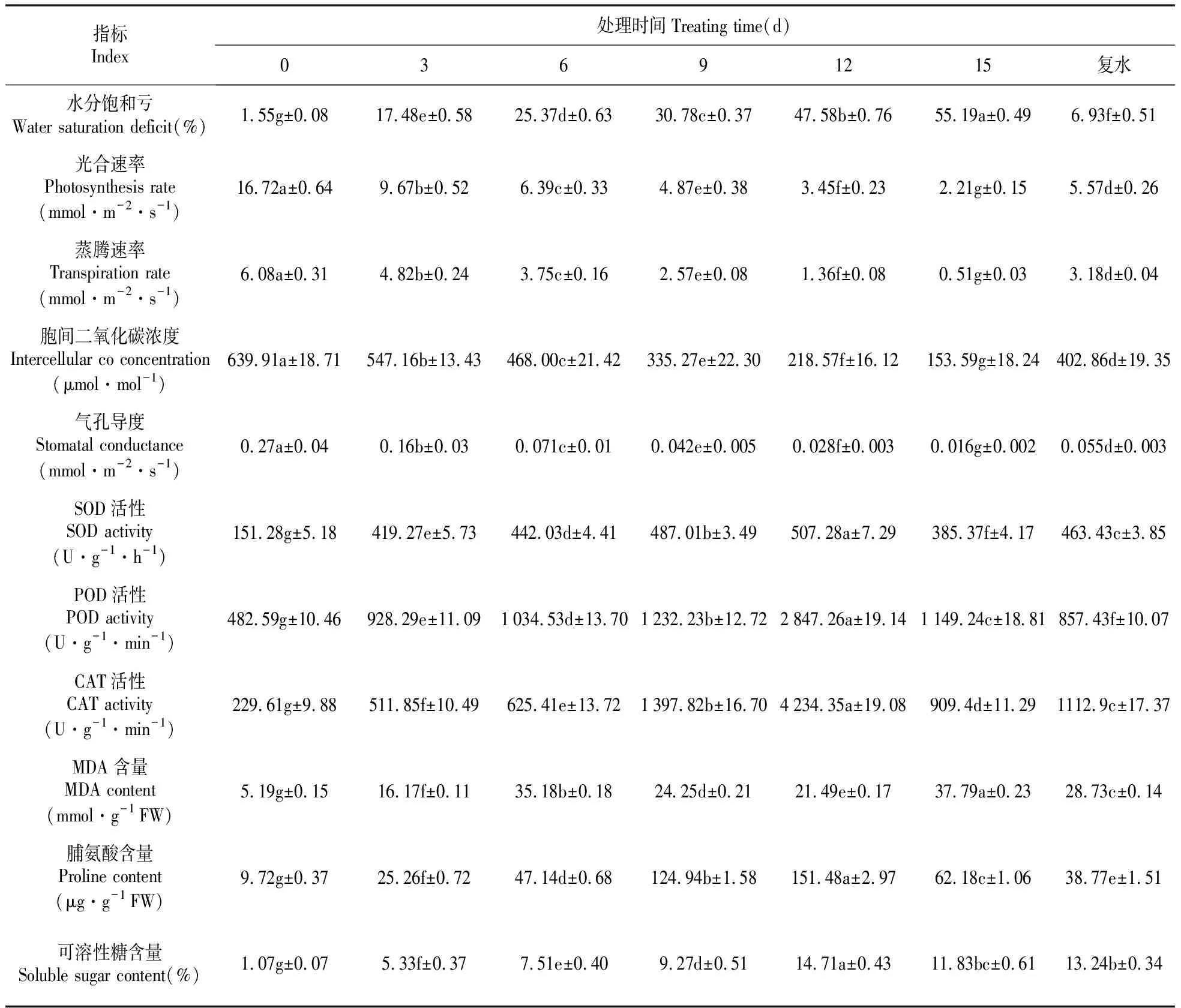
表1 干旱胁迫下杜仲叶片生理生化指标测定结果
注:FW.鲜重;SOD.超氧化物歧化酶;POD.过氧化物酶;CAT.过氧化氢酶;MDA.丙二醛 数字右上方字母相同的,表示无显著性差异,不同字母表示显著性差异,差异水平设置为P<0.05。
Note:FW. Fresh weight;SOD. Superoxide dismutase;POD. Peroxidase;CAT. Catalase;MDA. Malondialdehyde Mean values with the same letters in the same indices indicate non-significant difference,and means with different letters show significant difference atP<0.05 level.
通常情况下,干旱处理后的植物组织细胞中,渗透调节物质脯氨酸和可溶性糖含量会显著上升,以降低胞内渗透势从而减少水分损失。从表1中可以看出,杜仲叶片中脯氨酸和可溶性糖含量在干旱处理前期,含量逐渐上升,在处理第12 d时达到最大值,分别为151.48 μg·g-1、14.71%,结果表明,杜仲叶片可以通过提升胞内渗透调节物质脯氨酸和可溶性糖含量来应对干旱胁迫。但是在干旱胁迫处理第15 d时,两者含量显著下降,表明杜仲的干旱耐受能力有限,超过一定的时期,会造成杜仲不可逆转的损伤。在复水后,杜仲叶片中脯氨酸和可溶性糖水平下降,但是仍不能恢复到处理前(0 d)水平。
2.2 干旱胁迫对杜仲叶片中蛋白质组的影响
各种生理指标测定结果表明,杜仲叶片在干旱处理第15天时呈现最大伤害程度,为解析杜仲叶片在此条件下的分子响应机制,将0 d和处理15 d的杜仲叶片的蛋白质,通过双向电泳分离,分别检测到594、617个重复性较好的蛋白点(图1),其中1.5倍以上的差异表达蛋白点有36个(P<0.05)。经MALDI-TOF-TOF生物质谱鉴定和数据库比对,36个差异蛋白点均被鉴定成功,其中22个蛋白点丰度在干旱处理后上升,14个蛋白点丰度下降(表2)。通过功能富集分析,这些差异蛋白质涉及干旱胁迫信号感应和传导、光合作用、碳水化合物代谢、次生代谢物的合成、氨基酸生物合成、能量代谢、蛋白质生物合成,以及活性氧等自由基清除等(图2:A),其中上调表达的蛋白质主要参与信号传导、碳水化合物代谢、能量代谢、活性氧清除、氨基酸生物合成,光合作用、蛋白质生物合成、次生代谢物的合成等生物学过程相关蛋白则下调表达(表2)。从亚细胞定位结果可知,所鉴定的差异蛋白大部分定位于叶绿体(55%)中,其次是细胞质中(31%)(图2:B),表明光合作用相关蛋白受干旱胁迫影响最大。

图2 干旱胁迫下杜仲叶片差异蛋白的功能分类及亚细胞定位结果 A.差异蛋白的功能分类;B.差异蛋白的亚细胞定位Fig.2 Distribution representation of the identified proteins based on their function and subcellular localizationA.Function classification of the differential expressed proteins; B.Subcellular localization of the differential expressed proteins

点编号Spot No.蛋白描述Protein Description登录号Accession物种Species蛋白得分Protein score实验值Experimental理论值Theoretical分子量Mass(kDa)等电点pI分子量Mass(kDa)等电点pIFCPMCR1核糖体蛋白L22ribosomal protein L22ANP25540.1杜仲E.ulmoides37959.215.1654.7910.06-3.1843592ATP合酶CF1 α亚基ATP synthase CF1 alpha subunitANP25499.1杜仲E.ulmoides21853.625.1855.195.342.2423483黄酮醇合酶flavonol synthasegi|477542029杜仲E.ulmoides18641.075.5238.035.59-2.5228534ATPase α亚基ATPase alpha subunitgi|89112874杜仲E.ulmoides19148.136.0446.226.214.72244553-羟基-3-甲基戊二烯辅酶A合酶3-hydroxy-3-methylglutaryl-CoA synthasegi|1160524372杜仲E.ulmoides15250.715.2551.695.77-2.2120626Rubisco大亚基ribulose-1,5-bisphosphate carboxylase/oxygenase large subunitgi|1041926818杜仲E.ulmoides11252.896.1853.346.33-2.0134717乙酰辅酶A乙酰转移酶acetyl-CoA acetyltransferasegi|1160524370杜仲E.ulmoides20835.215.1442.948.92-2.6118428乙酰辅酶A乙酰转移酶acetyl-CoA acetyltransferasegi|1160524370杜仲E.ulmoides10229.595.2142.948.92-3.428279光捕获类蛋白3light harvesting-like protein 3gi|290782564杜仲E.ulmoides9812.365.929.126.38-1.72919101-脱氧基-D-5-磷酸核酮糖合酶1-deoxy-D-xylulose-5-phosphate synthasegi|408833344杜仲E.ulmoides10466.485.8776.968.14-3.13122111S-腺苷甲硫氨酸合酶3S-adenosylmethionine synthase 3gi|743783202胡杨Populus euphratica17834.605.4743.245.502.33205212磷酸甘油酸激酶phosphoglycerate kinaseXP_016702717.1陆地棉Gossypium hirsutum23150.174.2951.238.742.25112113谷氨酰胺合成酶glutamine synthetase leaf isozymegi|255551511蓖麻Ricinus communis35251.086.4949.846.574.871324142磷酸核酮糖脱羧/加氧酶活化酶ribulose bisphosphate carboxylase/oxygenase activase,chloroplastic isoform X2gi|747060719芝麻Sesamum indicum13546.046.3247.606.78-2.93235115RNA聚合酶α链RNA polymerase alpha chaingi|1041926828杜仲E.ulmoides10632.836.5637.556.51-1.93142616烯醇酶Enolasegi|743896837胡杨P.euphratica11044.385.1947.915.675.53111917磷酸甘油酸变位酶2,3-bisphosphoglycerate-independent phosphoglycerate mutasegi|922339631蒺藜状苜蓿Medicago truncatula20247.035.0250.575.452.52216218生长素结合蛋白1auxin-binding protein 1gi|46409853杜仲E.ulmoides16025.015.8821.455.663.82183719富胚胎发育晚期蛋白Dc3late embryogenesis abundant protein Dc3gi|702484246巨桉Eucalyptus grandis25514.216.5314.106.164.3994520Rubisco大亚基ribulose-1,5-bisphosphate carboxylase/oxygenase large subunit,partialgi|766946891杜仲E.ulmoides18432.174.3429.239.1610.85132821Rubisco大亚基ribulose-1,5-bisphosphate carboxylase/oxygenase large subunit,partialgi|343186353杜仲E.ulmoides26220.105.5421.985.783.61163722铁氧还蛋白-NADP还原酶ferredoxin-NADP reductasegi|1000938423蓖麻R.communis25840.624.8840.858.80-2.841843232-磷酸果糖醛缩酶1fructose-bisphosphate aldolase 1gi|743793523胡杨P.euphratica11955.126.1242.868.132.76133524光系统IIcp47蛋白photosystem II cp47 protein,partialgi|335060099杜仲E.ulmoides9460.156.7568.326.64-4.9282325过氧化物酶aperoxidase agi|51511062杜仲E.ulmoides23536.144.7336.018.108.531443
续表2Continuedtable2

点编号Spot No.蛋白描述Protein Description登录号Accession物种Species蛋白得分Protein score实验值Experimental理论值Theoretical分子量Mass(kDa)等电点pI分子量Mass(kDa)等电点pIFCPMCR26磷酸丙糖异构酶triosephosphate isomerasegi|1002246204甜椒Capsicum annuum27729.125.2427.095.722.71185427L-抗坏血酸过氧化物酶L-ascorbate peroxidasegi|823153064雷蒙德氏棉Gossypium raimondii14527.895.3527.535.593.01125328磷酸核酮糖激酶Phosphoribulokinasegi|743809191胡杨P.euphratica15542.765.6244.966.032.55226429甘氨酸脱氢酶glycine dehydrogenasegi|823234381雷蒙德氏棉G.raimondii397110.286.27113.926.505.81295830β-葡糖苷酶12类前体beta-glucosidase 12-like precursorgi|658309748苹果Malus domestica17862.145.4860.905.564.372853316-磷酸葡萄糖脱氢酶glucose-6-phosphate dehydrogenaseBAK22407.1本氏烟Nicotiana benthamiana9560.056.1758.596.09-3.18132932碳酸酐酶carbonic anhydrase,chloroplastic isoform X3gi|1111061574野生烟草Nicotiana attenuate17625.526.0129.195.922.84164933抗坏血酸过氧化物酶1cytosolic ascorbate peroxidase 1gi|148912162陆地棉G.hirsutum11226.615.7527.595.933.12114334RNA结合蛋白CP31BRNA-binding protein CP31BJAU51823.1天蓝遏蓝菜Noccaea caerulescens11929.884.8132.704.82-3.331459352-Cys过氧化物还原酶BAS12-Cys peroxiredoxin BAS1gi|255578581蓖麻R.communis9641.514.7129.308.385.0274736[Cu-Zn]超氧化物歧化酶superoxide dismutase[Cu-Zn]gi|747082905芝麻S.indicum10523.175.8222.865.892.881053
注:FC.变化倍数;PM.匹配肽段数;CR.覆盖率
Note:FC.Fold Change;PM.Peptides matched;CR.Coverage rate
3 讨论
3.1干旱胁迫下杜仲叶片生理生化变化
研究发现,在水分饱和亏达到46.2%时,杜仲叶片会发生萎蔫现象,而达到50%以上,则可发现叶片枯黄,表明此时干旱胁迫已对杜仲产生重度干旱胁迫[4]。本研究发现,在干旱处理15 d后的杜仲叶片,水分饱和亏达到55.19%(表1),表明此时,干旱胁迫已导致杜仲叶片重度干旱损伤。差异蛋白质组学研究亦选取此时的叶片进行研究,以筛选和分析重度干旱胁迫下杜仲叶片干旱胁迫响应相关蛋白及其机制。
随着干旱处理时间的延长,对杜仲造成的胁迫程度加剧,叶片净光合速率和蒸腾速率均以对照(0 d)为最大。气孔导度和胞间二氧化碳浓度也随着干旱胁迫时间的延长而逐渐显著降低(表1)。气孔的关闭是通过调节叶片气孔保卫细胞的运动来实现的[3],由表1结果表明,杜仲为适应干旱环境,植株会降低气孔导度,降低CO2的交换速度和浓度,维持较低的光合速率和蒸腾速率,从而降低能量和水分的损耗。因此,气孔限制是影响干旱胁迫下杜仲叶片光合作用的主要原因。
正常的植株体内,活性氧等自由基的含量水平处于一个动态平衡状态,在逆境胁迫中,活性氧还能起到信号传导的作用,然而,若过度的逆境胁迫,将会破坏自由基的平衡状态,从而攻击细胞膜、蛋白质、核酸等,造成植物组织细胞因代谢紊乱而损伤[3]。活性氧的清除,需要依靠一些抗氧化保护酶如SOD、POD、CAT等的作用[3]。丙二醛是细胞膜脂质过氧化的最终产物,其含量高低可以反映逆境胁迫导致膜损伤的程度[15]。在干旱处理前期(6 d),杜仲叶片中丙二醛含量逐渐上升,表明抗氧化酶还未完全发挥作用,虽然SOD、POD、CAT活性从干旱处理开始就逐渐上升(表1)。但是在处理第7~12 d,丙二醛含量逐渐下降,表明抗氧化保护酶已发挥其作用,尤其是POD和CAT的活性,分别由处理前的482.59和229.61 U·g-1·min-1增加至2 847.26和4 234.35 U·g-1·min-1(表2)。这一结果与Ge等[16]、刘红云等的结果一致[3]。
渗透调节是植物抵御逆境胁迫的一种重要方式,不同植物物种,因为基因型、蛋白谱等的差异,在响应逆境胁迫过程中,细胞内累积的渗透调节物质也不一致[17]。研究发现,持续性干旱胁迫导致杜仲叶片中脯氨酸和可溶性糖含量显著上升,在复水后,含量有所下降(表1)。结果表明,脯氨酸和可溶性糖是杜仲叶片中重要的渗透调节物质,以降低其在干旱环境中的水分损失,从而维持植物体内稳态,这与刘红云等[3]的研究结果类似。
3.2 干旱处理对杜仲叶片蛋白质的影响
根据逆境胁迫的强度和持续时间,可将植物响应逆境胁迫过程分为四个阶段[18]:起始预警阶段(initial alarm phase),该阶段会导致植物的快速应激反应,使植物的抗逆能力下降;第二阶段为适应阶段(acclimation phase),并持续数天,此时植物会发生各种生理生化代谢反应,以建立一个新的内稳态系统;第三阶段为维持期(maintenance phase),新建立的内稳态系统在该阶段会维持在一个较稳定的水平;如果逆境胁迫强度过大或者持续时间过长,植物无法维持其建立的新的内稳态系统,将会进入衰退期(recession phage),导致植物各种生物学代谢过程紊乱。每一个阶段对应植物不同的蛋白质组成[19]。
3.2.1 干旱对杜仲叶片信号转导相关蛋白的影响
植物响应干旱胁迫的第一步是感应和传导胁迫信号,继而引发植物响应逆境胁迫的四个反应阶段。在干旱处理后的杜仲叶片中,有2个蛋白涉及信号传导,即生长素结合蛋白1(ABP1,蛋白点18,表2)和β-葡糖苷酶12类前体(蛋白点30),ABP1蛋白定位于细胞壁,并在逆境胁迫中起到信号传导的作用[20]。ABP1基因在干旱胁迫下的玉米中的上调表达,可使玉米生长受限,以抵御缺水环境[21]。葡糖苷酶在逆境胁迫中可以通过生氰作用,催化葡萄糖苷的水解,继而激发各种活性激素的产生,包括细胞激素、赤霉素和生长素,从而将逆境信号传递至胞内[22]。ABP1和葡糖苷酶在干旱处理后的杜仲叶片中上调表达,表明杜仲可通过调控叶片中生长素水平,调节植物生长以适应干旱缺水环境。
3.2.2光合作用、碳代谢、能量代谢相关蛋白在干旱处理的杜仲叶片中的变化
光合作用是植物体内碳水化合物合成的主要生物学过程,对植物细胞生长和增殖及其重要,主要包括两个反应阶段,即光反应阶段(光捕获)和暗反应阶段(卡尔文循环),保持稳定光合速率对维持植物在逆境胁迫中的生长具有重要意义[14]。本研究发现共有7个蛋白参与干旱胁迫下杜仲叶片的光合作用(表2),其中2个上调表达(蛋白点20与21),5个下调表达(蛋白点6、9、14、22、24)。光捕获蛋白3(蛋白点9)、NADPH-铁氧还蛋白还原酶(蛋白点22)与光系统IIcp47蛋白(蛋白点24)参与光反应阶段,其中NADPH-铁氧还蛋白还原酶可催化电子从NADPH转移至铁氧还蛋白的反应,并产生质子(H+)和电子势,是光合反应过程的限速步骤之一[14]。这三个蛋白在干旱胁迫下的杜仲叶片中下调表达(表2),表明持续性干旱胁迫已导致杜仲叶片光合电子传递链受到显著抑制,从而导致过量的激发态能量被转移至活性氧的产生过程,从而导致氧化胁迫,这与Ghosh等[23]的推论一致。其余的4个蛋白点主要参与碳固定(卡尔文循环)阶段,包括1,5-二磷酸核酮糖羧化/加氧酶大亚基(Rubisco,蛋白点6,20,21)与1,5-二磷酸核酮糖羧化/加氧酶活化酶(Rubisco活化酶,蛋白点14)。Rubisco可以催化CO2与二磷酸核酮糖反应形成3-磷酸甘油酸,继而起始碳水化合物代谢反应,其中CO2是加氧反应的竞争性抑制子,而O2则是羧化反应的竞争性抑制子[14]。本研究发现,蛋白点6的分子量(52.89 kDa)要显著大于蛋白点20(32.17 kDa)和蛋白点21(20.10 kDa),而蛋白点6在干旱胁迫后的杜仲叶片中下调表达,蛋白点20与21则上调表达,表明蛋白点20与21是蛋白点6的降解片段,Rubisco酶在持续性干旱胁迫后的杜仲叶片中遭到破坏,影响杜仲叶片的光合作用,这与杨树叶片响应干旱胁迫的机制一致[24]。Rubisco活化酶基因通过可变剪辑,可表达形成两种亚型,且起不同作用的蛋白,它们的分子量分别在41~43与45~46 kDa,分子量较大的亚型主要通过调节细胞基质中氧化还原态,调控逆境胁迫中植物的光合作用,而小亚型则通过保持逆境胁迫下植物中Rubisco活性来适应胁迫环境[25]。本研究中Rubisco活化酶(蛋白点14)的分子量为46.06,属分子量较大的亚型,它的下调表达表明持续性干旱导致杜仲叶片氧化还原稳态遭到破坏,使其光合作用受到抑制。在生理生化指标分析过程中,也发现干旱处理可导致杜仲叶片气孔的关闭,降低蒸腾作用,减少水分损失,同时叶片对外界CO2的吸收也降低,最终导致杜仲叶片光合速率降低(表1)。综上所述,持续性干旱缺水环境,导致Rubisco酶和Rubisco活化酶活性受到影响,并抑制杜仲叶片光合作用。
碳水化合物代谢是继光合作用以后,最易受干旱影响的生物学过程,它包括糖酵解、三羧酸循环、磷酸戊糖途径。糖酵解/糖质新生可将葡萄糖转化为丙酮酸和H+,并将产生的能量以ATP和NADH的形式储存;三羧酸循环是将丙酮酸在有氧的情况下降解形成CO2和水,并产生能量ATP供植物正常生长和分化所需,同时,也可产生一些体内物质合成过程中所需的前体物质;磷酸戊糖途径是糖酵解途径中的一个旁路,产生5-磷酸核糖和NADPH,为代谢物生物合成提供基体物质和还原力[26]。本研究供发现有6个蛋白参与糖酵解途径,其中5个蛋白在干旱处理后的杜仲叶片中上调表达,包括磷酸甘油酸激酶(蛋白点12)、烯醇酶(蛋白点16)、磷酸甘油酸变位酶(蛋白点17)、二磷酸果糖醛缩酶1(蛋白点23)、磷酸丙糖异构酶(蛋白点26),只有一个蛋白下调表达,即6-磷酸葡萄糖激酶(蛋白点31)。另外,有1个蛋白参与杜仲叶片的磷酸戊糖途径,且在干旱处理后上调表达,磷酸核酮糖激酶(蛋白点28)。本次实验没有发现三羧酸循环相关蛋白。结果表明,持续性干旱胁迫下的杜仲叶片中,糖酵解和磷酸戊糖途径得到增强,这可能是杜仲叶片中可溶性糖含量在干旱处理后上升(表1)的主要原因。
糖酵解、三羧酸循环、磷酸戊糖途径伴随着能量的代谢。本研究共发现有2个能量代谢相关蛋白,包括ATP合酶CF1α亚基(蛋白点2)和ATPaseα亚基(蛋白点4),它们在干旱胁迫后的杜仲叶片中含量上升。ATPase是质膜和细胞器内膜系统的内嵌蛋白,包括Na+、K+、H+-ATPase,是植物体内能量代谢的关键酶;ATP合酶CF1α亚基是线粒体内Ca2+结合型的特异性蛋白,其产生的ATP作为能量物质,可维持膜上钙泵活性所需,并可调节细胞质中Ca2+浓度[27]。能量代谢相关蛋白的上调表达,表明杜仲叶片在干旱胁迫下能量代谢得到增强。
综上所述,持续性干旱胁迫对杜仲叶片的光合作用产生负面影响,但是可以通过糖酵解途径和磷酸戊糖途径生产的ATP、NADPH等能量物质,以维持其在干旱环境中的生长所需。
3.2.3干旱胁迫下杜仲叶片次级代谢物合成相关蛋白的变化
杜仲叶中富含萜类物质,是杜仲胶的主要成分,细胞质的甲羟戊酸(Mevalonate,MVA)途径和质体的脱氧木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate pathway,DXP)途径是萜类物质合成的两个重要途径[28]。在MVA途径中,乙酰辅酶A酰基转移酶(蛋白点7与8)是其中的一个关键酶,属Ⅱ型硫解酶[29],它们在干旱处理后的杜仲叶片中下调表达(表2)。3-羟基-3-甲基戊二酰辅酶A合酶(蛋白点5)是MVA途径的另一关键限速酶,它可催化3-羟基-3-甲基戊二酰辅酶A,然后经3-羟基-3-甲基戊二酰辅酶A还原酶的催化作用,形成甲羟戊酸[28],缺水处理同样导致3-羟基-3-甲基戊二酰辅酶A合酶在杜仲叶片中的表达量下降(表2)。脱氧木酮糖-5-磷酸合酶(蛋白点10)是DXP合成过程中的关键酶,然后经2-甲基-D-赤藓糖醇-4-磷酸(MEP)途径合成帖类物质[30],该酶在干旱处理后的杜仲叶片中的表达比对照下降3.13倍(表2)。结果表明,干旱处理导致杜仲叶片的萜类物质的合成受限,引起了杜仲的中药成分变化。
黄酮类化合物是一类具有抗氧化、抗肿瘤活性的多酚类次级代谢物,广泛存在于植物中,黄酮醇是其中较重要的一种,包括槲皮素、山奈酚和杨梅素均属于黄酮醇,黄酮醇合成酶(蛋白点3)是黄酮醇合成途径中的关键酶[31]。本研究发现,干旱处理15天以后,杜仲叶片中的黄酮醇合成酶下调表达(表2)。结果表明,在缺水环境中的杜仲叶片中,黄酮醇类物质合成受限。
3.2.4 干旱胁迫对杜仲叶片抗氧化保护酶的影响
活性氧(Reactive Oxygen Species,ROS)包含超氧化物阴离子自由基、羟基自由基、单线态氧、过氧化氢等,在逆境胁迫下,植物会产生过量的ROS,并引发氧化胁迫,攻击细胞膜导致脂质过氧化,并导致植物逆境胁迫损伤[22],因此,干旱处理后的杜仲叶片丙二醛含量会上升(表1)。ROS也会攻击蛋白质使其降解,比如干旱胁迫后的杜仲叶片Rubisco(蛋白点6)被降解成小片段(蛋白点20与21),从而抑制了杜仲叶片的光合作用(表1)。植物体一般会通过改变一些过氧化保护酶的表达量和活性,将过量ROS加以清除[22],比如过氧化物酶a(蛋白点25)、L-抗坏血酸过氧化物酶(蛋白点27)、碳酸酐酶(蛋白点32)、胞质抗坏血酸过氧化物酶1(蛋白点33)、2-Cys过氧化物氧化还原酶(蛋白点35)、[Cu-Zn]超氧化物歧化酶(蛋白点36),这些蛋白质在干旱处理的杜仲叶片中均上调表达(表2)。另一方面,生理指标结果表明,杜仲叶片中SOD、POD和CAT的活性,在干旱处理后增强(表1)。结果表明,杜仲叶片可以通过增加过氧化保护酶的表达量和活性来抵御干旱。
3.2.5干旱胁迫对杜仲叶片氨基酸和蛋白生物合成的影响
提升植物细胞内游离氨基酸含量是植物适应逆境胁迫的一个重要机制,因为氨基酸可以作为一种重要的渗透调节物质,因此,氨基酸合成相关酶的调控对植物适应干旱环境极其重要[22]。本研究发现,在干旱处理15 d后的杜仲叶片中,氨基酸合成相关蛋白均上调表达(表2),包括S-腺苷甲硫氨酸合成酶3(蛋白点11)、谷氨酰胺合成酶(蛋白点13)、甘氨酸脱氢酶(蛋白点27)。其中谷氨酰胺合成酶在氮代谢过程中起着关键作用,且与植物体内脯氨酸水平调节紧密相关[14],它在干旱胁迫下杜仲叶片中的上调表达,与杜仲叶片脯氨酸含量上升(表1)的结果一致。
本研究发现4个蛋白与蛋白质代谢相关,包括核糖体蛋白L22(蛋白点1)、RNA聚合酶α链(蛋白点15)、胚胎发育晚期蛋白Dc3(LEA Dc3,蛋白点19)、RNA结合蛋白CP31B(蛋白点34)。根据这些蛋白的分子功能,可将其归为两类蛋白,即蛋白质生物合成表达相关蛋白(蛋白点1、15和34)和分子伴侣蛋白(蛋白点19),这两类蛋白在干旱处理后的杜仲叶片中分别表现为下调表达和上调表达,表明干旱处理导致蛋白质的生物合成受到抑制,但是仍需要发挥分子伴侣蛋白的功能,以维持某些蛋白质的正常结构,保持其活性。
4 结论
通过生理生化指标分析和蛋白质组学差异研究,杜仲可以通过提升信号传导、碳水化合物代谢途径、能量代谢、氨基酸合成和抗氧化相关蛋白的表达,同时增加脯氨酸含量、可溶性糖含量以及氧化保护酶活性,以增强杜仲的抗旱能力;另一方面,持续性干旱胁迫通过降低杜仲叶片光合作用、次级代谢物合成、蛋白质的生物合成相关蛋白的表达,使这些生物学过程在干旱处理后受到限制。研究结果可为揭示杜仲响应干旱胁迫的分子机制奠定基础。
1.杜灵通,候静,胡悦,等.基于遥感温度植被干旱指数的宁夏2000~2010年旱情变化特征[J].农业工程学报,2015,31(14):209-216.
Du L T,Hou J,Hu Y,et al.Drought variation characteristics in Ningxia from 2000-2010 based on temperature vegetation dryness index by remote sensing[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(14):209-216.
2.Yi C X,Wei S H,Hendrey G.Warming climate extends dryness-controlled areas of terrestrial carbon sequestration[J].Scientific Reports,2014,4:5472.
3.杨全,孟平,李俊清,等.土壤水分胁迫对杜仲叶片光合及水分利用特征的影响[J].中国农业气象,2010,31(1):48-52.
Yang Q,Meng P,Li J Q,et al.Effect of soil water stress on photosynthetic and transpiration characters ofEucommiaulmoides[J].Chinese Journal of Agrometeorology,2010,31(1):48-52.
4.刘红云,梁宗锁,刘淑明,等.持续干旱及复水对杜仲幼苗保护酶活性和渗透调节物质的影响[J].西北林学院学报,2007,22(3):55-59.
Liu H Y,Liang Z S,Liu S M,et al.Effect of progressive drying and rewatering on protective enzyme activities and osmoregulatory molecules in leaves ofEucommiaulmoidesseeding[J].Journal of Northwest Forestry University,2007,22(3):55-59.
5.Zhu M Q,Xu W Z,Wen J L,et al.Dynamic changes of photosynthetic properties and chemical compositions ofEucommiaulmoidesOliver under two planting models[J].Industrial Crops and Products,2017,96:46-56.
6.Xiong L,Zhu J K.Molecular and genetic aspects of plant responses to osmotic stress[J].Plant,Cell & Environment,2002,25(2):131-139.
7.陈丽萍,何道一.植物抗旱耐盐基因的研究进展[J].基因组学与应用生物学,2010,29(3):542-549.
Chen L P,He D Y.Research advance on drought and salt resistant genes in transgenic plants[J].Genomics and Applied Biology,2010,29(3):542-549.
8.李国龙,吴海霞,孙亚卿.蛋白质组学在植物水分胁迫应答中的应用研究进展[J].西北植物学报,2015,35(10):2132-2140.
Li G L,Wu H X,Sun Y Q.Proteome and its applied advances in plant drought stress response[J].Acta Botanica Boreali-Occidentalia Sinica,2015,35(10):2132-2140.
9.曹瑞致,周自云,靳鹏博,等.黄土丘陵区不同立地条件下人工杜仲林土壤水分变化和生长规律研究[J].西北林学院学报,2017,32(1):12-18.
Cao R Z,Zhou Z Y,Jin P B,et al.Dynamic regularities of soil water and growth in artificialEucommiaulmoidesplantations with different site conditions in Loess Gullied-hilly Regions[J].Journal of Northwest Forestry University,2017,32(1):12-18.
10.谢寅峰,沈惠娟,罗爱珍,等.南方7个造林树种幼苗抗旱生理指标的比较[J].南京林业大学学报,1999,23(4):13-16.
Xie Y F,Shen H J,Luo A Z,et al.A Study on the physiological indexes of drought-resistance to seedlings of seven afforestation tree species in the South of China[J].Journal of Nanjing Forestry University,1999,23(4):13-16.
11.Hodges D M,Delong J M,Forney C F,et al.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207(4):604-611.
12.Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil,1973,39(1):205-207.
13.Farhad M S,Babak A M,Reza Z M,et al.Response of proline,soluble sugars,photosynthetic pigments and antioxidant enzymes in potato(SolanumtuberosumL.) to different irrigation regimes in greenhouse condition[J].Australian Journal of Crop Science,2011,5(1):55-60.
14.Liu H,Sultan M A R F,Liu X L,et al.Physiological and comparative proteomic analysis reveals different drought responses in roots and leaves of drought-tolerant wild wheat(Triticumboeoticum)[J].PLoS One,2015,10(4):e0121852.
15.韦小丽,徐锡增,朱守谦.水分胁迫下榆科3种幼苗生理生化指标的变化[J].南京林业大学学报:自然科学版,2005,29(2):47-50.
Wei X L,Xu X Z,Zhu S Q.Variation of physiological and biochemical indexes in seedlings of three Ulmaceae species under water stress[J].Journal of Nanjing Forestry University:Natural Sciences Edition,2005,29(2):47-50.
16.Ge T D,Sui F G,Bai L P,et al.Effects of water stress on the protective enzyme activities and lipid peroxidation in roots and leaves of summer maize[J].Agricultural Sciences in China,2006,5(4):291-298.
17.徐莲珍,蔡靖,姜在民,等.水分胁迫对3种苗木叶片渗透调节物质与保护酶活性的影响[J].西北林学院学报,2008,23(2):12-16.
Xu L Z,Cai J,Jiang Z M,et al.Effects of water stress on osmotic adjustment and activity of protect enzymes in the leaves of three sorts of seedlings[J].Journal of Northwest Forestry University,2008,23(2):12-16.
18.Larcher W.Physiological plant ecology:ecophysiology and stress physiology of functional groups:4th ed[M].Berlin Heidelberg:Springer,2003.
19.Kosová K,Vítámvás P,Prášil I T,et al.Plant proteome changes under abiotic stress contribution of proteomics studies to understanding plant stress response[J].Journal of Proteomics,2011,74(8):1301-1322.
20.Chen J G,Wang S C,Lazarus C M,et al.Altered expression of auxin-binding protein 1 affects cell expansion and auxin pool size in tobacco cells[J].Journal of Plant Growth Regulation,2006,25(1):69-78.
21.Jiménez S,Li Z G,Reighard G L,et al.Identification of genes associated with growth cessation and bud dormancy entrance using a dormancy-incapable tree mutant[J].BMC Plant Biology,2010,10:25.
22.Caruso G,Cavaliere C,FOGLIA P,et al.Analysis of drought responsive proteins in wheat(Triticumdurum) by 2D-PAGE and MALDI-TOF mass spectrometry[J].Plant Science,2009,177(6):570-576.
23.Ghosh D,Xu J.Abiotic stress responses in plant roots:a proteomics perspective[J].Frontiers in Plant Science,2014,5:6.
24.Yang F,Wang Y,Miao L F.Comparative physiological and proteomic responses to drought stress in two poplar species originating from different altitudes[J].Physiologia Plantarum,2010,139(4):388-400.
25.Wang D,Li X F,Zhou Z J,et al.Two Rubisco activase isoforms may play different roles in photosynthetic heat acclimation in the rice plant[J].Physiologia Plantarum,2010,139(1):55-67.
26.Hames B,Hooper N.Instant notes in biochemistry:4thed[M].Leeds,UK:BIO Sscientific Publishers Ltd,2011:304-326.
27.Senda M,Mikami T,Kinoshita T.The sugar beet mitochondrial gene for the ATPase alpha-subunit:sequence,transcription and rearrangements in cytoplasmic male-sterile plants[J].Current Genetics,1993,24(1-2):164-170.
28.王淋,杜红岩,乌云塔娜.杜仲MVA和MEP途径相关基因的亚细胞定位与表达分析[J].植物研究,2017,37(1):52-62.
Wang L,Du H Y,Wuyun T N.Subcellular localization and expression analysis of genes fromEucommiaulmoidesinvolved in MVA and MEP pathway[J].Bulletin of Botanical Research,2017,37(1):52-62.
29.贾宁,仇燕,王刚.紫杉醇生物合成相关酶类的研究进展[J].生物学杂志,2002,19(6):9-12.
Jia N,Qiu Y,Wang G.Progress of the studies on enzymes in taxol biosynthesis[J].Journal of Biology,2002,19(6):9-12.
30.Banerjee A,Wu Y,Banerjee R,et al.Feedback inhibition of deoxy-d-xylulose-5-phosphate synthase regulates the methylerythritol 4-phosphate pathway[J].Journal of Biological Chemistry,2013,288(23):16926-16936.
31.Owens D K,Alerding A B,Crosby K C,et al.Functional analysis of a predicted flavonol synthase gene family in Arabidopsis[J].Plant Physiology,2008,147(3):1046-1061.
