重复经颅磁刺激对卒中后失语语言功能重组的影响:基于功能磁共振的研究
2018-06-22邱国荣丘卫红邹艳冯小欢武惠香陈兆聪康庄
邱国荣,丘卫红,邹艳,冯小欢,武惠香,陈兆聪,康庄
1.中山大学附属第三医院,a.康复医学科;b.放射科,广东广州市510630
失语症(aphasia)作为脑卒中后最严重的功能障碍之一,极大地影响脑卒中患者的生活质量[1],是阻碍患者重返社会的重要因素[2]。卒中后失语的康复显得尤为重要。然而目前的治疗效果难以令人满意,需要寻求更有效的治疗方法。
重复经颅磁刺激(repeated transcranial magnetic stimulation,rTMS)作为卒中后失语的重要治疗手段,越来越受到国内外的关注[3-4]。其低频(≤1 Hz)刺激可抑制神经元兴奋性,高频(>1 Hz)刺激可提高神经元兴奋性。利用此特性,可对失语症患者相关语言功能区进行针对性刺激,改善患者语言功能。近年来兴起的血氧水平依赖的功能磁共振成像(blood oxygen level dependent-functional magnetic resonance imaging,ΒOLD-fMRI)技术中的任务态fMRI(task-f MRI)可让患者在执行语言任务的情况下,准确、直观地观察其大脑功能活动情况。两者结合,可对失语症患者语言功能重组模式进行探索。但由于价格较高、操作复杂,国内此类研究较少,国外也以小型病例对照研究或个案分析居多。
右侧大脑半球在卒中后失语恢复中所起的作用,一直以来都是学界争议的焦点。部分研究发现,运用低频rTMS抑制卒中后失语患者右侧半球后可使其语言功能改善[5],但亦有部分研究者运用高频rTMS兴奋患者右侧半球后观察到其语言功能有所提高[6]。
本研究拟采用低频rTMS对失语患者右侧大脑半球兴奋性进行干预,结合task-fMRI观察其脑区激活变化情况,探讨rTMS刺激右侧大脑半球对失语症患者大脑语言功能重组的影响,为寻求rTMS在卒中后失语的规范化治疗提供理论依据。
1 资料与方法
1.1 一般资料
选取2017年1月至2018年2月在中山大学附属第三医院康复医学科住院的脑卒中后失语症患者作为实验组,均符合1995全国脑血管病会议制定的脑梗死或脑出血诊断标准[7],并经CT或MRI确诊为左侧半球脑卒中。
纳入标准:①首次发病,发病后未接受过rTMS治疗,病程2周~12个月;②年龄18~75岁;③母语为汉语,且发病前语言功能正常;④既往无脑外伤、无严重躯体疾病、酒精和药物依赖史或其他可能影响脑功能与结构的疾病,无其他精神神经疾病;⑤小学或以上文化程度;⑥经中国人左右利手分布标准化问卷调查确定为右利手;⑦中文版西方失语症成套检验(Western Aphasia Βattery,WAΒ)评估[8-9]诊断为失语症,且听理解评估得分>80分,确保患者可理解语言任务内容;⑧无内置金属(如心脏起搏器、颅内金属植入物等)等磁刺激及磁共振检查禁忌症;⑨无癫痫病史;⑩患者本人或家属签署知情同意书。
排除标准:①存在意识障碍,不能配合完成相关治疗及相关评估;②存在听力或视力障碍;③多次脑血管疾病或有其他严重心肺并发症;④依从性差,检查治疗不合作;⑤幽闭恐惧症。
脱落标准:①治疗过程中出现病情加重或出现其他严重并发症;②继发二次卒中;③患者或家属要求终止试验;④无法耐受经颅磁刺激治疗。
另外选取年龄、性别相匹配的健康成年人作为健康对照组。
纳入标准:①年龄18~75岁;②语言功能正常,母语为汉语;③无内置金属等磁共振检查禁忌症;④无脑卒中病史或脑外伤病史;⑤无癫痫病史;⑥无认知障碍、无严重躯体疾病、无脑创伤、药物和酒精依赖史或其他可能影响脑的结构与功能的疾病,无精神障碍;⑦经中国人左右利手分布标准化问卷调查确定为右利手[10];⑧小学或以上文化程度;⑨本人自愿参加实验并签署知情同意。
排除标准:①存在听力或视力障碍;②幽闭恐惧症。
脱落标准:①试验过程中出现不适;②本人要求终止试验。
按照上述标准,实验组纳入6例,健康对照组纳入9例。两组性别、年龄比较无显著性差异(P>0.05)。见表1。
本研究已获得中山大学附属第三医院临床研究伦理委员会批准(批准号:中大附三医伦[2018]02-012-01)。

表1 两组一般资料比较
实验组所有被试一般情况见表2。
1.2 方法
1.2.1 主要仪器及器材
Visor2 Neuroaim光学神经导航系统:德国ANT公司。CCY-IA型高性能磁刺激仪(自带“8”字形线圈,直径70 mm)、表面肌电图(electromyogram,EMG)仪:武汉依瑞德医疗设备新技术有限公司。Discovery MR750 3.0 T超导型磁共振扫描仪:美国GE公司。

表2 实验组一般情况
1.2.2 rTMS
1.2.2.1 静息态运动阈值(resting motor threshold,RMT)测量
患者取坐位,将表面肌电电极置于左手第一背侧骨间肌(the first dorsal interosseous,FDI)处,将线圈置于右侧半球初级运动皮层进行刺激,连续刺激10次运动皮层,记录可以诱发出连续5个超过50μV或至少引起FDI收缩5次的最小输出强度,记录为静息态运动阈值。
1.2.2.2 刺激部位
通过神经导航定位系统进行精准定位刺激。首先在Visor2系统导入患者三维磁化准备快速梯度回波序列(3D-MPRAGE)磁共振DICOM图像,去除颅骨,生成患者大脑3D模型,标记右侧额下回三角部(parstriangularis,PTr)作为刺激靶点。通过红外线仪及导航定位笔录入磁刺激仪“8”字形线圈模型,患者头部佩戴导航追踪器,选择鼻根及双侧外耳道3个解剖部位并运用导航定位笔在患者头皮进行描画,记录100个以上描画点,录入患者实际头颅形态模型,使患者大脑和头颅相匹配。最后,患者取坐位,“8”字形线圈中心点移动到刺激位置,与刺激靶点部位头骨相切,与水平呈约45°角,对靶点进行刺激,此时患者头部和刺激线圈均处于同一参照系完成定位。每次刺激均需重新匹配线圈及患者头部模型,确保每次刺激点与靶点距离误差<2 mm,角度误差<5°,实现精准刺激。见图1、图2。
1.2.2.3 刺激方案
刺激部位为右侧额下回三角部,刺激强度90%RMT,频率1 Hz,2个治疗序列,每个治疗序列600个脉冲,间歇1 s,共1200个脉冲。每次20 min,每天1次,每周5 d,共治疗10次。

图1 定位右侧额下回三角部
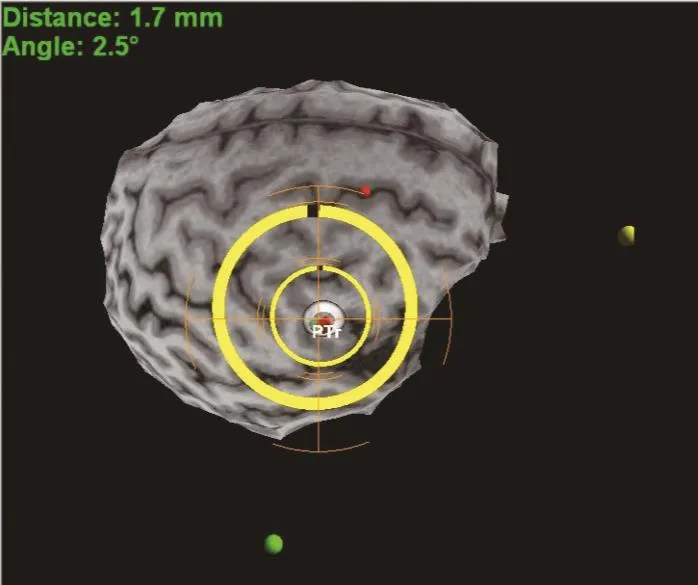
图2 对目标靶点进行刺激
1.2.3 评估方法
1.2.3.1 WAΒ评估
由同一语言治疗师在治疗前后对所有患者自发言语、理解、复述、命名4个方面进行评分,并计算失语商。

1.2.3.2 task-fMRI检查
两组在入组时均进行task-fMRI扫描,其中4例可耐受rTMS刺激的患者在完成2周治疗后进行第2次task-fMRI扫描。
1.2.4 fMRI成像方法
1.2.4.1 成像前准备
对受试者进行task-fMRI任务训练,并模拟执行语言任务,直至被试充分明白进行task-fMRI扫描时应如何执行任务。
1.2.4.2 语言任务
要求受试者对呈现在眼前的图片进行命名。
1.2.4.3 参数设置
3D-MPRAGE成像参数:Flip角=15°,TE=3.2 ms,层间距=1 mm,TR=8200 ms,层厚=1.2 mm,采集矩阵256×256。task-fMRI成像参数:TR=2000 ms,TE=35 ms,Flip角=90°,视野(field of view,FOV)240×240 mm,采集矩阵64×64,层厚=4 mm,层间距=1 mm。扫描范围:以平行于胼胝体前后联合的连线为基线,共35层,上缘完全包括额、顶叶皮质,下缘一般到小脑幕水平。
1.2.4.4 扫描过程
task-fMRI按组块设计任务,分三个组块。Rest组块:不设置任务。Task组块:运用随机数字法从国际公认的Snodgrass 260图库中挑选出30幅黑白线图让患者进行命名,每幅图片呈现3 s。Control组块:运用Matlab软件把此30幅图的像素打散变为散点图,图片亮度、像素数量及呈现时间不变,以排除视觉干扰。
1.2.4.5 扫描方案
在6 s指导语(“请做好准备,实验马上开始”)后,实验正式开始。每一组块持续30 s,所有组块均重复3次,最后8 s匀场。整个实验序列持续284 s。
1.2.4.6 图像后处理
导出fMRI原始DICOM文件,经dcm2nii软件转化为.nii格式文件,运用Matlab软件内置的SPM 12工具包进行预处理及统计分析,个体统计阈值概率设为P<0.0001,激活体积阈值(threshold voxel)设为V=35,表示连续激活体素数目达到35个或以上的激活点才考虑为有意义的激活;组内及组间统计阈值概率设为P<0.005,V=10。最终得到具体激活体素值及坐标。运用Matlab软件内置的REST_V1.8工具包导入加拿大蒙特利尔神经研究所(Montreal Neurological Institute,MNI)开发的AAL90模板,再导入被试的spmT.img结果图进行匹配,最后输入坐标得到激活体素所在脑区。运用ΒrainNet工具包及Mricron软件对结果进行可视化处理得到激活图。
1.2.5 指标分析
根据本实验前期研究[11]及前人研究基础[12-14],本研究感兴趣区(region of interest,ROI)设为双侧三角部、岛盖部、额中回、补充运动区、颞中回、颞上回,观察各被试脑区ROI的激活情况。
量化观察指标为如下。①受试者左右两侧脑区激活的体素值(voxel volume,V)以及与语言功能相关脑区激活的体素值。激活体素指数(activation voxel indices,AVI)主要用于衡量双侧大脑半球的偏侧化程度。
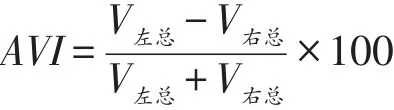
V左总表示左半球激活的所有体素值,V右总表示右半球激活的所有体素值,AVI 0至-100表明右侧大脑半球激活体素更多,右侧大脑半球为偏侧化半球,0至+100表示左侧大脑半球激活体素更多,左侧大脑半球为偏侧化半球[15]。②患者治疗前后WAΒ评估得分。
1.3 统计学分析
采用SPSS 20.0进行统计学分析。一般资料中,性别统计采用卡方检验Fisher确切概率法,年龄统计采用t检验。显著性水平α=0.05。
2 结果
实验组2例患者因无法耐受rTMS刺激,中途退出试验,最终4例患者完成全部研究内容。
2.1 组水平
实验组双侧大脑半球激活总体素均比健康对照组多,激活增多的脑区包括双侧额中回、双侧补充运动区等ROI;左楔前叶、左中央后回、左角回、左中央旁小叶、右海马、右内侧和旁扣带回等非感兴趣区(non-region of interest,n-ROI)。实验组比健康对照组激活减少的脑区包括ROI左侧额下回三角部;左距状裂周围皮层、左舌回、右前扣带回和旁扣带回等n-ROI。提示卒中后失语患者执行语言任务时双侧大脑半球激活均较正常人多,包括部分ROI及n-ROI。见表3~表4。

表3 实验组比健康对照组激活体素多的脑区
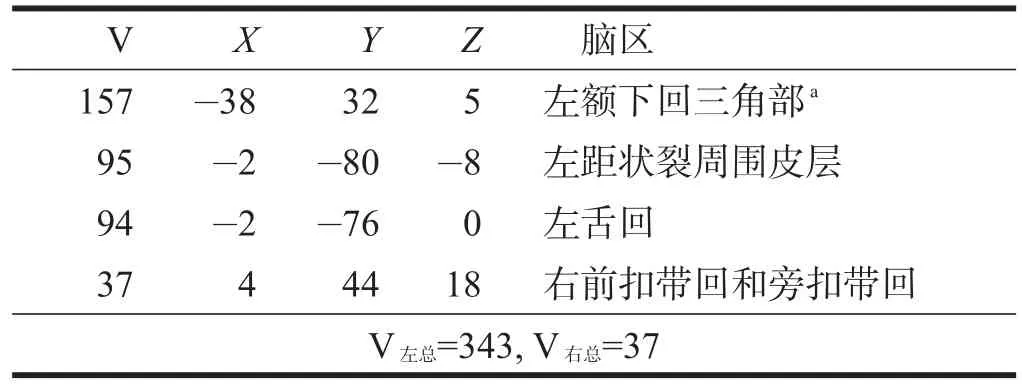
表4 实验组比健康对照组激活体素少的脑区
2.2 个体水平
病例1、病例2患者病程在半年内、病灶体积较小,治疗后双侧大脑半球激活均降低,且语言功能偏侧化半球由右侧大脑半球转为左侧大脑半球。病例1除复述无明显变化,自发言语、理解、命名和失语商均较前提高;fMRI图像分析显示,治疗后激活的ROI为右侧额中回,激活增加的ROI为左侧补充运动区,激活降低的ROI为右侧补充运动区和右侧颞上回。病例2自发言语、理解、复述、命名及失语商均较前提高,fMRI图像分析显示治疗后激活的ROI为左侧额下回三角部、左侧颞中回,激活降低的ROI为双侧补充运动区,较治疗前无再激活的ROI为双侧颞上回、右侧额中回。结合实验组和健康对照组组间对比结果分析,提示病灶较小、病程较短患者双侧半球可能存在无效激活,抑制这种无效激活可使有效激活增加,使患者语言功能改善。
病例3、病例4病程超过半年、病灶体积较大,治疗前双侧激活较低,治疗后双侧激活均增高。病例3治疗后语言功能偏侧化半球仍为右侧;语言功能自发语言、复述、命名、理解及失语商均较前有所提高;f MRI图像分析显示,治疗后激活的ROI为左侧额中回、右侧颞中回,激活增加的ROI为右侧补充运动区,激活降低的ROI为右侧颞上回,较治疗前无再激活的ROI为左侧颞上回及右侧额中回。病例4语言功能偏侧化半球由左侧大脑半球转为右侧大脑半球,语言功能除自发语言评分无明显变化外,理解、复述、命名及失语商较前提高;fMRI图像分析显示,治疗前未见激活,治疗后激活的ROI为双侧补充运动区、右侧岛盖部及右侧颞中回。提示病灶较大、病程较长的卒中后失语患者可能由于病情较重,双侧半球语言功能区激活均较低,rTMS治疗后可使患者双侧半球激活增加,且语言功能较前改善,但二者语言功能偏侧化半球均为右侧半球,提示此类患者语言功能的恢复可能更依赖右侧大脑半球的代偿。见表5~表7、图3~图6。
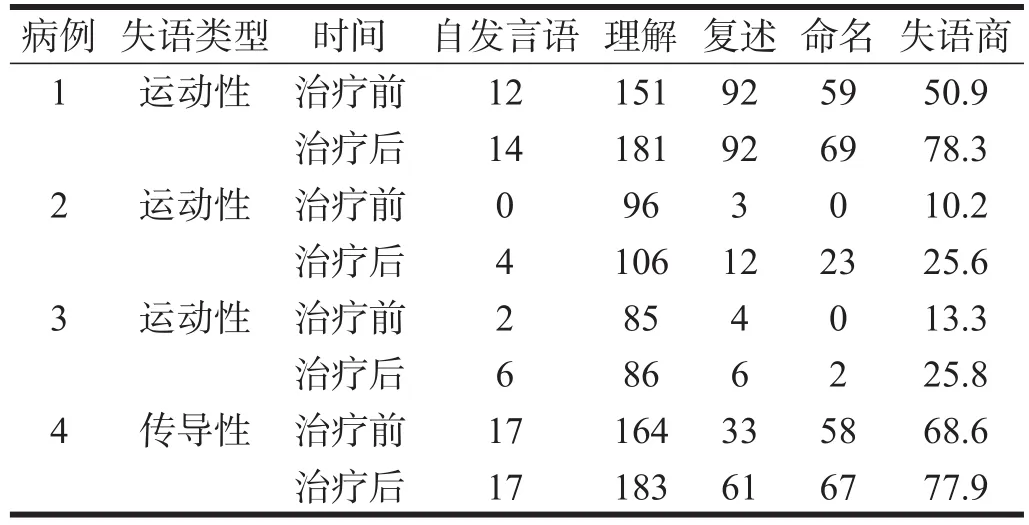
表5 患者个体治疗前后WAB评分

表6 患者个体治疗前后激活体素比较

表7 患者个体治疗前后ROI激活情况

图3 病例2治疗前激活图

图4 病例2治疗后激活图
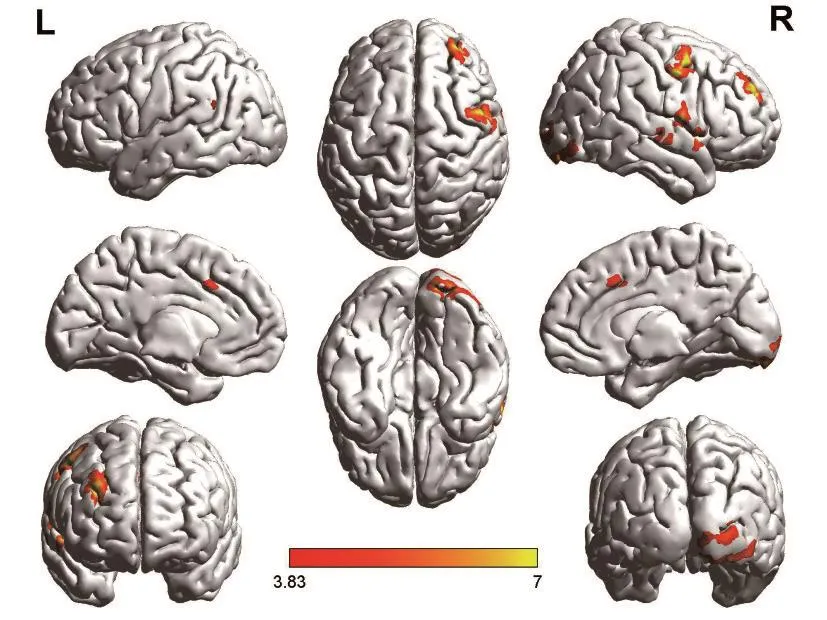
图5 病例3治疗前激活图

3 讨论
失语症具有发病率高、恢复难度大等特点,卒中后约21%~38%的患者遗留失语,但仅有小部分患者能获得到较好的恢复[16],其预后主要取决于病变部位及范围,并且与病灶周围组织血液再灌注、正常皮层低代谢的恢复等有关。卒中后失语恢复时间窗非常长,但仅在卒中后6个月内恢复较快,之后恢复速度大大减缓,逐渐步入平台期[17-18]。
本研究采用task-fMRI结合WAΒ量表进行评估,对比单纯运用神经行为学量表作为评估指标的研究,更具客观性。此外,本研究采用神经导航定位系统,对不同被试大脑进行个体化的3D建模,精准定位其右侧额下回三角部,确保每次刺激点与靶点距离误差小于2 mm,角度误差小于5°,比常用的脑电国际标准导联10-20系统定位法[19]更加精准。
本研究结果显示,命名任务下,实验组双侧大脑半球激活总体素均比健康对照组高,但一些高效语言功能区如左侧额下回三角部激活则比健康对照组低。可能原因在于脑卒中破坏了左侧大脑半球部分语言功能区,这部分脑区激活较健康对照组低。另一方面,ROI中双侧补充运动区及双侧额中回激活增加,既往研究提示此部分脑区对语言产生及图片命名起重要作用[20-22],因此其激活增加可能是为了代偿受损的语言功能;n-ROI中双侧旁扣带回、左侧中央旁小叶等脑区激活亦较健康对照组增加,这可能与语言功能区损伤后招募周围脑区以代偿受损的语言功能有关,也可能是由于残存语言功能区代偿活跃而导致其周围部分脑区也产生激活,亦可能与相关语言功能区受损后同侧大脑半球周围区域与对侧同源区受到的抑制解除有关。Heiss等[23]认为,部分脑区激活增加是由于语言功能区执行语言任务时对其周围区域及对侧同源区有一定的抑制作用,其受损后这部分区域所受抑制解除,激活增加,并提出这部分激活可能是无效激活,甚至会阻碍语言功能的恢复。提示实验组双侧大脑半球激活虽较健康对照组高,且部分残存语言功能区代偿活跃,但不排除部分脑区存在无效激活。
个体分析显示,病灶体积较小、病程较短的病例1、病例2治疗前两者双侧半球激活较高,治疗后双侧激活均较前降低,且整体语言功能较前改善。fMRI图像分析显示,治疗后病例1 ROI双侧补充运动区激活增加,右侧颞上回激活减少;病例2 ROI左侧额下回三角部及左侧颞中回治疗前无激活,治疗后出现激活,双侧颞上回较前无再激活。既往文献报道[20],失语患者双侧补充运动区的激活对自发言语的产生及图片命名起重要作用。故病例1治疗后自发言语及命名能力较前改善,可能与其双侧补充运动区激活增加有关。左侧额下回三角部及岛盖部作为Βroca区,是学界公认与语言产生及命名相关的运动性语言功能区,病例2自发言语及命名能力较前改善与治疗后激活左侧额下回三角部有关。病例1、2治疗后右侧颞上回激活均降低,理解功能改善。You等[24]运用经颅直流电刺激(transcranial direct current stimulation,tDCS)阴极刺激抑制失语患者右侧颞上回,阳极刺激兴奋患者左侧颞上回,发现兴奋左侧颞上回或抑制右侧颞上回均可提高患者的理解力,且抑制右侧颞上回改善程度更高。提示抑制右侧额下回三角部这一关键节点,可能通过对语言功能网络的调整,对其他重要语言功能区产生影响,使对语言功能恢复有利的脑区激活增加,无益甚至阻碍的脑区激活降低,最终使患者整体语言功能得到改善。既往有研究者[25-26]运用低频rTMS抑制失语患者右侧额下回三角部,发现患者命名能力较前显著提高,由此认为右侧半球对语言功能的恢复起阻碍作用。但也有研究表明,患者语言功能恢复伴随着右侧半球激活增多,并且两者间具有显著的相关性[27]。更有报道指出,左半球前额叶可能会干扰语言功能恢复[28]。提示在探讨双侧大脑半球激活对语言功能恢复造成的影响时,不能一概而论地否定右侧大脑半球的作用,而更应该将脑区细分后再进行进一步的探索,并将大脑受损程度和病程等因素纳入考虑范围。
纵观上述结果结合组水平分析,提示卒中后失语患者双侧大脑半球部分脑区可能均存在无效激活,这些无效激活在增加脑区耗氧的同时却没有为语言功能的改善带来益处,低频rTMS可通过刺激关键节点,影响语言功能重组模式,抑制双侧半球无效激活,间接令高效语言功能区供氧增加,激活增多,改善语言功能。此外,AVI显示治疗后病例1、病例2的语言功能偏侧化由右侧大脑半球转为左侧大脑半球,而既往研究及我们的前期研究显示,健康成人执行语言任务时双侧半球多个脑区均被激活,但大脑半球激活偏侧化以左侧为主[11,29]。提示病灶体积较小、病程在半年内的患者,治疗后语言功能重组激活模式趋向正常,其语言功能恢复主要依赖左侧大脑半球残存语言功能区及其周围组织。
病例3、病例4病灶体积较大、病程较长,治疗前二者双侧激活均较低,治疗后二者双侧激活均较前增加。fMRI图像分析显示,二者ROI右侧颞中回治疗前无激活,治疗后均出现激活,理解能力较前改善。Turken等[30-31]的研究亦表明,失语患者理解能力的提高与双侧颞中回的激活有关。此外,病例3右侧颞上回治疗后激活降低也有助于其理解能力的恢复[24]。病例3治疗后自发言语及命名能力较前改善,可能与fMRI图像分析显示治疗后ROI左侧额中回被激活且右侧补充运动区激活较前增加有关,与既往的研究认为左侧额中回及双侧补充运动区的激活对语言功能的恢复起促进作用一致[20-22]。病例4治疗后复述和命名能力较前改善,可能与治疗后ROI中双侧补充运动区、右侧额下回岛盖部出现激活有关。既往Naeser等[32]的研究也表明,右侧额下回三角部的激活对语言功能恢复起抑制作用,而右侧额下回岛盖部的激活对语言功能恢复起促进作用。提示病灶体积较大的患者由于左侧半球损伤严重,语言功能网络整体上受到的打击较大,导致双侧半球语言功能区激活较低,无法很好地代偿相关语言功能,通过低频rTMS抑制右侧额下回三角部,可优化语言功能重组模式,促使高效语言功能区激活增加,同时减少阻碍功能恢复脑区的激活,改善患者语言功能。同时,治疗后病例3语言功能偏侧化仍为右侧大脑半球,病例4由原来左侧大脑半球转为右侧大脑半球,与既往的研究认为左侧大脑半球大面积梗死患者的语言功能恢复主要由右侧大脑半球代偿[33]的观点相似,进一步验证了当左侧大脑半球损伤过大时,右侧大脑半球的代偿在语言功能恢复中起重要作用。
本研究中我们还注意到,抑制右侧额下回三角部使语言功能得到改善是基于调整了双侧大脑半球的激活模式,与既往的一些研究认为低频rTMS治疗有效是基于“半球间竞争性抑制理论”[26]不同。我们认为,语言作为人类特有的高级功能,比运动功能更复杂,偏侧化更明显,其产生到输出涉及左侧额、颞区以外的更多大脑皮层甚至小脑等共同组成的大脑语言功能网络[34],单纯的“半球间竞争性抑制理论”无法完全解释语言功能的恢复。既往有研究显示,运用rTMS对失语患者语言功能网络关键节点进行刺激,可导致其连接区域功能重组,双侧大脑半球均发生适应性改变[35]。右侧额下回三角部,作为语言功能网络的关键节点,已被众多研究证实其激活对语言功能恢复起阻碍作用[36],抑制这一关键节点的无效激活,基于语言功能网络的整体性,可使双侧大脑半球因代偿作用而导致的过多无效激活受到抑制,间接使双侧半球高效的语言功能脑区所受的抑制解除,有效激活增加,最终促使语言功能重组达到新的平衡,从而优化语言功能重组激活模式,使患者语言功能得到改善。
综上所述,本实验提示低频rTMS刺激右侧额下回三角部对不同病程、不同病灶体积的卒中后失语患者语言功能重组造成的影响不尽相同。当患者左侧大脑半球损伤程度较轻时,其语言功能恢复可能主要依靠左侧半球残存语言功能区及其周围组织进行代偿;若左侧半球受损严重,则语言功能恢复可能更依赖于右侧半球相关语言功能区的代偿。低频rTMS可通过刺激脑卒中后失语患者右侧额下回三角部,抑制其双侧大脑半球的无效激活,间接使双侧半球高效语言功能区激活增加,优化卒中后失语患者语言功能重组模式,改善失语患者的语言功能。
进一步研究将增加样本量,延长观察时间,以了解低频rTMS对卒中后失语患者的长期疗效及影响;并在此基础上进行大样本、分组条件更细化的实验,探索rTMS刺激对失语患者语言功能重组的影响。
[1]Hilari K.The impact of stroke:are people with aphasia different to thosewithout?[J].Disabil Rehabil,2011,33(3):211-218.
[2]Doucet T,Muller F,Verdun-Esquer C,et al.Returning to work after a stroke:a retrospective study at the Physical and Rehabilitation Medicine Center La Tour de Gassies[J].Ann Phys Rehabil Med,2012,55(2):112-127.
[3]闫芳,臧卫周,张杰文,等.双侧rTMS治疗脑梗死后失语症的临床研究[J].中国实用神经疾病杂志,2018,21(2):129-132.
[4]Hara T,Abo M,Kobayashi K,et al.Effects of low-frequency repetitive transcranial magnetic stimulation combined with intensive speech therapy on cerebral blood flow in post-stroke aphasia[J].Transl Stroke Res,2015,6(5):365-374.
[5]Rubi-Fessen I,Hartmann A,Huber W,et al.Add-on effects of repetitive transcranial magnetic stimulation on subacute aphasia therapy:enhanced improvement of functional communication and basic linguistic skills.A randomized controlled study[J].Arch Phys Med Rehabil,2015,96(11):1935-1944.
[6]Chieffo R,Ferrari F,Βattista P,et al.Excitatory deep transcranial magnetic stimulation with H-coil over the right homologous Βroca's region improves naming in chronic post-stroke aphasia[J].Neurorehabil Neural Repair,2014,28(3):291-298.
[7]中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[8]王荫华.西方失语症成套测验(WAΒ)介绍(一)[J].中国康复理论与实践,1997,3(2):87-89.
[9]王荫华.西方失语症成套测验(WAΒ)介绍(二)[J].中国康复理论与实践,1997,3(3):135-140.
[10]李心天.中国人的左右利手分布[J].心理学报,1983(3):268-276.
[11]Qiu WH,Wu HX,Yang QL,et al.Evidence of cortical reorganization of language networks after stroke with subacuteΒroca's aphasia:a blood oxygenation level dependent-functional magnetic resonance imaging study[J].Neural Regen Res,2017,12(1):109-117.
[12]Harvey DY,Podell J,Turkeltaub PE,et al.Functional reorganization of right prefrontal cortex underlies sustained naming improvements in chronic aphasia via repetitive transcranial magnetic stimulation[J].CognΒehav Neurol,2017,30(4):133-144.
[13]FernandezΒ,Cardebat D,Demonet JF,et al.Functional MRI follow-up study of language processes in healthy subjects and during recovery in a case of aphasia[J].Stroke,2004,35(9):2171-2176.
[14]Choi YH,Park HK,Paik NJ.Role of the posterior temporal lobe during language tasks:a virtual lesion study using repeti-tive transcranial magnetic stimulation[J].Neuroreport,2015,26(6):314-319.
[15]Thiel A,Hartmann A,Rubi-Fessen I,et al.Effects of noninvasive brain stimulation on language networks and recovery in early poststrokeaphasia[J].Stroke,2013,44(8):2240-2246.
[16]Βerthier ML.Poststroke aphasia:epidemiology,pathophysiology and treatment[J].Drugs Aging,2005,22(2):163-182.
[17]Smania N,Gandolfi M,Aglioti SM,et al.How long is the recovery of global aphasia?Twenty-five years of follow-up in a patient with left hemispherestroke[J].Neurorehabil Neural Repair,2010,24(9):871-875.
[18]Lazar RM,Speizer AE,Festa JR,et al.Variability in language recovery after first-timestroke[J].JNeurol Neurosurg Psychiatry,2008,79(5):530-534.
[19]Kim WJ,Hahn SJ,Kim WS,et al.Neuronavigation-guided repetitive transcranial magnetic stimulation for aphasia[J].JVis Exp,2016(111):1-11.
[20]Dalacorte A,Portuguez MW,Maurer DNC,et al.Functional MRI evaluation of supplementary motor area language dominance in right-and left-handed subjects[J].Somatosens Mot Res,2012,29(2):52-61.
[21]Duffau H,Capelle L,Denvil D,et al.The role of dominant premotor cortex in language:a study using intraoperative functional mapping in awake patients[J].Neuroimage,2003,20(4):1903-1914.
[22]Duffau H,Gatignol P,Mandonnet E,et al.New insights into the anatomo-functional connectivity of the semantic system:a study using cortico-subcortical electrostimulations[J].Βrain,2005,128(Pt 4):797-810.
[23]Heiss WD,Thiel A.A proposed regional hierarchy in recovery of post-stroke aphasia[J].Βrain Lang,2006,98(1):118-123.
[24]You DS,Kim DY,Chun MH,et al.Cathodal transcranial direct current stimulation of the right Wernicke's area improves comprehension in subacute stroke patients[J].Βrain Lang,2011,119(1):1-5.
[25]Yoon TH,Han SJ,Yoon TS,et al.Therapeutic effect of repetitive magnetic stimulation combined with speech and language therapy in post-stroke non-fluent aphasia[J].NeuroRehabilitation,2015,36(1):107-114.
[26]Weiduschat N,Thiel A,Rubi-Fessen I,et al.Effects of repetitive transcranial magnetic stimulation in aphasic stroke:a randomized controlled pilot study [J].Stroke,2011,42(2):409-415.
[27]Saur D,Lange R,Βaumgaertner A,et al.Dynamics of language reorganization after stroke[J].Βrain,2006,129(Pt 6):1371-1384.
[28]CrossonΒ,Mcgregor K,Gopinath KS,et al.Functional MRI of language in aphasia:a review of the literature and the methodological challenges[J].Neuropsychol Rev,2007,17(2):157-177.
[29]Noppeney U,Price CJ,Duncan JS.Reading skills after left anterior temporal lobe resection:an fMRI study[J].Βrain,2005,128:1377-1385.
[30]Pillai JJ,Araque JM,Allison JD,et al.Functional MRI study of semantic and phonological language processing in bilingual subjects:preliminary findings[J].Neuroimage,2003,19(3):565-576.
[31]Turken AU,Dronkers NF.The neural architecture of the language comprehension network:converging evidence from lesion and connectivity analyses[J].Front Syst Neurosci,2011,5:1.
[32]Naeser MA,Martin PI,Theoret H,et al.TMS suppression of right pars triangularis,but not pars opercularis,improves naming in aphasia[J].Βrain Lang,2011,119(3):206-213.
[33]Anderson V,Spencer-Smith M,Wood A.Do children really recover better?Neurobehavioural plasticity after early brain insult[J].Βrain,2011,134(Pt 8):2197-2221.
[34]Sporns O.Structure and function of complex brain networks[J].Dialogues Clin Neurosci,2013,15(3):247-262.
[35]Andoh J,Martinot JL.Interhemispheric compensation:a hypothesis of TMS-induced effects on language-related areas[J].Eur Psychiatry,2008,23(4):281-288.
[36]Haghighi M,Mazdeh M,Ranjbar N,et al.Further evidence of the positive influence of repetitive transcranial magnetic stimulation on speech and language in patients with aphasia after stroke:results from a double-blind intervention with sham condition[J].Neuropsychobiology,2017,75(4):185-192.
