镜像疗法在脑卒中偏瘫患者运动康复中的研究进展
2018-06-22陈英伦白玉龙
陈英伦,白玉龙
复旦大学附属华山医院康复医学科,上海市200040
1 镜像疗法的背景、治疗方法及应用
脑卒中为脑血液循环障碍引起的全面性或局限性脑功能缺损综合征,是成年人残疾的主要原因。脑卒中引起的上肢和手运动障碍严重影响患者生活质量[1]。早期药物、手术治疗均可降低脑卒中死亡率,但致残率仍较高,仅5%~20%脑卒中后轻瘫患者能完全恢复上肢运动功能,约74.6%的患者后期存在语言、运动、认知等功能障碍[2]。
镜像疗法,也称镜像视觉反馈(mirror visual feedback,MVF)疗法,于1995年首次提出,最先应用于截肢后幻肢痛[3]。Moseley等[4]将镜像疗法用于复杂区域性疼痛综合征(complex regional pain syndrome,CRPS)的治疗,初步证实镜像疗法能在一定程度上减轻其引起的疼痛。
1999年Altschuler等[5]首次报道镜像疗法应用于脑卒中后期上肢功能康复治疗,可改善患侧肢体关节运动范围、速度、准确度。之后研究发现,观察并模仿他人运动可刺激支配相同动作的脑区,加速大脑对相应运动的理解学习[6],有文献论述这种现象很可能和镜像神经元系统密切相关[7]。随着“感觉再传入(re-afference)”概念被提出,即肌肉主动屈伸产生运动信号后诱发传入性感觉信号,形成传出-传入通路环;若通路被破坏可造成“习得性废用”(learned non-use),研究发现镜像疗法可恢复破坏的通路,这成为经视觉传递信息的镜像疗法治疗运动功能障碍的理论依据[8]。
镜像疗法最基本的形式,是采用镜盒或镜面矢状位立于受试者前,利用平面镜成像原理,受试者只被允许通过镜子观察一侧上肢运动,而对侧上肢被镜面遮挡不能被直接看到,大多数情况下镜子遮挡的肢体为保持静止的患肢。这种形式可“欺骗”大脑使之误以为双手在做对称运动,继而改变受损肢体对应脑区的活动、运动信号输出[9]、疼痛处理能力[10]等。设备从开始的平面镜、放大镜,发展到虚拟现实反馈装置,呈现数字化程序设计的形式。此疗法有效激活运动同侧初级运动皮质(primary motor cortex,M1)等脑皮质[11-12],越来越多地用于脑卒中后运动功能障碍患者的康复。
2 镜像疗法影响脑卒中患者运动功能的可能机制
镜像疗法结合视觉和躯体运动感觉刺激。经镜面成像的视觉信息和肢体运动的本体感觉信息整合后,激活解剖、功能完整的通路并将信号传至大脑感觉、运动相关的脑区,诱发MVF[13],引起运动能力改变。通过镜面成像,运动手反射像变成另一只手(静止)的视觉反馈像,让大脑神经元产生微小放电,后随训练逐渐加强,形成稳定、不可逆的神经放电活动。经颅磁刺激(transcranial magnetic stimulation,TMS)、功能磁共振成像(functional magnetic resonance imaging,f MRI)、脑磁图(magnetoencephalogram,MEG)、脑电图(electroencephalogram,EEG)、肌电图(electromyography,EMG)、正电子发射型断层仪(positron emission tomography,PET)等评价方法可评定受试者皮质激活区、肌肉活动,发现相对于对照组(无镜像),健康者单侧治疗或双侧非对称训练会激活顶上叶(双侧楔前叶)、运动肢体对侧顶后叶上部、后外侧沟、中央后沟、颞上回、舌回、枕上回、枕中回、梭状回等;脑卒中患者的中央前回(M1)、中央后回(S1)、楔前叶、后扣带回、辅助运动区、运动前回被激活[8,14]。此外,2012年有人曾用TMS和EMG研究健康人MVF,发现双侧半球M1相对于其他区域明显被激活,未见短期皮质内抑制(short intracortical inhibition,SICI)、半球间抑制(interhemispheric inhibition,IHI)差异,即半球内、半球间抑制功能未产生变化,但未研究此疗法对脑卒中患者的作用[15]。上述研究表明,镜像疗法产生的改变和实验设计有关,大脑兴奋性变化需要一定时间显现,具体与哪些脑区有关仍待研究;复杂的神经联系不仅使运动调节、控制多样化,也使寻找脑卒中后运动恢复的方法变得更加困难。
根据皮质激活区域,研究者猜测3条可能的运动调节机制:①初级、次级视觉区和躯体感觉区激活(岛叶、背外侧前额叶皮质、后扣带回、楔前叶);②颞上回(superior temporal gyrus,STG)、运动前区(premotor cortex,PMC);③训练肢体同侧M1。三种机制可能并非孤立,而是互相整合。
2.1 镜像神经元系统(mirror neuron system,MNS)
MNS是包含支配感觉、运动神经的网络。镜像神经元连接视觉处理的感觉神经元和动作信号传递的运动神经元,在观察和执行运动时激活[16]。脑-机接口技术重建运动功能所产生的电信号中,μ波抑制可证明镜像神经元的存在[17]。
实验证明,MNS位于枕叶、颞叶、顶叶视觉相关区域和两侧额顶运动区(顶下回喙部、中央前回和额下回后部[18])的边缘镜像系统和额顶镜像系统[6]。推测成人镜像神经元能被有效激活的解剖生理优势在于[19]:①除了孤独症患者,健康人和多数患者MNS结构完整;②MNS与多个脑区间具有神经解剖联系,主要影响运动系统;③MNS激活无需依赖于手术植入或庞大治疗设备;④听觉和视觉均能激活MNS;⑤MNS激活后可编码生理信号改变脑区功能。由于成年人大脑MNS仍具有可塑性[20],部分文献报道镜像神经元可能和大脑功能重塑有关。
有研究称MNS在观察镜像、学习和模仿动作过程中起到巨大作用[21]。若在患侧手的位置观察到健侧手运动的反射镜像,脑卒中患者患侧手运动功能将提高,由此猜测可能激活了包含MNS的大脑区域[22]。图1[6]展示MNS皮质区域的相互联系。颞上沟(superior temporal sulcus,STS)接收视觉信息后进行处理,形成视觉性描述信号,经反向通路传递至更高一级额顶叶MNS,编码形成特定运动模式,后正向传入STS将其与实际看到的影像对比并输出。当健康受试者模仿简单或熟悉的运动时,此通路明显激活;若模仿做不熟悉的运动时,可另外见额中回、背侧PMC、顶上回、尾额激活[23]。此模型可证实镜像疗法后见到运动同侧M1、STS、枕上回激活,说明MNS也部分参与视觉和运动结合的模仿动作[24]。
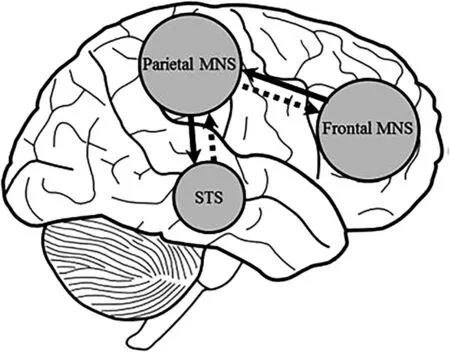
图1 MNS皮质区域的相互联系
研究同时关注镜像神经元可塑性,推测MNS活化使损伤脑区残存神经元功能部分恢复,引起神经元重建运动联系,甚至受损轴索芽生[25];同时激活的运动皮质为了维持康复阶段神经系统稳定,可能会产生脊髓抑制,在观察他人运动的同时阻碍肢体运动[26]。这种现象曾在处于持续脊髓受损的灵长类动物的神经元研究中发现[27]。
但也有人认为,镜像疗法和MNS关系并不密切。如Michielsen等[28]记录脑卒中患者双上肢运动时的fMRI发现,楔前叶和后扣带回产生激活信号,表明视错觉激活自我意识和空间意识密切相关的区域,影响患肢对侧大脑意识水平并降低患肢废用程度,但未发现MNS相关脑区的兴奋性改变。结果存在差异的可能原因在于难以明确区分不同解剖区的边界,同时常规功能成像设备难以检测到微小的皮质活性变化,因此镜像对初级皮质、躯体感觉区域作用的结论不一致[29]。对于不同实验,评价方法不同,观察到的激活区也存在差异,因此需要更多治疗形式统一、参数一致的实验结果来论证。
2.2 视觉反馈-运动观察机制
感觉-运动整合能力,是指中枢神经系统整合外界不同来源的感觉并产生相应运动的能力。运动表现、获知运动过程中的错误需要视觉反馈调控信号[30]。当视觉和感觉信息无法对应或发生冲突,大脑产生跨二者模式的感知幻象[31],镜盒视觉幻象即为视觉-运动信息冲突的范例之一。
总体上分析,镜像疗法可提高运动学习能力,被视为“增强视觉反馈[32]”,有研究指出它比“标准视觉反馈”(即直接注视执行任务的手)更能提高单手运动时双侧肢体活动水平,促使跨肢体运动转移效应(cross-limb transfer,CLT)于皮质水平发生,此效应或许基于左右M1半球间的神经联系[33]。2009年Ramachandran等[21]认为,当脑卒中受试者观察镜面反射单手运动像时,视觉信息进入皮质,经过复杂处理,兴奋皮质感觉-运动区域;虽然受试者不是直接观察一侧运动,但与之相关的大脑运动区仍会被激活。无论单手或双手运动,只要有视觉参与均可调节双侧M1兴奋性,与皮质、皮质下视觉、本体感觉整合[33]。Celnik等[34]论证了运动观察结合运动训练的效果优于仅进行运动训练,推测传入信息从腹侧PMC(观察)、辅助运动区和背侧PMC(执行)输出至M1后引起功能改变。而Reissig等[35]设计单侧弹指任务发现,视觉反馈组未训练侧手活动能力无显著提高,认为视觉反馈既非准确完成运动的前提,亦非提高运动能力的必要条件,但受试者人数较少、任务复杂性难以比较等因素可能影响结论。
脑卒中患者进行单手运动镜像疗法前,损伤半球对侧的运动皮质会抑制损伤侧半球支配的运动[36]。Rossiter等[37]采用两组均设计成双手运动的模式,一组直视运动受影响的手,另一组遮盖未受影响手并观察其对侧镜中像的方法,得出通过镜像疗法双手运动时,脑卒中患者大脑半球间抑制趋于平衡。这说明镜像疗法能重新调整卒中后半球间兴奋-抑制不平衡的现象,使之趋于正常人半球间功能的平衡状态。
有学者研究大脑病理生理学与视觉反馈相关脑区,得出镜面反馈组可引起偏侧优势的半球激活,而直接观察组未发现相关区域激活[38]。通过镜子观察一侧手运动,运动同侧M1激活同时运动对侧肌肉的运动诱发电位(motor evoked potentials,MEPs)、主动运动阈值(active motor threshold,aMT)提高[14];镜面观察可引起皮质脊髓通路兴奋性短期内变化,长期影响运动皮质功能[39]。功能完整的上肢行镜像疗法后的脑卒中患者神经影像学显示,楔前叶和后扣带回皮质区激活[28],这两个区域包含处理多种感觉联系、自我意识和空间注意力有关的神经元,其中γ-氨基丁酸(γ-aminobutyric acid,GAΒA)能抑制性神经环路介导皮质内抑制,谷氨酰胺能神经纤维束多存在于皮质间的联系,镜像疗法使半球抑制活性降低,有利于未训练手学习运动,激活相应皮质神经元可塑性[40]。
2.3 运动通路易化机制
脑卒中患者两侧半球间运动皮质受损,皮质间易化和抑制出现不平衡。研究显示,脑卒中轻瘫、偏瘫患者健侧M1抑制损伤侧对应的皮质,抑制水平将影响预后和恢复;脑卒中患者进行单侧肢体自主运动能易化对侧皮质区兴奋,同时提高同侧半球皮质脊髓通路兴奋性,进而驱动双侧肢体运动能力改变[41]。当半球间兴奋-抑制通路平衡后,有助于恢复损伤侧半球的功能[42];对称运动能激活双侧皮质,减轻皮质间抑制,有助于双侧信息传递。
2.4 经胼胝体连接、抑制通路
胼胝体含大量连接双侧半球的感觉运动易化和抑制通路,因此胼胝体假说被引入。胼胝体机制即优势半球对应肢体(常为右侧肢体)运动后损伤,运动同侧半球通过胼胝体连接通路提高运动对侧肢体运动性。Chieffo等[43]提出,当胼胝体抑制能力减弱,患侧肢体的自主运动可引起健侧肢体对应肌群的非自主运动,这种现象被称为“镜面运动”(mirror movement)。镜像疗法减弱胼胝体抑制作用,增强病灶侧运动皮质的活性,有利于所支配患肢的功能恢复。Matthys等[24]发现,健康者单侧运动激活的M1与经胼胝体纤维传导有联系,而Nojima等[15]收集的两例胼胝体损伤者数据表明,患者运动能力均有提高,说明胼胝体机制可能未在学习运动方面起到主要作用。此机制仍有待更深入的研究。
3 镜像疗法对脑卒中患者运动功能的影响
对于肢体仍保留一定运动功能的患者,可优先选择肢体运动训练,例如重复性主动运动训练、限制健侧肢体运动训练,近年来机器人也被用于康复治疗;而对于偏瘫后丧失肢体运动能力的患者,常选用基于神经细胞可塑性的运动皮质或脊髓直接刺激的方式,如脑深部刺激(deep brain stimulation,DΒS)或经颅电刺激[44](intracranial electrical stimulation),但设备操作较繁琐、价格高昂,需要治疗师一对一治疗,限制了装置的广泛应用,因此基于视觉刺激的镜像疗法逐渐进入康复领域。
1999年首次使用镜像疗法治疗脑卒中轻瘫、偏瘫,以Fugl-Meyer评定量表(Fugl-Meyer assessment,FMA)、运动评估量表(Motor Assessment Scale,MAS)、Βarthel指数(Βarthel index,ΒI)、徒手肌力测试(Manual Muscle Test,MMT)和改良Ashworth痉挛评定量表等临床评估量表评价脑卒中患者运动能力和日常生活活动能力,对比治疗前后变化,以TMS、fMRI等检测其神经生理和功能改变。研究发现[45],镜像疗法可恢复脑卒中后轻瘫、偏瘫患者部分肌力和肢体活动能力,改善感觉缺失,但不能缓解痉挛状态。实验显示,镜像疗法能加快脑卒中患者运动的恢复,单侧运动镜像疗法后患肢运动恢复程度(61%),比无镜像疗法的程度(31%)好[40],并提出适用于丧失或仅存很少手功能的脑卒中患者[46]。虽然有研究认为,脑卒中患者进行健侧肢体的单侧运动可能对受损半球功能重建有害,建议采取限制健侧运动的模式进而提高运动能力[47],但此结论少有其他实验支持,同时可能不适用于通过重复训练而获得运动技能的情况。利用大脑功能完整并且正常的半球弥补受损半球功能上缺失的方式具有可行性,因此镜像疗法对治疗脑卒中引起的偏瘫具有极大价值。
大量临床实验证实,此疗法有利于患者偏瘫侧肢体运动康复,大部分患者可获益。最近Thieme[48]总结506例脑卒中患者经镜像疗法(实验组)和传统疗法(对照组)治疗后效果,得出镜像疗法确实比传统治疗在运动恢复上更有效,同时6个月后实验组生活能力较前明显改善。实验证明当一侧实际运动能力偏差,训练时间越长,镜像疗法效果越好。Yavuzer等[46]发现,经镜像疗法治疗的患者6个月后日常生活活动能力(activities of daily living,ADL)仍保持较高水平;但也有实验未得出相应结论[15]。有实验显示,训练结束最快4周后,运动能力便恢复到训练前水平,所以推测镜像产生的效应不能直接、快速改变M1等皮质活性,而需要长时间训练后相关神经元才会发生变化;大脑S1活性受镜像视觉直接调控,尤其对于大多数左脑为优势半球的、左半球卒中的患者[38],发现结束实验后S1活性逐渐降低,这和短期镜像疗法的结果相符。
在大量临床实验研究镜像疗法对患侧肢体的活动程度、关节活动范围、灵活性,重塑受损神经元的影响同时,有研究提出其他假设:单侧运动本身才是皮质兴奋性改变、SICI水平改变的主要原因,而非视觉反馈[49]。因此应更关注患者疾病本身因素及治疗因素变化对运动能力恢复的意义。
目前许多实验设计脑卒中患者参与镜像疗法的不同模式(表1)[28,50-57]。
3.1 镜像疗法与不同病程的脑卒中
大量实验受试者处于亚急性、慢性期阶段。2014年Samuelkamaleshkumar等[58]、2015年Park等[59]均发现,脑卒中后6个月的患者经短期镜像疗法比传统治疗后功能恢复更佳。2017年Xu等[60]证明,脑卒中后至少1个月的患者可受益。经4周镜像疗法的亚急性卒中患者运动能力评分显著提高,但肌张力未改变,且运动改变在6个月间逐渐消失[45]。右侧上肢轻瘫的亚急性患者经镜像疗法和传统康复,其ADL显著提高;但发现左侧肢体轻瘫的患者经镜像疗法后,左侧患肢功能改善的证据不足,此现象可能和大脑偏侧优势有关。虽然实验之间治疗时间、频率等存在差异,但总体上或许可证明镜像疗法能提高亚急性及慢性期患者肢体运动功能,但所需时间长。对于急性期患者,研究发现行镜像疗法6周后,瘫痪上肢远端的活动能力改善,同时皮肤敏感性提高[46];另一篇随机对照试验研究显示[61],急性期患者经2周单侧下肢镜像疗法后下肢活动能力提高。基于目前数据,可认为急性期、亚急性期、慢性期脑卒中患者大多能得益于单侧镜像疗法。
目前尚没有研究专门比较脑卒中后不同的病程与镜像疗法运动恢复效果的关系,原因之一是脑卒中后慢性恢复期长短不一,大脑兴奋-抑制平衡在不同阶段各不相同,实验设计困难,变量众多;原因之二是脑卒中后恢复期时间难以划分出确定的时间长度,神经生理变化不明,难以科学地分组。影像学显示,处于脑卒中不同阶段的患者双侧半球被激活的区域存在差异,不同时期可能需要不同的治疗策略[62],但实验证明针对损伤半球重复有效的刺激仍然有效可行[63],因此目前重复性镜像疗法仍可作为脑卒中各阶段患者的治疗方法。
3.2 镜像疗法与上、下肢
上肢承担了人大部分工作,脑卒中偏瘫患者手功能减弱,明显影响生活质量。神经生理学发现,上肢肢体远端部分(如手指、手腕等)的肌肉主要受对侧半球控制[64],而近端肢体(如肩部关节、上臂等)及躯干肌肉的运动调控更依赖于双侧半球共同支配[65],因此研究更多关注脑卒中患者手指、手腕活动,恢复手、腕等功能具有良好前景。研究多采用手指外展-内收、弹指实验等训练患者未受影响的手功能,发现双侧手活动范围增加,运动速度、精确度提高,恢复一定的运动、感觉、日常生活能力,减少脑卒中后受支配区域疼痛感,但无法改善痉挛状态[31]。
Altschuler最先提出采用双上肢同时运动的镜像疗法模式,证实能提高患侧远端肢体功能[5]。现对于脑卒中患者进行双上肢镜像疗法有效性仍存在争论。患者本身存在肢体运动障碍,支持者表明不论做对称或非对称的双手运动,训练后都获得良好的运动调节能力,提高上肢间、一侧上肢内部协调效果,受损半球将接收到未损伤半球运动兴奋性提高产生的易化信号[66]。但Selles等[67]实验表明,镜像疗法联合双侧运动和仅进行双侧运动所产生的运动改变并无差异,猜测若患手也进行任务训练,可能造成镜像视觉(健手的运动)和动作信息(患手的运动)不协调,同时患手本体感觉的变化可能会干扰视觉信息输入和处理,提出或许双手训练更适合偏瘫或一侧易疲劳患者。同时镜像疗法联合神经肌肉电刺激也能提高患侧上肢运动功能,提高关节运动范围、手运动精确度[68]。
约80%脑卒中患者感觉下肢无力、足下垂,是因为脑卒中引起的神经核团、神经束的损伤会引起肌肉激活时间异常、肌张力升高、关节痉挛,干扰下肢自主运动[69]。目前对下肢轻瘫、偏瘫患者运动恢复的研究较少。实验用f MRI评价镜像疗法(治疗方案:2~5 h/d,每周5 d,共4周)后患者踝关节屈伸相关皮质激活,结果证明其踝关节独立性功能运动和运动恢复能力提高,但未见功能性步行分级(functional ambulation category,FAC)的差异[70]。Crosby等[50]设计3例脑卒中慢性期患者双下肢镜像疗法(即镜子前后的下肢均行尽可能对称的运动,30 min/d,每周3 d,共4周)后,发现步速提高、步态改善。
对于脑卒中患者的镜像疗法研究,存在若干限制性因素:①双侧协调运动,只能训练对称运动,难以做相互配合的、形式变化的运动;②不同实验设计不同治疗任务,研究之间不具有可比性,难以确定提升运动能力的最佳训练方式;③任务相对简单,恢复程度有限;④纳入人数少。

表1 脑卒中患者参与镜像疗法的不同模式
3.3 镜像疗法与左右手判断能力
有研究表明,镜像疗法效果可能与脑卒中患者实验前和实验中判断图像是左手或右手操作有关,即左/右手判断能力(left/right judgement)。Sirigu等[71]发现左/右手判断能力、图片想象能力与顶叶皮质活性有关,实验前给予受试者需要判断的图片,并记录识别出正确结果的时长,认为运动能力受左/右手辨别能力影响。Moseley等[72]表示在实验前判断左右手能明显提高脑卒中慢性期患者运动恢复。但也有实验未得出有意义结论[73]。
3.4 镜像疗法联合传统疗法、电刺激
脑卒中后偏瘫的治疗有多种方法,如被动运动患侧肢体等。目前多采用单一镜像疗法、镜像疗法联合经颅直流电刺激(transcranial direct current stimulation,tDCS)或传统治疗,联合治疗效果更显著,但没有与单一镜像疗法的结果对比,因此不清楚联合疗法是否会缩短治疗时间、改变大脑神经元可塑性。
2014年Lin等[74]首次将镜像疗法和躯体感觉刺激结合,结果表明结合疗法比单用镜像疗法更能提高患侧偏瘫肢体的活动能力和灵活性,但未提及机制。而后利用tDCS结合镜像疗法研究双侧大脑M1活性的变化,证明此方法能增强皮质兴奋性,明显提高功能康复的可能性,且不同强度的tDCS对半球效应不同。镜像疗法配合生物反馈功能性电刺激也能改善脑卒中后上肢运动功能和ADL。因此镜像疗法联合电刺激治疗有可能更大程度上恢复患侧运动功能。
镜像疗法联合传统康复训练、任务导向性训练也有利于患者运动、灵敏度的恢复,可有效提高轻度偏瘫肢体的运动能力,6周后ADL仍未减退[75]。由于镜像疗法能提高患者偏瘫肢体肌力、改善运动功能,但难以缓解肌痉挛,镜像疗法联合其他治疗方法可针对患者肌肉功能多方面不足来治疗。
3.5 创新镜像治疗与运动康复
仅少量研究涉及新形式的镜像疗法。例如把单侧运动影像转接到受试者面前的屏幕上播放,患肢放于屏幕下方模仿,结果显示3例受试者中有2例相应皮质激活,证明重建手代表区的神经联系[76]。电脑特效、虚拟现实技术[77]也可模拟肢体动作。有研究应用延迟视觉反馈技术,即单手训练同时利用电脑等设备延迟播放训练手的动作,这对促进双手协调有一定作用。但由于技术水平、影像分辨率存在差异,受试者可能无法认同其为真实手的运动。
2016年有学者提出机器人镜像疗法治疗偏瘫肢体,实验证明可提高慢性偏瘫患者FMA评分和肢体屈伸能力[78],拥有广阔的前景。
4 总结
镜像疗法从20世纪末提出,发展至今已被成功应用于脑卒中偏瘫、疼痛及其他感觉运动功能障碍患者的治疗,其设备范式不断改进,治疗效果被大量临床实验证实,但其神经机制仍在探索中。镜像疗法激活了控制注意力和运动调节的广泛大脑神经网络,内在神经联系互相影响,多种假说被提出,同时指导其运用于临床。镜像疗法对脑卒中患者运动功能具有积极影响,是促进运动功能恢复的重要手段之一。尽管未来需要更多实验发掘镜像疗法在神经康复领域的潜能,毫无疑问,镜像疗法拥有稳定的运动系统调节能力,可有效激活大脑运动相关区域,促进偏瘫侧运动能力提升。
[1]National Institutes of Neurological Disorders and Stroke.NINDS Final Report of the Stroke Progress Review Group[DΒ/OL].(2011-09-12).http://www.ninds.nih.gov/find_people/groups/stroke_prg/01-2012-stroke-prgreport.htm.
[2]Kawakami K,Miyasaka H,Nonoyama S,et al.Randomized controlled comparative study on effect of training to improvelower limb motor paralysis in convalescent patients with post-strokehemiplegia[J].J Phys Ther Sci,2015,27(9):2947-2950.
[3]Ramachandran VS,Rogers-Ramachandran D,Cobb S.Touching the phantom limb[J].Nature,1995,377(6549):489-490.
[4]Moseley GL,Parsons TJ,Spence C.Visual distortion of a limb modulates the pain and swelling evoked by movement[J].Curr Βiol,2008,18(22):1047-1048.
[5]Altschuler EL,Wisdom SΒ,Stone L,et al.Rehabilitation of hemiparesis after stroke with a mirror[J].Lancet,1999,353(9169):2035-2036.
[6]Zult T,Howatson G,Kádár EE,et al.Role of the mirror-neuron system in cross-education[J].Sports Med,2014,44(2):159-178.
[7]Rosén Β,Lundborg G.Training with a mirror in rehabilitation of the hand[J].Scand JPlast Reconstr Surg Hand Surg,2005,39(2):104-108.
[8]Deconinck Frederik JA,Smorenburg Ana RP,Βenham A,et al.Reflections on mirror therapy:a systematic review of the effect of mirror visual feedback on the brain[J].Neurorehabil Neural Repair,2015,29(4):349-361.
[9]Altschuler EL.Interaction of vision and movement via a mirror[J].Perception,2005,34(9):1153-1155.
[10]Longo MR,Βetti V,Aglioti SM,et al.Visually induced analgesia:seeing the body reduces pain[J].J Neurosci,2009,29(39):12125-12130.
[11]Saleh S,Adamovich SV,Tunik E.Mirrored feedback in chronic stroke:recruitment and effective connectivity of ipsilesional sensorimotor networks[J].Neurorehabil Neural Repair,2014,28(4):344-354.
[12]Funase K,Tabira T,Higashi T,et al.Increased corticospinal excitability during direct observation of self-movement and indirect observation with a mirror box[J].Neurosci Lett,2007,419(2):108-112.
[13]Lee D,Lee M,Lee K,et al.A symmetric training using virtual reality reflection equipment and the enhancement of upper limb function in stroke patients:a randomized controlled trial[J].JStroke Cerebrovasc Dis,2014,23(6):1319-1326.
[14]Michielsen ME,Selles RW,Geest JNVD,et al.Motor recovery and cortical reorganization after mirror therapy in chronic stroke patients:a phase II randomized controlled trial[J].Neurorehabil Neural Repair,2011,25(3):223-233.
[15]Nojima I,Mima T,Koganemaru S,et al.Human motor plasticity induced by mirror visual feedback[J].JNeurosci,2012,32(4):1293-1300.
[16]Cook R,Βird G,Catmur C,et al.Mirror neurons:from origin to function[J].ΒehavΒrain Sci,2014,37(2):177-192.
[17]Holper L,Wolf M.Motor imagery in response to fake feedback measured by functional near-infrared spectroscopy[J].Neuroimage,2010,50(1):190-197.
[18]Iacoboni M.Neural mechanisms of imitation[J].Curr Opin Neurobiol,2005,15(6):632-637.
[19]Yuan TF,Chen W,Shan CL,et al.Activity-dependent neurore-habilitation beyond physical trainings:"Mental Exercise"through mirror neuron activation[J].CNSNeurol Disord Drug Targets,2015,14(10):1267-1271.
[20]Catmur C,Walsh V,Heyes C.Sensorimotor learning configures the human mirror system[J].CurrΒiol,2007,17(17):1527-1531.
[21]Ramachandran VS,Altschuler EL.The use of visual feedback,in particular mirror visual feedback,in restoring brain function[J].Βrain,2009,132(Pt 7):1693-1710.
[22]Hortobágyi T,Richardson SP,Lomarev M,et al.Interhemispheric plasticity in humans[J].Med Sci Sports Exerc,2011,43(7):1188-1199.
[23]Βuccino G,Vogt S,Ritzl A,et al.Neural circuits underlying imitation learning of hand actions:an event-related f MRI study[J].Neuron,2004,42(2):323-334.
[24]Matthys K,Smits M,Van der Geest JN,et al.Mirror-induced visual illusion of hand movements:a functional magnetic resonance imaging study[J].Arch Phys Med Rehabil,2009,90(4):675-681.
[25]Numata K,Murayama T,Takasugi J,et al.Mirror observation of finger action enhances activity in anterior intraparietal sulcus:a functional magnetic resonance imaging study[J].J Jpn Phys Ther Assoc,2013,16(1):1-6.
[26]Βaldissera F,Cavallari P,Craighero L,et al.Modulation of spinal excitability during observation of hand actions in human[J].Eur JNeurosci,2001,13(1):190-194.
[27]Nishimura Y,Onoe H,Morichika Y,et al.Time-dependent central compensatory mechanisms of finger dexterity after spinal cord injury[J].Science,2007,318(5853):1150-1155.
[28]Michielsen ME,Smits M,Ribbers GM,et al.The neuronal correlates of mirror therapy:an fMRI study on mirror induced visual illusions in patients with stroke[J].J Neurol Neurosurg Psychiatry,2011,82(4):393-398.
[29]Diers M,Christmann C,Koeppe C,et al.Mirrored,imagined and executed movements differentially activate sensorimotor cortex in amputees with and without phantom limb pain[J].Pain,2010,149(2):296-304.
[30]McCabe CS,Βlake DR.Evidence for a mismatch between the brain's movement control system and sensory system as an explanation for some pain-related disorders[J].Curr Pain Headache Rep,2007,11(2):104-108.
[31]Senna I,Russo C,Parise CV,et al.Altered visual feedback modulates cortical excitability in a mirror-box-like paradigm[J].ExpΒrain Res,2015,233(6):1921-1929.
[32]Howatson G,Zult T,Farthing JP,et al.Mirror training to augment cross-education during resistance training:a hypothesis[J].Front Hum Neurosci,2013,7(30):396.
[33]Läppchen CH,Ringer T,Βlessin J,et al.Optical illusion alters M1 excitability after mirror therapy:a TMSstudy[J].JNeurophysiol,2012,108(10):2857-2861.
[34]Celnik P,Stefan K,Hummel F,et al.Encoding a motor memory in the older adult by action observation[J].Neuroimage,2006,29(2):677-684.
[35]Reissig P,Stöckel T,Garry MI,et al.Age-specific effects of mirror-muscle activity on cross-limb adaptations under mirror and non-mirror visual feedback conditions[J].Front Aging Neurosci,2015,7:222.
[36]Murase N,Duque J,Mazzocchio R,et al.Influence of interhemispheric interactions on motor function in chronic stroke[J].Ann Neurol,2004,55(3):400-409.
[37]Rossiter HE,Eaves C,Davis E,et al.Changes in the location of cortico-muscular coherence following stroke[J].Neuroimage Clin,2012,2(1):50-55.
[38]Fritzsch C,Wang J,Dos Santos LF,et al.Different effects of the mirror illusion on motor and somatosensory processing[J].Restor Neurol Neurosci,2014,32(2):269-280.
[39]Stefan K,Cohen LG,Duque J,et al.Formation of a motor memory by action observation[J].J Neurosci,2005,25(41):9339-9346.
[40]Zult T,Goodall S,Thomas K,et al.Mirror training augments the cross-education of strength and affects inhibitory paths[J].Med Sci Sports Exerc,2016,48(6):1001-1013.
[41]Perez MA,Cohen LG.Mechanisms underlying functional changes in the primary motor cortex ipsilateral to an active hand[J].JNeurosci,2008,28(22):5631-5640.
[42]Ruddy KL,Carson RG.Neural pathways mediating cross education of motor function[J].Front Hum Neurosci,2013,7:397.
[43]Chieffo R,Inuggi A,Straffi L,et al.Mapping early changes of cortical motor output after subcortical stroke:a transcranial magnetic stimulation study[J].Βrain Stimul,2013,6(3):322-329.
[44]Jax SA,Rosa-Leyra DL,Coslett HΒ.Enhancing the mirror illusion with transcranial direct current stimulation[J].Neuropsychologia,2015,71:46-51.
[45]Dohle C,Püllen J,Nakaten A,et al.Mirror therapy promotes recovery from severe hemiparesis:a randomized controlled trial[J].Neurorehabil Neural Repair,2009,23(3):209-217.
[46]Yavuzer G,Selles R,Sezer N,et al.Mirror therapy improves hand function in subacute stroke:a randomized controlled trial[J].Arch Phys Med Rehabil,2008,89(3):393-398.
[47]Taub E,Uswatte G,King DK,et al.A placebo-controlled trial of constraint-induced movement therapy for upper extremity after stroke[J].Stroke,2006,37(4):1045-1049.
[48]Thieme H,Mehrholz J,Pohl M,et al.Mirror therapy for improving motor function after stroke[J].Stroke,2013,44(1):e1-e2.
[49]Reissig P,Garry MI,Summers JJ,et al.Visual feedback-related changes in ipsilateral cortical excitability during unimanual movement:implications for mirror therapy[J].Neuropsychol Rehabil,2014,24(6):936-957.
[50]Crosby LD,Marrocco S,Βrown J,et al.A novel bilateral lower extremity mirror therapy intervention for individuals with stroke[J].Heliyon,2016,2(12):e00208.
[51]Βae SH,Jeong WS,Kim KY.Effects of mirror therapy on subacute stroke patients'brain waves and upper extremity functions[J].JPhys Ther Sci,2012,24(11):1119-1122.
[52]Βhasin A,Padma Srivastava M,Kumaran S,et al.Neural interface of mirror therapy in chronic stroke patients:a functional magnetic resonance imaging study[J].Neurol India,2013,60(6):570-576.
[53]Mirela CL,Matei D,IgnatΒ,et al.Mirror therapy enhances upper extremity motor recovery in stroke patients[J].Acta NeurolΒelg,2015,115(4):597-603.
[54]Amasyali SY,Yaliman A.Comparison of the effects of mirror therapy and electromyography-triggered neuromuscular stimulation on hand functions in stroke patients:a pilot study[J].Int JRehabil Res,2016,39(4):302-307.
[55]Arya KN,Pandian S.Effect of task-based mirror therapy on motor recovery of the upper extremity in chronic stroke patients:a pilot study[J].Top Stroke Rehabil,2013,20(3):210-217.
[56]Thieme H,Mehrholz J,Pohl M,et al.Mirror therapy for improving motor function after stroke[J].Cochrane Database Syst Rev,2012,44(1):1-2.
[57]Arya KN,Pandian S,Kumar D,et al.Task-based mirror therapy augmenting motor recovery in poststroke hemiparesis:a randomized controlled trial[J].JStroke Cerebrovasc Dis,2015,24(8):1738-1748.
[58]Samuelkamaleshkumar S,Reethajanetsureka S,Pauljebaraj P,et al.Mirror therapy enhances motor performance in the paretic upper limb after stroke:a pilot randomized controlled trial[J].Arch Phys Med Rehabil,2014,95(11):2000-2005.
[59]Park JY,Chang M,Kim KM,et al.The effect of mirror therapy on upper extremity function and activities of daily living in stroke patients[J].JPhysTher Sci,2015,27(6):1681-1683.
[60]Xu Q,Guo F,Salem HMA,et al.Effects of mirror therapy combined with neuromuscular electrical stimulation on motor recovery of lower limbs and walking ability of patients with stroke:a randomized controlled study[J].Clin Rehabil,2017,31(12):1583-1591.
[61]Mohan U,Βabu SK,Kumar KV,et al.Effectiveness of mirror therapy on lower extremity motor recovery,balance and mobility in patients with acute stroke:A randomized sham-controlled pilot trial[J].Ann Indian Acad Neurol,2013,16(4):634-639.
[62]Feydy A,Carlier R,Roby-Βrami A,et al.Longitudinal study of motor recovery after stroke:recruitment and focusing of brain activation[J].Stroke,2002,33(6):1610-1617.
[63]Page SJ,Gater DR,Βach-Y-Rita P.Reconsidering the motor recovery plateau in stroke rehabilitation[J].Arch Phys Med Rehabil,2004,85(8):1377-1381.
[64]Parsons LM,Gabrieli JD,Phelps EA,et al.Cerebrally lateralized mental representations of hand shape and movement[J].J Neurosci,1998,18(16):6539-6548.
[65]Βawa P,Hamm JD,Dhillon P,et al.Βilateral responses of upper limb muscles to transcranial magnetic stimulation in human subjects[J].ExpΒrain Res,2004,158(3):385-390.
[66]Cauraugh JH,Summers JJ.Neural plasticity and bilateral movements:a rehabilitation approach for chronic stroke[J].Prog Neurobiol,2005,75(5):309-320.
[67]Selles RW,Michielsen ME,Βussmann JΒ,et al.Effects of a mirror-induced visual illusion on a reaching task in stroke patients:implications for mirror therapy training[J].Neurorehabil Neural Repair,2014,28(7):652-659.
[68]Kojima K,Ikuno K,Morii Y,et al.Feasibility study of a combined treatment of electromyography-triggered neuromuscular stimulation and mirror therapy in stroke patients:a randomized crossover trial[J].Neuro Rehabilitation,2014,34(2):235-244.
[69]Arene N,Hidler J.Understanding motor impairment in the paretic lower limb after a stroke:a review of the literature[J].Top Stroke Rehabil,2009,16(5):346-356.
[70]Guo F,Xu Q,Abo Salem HM,et al.The neuronal correlates of mirror therapy:A functional magnetic resonance imaging study on mirror-induced visual illusions of ankle movements[J].Βrain Res,2016,1639:186-193.
[71]Sirigu A,Duhamel JR,Cohen L,et al.The mental representation of hand movements after parietal cortex damage[J].Science,1996,273:1564-1568.
[72]Moseley GL.Graded motor imagery is effective for long-standing complex regional pain syndrome:a randomised controlled trial[J].Pain,2004,108:192-198.
[73]Lundquist CΒ,Nielsen JF.Left/right judgement does not influence the effect of mirror therapy after stroke[J].Disabil Rehabil,2013,36(17):1452-1456.
[74]Lin KC,Huang PC,Chen YT,et al.Combining afferent stimulation and mirror therapy for rehabilitating motor function,motor control,ambulation,and daily functions after stroke[J].Neurorehabil Neural Repair,2014,28(2):153-162.
[75]de Almeida Oliveira R,Cintia Dos Santos Vieira P,Rodrigues Martinho Fernandes LF,et al.Mental practice and mirror therapy associated with conventional physical therapy training on the hemiparetic upper limb in poststroke rehabilitation:a preliminary study[J].Top Stroke Rehabil,2013,21(6):484-494.
[76]Giraux P,Sirigu A.Illusory movements of the paralyzed limb restore motor cortex activity[J].Neuroimage,2003,20(Suppl 1):S107-S111.
[77]Murray Craig D,Pettifer S,Howard T,et al.The treatment of phantom limb pain using immersive virtual reality:three case studies[J].Disabil Rehabil,2007,29(18):1465-1469.
[78]Hinder MR,Schmidt MW,Garry MI,et al.Absence of cross-limb transfer of performance gains following ballistic motor practice in older adults[J].JAppl Physiol,2011,110(1):166-175.
