秋茶光合作用与品质成分变化的分析
2018-06-21张兰魏吉鹏沈晨颜鹏张丽平李鑫韩文炎
张兰,魏吉鹏,2,沈晨,2,颜鹏,张丽平,李鑫*,韩文炎*
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
“春茶好,夏茶涩,秋茶好吃摘不得”。与春茶相比,夏秋茶芽叶中呈苦涩味的儿茶素、花青素等物质含量增多,氨基酸含量减少,使其苦涩味重、滋味鲜爽度差,严重影响茶叶品质和经济效益[1]。夏秋季光照充足、雨水充沛,茶鲜叶产量很高,但品质差、效益低在很大程度上降低了茶农的生产积极性,许多地方夏秋茶仅少量采摘或弃之不采,造成严重的资源浪费[2-3]。
茶叶品质的季节性变化及地区间的适制性差异反映了环境因素对品质的影响,如光、温度等因子不仅对茶树生育具有十分重要的作用[4-5],同时影响茶树多酚类、咖啡碱及茶氨酸等品质成分的合成与代谢[6]。遮荫覆盖作为目前生产上提高夏秋茶品质最有效的农艺措施[7],就是通过种植遮荫树或覆盖遮阳网等措施直接改变茶树冠层的光照、温度等环境因子,促进茶树生长,影响并调节茶树生理代谢和生化过程,最终降低茶多酚含量,提高氨基酸、咖啡碱含量,改善夏秋茶品质[8-11]。另外,适度遮荫在改善茶叶品质的同时能有效提高茶树的净光合速率,打破茶树光合“午休现象”[12-13]。光合作用为茶树碳、氮代谢提供碳源和能量[14-15],而糖作为碳源或信号分子可能参与类黄酮生物合成的代谢调控[6]。因此,环境因子光、温度及光合作用可能是影响夏、秋茶品质的关键因素。
目前关于夏秋季强光、高温等环境因素对茶品质成分影响的研究较少,本试验以自然生长的龙井43为材料,测定在日照强度、日平均温度显著不同的两时间里,秋茶冠层处光强、叶片温度、光合作用、主要品质成分含量及品质成分相关基因合成表达,从而初步明确光强、温度及光合作用与秋茶品质成分之间存在的联系,为茶叶生产者在改善夏秋茶品质方面提供理论依据。
1 材料与方法
1.1 试验材料与处理
试验在中国农业科学院茶叶研究所龙冠公司茶园中进行,采用适制绿茶品种龙井 43为材料。在茶园中选择受光均匀,无树木遮蔽的连续3行(长度为10 m)茶树作为试验区。分别于2016年8月19日、9月23日(都为晴天)6时至18时每3 h测定冠层处光强,并随机选取试验区12片茶树新完全展开叶(一般为第三叶)测定叶片温度及相关光合指标;6时至21时每3 h均匀地在试验区采集一芽二叶新梢样,用于测定茶主要品质成分含量和品质相关合成基因表达。
1.2 测定项目与方法
1.2.1 光合气体交换
利用 LI-COR 6400xt型便携式光合荧光测量系统在光照强度为 600 μmol·m-2·s-1、CO2浓度为 400 μmol·mol-1条件下测定茶树冠层处新展开叶片的净光合速率、胞间 CO2浓度、气孔导度及蒸腾速率,同时利用外部光强探头及叶室内叶温热电偶测定冠层处光强及叶片的温度。
1.2.2 茶多酚、游离氨基酸及咖啡碱含量测定
茶多酚含量测定参照GB/T 8313—2008。游离氨基酸、咖啡碱含量测定参照GB/T 8314—2013及GB/T 8312—2013有所改进。上清液浸提方法:准确称取1.0000 g茶粉末于50 mL锥形瓶中,加入超纯水 45 mL后转入沸水浴中,浸提45 min(每隔10 min摇动 1次)后立即趁热减压过滤,残渣用热超纯水洗涤4~5次。滤液冷却后转入 50 mL离心管中,用超纯水定容至刻度,摇匀。
游离氨基酸测定方法:吸取0.1 mL上清液于10 mL离心管中,分别加入50 μL 2%茚三酮、50 μL pH 8.0的磷酸缓冲液,沸水浴中加热15 min后在冰水中快速冷却,然后加入4.8 mL超纯水,摇匀后在570 nm波长下测定吸光值。茶咖啡碱含量测定:准确吸取 5 mL溶液至50 mL离心管中,分别加入4 mL 0.01 mol·L-1盐酸和2 mL 50%(w/v)的乙酸铅溶液,然后用超纯水定容至刻度,静置澄清过滤。准确吸取滤液25 mL至50 mL离心管中,加入0.1 mL 4.5 mol·L-1硫酸溶液,加水稀释至刻度,混匀,静置澄清过滤。滤液在274 nm处测定吸光值。
吸光值的测定使用SHIMADZU UV-2550分光光度计。
1.2.3 茶树总RNA提取及反转录
使用TIANGEN RNAprep pure Plant Kit(离心柱型)试剂盒,根据推荐步骤提取茶树叶片的总RNA。总RNA浓度及质量的测定使用NaNoDrop2000超微量分光光度计(中国香港,Gene Company Limited)。使用ReverTra Ace qPCR RT试剂盒(日本,TOYOBO)将提取的叶片总RNA根据推荐步骤进行反转录,合成cDNA模板。
1.2.4 基因表达
qRT-PCR(Quantitative real time-PCR,荧光实时定量PCR)使用StepOnePlus Real-Time PCR System仪器(美国,Applied Biosystems公司)进行。20 μL 反应体系中包括 10 μL SYBR Green Master Mix荧光染料(中国,Vazyme),浓度稀释为 10 μmol·L-1的正、反向引物各 0.4 μL,0.4 μL ROX,2 μL cDNA 模板及 6.8 μL灭菌超纯水。PCR采用两步法标准程序,反应条件:95℃预变性5 min;95℃变性 10 s,65℃延伸 40 s,扩增 40个循环。基因相对表达量计算参照Livak等方法[16]。
1.2.5 数据分析
采用Excel 2010进行数据整理,SAS 8.1及SPSS 21.0统计软件进行显著性差异及相关性分析,Primer Premier 5.0设计引物序列,Origin 7.5作图。
2 结果与分析
2.1 茶树冠层光强和叶片温度的变化
茶树冠层叶片处的光强及叶片温度直接受外界环境光强及空气温度的影响,也是直接影响茶树新梢生长发育的关键因素。从6时至18时,茶树冠层处光照强度和叶片温度均呈先升高后降低的趋势。8月19日及9月23日光照强度在正午 12时达到最大值,分别为1649.3、1467.7 μmol·m-2·s-1,随后迅速下降(图1-A)。两者的叶片温度在12时至15时内稳定维持当天最高值,分别约为42.8℃、34.2℃,前者最高温比后者高约 8.6℃(图 1-B)。通过图1可知,8月 19日冠层处光强与叶片温度显著高于9月23日同一时间点的冠层处光强和叶片温度。
2.2 茶树冠层功能叶片光合参数的变化
光合作用是碳代谢的重要部分,植物体内的糖、淀粉等碳水化合物和氨基酸、蛋白等含氮化合物都直接或间接地来源于光合作用。此外,植物体内的碳氮代谢还需要光合作用提供能量。测定8月19日及9月23日茶树新展开功能叶的净光合速率发现,前者净光合速率在6 时至 9 时最大,约为 10 μmol·m-2·s-1,其光合作用强度在12时显著降低,至18时净光合速率下降为 0.77 μmol·m-2·s-1;后者净光合速率变化呈现典型的“单峰型”,峰值在上午9时,约 13.37 μmol·m-2·s-1(图 2-A)。9 时至 18时前,后者光合作用强度显著高于前者。不同时间点茶树叶片的气孔导度如图 2-B所示,8月19日叶片气孔导度最大值在9时至12时,约 0.11 mol·m-2·s-1;9 月23 日6~12 时,气孔导度逐渐上升至最大值,约 0.17 mol·m-2·s-1。前者气孔导度在15时之前显著低于后者。图2-C为不同时间点茶树叶片的胞间 CO2浓度。8月19日叶片胞间CO2浓度在6时、9时、15时有最低值,12时和18时存在显著上升;9月23日其趋势变化较明显,在9时、15时存在胞间 CO2浓度的当天最低值,6时、18时其浓度相对较高。8月19日和9月23日的茶树叶片蒸腾速率在中午12时达到最大值,约为3.70 mmol·m-2·s-1,9 时、15 时前者蒸腾速率显著高于后者(图2-D)。
2.3 茶树一芽二叶品质成分的变化

图1 茶树冠层光强和叶片温度的变化Fig. 1 The changes of luminous intensity and leaf temperature of tea canopy
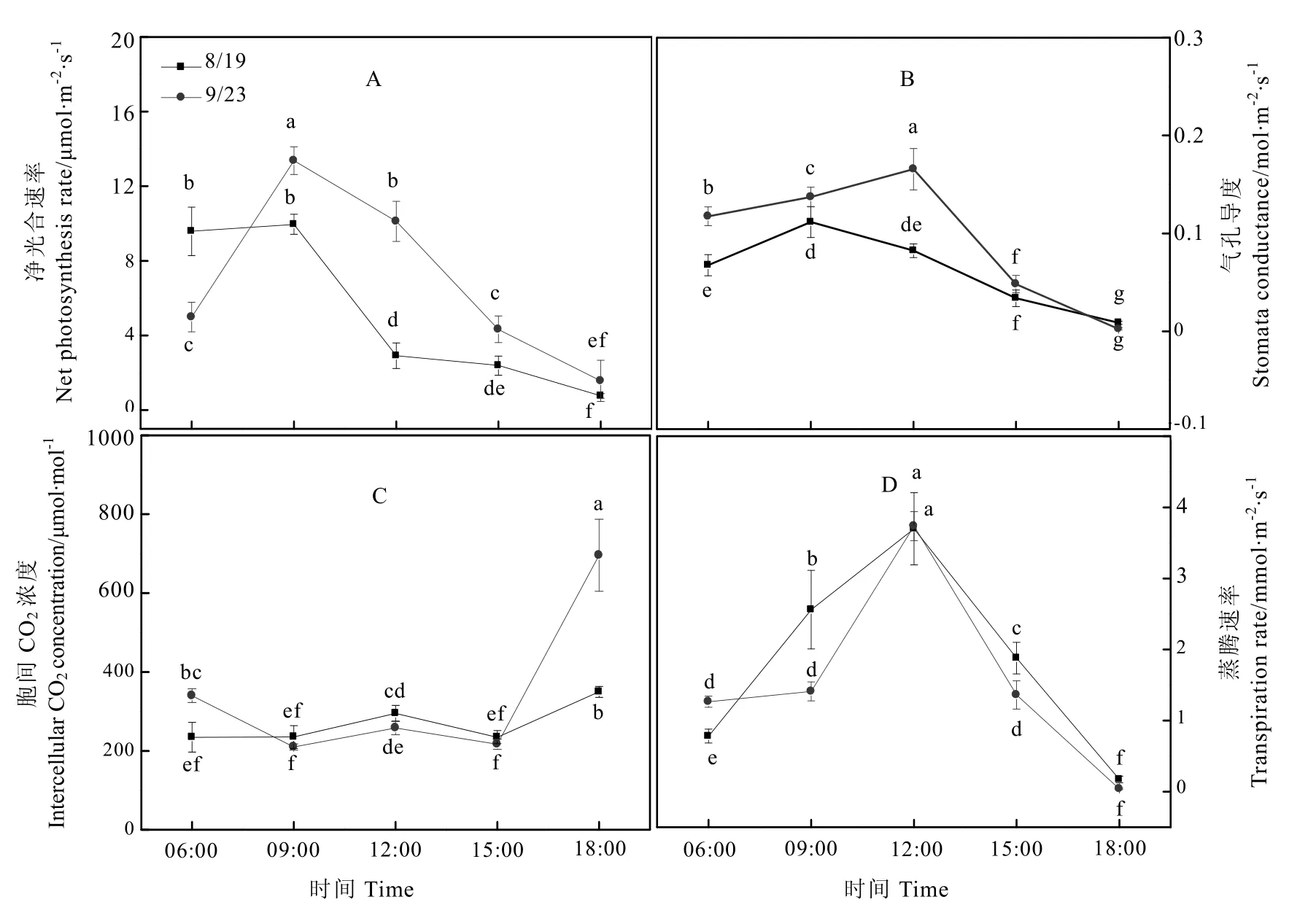
图2 茶树冠层功能叶片光合参数的变化Fig. 2 The changes of photosynthesis parameters of tea functional leaves
茶叶中的茶多酚、游离氨基酸、咖啡碱是影响茶叶品质的主要成分,三者的含量及比例直接影响茶叶的滋味品质[17]。由图3-A可知,8月19日6时至21时茶树一芽二叶中茶多酚含量在 15时达到最大值,约为 32.41%,21时下降至28.59%。9月23日茶多酚含量在9时、12最高,范围在14.94%~15.41%,21时含量下降至 12.68%。前者茶多酚含量是后者同一时间茶多酚含量1.9~2.3倍。8月19日游离氨基酸含量整体维持在2.09%~2.29%,但9月23日的含量变化幅度相对较大,不同时间点游离氨基酸含量分别为 3.93%、3.60%、3.76%、3.87%、3.96%、3.12%(图3-B)。利用茶多酚及游离氨基酸含量的比值,获得酚氨比(图3-C)。结果显示 8月 19日酚氨比维持在很高的水平,约13.27~14.75;9月23日酚氨比相对较低,范围在 3.57~4.24。前者酚氨比是后者的3.14~4.09倍。图3-D所示为茶叶片中咖啡碱含量,发现8月19日咖啡碱含量显著高于9月23日。前者不同时间点咖啡碱含量分别为3.81%、2.92%、2.90%、3.00%、3.01%、2.62%,在上午 6时开始下降。后者咖啡碱含量分别为 2.37%、2.47%、2.61%、2.12%、2.09%、1.97%,在 12时达最大值后开始降低。
2.4 茶树冠层处光强、叶片温度与光合作用参数、品质成分含量相关性分析
将8月19日、9月23日6时至18时茶树冠层处光强、叶片温度、光合作用参数与品质成分含量进行相关性分析(表1)。结果表明,茶树冠层处光强与叶片温度显著相关,同时影响茶树叶片的气孔导度、蒸腾速率及胞间 CO2浓度,相关性系数分别为 0.659、0.409、–0.597和0.885。叶片温度与净光合速率负相关,与蒸腾速率正相关。同时,叶片温度与品质成分茶多酚、氨基酸含量及酚氨比分别有0.604、–0.691、0.676的显著相关性。另外,茶树主要品质成分含量之间也具有显著的相关关系。茶多酚含量与酚氨比、咖啡碱含量呈显著正相关,相关系数高达0.960、0.802;与氨基酸含量负相关,相关系数为–0.939。氨基酸含量与酚氨比、咖啡碱含量呈显著负相关。酚氨比与咖啡碱含量显著正相关,相关系数达0.800。

图3 茶树一芽二叶品质成分含量的变化Fig. 3 The changes of tea quality components in two leaves and one bud shoot

表1 茶树冠层处光强、叶片温度与光合参数、品质成分含量之间的相关性分析Table 1 Correlation analysis of luminous intensity, leaf temperature, net photosynthesis rate andquality component contents
2.5 茶树冠层处光强、叶片温度、净光合速率与品质成分基因表达水平的相关性分析
为在转录水平上进一步明确光强、叶片温度、净光合速率是否与品质成分相关合成基因表达存在联系,通过GenBank中登录的有关茶多酚[18-19]、氨基酸[20-21]及咖啡碱[22]合成基因的序列信息,设计相关引物(表2)。以CsPTB为内参基因[23],8月19日6时的表达量为对照,得到8月19日与9月23日不同时间点相关基因表达数据。利用基因表达数据与光强、叶片温度、净光合速率及品质成分含量进行相关性分析(表3)。
结果表明,基因CsPAL、CsCHI、CsF3′5′H、CsDFR、CsANS、CsUFGT、CsLAR的表达水平与秋茶茶多酚含量显著相关,其中CsPAL、CsANS、CsLAR与茶多酚含量的相关系数分别为 0.603、0.469、0.425,而CsCHI、CsF3′5′H、CsDFR、CsUFGT与茶多酚含量的相关系数分别为–0.683、–0.754、–0.696、–0.870。基因CsGDH、CsGS、CsGOGAT、CsTS1及CsTS2与秋茶氨基酸含量的显著相关系数分别为 0.559、–0.427、0.413、0.882、–0.445。基因CsTIDH、CssAMS与咖啡碱含量具有显著相关性,相关性系数分别为–0.421、0.503。在上述基因中进一步筛选,表达量与叶片温度显著相关的分别是CsPAL、CsF3′5′H、CsANS、CsUFGT、CsGS、CsGOGAT及CsTS1;与光强显著相关的是基因CsPAL、CsANS、CsGS、CsTS1、CsTS2及CssAMS;与净光合速率显著相关的基因是CsF3′5′H、CsANS、CsUFGT、CsGOGAT及CsTS2。
3 讨论
在茶园生态系统中,光、CO2浓度、温度、水分是影响茶树光合作用的主要生态因子,叶片温度、气孔导度、胞间CO2浓度及蒸腾速率是影响茶树光合作用的主要生理因子[24]。本研究发现,秋茶生长期典型的强光、高温环境下,冠层处光强并不是影响秋茶净光合速率的直接因素,而与冠层处光强有显著相关性的叶片温度、气孔导度、胞间CO2浓度是影响秋茶净光合速率的关键生理因子。叶片胞间CO2浓度与气孔导度密切相关,两者的变化共同反映出净光合速率主要受气孔限制还是叶肉细胞活性限制[25]。由图2-C可知,秋茶净光合速率的下降伴随着胞间CO2浓度的提高,此时叶肉细胞光合活性成为秋茶光合作用的主要限制因素。因此,秋茶叶片温度以及叶肉细胞光合活性成为影响其净光合速率的关键因素。

表2 茶树茶多酚、氨基酸、咖啡碱合成相关基因的实时荧光定量引物序列Table 2 Primer sequences of genes related to the biosynthesis of tea catechins, amino acids and caffeine for qRT-PCR

表3 茶树品质成分合成基因表达与冠层处光强、叶片温度及净光合速率的相关性分析Table 3 Correlation analysis of the expressions of genes involved in quality component biosynthesis, the luminous intensity, leaf temperature and net photosynthesis rate
光、温度不仅影响茶树光合作用,同时也直接参与调控茶树次生代谢途径中一些关键基因的表达。李丽田[26]研究表明,光强影响茶树儿茶素的组分含量并且多数儿茶素合成相关基因的表达受光强的影响,但不同基因对光强的响应模式不同。表3研究结果显示,秋茶冠层处光强可能对儿茶素合成基因CsPAL、CsCHS、CsANS、CsANR存在显著诱导作用。目前,光对氨基酸、咖啡碱代谢调控的研究报道相对较少,本研究发现,冠层处光强可能在转录水平调控基因CsGS、CsTS1、CsTS2及CssAMS的表达。值得注意的是,冠层处光强与秋茶茶多酚、氨基酸及咖啡碱含量没有显著相关性,因此,光强虽然对秋茶部分品质相关基因存在转录调控,但可能不是影响最终品质成分含量的关键因素。
有研究证明,昼夜温度为15℃/5℃的低温环境下,银杏叶片中类黄酮总量,PAL、C4H及4CL活性显著提高[27];葡萄果实的转录组测序结果证实,温度对类黄酮代谢途径可能存在转录后或翻译后调控[28]。但是,目前关于温度对茶树次生代谢产物的影响还未见报道。表1和表3结果证明,秋茶叶片的温度可能在转录水平上调控儿茶素合成基因CsPAL、CsF3′5′H、CsANS、CsUFGT与氨基酸合成基因CsGS、CsGOGAT、CsTS1的表达,进而影响秋茶茶多酚、氨基酸的合成积累。咖啡碱合成基因CsTCS1的表达虽与叶片温度相关系数达0.511,但与咖啡碱含量无直接相关性。因此,在合成基因的转录调控方面,叶片温度可能不是影响秋茶咖啡碱合成的关键因素。
光合作用是葡萄糖、果糖、蔗糖等物质的主要来源。许多研究报道糖作为碳源和能源或信号分子促进类黄酮物质的合成[29-30],同时调控类黄酮途径中PAL、C4H、4CL、CHS、DFR、F3H、UF3GT等基因表达[31]。表3结果显示,秋茶光合作用的强弱与部分品质基因的表达水平有显著的相关性,糖类是否也作为碳源或信号分子对秋茶儿茶素、氨基酸某些合成相关基因进行调控是值得深入研究的科学问题。
随着全球极端气候变化越来越明显,夏、秋季持续的高温天气越来越普遍[32-33],明确光、温度等主要环境因素对茶树光合作用、品质成分的影响及调控机制能进一步帮助生产者采取有效管理措施在生产栽培上预防极端天气对茶树生长的影响,有利于茶产业更好地发展。
[1] 陆文渊, 楼黎静, 钱文春. 湖州市夏秋茶资源的开发和利用[J]. 茶叶学报, 2011(3): 22-24.
[2] 何小庆. 夏秋茶资源开发利用现状及发展对策[J]. 现代农业科技, 2011(16): 361-362.
[3] 郭敏明, 余继忠, 师大亮, 等. 杭州市夏秋茶生产现状及对策建议[J]. 浙江农业科学, 2010, 1(6): 1268-1271.
[4] 杨亚军. 中国茶树栽培学[M]. 上海: 上海科学技术出版社, 2005: 116-121.
[5] 李治鑫, 李鑫, 范利超, 等. 高温胁迫对茶树叶片光合系统的影响[J]. 茶叶科学, 2015, 35(5): 415-422.
[6] 宛晓春, 夏涛. 茶树次生代谢[M]. 北京: 科学出版社,2015: 51-100.
[7] 陆春莲, 章卓梁, 胡江波, 等. 夏季茶树覆盖遮阳网改善夏秋茶品质试验研究[J]. 现代农业科技, 2014(18): 18.
[8] 付晓青, 陈佩, 秦志敏, 等. 遮荫处理对丘陵茶园生态环境及茶树气体交换的影响[J]. 中国农学通报, 2011,27(8): 40-46.
[9] 石元值, 方丽, 吕润强. 树冠微域环境对茶树碳氮代谢的影响[J]. 植物营养与肥料学报, 2014(5): 1250-1261.
[10] 王玉花, 秦志敏, 肖润林, 等. 遮光水平对丘陵茶园茶叶生长指标和品质的影响[J]. 经济林研究, 2011, 29(2):48-53.
[11] 陈佩. 茶园遮光效应及其对茶树光合作用和茶叶品质成分的影响[D]. 长沙: 湖南农业大学, 2010: 8-24.
[12] Zhao T T, Liu S H, Yan S J et al. Effects of intercropping and shading systems on tea photosynthesis and respiration[J]. Agricultural Science & Technology, 2016, 17(10):2225-2227.
[13] 肖润林, 王久荣, 单武雄, 等. 不同遮荫水平对茶树光合环境及茶叶品质的影响[J]. 中国生态农业学报, 2007,15(6): 6-11.
[14] 田纪春, 王学臣, 刘广田. 植物的光合作用与光合氮、碳代谢的耦联及调节[J]. 生命科学, 2001, 13(4): 145-147.
[15] 陈锦强, 李明启. 高等植物绿叶中的氮素代谢与光合作用的关系[J]. 植物生理学报, 1984(1): 3-10, 23.
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods, 2001, 25(4): 402-408.
[17] 施兆鹏. 茶叶审评与检验[M]. 北京: 中国农业出版社,2010: 59-62.
[18] Liu M, Tian H L, Wu J H, et al. Relationship between gene expression and the accumulation of catechin during spring and autumn in tea plants (Camellia sinensisL.) [J].Horticulture Research, 2015, 2(1): 15011. Doi:10.1038/hortres.
[19] 李治鑫. CO2浓度升高和高温胁迫对茶树生长发育的影响[D]. 北京: 中国农业科学院, 2016: 27.
[20] 林郑和, 钟秋生, 陈常颂. 茶树叶片GDH、GS、GOGAT基因的克隆及荧光定量 PCR分析[J]. 茶叶科学, 2012,32(6): 523-529.
[21] Deng W W, Ogita S, Ashihara H. Biosynthesis of theanine(γ-ethylamino- l -glutamic acid) in seedlings ofCamellia sinensis[J]. Phytochemistry Letters, 2008, 1(2): 115-119.
[22] 李金, 魏艳丽, 庞磊, 等. 茶树咖啡碱合成途径中TCS1、TIDH、SAMS的基因表达量差异及其与咖啡碱含量的相关性[J]. 江苏农业科学, 2013, 41(10): 21-24.
[23] Hao X Y, Horvath D P, Chao W S, et al. Identification and evaluation of reliable reference genes for quantitative real-time PCR analysis in tea plant (Camellia sinensis(L.)O. Kuntze) [J]. International Journal of Molecular Sciences, 2014, 15(12): 22155-22172.
[24] 孙君, 朱留刚, 林志坤, 等. 茶树光合作用研究进展[J].福建农业学报, 2015, 30(12): 1231-1237.
[25] 王静. 桂花净光合作用与环境因子和生理因子的关系[J].安徽农业科学, 2010, 38(20): 10985-10987.
[26] 李丽田. 光对茶树儿茶素合成的影响[D]. 北京: 中国农业科学院, 2015: 17-26.
[27] Wang G, Cao F, Chang L, et al. Temperature has more effects than soil moisture on biosynthesis of flavonoids in Ginkgo (Ginkgo biloba, L.) leaves [J]. New Forests, 2014,45(6): 797-812.
[28] Pastore C, Santo S D, Zenoni S, et al. Whole plant temperature manipulation affects flavonoid metabolism and the transcriptome of grapevine berries [J]. Frontiers in Plant Science, 2017, 8: 1-16. DOI:10.3389/fpls.2017.00929.
[29] Baier M, Smith C, Rook F, et al. Characterization of mutants inArabidopsisshowing increased sugar-specific gene expression, growth, and developmental responses [J].Plant Physiology, 2004, 134(1): 81-91.
[30] Ohto M, Onai K, Furukawa Y, et al. Effects of sugar on vegetative development and floral transition inArabidopsis[J]. Plant Physiology, 2001, 127(1): 252-261.
[31] Solfanelli C, Perata P. Sucrose-specific induction of the anthocyanin biosynthetic pathway inArabidopsis[J]. Plant Physiology, 2006, 140(2): 637-646.
[32] 唐恬, 金荣花, 彭相瑜, 等. 2013年夏季我国南方区域性高温天气的极端性分析[J]. 气象, 2014, 40(10):1207-1215.
[33] 陈晓晨, 徐影, 姚遥. 不同升温阈值下中国地区极端气候事件变化预估[J]. 大气科学, 2015, 39(6): 1123-1135.
