(1S,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-1,4-二醇的一步催化合成及其除草活性
2018-06-20谢志鹏黄道战黄燕培黄燕妮
谢志鹏, 黄道战, 黄燕培, 黄燕妮
(广西民族大学 化学与化工学院, 广西 南宁 530008)
5,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷- 4-醇(1)是含有6-氧杂二环[3.2.1]辛烷骨架的双环单萜含氧化合物,具有良好的除草活性[1-2]。然而,由于其合成原料α,α,3-三甲基-3-环己烯-1-甲醇来源少、制备成本高,化合物1在产业化及应用推广上严重受限。基于化合物1的分子结构特征、合成原理以及农业生产对植物源除草剂的需求,人们以资源丰富、价廉易得的单萜烯烃及其含氧衍生物为原料,合成了具有6-氧杂二环[3.2.1]辛烷骨架的系列双环单萜含氧化合物并对化合物的除草活性进行了研究[3-7]。但是,目前此类双环单萜含氧化合物在品种和数量上还较少,其生物活性方面的研究也不够深入。(1S,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-1,4-二醇(2)含有6-氧杂二环[3.2.1]辛烷骨架和2个羟基,在分子结构上与化合物1十分相似,目前国内外尚无对其除草活性的研究报道。另外,化合物2的合成方法[8]仍是采用两步或多步化学合成工艺,即以由α-蒎烯经酸催化异构制成的异松油烯为原料或直接以天然异松油烯为原料,经过氧酸环氧化、酸催化环氧和开环重排反应制备,制备过程存在工艺复杂、操作安全性差等不足。本课题组前期研究采用具有氧化-酸双功能催化作用的过氧磷钼钨酸十六烷基吡啶盐为催化剂,在H2O2存在下,催化α-蒎烯一步转化合成得到了(3R,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-3,4-二醇[5],在此基础上,本研究在过氧磷钼钨酸十六烷基吡啶盐催化作用下,采用异松油烯与H2O2反应合成得到化合物2,并对化合物2的结构进行了表征,进一步分析了其对常见杂草黑麦草的除草活性。
1 实 验
1.1材料与仪器
异松油烯,购于江西环球天然香料有限公司,纯度为96.1 %。催化剂过氧磷钼钨酸十六烷基吡啶盐[π-C5H5N(CH2)15CH3]3PMo2W2O24(简称HPP)按文献[9~10]方法制备。质量分数30 %的H2O2、氯仿、乙酸乙酯等均为市售分析纯。黑麦草,购自美国百绿集团。
GC-2014C型气相色谱仪,岛津(苏州)仪器有限公司;Magna IR 550型红外光谱(IR)仪,美国Nicolet公司;Advance 600型低温超导核磁共振波谱(NMR)仪,瑞士Bruker公司;Smart APEX Ⅱ型单晶X射线衍射(XRD)仪,德国Bruker公司;LRH-250-GSI人工气候箱,广东韶关市泰宏医疗器械有限公司。
1.2样品合成

向25 mL恒温水浴夹套玻璃反应器中依次加入异松油烯(0.54 g,4 mmol)、催化剂HPP、H2O2和溶剂(0.8 mL),在一定温度下磁力搅拌反应一段时间。反应结束后,待反应混合物冷却至室温,加入一定质量的内标物萘和溶剂无水乙醇,充分溶解混合,静置使催化剂沉淀析出,取澄清液直接进行气相色谱定量分析,采用内标法计算异松油烯的转化率和目标产物的产率。化合物2的合成反应式如右所示。
1.3样品结构表征
1.3.1XRD单晶结构表征 将1.2节中反应混合物冷却后蒸发脱水浓缩,然后用乙酸乙酯溶解并过滤,滤液冷却结晶得到粗产品,再将粗产品重结晶6次,然后用乙酸乙酯将所得晶体溶解配制成稀溶液,采用溶剂挥发法在室温下培养单晶,选取一定尺寸(0.20 mm×0.20 mm×0.05 mm)的单晶样品,进行XRD分析。采用石墨单色化Mo Kα射线(λ=0.071 073 nm),在温度为296.15 K条件下采集数据,采用多重扫描法对采集的数据进行吸收校正,直接法解出结构,全矩阵最小二乘法对非氢原子坐标及各向异性热参数进行精修[11],其中氢原子均为理论加氢。
1.3.2IR表征 将1.3.1节中的粗产品经4次重结晶后,取少量采用KBr压片法,获取红外吸收光谱。
1.3.3NMR表征 将1.3.1节中的粗产品经4次重结晶后,取少量以氘代氯仿为溶剂,在核磁共振波谱仪中测定其1H NMR和13C NMR。
1.4除草活性测试
采用平皿培养法[12-13],以黑麦草为研究对象,初步评价化合物2的除草活性。将适量黑麦草种子在无菌水中浸泡18 h后,置于人工气候箱中,在28 ℃下催芽萌发露白。在直径为9 cm的培养皿中铺放一张直径为8.5 cm的消毒纱布,加入10 mL一定浓度的供试化合物溶液和10粒刚萌发露白的黑麦草种子,每个浓度溶液做3组平行实验,以等体积的无菌水作为空白对照液,在人工气候箱中28 ℃下遮光培养72 h,测量、统计胚根和胚芽的平均长度,按公式(1)和(2)分别计算根长或芽长抑制率,评价化合物2的除草活性。

(1)

(2)
2 结果与分析
2.1合成反应条件的讨论
2.1.1溶剂种类 在异松油烯用量4 mmol、反应物料比(H2O2与异松油烯物质的量比,下同)值为3、催化剂用量5.0 %(以异松油烯质量计,下同)、反应温度30 ℃、溶剂用量0.8 mL、反应时间3 h的条件下,考察溶剂种类对反应转化率和产率的影响,结果列于表1。由表1可知,溶剂种类明显影响反应转化率和产率,以极性的乙醇、中极性的乙酸乙酯和丙酮以及非极性的正己烷为溶剂时,反应转化率和产率都较低,而以弱极性的氯仿和1,2-二氯乙烷为溶剂,转化率和产率均高于其他溶剂,其中转化率均高达100 %。究其原因可能与催化剂在不同溶剂中的溶解情况有关,催化剂HPP是一种相转移催化剂[10],在分子结构上是由十六烷基吡啶阳离子和过氧磷钼钨酸阴离子两部分按3∶1的物质的量比组成,即存在3条疏水性的十六烷基长链将亲水性的阴离子“包埋”的情况,有机溶剂种类明显影响“包埋”情况,进而影响催化剂的溶解性能及催化性能。催化剂HPP在极性、中极性和非极性溶剂中溶解性差,催化活性不高,转化率较低,而在弱极性卤代烃溶剂中溶解性较好,并表现出良好的相转移催化作用。亲水性杂多阴离子能够与水相中的双氧水反应生成“活性氧物种”,然后作为反离子与亲油性的十六烷基吡啶阳离子结合,被带到有机相,与底物接触反应。卤代烃溶剂中,与氯仿相比,1,2-二氯乙烷易燃、毒性较大,因此,选择氯仿作为反应溶剂。

表1 溶剂种类对转化率和产率的影响
2.1.2温度 以氯仿为溶剂,其他反应条件同2.1.1节,考察温度对反应转化率和产率的影响,结果如图1(a)所示。由图1(a)可知,温度对反应转化率和产率有一定的影响,温度为20 ℃时,转化率和产率很低,分别为66.0 %和3.4 %;温度高于25 ℃,随着温度升高,转化率和产率先快速提高而后趋于平稳或缓慢降低,其中转化率在30 ℃时就已达到100 %而后保持不变,而产率先由5.8 %(25 ℃)提高到25.7 %(35 ℃),然后缓慢降低。这是由于异松油烯具有2个活泼的碳碳双键,常温下容易发生氧化反应,而氧化剂过氧化氢属于过氧化物,较低温度下相对稳定,需达到一定温度才能发生自分解,释放“活性氧”参与反应,但当温度高于35 ℃时,过氧化氢自分解反应加剧,环氧和开环水解反应加速,副产物增多,化合物2的产率下降。因此,反应温度选取35 ℃为宜。
2.1.3催化剂用量 反应温度35 ℃,其他反应条件同2.1.2节,考察催化剂用量对反应转化率和产率的影响,结果如图1(b)所示。由图1(b)可知,催化剂用量对转化率和产率有较大的影响。不添加催化剂,转化率和产率较低。随着催化剂用量由0增加至9.19 %时,转化率呈先增加后不变的趋势,化合物2的产率大致呈先增加后略微减小的趋势。催化剂用量为7.35 %时,转化率为100 %,同时产率达到最大值,为27.1 %。原因可能是随着催化剂用量的增加,异松油烯发生高效的氧化反应,但用量的增加会使反应体系酸量增加,环氧和开环水解反应加速,副产物增多,故化合物2的产率下降。因此,本实验的最佳催化剂用量为7.35 %。
2.1.4反应物料比 催化剂用量为7.35 %,其他反应条件同2.1.3节,考察反应物料比对反应转化率和产率的影响,结果如图1(c)所示。由图1(c)可知,反应物料比对反应转化率和产率有一定的影响,随着反应物料比值由1增加至5,转化率由88.3 %很快提高至100 %并保持不变,而产率呈先增后减的变化趋势。当反应物料比值为3时,转化率为100.0 %,同时产率达到最大值,为27.1 %。究其原因可能是异松油烯转化生成目标产物的反应经历环氧化、酸催化开环重排,催化反应体系需要一定的酸性条件,但酸性太强或酸量过多对转化反应不利。实验发现,随着反应物料比值增加,即自身具有一定酸性的H2O2用量增多,反应体系酸量增加,环氧和开环水解反应加速,生成了较多的双羟基化、脱水等副产物,目标产物产率降低。故反应物料比值选择3为宜。
2.1.5反应时间 反应物料比值为3,其他反应条件同2.1.4节,考察反应时间对转化率和产率的影响,结果如图1(d)所示。由图1(d)可知,反应时间对转化率的影响不明显,而对产率的影响较明显;反应0.5 h,转化率就达到99.6 %,而产率才达到13.1 %,随着反应时间延长至6 h,产率先缓慢增加至29 %而后略微降低。究其原因,异松油烯具有2个活泼的碳碳双键,容易发生氧化反应,生成环氧化物中间体,中间体再经开环、水解、重排等系列反应,最终生成目标化合物2,适当延长反应时间,有利于产率的提高。因此,反应时间选择6 h。
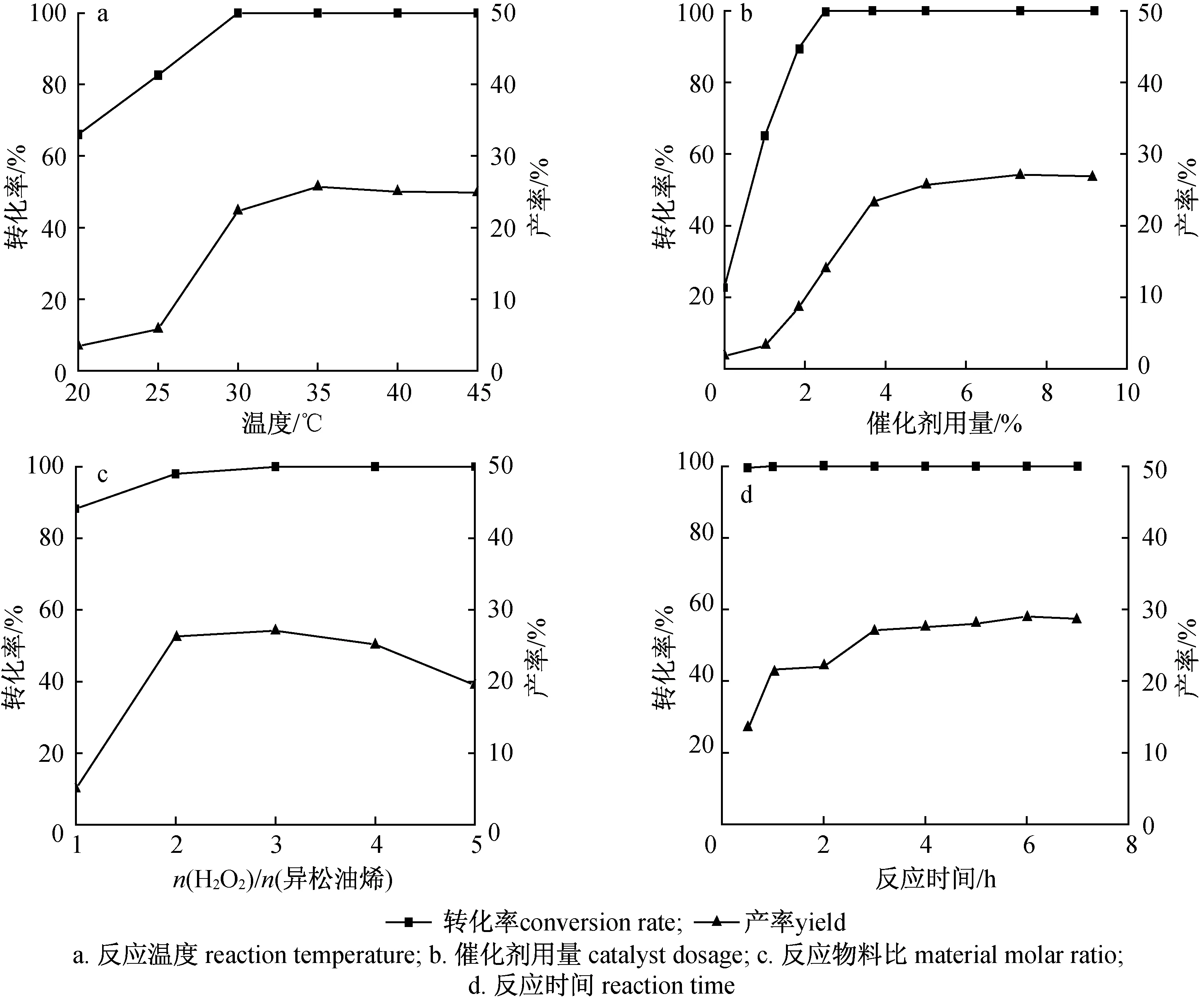
图1 反应条件对转化率和产率的影响Fig. 1 Effect of reaction conditions on the conversion rate and yield
研究发现较佳的反应条件是异松油烯用量4 mmol,催化剂HPP用量7.35 %,溶剂氯仿用量0.8 mL,反应物料比值3,于35 ℃反应6 h,此条件下异松油烯的转化率高达100 %,目标产物的产率达到29 %,产率不高,催化剂及催化反应体系有待进一步改进,以提高目标产物的产率。
按上述反应物料比扩大125倍,催化剂用量5.0%,其他条件相同进行反应。反应结束后,冷却至室温,静置、分液,分出水相,减压蒸发脱水浓缩,得浅黄色油状黏稠物;该黏稠物用适量乙酸乙酯加热溶解,过滤除去不溶物;滤液冷却结晶,减压过滤收集得到粗产品;将粗产品重结晶4次,真空干燥得到白色粉末晶体产品,得率为8.47 %,纯度(气相色谱峰面积归一化法)达到98.8 %。
2.2化合物2的结构表征
2.2.1红外光谱表征 化合物2红外光谱图如图2所示,其主要特征峰及归属为:3367 cm-1为O—H的伸缩振动吸收峰;2965和2928 cm-1为甲基和亚甲基的C—H不对称伸缩振动吸收峰;1135 cm-1为C—O的伸缩振动吸收峰;1063 cm-1为C—O—C的伸缩振动吸收峰。IR表明,目标产物中含有羟基和醚键等官能团。
2.2.2核磁共振表征 化合物2的NMR谱见图3。1H NMR(CDCl3为溶剂,600 MHz)δ:3.72~3.75(1H,t,H-5),2.23(1H,s,OH-1),2.22(1H,s,OH- 4),1.90~1.91(2H,d,H-8),1.76~1.77(2H,t,H-3),1.58~1.60(2H,t,H-2),1.24(3H,s,H-11),1.24(3H,s,H-10),1.20(3H,s,H-9);13C NMR谱(CDCl3为溶剂,150 MHz)δ:21.25(C-9),26.79(C-10),27.96(C-11),32.56(C-2),34.19(C-3),37.05(C-8),71.64(C- 4),77.50(C-5),80.81(C-1),81.39(C-7)。由NMR分析可知,目标产物有18个H和10个C,与理论值相符。
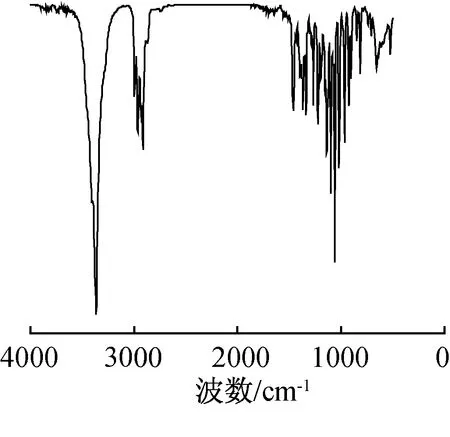
图2 化合物2的IR谱图Fig. 2 IR spectrum of compound 2

图3 化合物2的核磁共振谱图Fig. 3 NMR spectra of compound 2

图4 化合物2的分子晶体结构图Fig. 4 Molecular crystal structure of compound 2
2.2.3XRD表征 对化合物2进行单晶X射线衍射分析,其分子晶体结构如图4所示,显示该化合物是一种含有一个五元含氧杂环和一个环己烷的单萜6-氧杂双环[3.2.1]辛烷类衍生物,拥有3个手性碳原子,其中手性碳原子C1和C4均连接有一个羟基,分别为S构型和R构型。据此证实了该化合物分子的立体结构,按照系统命名法,其名称为(1S,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-1,4-二醇,这也与多步合成方法[8]的结果相符。
2.3除草活性
采用2.1节中较佳条件下重结晶提纯后得到的化合物2对黑麦草进行除草活性实验,结果如表2所示。由表2可知,化合物2能明显抑制黑麦草的根和芽的生长,其抑制作用随着浓度的升高而增强。浓度低于80 mmol/L,芽长的抑制率高于根长的抑制率,即化合物2对芽生长的抑制作用大于对根生长的抑制作用;而浓度高于80 mmol/L,芽长的抑制率稍低于根长的抑制率,即化合物2对芽生长的抑制作用小于对根生长的抑制作用;可能是在低浓度时芽对化合物2的吸收强于根,所以化合物2对芽长的抑制率高于根,而在高浓度时,情况正好相反。在浓度为120 mmol/L时,化合物2对黑麦草的根长和芽长的抑制率分别高达91.8 %和80.7 %,表现出较高的除草活性。在相同浓度下,与已报道的结构类似的1,8-桉树脑[14]相比,化合物2对黑麦草的抑制作用更好。
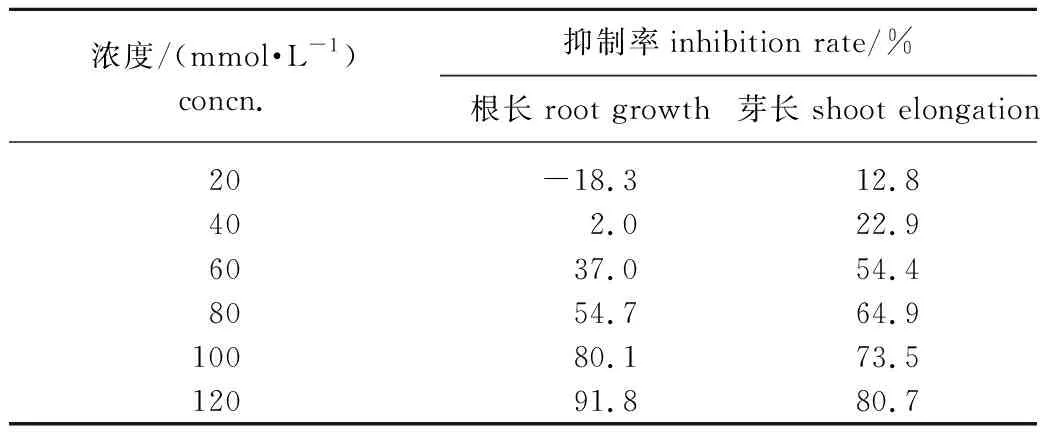
表2 化合物2对黑麦草的除草活性Table 2 Herbicidal activity of compound 2 against ryegrass
3 结 论
3.1以过氧磷钼钨酸十六烷基吡啶盐(HPP)为氧化-酸双功能相转移催化剂,在30 %(质量分数)H2O2存在下,催化异松油烯一步合成(1S,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-1,4-二醇。溶剂种类、反应温度、反应物料比、催化剂用量和反应时间对转化率和产率有较大影响,研究发现较佳的反应条件为异松油烯用量4 mmol、催化剂HPP用量7.35 %,溶剂氯仿用量0.8 mL、反应物料比值3、35 ℃反应6 h,此条件下异松油烯的转化率高达100 %,目标产物的产率达到29 %。
3.2红外光谱、1H核磁共振谱、13C核磁共振谱及单晶X射线衍射的分析结果表明成功合成了化合物2。
3.3化合物2能抑制黑麦草的根和芽的生长,其抑制作用随着浓度的升高而增强。在120 mmol/L的浓度下,化合物2对黑麦草根和芽的生长的抑制率分别达到91.8 %和80.7 %,表现较高的除草活性。
参考文献:
[1]POWELL J E. 6-Oxabicyclo[3.2.1]octane derivatives and compositions and methods for controlling plant growth:US 4486219[P]. 1984-12- 04.
[2]POWELL J E. Trimethyl 6-oxabicyclo[3.2.1]octan- 4-ols and 4-ones:US 4536586[P]. 1985- 08-20.
[3]POPOVA L A,BIBA V I,PRISHCHENPENKO V M,et al. Synthesis of monoterpene oxabicyclodiols starting fromα-pinene[J]. Journal of General Chemistry of the USSR in English Translation,1992,62(72):1346-1350.
[4]COSTA V V,ROCHA K A,SOUSA L F,et al. Isomerization ofα-pinene oxide over cerium and tin catalysts:Selective synthesis of transcarveol andtrans-sobrerol[J]. Journal of Molecular Catalysis A:Chemical,2011,345(1/2):69-74.
[5]黄道战,朱守记,蓝虹云,等. 一种制备(3R,4R)- 4,7,7-三甲基- 6-氧杂二环[3.2.1]辛烷-3,4-二醇的新方法[J]. 林产化学与工业,2015,35(1):9-15.
[6]黄道战,朱守记,蓝虹云,等. 双官能单萜氧杂二环二醇乙酸酯类衍生物的合成及其除草活性[J]. 合成化学,2015,23(3):185-190.
[7]ZHAO Z Y,HUANG D Z,LAN H Y,et al. Novel synthesis, crystal structure and herbicidal activity of (3R,4R)- 4,7,7-trimethyl- 6- oxabicyclo[3.2.1]octane-3,4-diol[J]. Chinese Journal of Structure Chemistry,2015,34(12):1819-1824.
[8]SALOMATINA O V,YAROVAYA O I,KORCHAGINA D V,et al. Acid-catalyzed transformations of diepoxy derivatives of terpinolene[J]. Russian Journal of Organic Chemistry,2011,47(10):1479-1486.
[9]黄道战,农秀李,黄雪梅,等. 过氧磷钼钨酸盐催化一步法合成2-羟基-1,4-桉树脑[J]. 精细化工,2015,32(10):1185-1189.
[10]ZHAO W,MA B,HUA H,et al. Environmentally friendly and highly efficient alkenes epoxidation system consisting of [π-C5H5N(CH2)11CH3]3PW4O32/H2O2/ethyl acetate/olefin[J]. Catalysis Communications,2008,9(14):2455-2459.
[11]SHELDRICK G M. Shelxl-97, Program for X-ray Crystal Structure Refinement[M]. Germany:University of Göttingen,1997.
[12]乌婧,王宝雷,李永红,等. N-苄氧/烷氧苯基- 4,6-二取代嘧啶胺类化合物的合成、晶体结构及除草活性[J]. 高等学校化学学报,2008,29(8):1583-1587.
[13]黄道战,王小淑,朱守记,等. 对孟烷-1,2,4-三醇的合成及对水稻稗草的除草活性研究[J]. 生物质化学工程,2013,47(5):40-44.
[14]BARTON A F M,CLARKE B R,DELL B,et al. Post-emergent herbicidal activity of cineole derivatives[J]. Journal of Pest Science,2014,87(3):531-541.
