植物乳杆菌和干酪乳杆菌的抗氧化活性研究
2018-06-20胡姝敏刘宝华孙欣瑶李晓东李东花
胡姝敏,刘宝华,孙欣瑶,李晓东,李东花
(1.黑龙江龙丹乳业科技股份有限公司,哈尔滨150010;2.东北农业大学食品学院,哈尔滨150030)
0 引言
益生菌为适当量服用时对宿主健康有益的活体微生物制剂,具有降低血清胆固醇和抗氧化等生理功能。氧化是导致某些疾病的根本原因[1-4],引起氧化的主要因素则是自由基[5]。如果能够消除过多的氧化自由基,相关疾病便能得到预防[6]。研究表明,益生菌具有一定的抗氧化能力,能够清除肠道内的活性氧分子,使机体内活性氧分子保持在相对稳定的状态[7-9]。
干酪独特的理化特性,使其成为了益生菌的良好载体[10]。而 Lucía Abadía-García等人[11]研究表明益生菌能够提高农家干酪的抗氧化性。目前商业上应用的最广泛的益生菌为乳杆菌属[12]。所以本论文首先研究植物乳杆菌KLDS1.0202和干酪乳杆菌KLDS1.0319自身的抗氧化性情况,然后确定其在干酪中的抗氧化能力,为功能性食品的研究和开发提供理论依据。
1 实验
1.1 材料
植物乳杆菌KLDS1.0202;干酪乳杆菌KLDS1.0319,商业发酵菌种Lactococcus lactissubsp.C remoris和Lactococcus lactissubsp.lactis混合菌种,铁氰化钾,三氯乙酸,三氯化铁,DPPH,1,10-邻二氮菲,硫酸亚铁,双氧水。
M RS培养基:酪蛋白消化物10.0 g,牛肉膏10.0 g,酵母膏10.0 g,柠檬酸三铵2.0 g,乙酸钠5.0 g,硫酸镁0.2 g,硫酸锰0.05 g,磷酸氢二钾2.0 g,葡萄糖20.0 g,吐温-80 1.08 g。
M RS固体培养基:在上述M RS液体培养基中加入1.5%的琼脂。
1.2 仪器与设备
JD 500-2电子天平,VD-1320超净工作台,DH 5000A电热恒温培养箱,SYQ-DSX-280B手提式蒸汽灭菌锅,U LTRA-TURRAX T 8均质机,数显恒温水浴箱,JY-92-ⅡN超声波细胞粉碎机,离心机,GL-20G-Ⅱ冷冻离心机,UT-1800紫外可见分光光度计。
1.3 方法
1.3.1 菌株的活化与保存
植物乳杆菌和干酪乳杆菌作为益生菌采用MRS培养基进行培养。将MRS培养基于121℃灭菌15 m in,于37℃培养24 h,反复传代至菌株的活菌数在1.0×108m L-1以上,将菌液与50%灭菌甘油按2∶3混合,于-20℃冻存备用。
1.3.2 植物乳杆菌和干酪乳杆菌抗氧化活性的测定
根据Lee及宋晓辰等人的方法[13,14]。将筛选得到的乳酸菌株活化,传代3次后,2%接种于M RS液体培养基,37℃培养24 h,培养液经转速为4 000 r/m in,4℃离心10m in,收集菌体沉淀,经无菌去离子水洗涤两次.将上述进行一次,收集菌体。将菌体使用生理盐水调整OD600=1.0。所得菌悬液分为4组:1组作为活细胞组;2组,在冰浴条件下使用超声波粉碎仪进行粉碎,300W条件下,每处理5 s,间隔5 s,持续25m in,显微镜下检查没有完整细胞后,在温度为4℃转速为8 000 r/m in下,离心15 m in,收集上清液,即为无细胞提取物;3组,在温度为37℃下,培养20 m in,然后在4℃转速为5 000 r/m in,离心15 m in,收集上清液,即为胞外分泌物组;4组,在100℃条件下加热处理30m in,即为菌体灭活组。
1.3.2.1 菌株清除DPPH自由基能力的测定
细胞破碎液离心后取上清液1.0 m L,加入浓度为0.2 mmol/L的DPPH·甲醇溶液1 m L,混匀后在室温下避光反应30m in,离心后取上清液在517 nm下测定光密度值,按照下式计算菌株清除DPPH自由基的能力,以PBS缓冲液作空白对照。
DPPH自由基清除率=[1-A 517(样品)/A 517(空白)]×100%。
1.3.2.2 菌株清除羟自由基(·OH)能力的测定
0.1 m L的EDTA,0.01m L的FeC l3,0.1 m L的H2O2,0.36m L的脱氧核糖,0.33m L的PBS,0.1m L的抗坏血酸混合液中加入1 m L细胞破碎后的上清液,然后在37℃水浴1 h,水浴完成后向混合液中加入TBA和TCA显色,形成的粉红色物质在532 nm测光密度值,按照下式计算清除羟自由基的能力,以PBS缓冲液作空白对照。
羟自由基清除率=[1-A532(样品)/A532(空白)]×100%。
1.3.2.3 菌株还原能力的测定
反应液中菌0.5m L,铁氰化钾(质量分数1%)0.5m L和磷酸盐缓冲液(PBS浓度为0.2 mol/L,pH=6.6)0.5 m L混合在50℃水浴20 m in,反应后冷却并加入0.5 m L三氯乙酸(TCA质量分数1%)沉淀蛋白。离心后取1 m L上清液与1 m L氯化铁(质量分数0.1%)反应,于700 nm下测吸光度,其中L-半胱氨酸作为标品。
1.3.3 益生菌契达干酪的制作
原料乳→标准化→巴氏杀菌(63℃,30m in)→冷却(32℃)→添加发酵剂和益生菌→发酵(30℃,1 h)→添加CaC l2→添加凝乳酶(0.003%)→凝乳(31℃,1 h)→切割(1 cm3)→搅拌升温至42℃(每3~5 m in升高1℃)→保温搅拌(45 m in)→静置(30 m in)→排乳清→凝块堆砌(每15 m in反转堆积1次,反转7次)→破碎与加盐→成型压榨→包装、8℃成熟。
1.3.4 益生菌契达干酪抗氧化活性
共4组契达干酪,其中空白组(Batch-1):只添加2%商业发酵剂。实验组:Batch-2为添加质量分数为2%商业发酵剂和1.2%植物乳杆菌;Batch-3为添加质量分数为2%商业发酵剂和1.2%干酪乳杆菌;Batch-4为添加质量分数为2%商业发酵剂、0.6%植物乳杆菌和0.6%干酪乳杆菌。以清除DPPH自由基、还原力和清除羟自由基为指标,分别测定4种契达干酪的抗氧化活性。
1.3.4.1 组成成分
总蛋白质的测定方法根据GB5009.5-2010;
脂肪测定方法根据GB 5413.3-2010;
水分测定根据GB 5009.3-2010中方法;
氯化钠质量分数的测定参照GB/T 12457-2008中方法。
pH值测定:干酪与去离子水在无菌条件下以1∶2的比例均匀混合,用pH计直接测定。
1.3.4.2 水溶性提取物的制备
根据Kuchroo&Fox[15]的方法制备水溶性提取物(W SE)。30 g干酪加90 m L 50 mm o l/L磷酸盐缓冲液,并在匀浆器中匀浆10 m in。悬浮液在40℃下利用均质机滤纸过滤。提取液温和搅拌1 h(150 r/m in),然后在4℃,3 000 g下离心30 m in。悬浮液通过W hatm an no.2滤纸过滤,提取液用1 m o l的HC l调pH值到4.6,水溶性提取物冷冻干燥并在-18℃下保存使用。
15 m g冻干样品加1 m L蒸馏水用于还原力分析,50 m g冻干样品加1 m L蒸馏水用于DPPH自由基清除能力和羟自由基清除能力分析。
1.3.4.3 水溶性提取物抗氧化性的测定
(1)DPPH自由基清除能力的测定。根据Shim ada等人[16]的方法进行测定。0.1 m L(质量浓度50 m g/m L)水溶性提取物(W SE)样品与3.9 m L新制备的60 μm ol/L DPPH-甲醇溶液混合,45 m in后,用紫外可见分光光度计在517 nm下测其吸收值,并用蒸馏水代替样品作空白。

(2)还原力的测定。水溶性提取物的还原力根据Duh等人[17]的方法进行测定。2.5 m L(质量浓度15 m g/m L)样品加入2.5m L浓度为0.2mol/L(pH=6.6)磷酸盐缓冲液,再加入2.5 m L质量浓度为10 m g/m L铁氰化钾溶液,混合物在50℃下放20 m in,然后加入2.5 m L质量浓度为 100 g/L三氯乙酸(TCA),在3 000 g下离心10 m in。2.5 m L上清液加入2.5 m L蒸馏水和0.5m L三氯化铁(质量浓度1mg/m L),在700 nm下测吸光值。反应物吸光值越高,还原能力越强。用和样品相同浓度的BHT做空白。
(3)羟自由基清除能力的测定。根据Liu等人[18]的方法进行测定。1 m L浓度为0.75mmol/L的1,10-邻二氮菲,1 m L浓度为0.75mm ol/L的FeSO4,1m L的H2O2(体积分数0.01%),1.5 m L(0.15 m o l,pH=7.4)磷酸盐缓冲液混合,产生羟自由基,再加入1m L样品溶液,在37℃下培养30 m in。在536nm下测混合物的吸光值。

式中:A0为代替H2O2和提取物的去离子水的吸光值;A样为提取液存在时的吸光值;A空为没有提取液的吸光值。
1.4 数据统计分析
每个实验重复3次,结果表示为平均数(M ean)±SD。数据统计分析采用Statistix 8.1(分析软件,St Pau l,M N)软件包中Linear M odels程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序。采用Sigm aplot11.0软件作图。
2 结果与分析
2.1 植物乳杆菌和干酪乳杆菌抗氧化活性的测定
将乳酸菌的四种处理成分,包括活细胞(1组)、无细胞提取物(2组)、胞外分泌物(3组)、灭活的菌体(4组),采用DPPH方法、羟自由基清除及还原能力的方法,进行抗氧化性的评价。
2.1.1 DPPH自由基清除能力的测定
由图1可以看出,植物乳杆菌与干酪乳杆菌对DPPH自由基的清除能力比较强。DPPH自由基是一种以氮为中心、比较稳定、灵敏的自由基,广泛地用于评价物质的抗氧化活性。自由基清除剂可与其单电子配对,致使其本身深紫色逐渐消失或减弱,其褪色程度与抗氧化物质呈现定量关系。无论是植物乳杆菌还是干酪乳杆菌,其2组的无细胞提取物对DPPH的清除能力最强,分别为53.86%和51.96%。然后是胞外分泌物,其次是菌体灭活组,菌体活细胞组对DPPH的清除能力最弱。由图看出,植物乳杆菌对DPPH的清除能力均比干酪乳杆菌强。而无论是无论是哪一组,植物乳杆菌的DPPH自由基清除能力都高于干酪乳杆菌。
2.1.2 羟自由基清除能力的测定
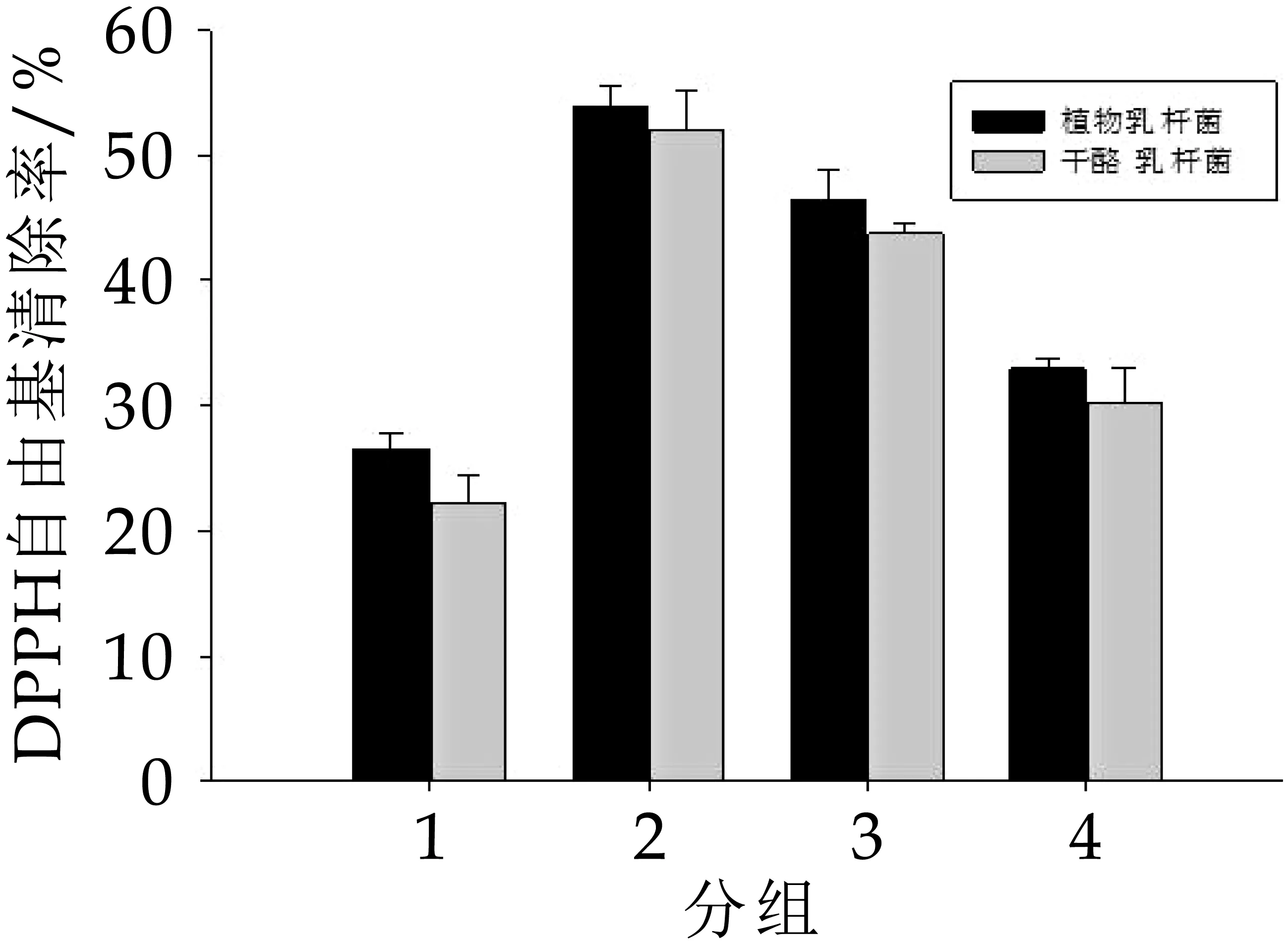
图1 植物乳杆菌与干酪乳杆菌的DPPH自由基的清除能力
由图2可以看出,植物乳杆菌与干酪乳杆菌对羟基的清除能力各有差异。·OH是体内氧化性很强的自由基。病理实验中,常研究·OH的清除作用揭示某些病变原因、衰老机理。2组的无细胞提取物对·OH的清除能力最强,分别为13.03%和10.89%。然后是菌体活细胞组,其次是胞外分泌物,菌体灭活组对·OH的清除能力最弱。

图2 植物乳杆菌与干酪乳杆菌的羟自由基清除能力
2.1.3 还原能力的测定
由图3可以看出,植物乳杆菌与干酪乳杆菌对铁离子的还原力各有差异。良好的电子供体不仅能使Fe3+还原成Fe2+,从而使吸光值上升;同时能与自由基反应,使自由基成为较为稳定的物质,从而中断自由基连锁反应,其反应产物在700 nm处吸光度越大表明样品的还原力越强。而良好的电子供体是还原能力强的物质。无论是菌体灭活组、胞外分泌物还是菌体活细胞组,植物乳杆菌的还原力都大于干酪乳杆菌,但是干酪乳杆菌的无细胞提取物的还原能力大于植物乳杆菌,并且两种菌株的无细胞提取物的还原能力在所有分组中最强,分别为0.257和0.305。

图3 植物乳杆菌与干酪乳杆菌的还原能力
2.2 益生菌契达干酪抗氧化活性
2.2.1 益生菌契达干酪组成成分
干酪产品的成分主要受原料乳的成分和性质以及生产过程的差异这两方面因素的影响。标准契达干酪的组成成分如下:蛋白质20%~30%,脂肪20%~34%,盐1%~3%,pH值4.7~5.3。由表1所知,4种契达干酪样品组成成分的质量分数值均处于文献中标准文献契达干酪的组成成分含量范围之内。并从表中可以看出,4种契达干酪的组成成分之间并无显著性差异(P>0.05),说明益生菌的添加对干酪组成成分没有显著的影响,以下抗氧化活性测定的实验可以进行。

表1 契达干酪在8℃下成熟24周后组成成分分析结果 %
2.2.2 水溶性提取物抗氧化性的测定
2.2.2.1 DPPH自由基清除能力的测定
由图4可以看出,4种干酪在24周的成熟过程中,DPPH自由基的清除能力先增加后减小,并在16周左右达到最大值,添加益生菌的干酪分别为47.30%,48.65%,51.72%;显著高于空白组的45.05%(P<0.05)。这是由于干酪在成熟过程中,蛋白质会发生降解反应,生成一些小分子肽,这些肽中有些具有一定的抗氧化性,并且随着成熟时间的加长,还会形成一些具有抗氧化性的氨基酸,这些物质都会增加契达干酪的抗氧化性。在16周之后,蛋白质降解的速度变得缓慢,生成的具有抗氧化性的肽类物质又会降解成一些不具有抗氧化性的氨基酸,所以在第20周和24周抗氧化性有所降低。乳杆菌已经被证明具有产生二肽酶、羧肽酶、三肽酶、氨肽酶和肽链内切酶的能力[15],由此可知在四种干酪样品中,加入植物乳杆菌和干酪乳杆菌的契达干酪的DPPH自由基清除能力显著高于空白组(P<0.05)。
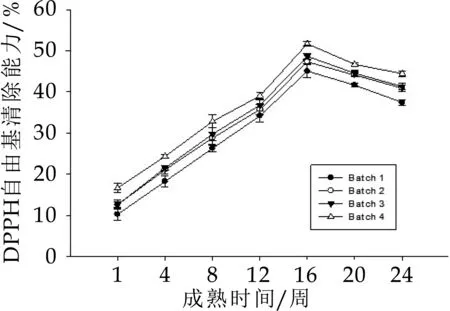
图4 契达干酪水溶性提取物的DPPH自由基的清除能力
2.2.2.2 还原力的测定
由图5可以看出,四种干酪样品的还原能力在20周前都会随着成熟时间的增加而增大,尤其在12~20周增长的较为显著(P<0.05),并在第20周达到最大值,分别为0.366,0.479,0.515,0.656;而在20周以后有所下降。而加入菌的干酪的还原能力显著高于空白组干酪样品的还原性(P<0.05),而加入两种益生菌的干酪的还原力最大。反应产物在700 nm处吸光度越大表明样品的还原力越强,抗氧化性也就越强,所以结果表明空白组契达干酪抗氧化活性较其他三种切达干酪最低。这是因为契达干酪在成熟期间蛋白质会发生降解生成小分子物质肽、氨基酸等,在成熟前期蛋白质降解生成的物质的分子量要比后期的分子量大,还原性显著低于后期生成的氨基酸等小分子量的物质,这与K.H.Sabeena Farvin[16]研究的结果相似。他证明>30 ku和在10~30 ku之间的大分子片段的还原能力明显低于抗坏血酸,相反,小于3 ku的低分子物质的还原能力要高于抗坏血酸。所以分子量月底的物质片段的还原性越强,抗氧化性也就越强。
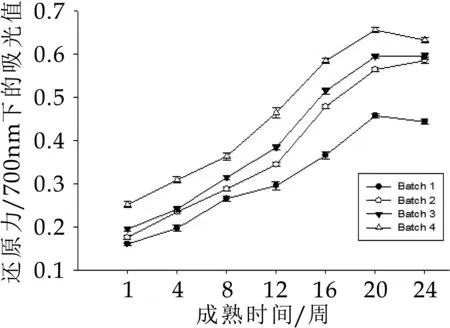
图5 契达干酪水溶性提取物的还原力
2.2.2.3 羟自由基清除能力的测定
由图6可以看出,契达干酪的羟自由基清除能力随着成熟时间的延长而增加,尤其在8~16周增长速度较快,并在第16周左右分别达到最大值43.86%,46.19%,46.66%和47.43%;在第20和24周有所下降。这是由于加入了益生菌作为抗氧化剂与羟自由基发生了反应,阻止了羟自由基与蛋白质结合,从而蛋白质发生降解产生抗氧化肽,使得契达干酪具有抗氧化性。加入了益生菌的契达干酪的羟自由基的抑制能力明显高于未加入益生菌的契达干酪的羟自由基的抑制能力(P<0.05),而加入植物乳杆菌和干酪乳杆菌的羟自由基的抑制能力没有明显的差别(P>0.05),加入混合益生菌的契达干酪要稍高于其他切达干酪。

图6 契达干酪水溶性提取物的羟自由基清除能力
由以上可知,在8℃成熟时,分别加入植物乳杆菌、干酪乳杆菌和同时加入两种益生菌干酪的DPPH自由基清除能力及羟自由基清除能力均在第16周达到最大值,而还原力在第20周达到最大值,且均显著高于空白组(P<0.05),表明两种菌能够显著提高干酪的抗氧化活性。
3 结论
植物乳杆菌KLDS1.0202和干酪乳杆菌KLDS1.0319自身都有一定的抗氧化活性,而且通过试验发现,对于两种菌株来说,无细胞提取物的DPPH自由基和羟自由基的清除能力以及还原能力都是最强的。对于无细胞提取物来说,植物乳杆菌KLDS1.0202的DPPH自由基清除和羟自由基清除能力略高于干酪乳杆菌KLDS1.0319,而干酪乳杆菌KLDS1.0319的还原能力高于植物乳杆菌KLDS1.0202,表明不同的评价方法会产生不同的结果。同时也发现,植物乳杆菌和干酪乳杆菌添加到契达干酪中能够提高干酪在成熟过程的抗氧化活性,与空白组契达干酪相比,分别加入植物乳杆菌KLDS1.0202、干酪乳杆菌KLDS1.0319和同时加入两种益生菌干酪的DPPH自由基清除能力、还原力和羟自由基清除能力都有显著的提高(P<0.05),DPPH自由基清除能力和羟自由基清除能力在第16周达到最大值,分别为47.30%,46.19%;48.65%,46.66%和51.72%,47.43%;还原力在第20周达到最大值,分别为0.479和0.515、0.656。添加益生菌的干酪在组成成分上与空白干酪相比并无显著差异(P>0.05)。以上表明两种菌不仅自身具有一定的抗氧化活性,还能促进干酪蛋白质的分解,提高干酪的抗氧化活性。
[1]MARTINDALE JL,HOLBROOK N J.Cellular response to oxidative stress:signaling for suicide and survival[J].Journalof cellular physiology,2002,192(1):1-15.
[2]SIESH.Oxidative stress:oxidants and antioxidants[J].Experimental physiology,1997,82(2):291-295.
[3]ADLY A A M.Oxidative Stressand Disease:An Updated Review[J].Research Journalof Immunology,2010(2),3:129-145.
[4]HYBERTSON B M,GAO B,BOSE SK,et al.Oxidative stress in health and disease:the therapeutic potentialof N rf2 activation[J].M olecular aspectsofmedicine,2011,32(4-6):234-246.
[5]KULLISAA R T,ZILMER M,M IKELSAAR M,et al.Two antioxidative lactobacilli strains as prom ising probiotics[J].International Journalof Food M icrobiology,2002(3),72:215-224.
[6]HUANG S,DING S,FAN L.Antioxidantactivitiesof?ve polysaccharides from Inonotus obliquus[J].International Journal of Biological M acromolecules,2012,50(5):1183–1187.
[7]HATHOUT A S,MOHAMED SR,EL-NEKEETY A A,etal.Ability of Lactobacilluscaseiand Lactobacillus reuteri to protectagainst oxidative stress in rats fed aflatoxins-contam inated diet[J].Toxicon,2011,58(2):179-186.
[8]KULLISAAR T,ZILMER M,M IKELSAAR M,et al.Two antioxidative lactobacilli strainsasprom ising probiotics[J].International journalof foodmicrobiology,2002,72(3):215-224.
[9]LEE J,HWANG K T,HEO M S,et al.Resistance of Lactobacillus plantarum KCTC 3099 from Kimchi to oxidative stress[J].Journal of medicinal food,2005,8(3):299-304.
[10]白明,孟祥晨.益生菌抗氧化活性及菌体抗氧化相关成分的分析[J].食品与发酵工业,2009,35(5):6-11.
[11]LUCIA ABADIA-GARCIA,ANABERTA CARDADOR,SANDRA T.MARTIN DEL CAMPO,et al.In?uence of probiotic strains added to cottage cheese on generation of potentially antioxidant peptides,anti-listerialactivity,and survivalof probioticm icroorganisms in simulated gastrointestinal conditions[J].International Dairy Journal,2013,33(2):191-197.
[12]张莉.植物乳杆菌的黏附特性研究及其在益生菌干酪中的应用[D].吉林大学,2013.
[13]LEEB,KIM J,KANG Y M,etal.Antioxidantactivity andγ-aminobutyric acid(GABA)content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J].Food Chemistry,2010,122(1):271-276.
[14]宋晓辰,彭新颜,李凤梅,等.植物乳杆菌NDC75017抗氧化活性研究[J].食品科学,2014,35(21):106-112.
[15]KUCHROO C,FOX P.Soluble nitrogen in Cheddar cheese:comparison of extraction procedures[J].M ilchw issenschaft-M ilk science international,1982,37:331-335.
[16]SHIMADA K,FUJIKAWA K,YAHARA K,et al.Antioxidative propertiesof xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chem istry,1992,40(6):945-948.
[17]DUH P D,TU Y Y,YEN G.C.Antioxidant activity ofwater extract of Harng Jyur(Chrysanthemum morifolium Ramat)[J].LWT-Food Science and Technology,1999,32(5):269-277.
[18]LIU J,LUO J,YE H,et al.Production,characterization and antioxidantactivitiesin vitro ofexopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Carbohydrate Polymers,2009,78(2):275-281.
