留兰香环糊精抑菌缓释功能改性对聚丙烯基薄膜包装性能及乳化香肠货架期的影响
2018-06-19贾晓云张顺亮刘文营李迎楠王守伟成晓瑜
贾晓云,张顺亮,刘文营,李迎楠,赵 燕,杨 凯,王 乐,李 享,王守伟,成晓瑜*
(中国肉类食品综合研究中心,北京食品科学研究院,肉类加工技术北京市重点实验室,北京 100068)
随着生活水平的提升,人们更多地关注食品的安全与新鲜,对食品的贮藏与流通环节提出了更高的要求,一种好的包装方式既要满足保证食品的营养、品质、风味以及安全,又要能延长食品的货架期[1-5]。
将功能性的天然物质添加到高分子聚合物中,是最近研究的热点[6-9]。缓释抗菌包装有着很大优势,可以极大地延长食物的保鲜期,且抗菌效果既具有彻底性还具有长期性,抗菌成分以某种速率缓慢释放,使得抗菌效果持续且明显。可以通过选用包材物质改变添加剂的油溶性和水溶性,从而更适合实际使用。
环糊精是外亲水内疏水的立体手性环状特殊结构,β-环糊精(β-cyclodextrin,β-CD)是7 个葡萄糖单元的环糊精,与客体分子通常以范德华力或者氢键相结合[10]。β-CD具有很好的热稳定性,280 ℃时发生热重损失,分子结构被破坏,开始发生降解,因此适合200 ℃以下的热加工处理,有利于提高客体分子的利用率[11]。
乳化香肠是经过绞肉、斩拌、真空充填、蒸煮等步骤制备而成的方便、快捷且深受消费者喜爱的常见肉制品。与采用中温技术杀菌制备的中温肉制品和普通的高温杀菌产品相比,乳化香肠产品水分活度高,微生物风险高,产品货架期短,导致产品在流通环节极易腐败变质,造成大量经济损失。肉制品腐败变质主要表现为颜色褐变、风味变化、油脂氧化及微生物增长等现象。肉制品的微生物增长首先是在食品表面,然后逐渐深入肉品内部,所以采用抗菌活性薄膜可以有效抑制微生物在肉制品表面生长,从而进一步延长产品的货架期。随着生鲜电商行业飞速发展,研究活性包装材料,建立生物活性抗菌包装技术和抑菌物质缓释技术延长产品的货架期,具有很强的现实意义。
本研究采用β-CD作为包埋介质,可以极大地避免在薄膜加工过程中温度对留兰香(spearmint,S)提取物有效成分的破坏。采用β-CD包埋留兰香提取物的同时可以解决留兰香难溶于水、易挥发、易氧化的问题,为留兰香在肉制品包装领域的应用扩大了范围。
1 材料与方法
1.1 材料与试剂
留兰香提取物 美国KEMIN公司;聚丙烯(polypropylene,PP) 中国石油化工集团公司;β-CD、氯化钠、硫代巴比妥酸(thiobarbituric acid,TBA)、三氯乙酸、冰醋酸、淀粉、碘化钾、石油醚国药集团化学试剂有限公司;平板计数琼脂(plate count agar,PCA)培养基、营养肉汤 北京陆桥技术有限责任公司;其他试剂均为国产分析纯。
大肠杆菌、金黄色葡萄球菌于中国肉类食品综合研究中心检测中心实验室保藏。
1.2 仪器与设备
AL104电子天平、SG2-FK SevenGo pH测定仪瑞士Mettler-Toledo公司;LCH-18恒温水槽 日本三洋株式会社;FC-42恒温鼓风烘箱、F1-45培养箱 日本东洋公司;UV2800可见分光光度计 尤尼柯(上海)仪器有限公司;DF-101S集热式恒温加热磁力搅拌器、DZ-600/2S真空包装机 山东小康机械有限公司;GI54DWS高压蒸汽灭菌 致微仪器有限公司;XSS-300转矩流变仪、LSSJ-20双螺杆挤出机、LSC-120吹膜机 上海科创橡塑机械设备有限公司;Nicolet iS10傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;WGT-S透光率/雾度测定仪、W303水蒸气透过率测定仪、GBH电子拉力试验机 广州标际包装设备有限公司。
1.3 方法
1.3.1 β-CD-留兰香包合物的制备
将20 g β-CD加600 mL水中置于烧杯中,60 ℃加热至全溶,冷却至40 ℃。在磁力搅拌下,用注射器滴加留兰香提取物溶液(1∶2,m/V)8 mL,40 ℃条件下搅拌3 h,抽滤冷冻干燥,过80 目筛后放在干燥器备用。所得的包合物记为S-β-CD。
1.3.2 功能性缓释膜的制备
通过挤出吹塑法制备PP、S/PP、S-β-CD/PP 3 种不同的薄膜包装袋,将S和S-β-CD以质量分数0.5%和1.0%添加到PP母粒中,单螺杆挤出机各区段温度分别为121、198、203 ℃,挤出模头温度为200 ℃,单螺杆转速为30 r/min。制备得到产品记录为PP、0.5% S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP。对各组功能性缓释膜的功能性指标进行测定。
1.3.3 样品处理与分组
制备中温乳化香肠,加工工艺如下:原料肉→解冻→修整→斩拌→灌制→干燥→蒸煮→冷却。然后用5 种膜所做包装袋分别对其进行真空包装。采用中温杀菌技术,在100 ℃、0.175 MPa条件下杀菌20 min后成品。25 ℃避光贮存,对贮存过程中样品进行指标测定。
1.3.4 功能性释缓膜基本特性指标的测定
1.3.4.1 厚度的测定
根据GB/T 6672—2001《塑料薄膜与薄片厚度的测定机械测量法》[12],试样随机取5 个点采用薄膜测厚仪测定薄膜厚度,取平均值。
1.3.4.2 拉伸强度和断裂伸长率的测定
根据GB/T 1040.1—2006《塑料 拉伸性能的测定 第1部分:总则》[13],将待测样品修剪成长100 mm、宽20 mm的样条,使用电子拉力试验机进行拉伸性能,初始间距20 mm,拉伸速率为50 mm/min,每个样品测定5 次。
1.3.4.3 透光率和雾度的测定
依照GB 2410—2008《透明塑料透光率和雾度的测定》[14],采用透光率/雾度测试仪测定薄膜的透明性,测定5 组平行,取平均值。
1.3.4.4 水蒸气透过率的测定
采用水蒸气透过率测定仪测定样品在相对湿度100%、37 ℃下的水蒸气透过率,测定3 次取平均值[15]。1.3.4.5 抑菌性能的测定
菌落总数的测定参考户帅锋等[15]的方法,将实验菌种金黄色葡萄球菌、大肠杆菌用3 mL营养肉汤培养基在37 ℃下活化24 h,重复2 次。以生理盐水为稀释液依次10 倍稀释,以5.0×105CFU/mL稀释液为菌悬液。将5 种薄膜各0.4 g浸渍于10 mL营养肉汤中48 h后,接种100 μL菌悬液,37 ℃恒温振荡24 h。梯度稀释至0.5 麦氏浊度标准,各取200 μL于平板计数琼脂中培养,37 ℃培养48 h,测定菌落总数。
1.3.5 乳化香肠指标的测定
1.3.5.1 色差的测定
将色差计开机自检,用白板进行校正。将1.3.3节中的乳化香肠切片,测量其亮度值(L*)、红度值(a*)和黄度值(b*),每测1 次顺时针旋转60°,总共测5 次平行。参考方梦琳[16]的方法,以e值为色泽评判参数,e值表示在明亮度和黄度的影响下样品的红度值,计算如式(2)所示。

1.3.5.2 pH值的测定
参照GB/T 9695.5—2008《肉与肉制品 pH测定》[17]中的方法测定。将肉样在无菌条件下用灭菌后的刀剁碎后取10.0 g,加入到90 mL生理盐水中混匀,浸泡20 min并不时搅拌,然后用pH测定仪测定其pH值。每个样品重复测3 次,结果以平均值表示。
1.3.5.3 TBA含量的测定
TBA含量的测定参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》[18]。
1.3.5.4 菌落总数的测定
菌落总数参照GB 4789.2—2016《食品安全国家标准食品微生物学检验 菌落总数测定》[19]中的方法测定。
1.4 数据分析
采用SPSS 22.0进行数据分析,采用方差分析(analysis of variance,ANOVA)进行单因素显著性分析和Duncan’s多重比较检验法进行显著性分析,采用Origin 8.0软件制图。P<0.05表示差异显著。
2 结果与分析
2.1 不同功能性缓释膜的基本特性
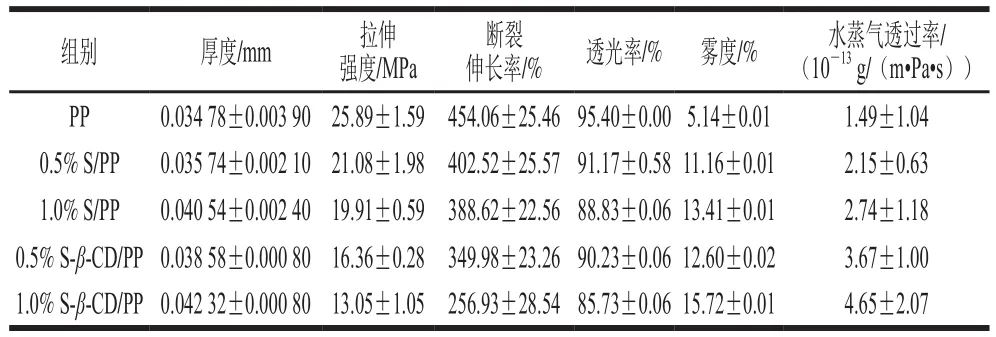
表1 不同功能性释缓膜的基本特性Table 1 Characteristics of different functional sustained-release films
由表1可知,功能性缓释膜的厚度依次为:PP<0.5%S/PP<0.5% S-β-CD/PP<1.0% S/PP<1.0% S-β-CD/PP。包合物添加量为0.5%的样品厚度均小于添加量1.0%的样品;这表明,随着包埋物添加量的增加,功能性缓释膜的厚度增大。并且相同添加量的样品,含有β-CD包埋物成分的样品厚度更大,这可能与环糊精分子的空间位阻较大有关,从而导致功能性缓释膜厚度增加。
拉伸强度随着S和S-β-CD添加物含量的提高,断裂伸长率和拉伸强度均降低;这是因为添加留兰香会使得聚丙烯的结晶结构完整性被破坏,分子链间距增大,分子间作用力降低,导致力学性能变差。而环糊精微胶囊可能在功能性缓释膜里发生团聚现象,导致应力集中,从而使拉伸强度和断裂伸长率显著降低,包埋物添加量越多可能导致添加物在PP中分散性越不均匀。所以综合上述分析,力学性能的优劣为:PP<0.5% S/PP<0.5%S-β-CD/PP<1.0% S/PP<1.0% S-β-CD/PP。
透光率是透过样品的光通量与射到试样上的光通量之比。透光率与功能性缓释膜的透明性成正比[20]。雾度是偏离入射光2.5°以上的透射光强占总透射光强的百分数。雾度与功能性缓释膜的通透性成反比,雾度越大,缓释膜的光泽和透明度越差。如表1所示,对于相同的包埋物添加组,添加量为0.5%的样品透光率高于1.0%的样品,添加量为0.5%的样品雾度小于1.0%的样品。这表明,随着包合物添加量的增加,功能性缓释膜的颜色加深、透明性变差。对于相同添加量包埋物的样品(0.5%S/PP和0.5% S-β-CD/PP、1.0% S/PP和1.0% S-β-CD/PP),含有β-CD的样品透光率更低。此外,透光率还与厚度有关,厚度增加导致透光率降低和雾度增加。因此,功能性缓释膜的透光率和雾度的变化是添加物质和厚度共同作用的结果[20]。
水蒸气透过率:PP<0.5% S/PP<1% S/PP<0.5% S-β-CD/PP<1% S-β-CD/PP。PP是非极性大分子,不亲水,对水蒸气的阻隔性最好,所以PP样品水蒸气透过率最小。和纯PP相比,添加S和S-β-CD后,聚丙烯分子链间距离加大,所以导致水蒸气透过率增大。0.5% S/PP和1.0% S/PP相比,随着留兰香添加量的增加,水蒸气透过率增加,这是因为留兰香添加量越多,PP分子链间距越大导致的。0.5% S/PP和0.5% S-β-CD/PP相比,随着β-CD包埋物的添加,水蒸气透过率增大,这是因为β-CD亲水,并且β-CD分子空间位阻较大使得分子链间距进一步加大导致的。0.5% S-β-CD/PP和1% S-β-CD/PP相比,β-CD添加量越大,水蒸气透过率越大。
2.2 不同功能性缓释膜的抑菌活性
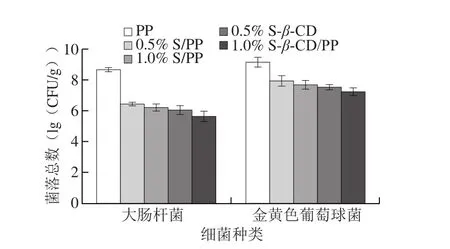
图1 不同功能性缓释膜对大肠杆菌和金黄色葡萄球菌的抑菌效果Fig. 1 Antibacterial effect of different functional sustained-release films on Escherichia coli and Staphylococcus aureus
图1显示0.5% S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP对大肠杆菌和金黄色葡萄球菌都有一定程度的抑制效果。与PP相比,0.5% S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP使大肠杆菌下降2.24、2.45、2.62、3.04(lg(CFU/g)),使金黄色葡萄球菌下降1.20、1.45、1.60、1.90(lg(CFU/g))。
结果显示,0.5% S-β-CD/PP、1.0% S-β-CD/PP相比于0.5% S/PP、1.0% S/PP的抑菌效果好,环糊精包埋组别的抑菌效果优于直接添加留兰香的组别;这说明环糊精可以在加工过程中保护留兰香的有效成分,避免在加工过程中200 ℃的高温对留兰香的破坏及有效成分的损失。并且1.0% S/PP的抑菌效果优于0.5% S/PP,1.0% S-β-CD/PP的抑菌效果优于0.5% S-β-CD/PP;这是因为添加量越大,释放抑菌成分越多,从而抑菌效果越好。本研究以革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌为代表研究抑菌效果,结果表明,0.5% S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP对革兰氏阴性菌的抑制效果优于革兰氏阳性菌;这可能是因为金黄色葡萄球菌和大肠杆菌的细胞壁有着明显的不同,留兰香中的抑菌有效成分是左旋香芹酮[21],左旋香芹酮在12.5 μg/mL即可对大肠杆菌和金黄色葡萄球菌起到良好杀菌效果。而留兰香通过破坏细菌的细胞壁使得细菌失活,革兰氏阴性菌细胞壁肽聚糖含量较革兰氏阳性菌少且细胞壁比革兰氏阳性菌的薄,所以对革兰氏阴性菌的抑制效果要明显优于阳性菌,从而导致抑菌效果的不同。
2.3 不同功能性缓释膜对乳化香肠贮藏过程中色泽的影响
e值是可以客观表示不同样品的色泽变化的参数[22],是受明亮度(L*)和黄度(b*)影响下的红度值,可以更直观地反映色泽的变化。如图2所示,前期各组香肠e值变化不大,随着时间的延长,均呈现明显的下降趋势。下降速率:PP>0.5% S/PP>1.0% S/PP>0.5%S-β-CD/PP>1.0% S-β-CD/PP。相对于PP组的色泽,相同的贮存时间,其他组别的色泽e值优于PP组;这主要是因为随着贮存时间延长,乳化香肠中氧合肌红蛋白与铁离子结合导致a*值降低,脂肪氧化和蛋白变性导致的b*值上升,从而使得e值下降。
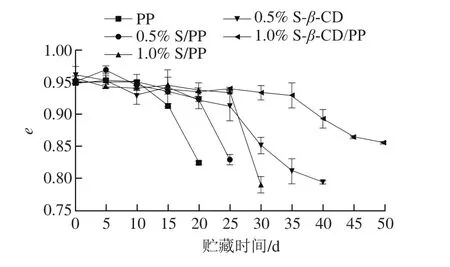
图2 贮藏时间对不同包装的乳化香肠e值的影响Fig. 2 Changes in e value of sausage samples packaged with different films during storage
0.5% S/PP、0.5% S-β-CD/PP、1.0% S/PP、1.0% S-β-CD/PP组分别在第25、40、30、50天时色泽明显变差,与PP组货架期截止时(20 d)的色泽存在显著差异(P<0.05),这说明β-CD包埋留兰香可以起到较好的缓释效果。
2.4 不同功能性缓释膜对乳化香肠贮藏过程中pH值的影响
pH值为判断肉与肉制品微生物腐败的重要标准[23],pH值下降的速率与程度对贮藏期间肉制品的颜色和细菌繁殖有重要的影响。
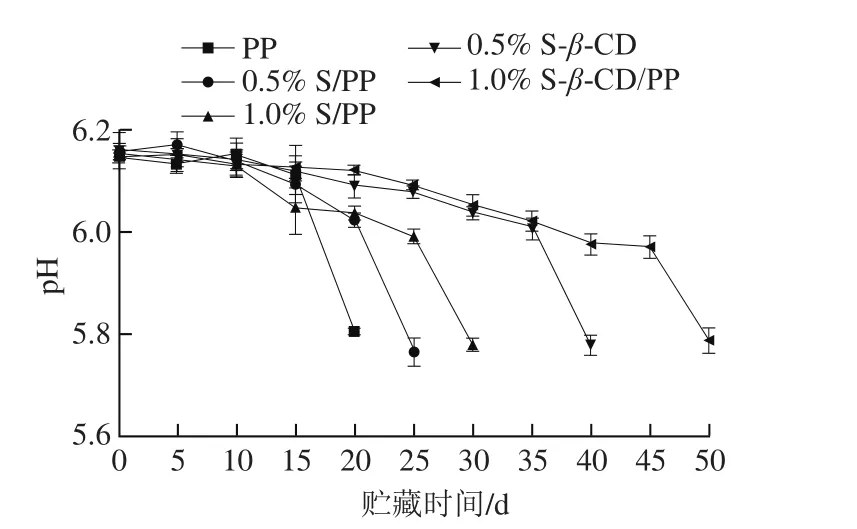
图3 贮藏时间对不同包装的乳化香肠pH值的影响Fig. 3 Changes in pH of sausage samples packaged with different films during storage
由图3可知,随着贮存时间的延长,乳化香肠的pH值呈下降趋势。中温杀菌后的乳化香肠由于初始pH值较高(6.15±0.02),为大多数微生物提供了合适的繁殖环境,导致货架期较短。结合pH值和菌落总数的变化可知,乳化香肠的pH值与菌落总数之间存在关联性。尤其贮存后期微生物繁殖快,发酵产酸导致pH值下降较快[24]。并且0.5% S-β-CD/PP和1.0% S-β-CD/PP的pH值的下降变化平缓,且相同贮藏时间时pH值显著高于PP组(P<0.05);这说明β-CD包埋材料缓释留兰香的效果显著,可以一定程度上抑制香肠表面微生物的繁殖,延缓了pH值的下降。β-CD包埋材料可以较大程度地延长产品的货架期,采用1.0% S-β-CD/PP包装的乳化香肠可以延长至50 d,效果大大优于采用PP包装(20 d)。
2.5 不同功能性缓释膜对乳化香肠贮藏过程中TBA含量的影响
丙二醛是脂质过氧化的分解产物,TBA是脂质氧化与丙二醛含量变化的综合衡量指标,可以直观分析肉制品的腐败程度。通常TBA含量越大,腐败程度越严重。王正勇等[25]认为,当肉制品TBA含量大于1 mg/kg时,该产品被认为已经腐败不能食用。

图4 贮藏时间对不同包装的乳化香肠TBA含量的影响Fig. 4 Changes in TBA value of sausage samples packaged with different films during storage
如图4所示,乳化香肠的初始TBA含量为0.47 mg/kg,不同的样品组都随着贮存时间的延长而不断上升,变化趋势一致;这说明整个贮存期间,脂肪氧化程度不断加大。贮藏时间大于20 d后,在相同的贮藏时间,其他组别的TBA含量显著低于PP组(P<0.05)。在产品贮存初期,是包装内部残存的氧气使得肉制品氧化,而随着贮存时间的延长,乳化香肠失水,使得包装膜的阻隔性进一步下降,脂肪氧化程度加重。而PP组最早腐败则可能与微生物超标有一定的关联性[26]。这进一步说明,留兰香和β-CD包埋留兰香的添加缓释薄膜可以显著抑制中温乳化香肠肉制品中脂质的氧化,从而减少TBA的产生,延长乳化香肠的贮存期。
2.6 不同功能性缓释膜对乳化香肠贮藏过程中菌落总数的影响
参照GB 4789.1—2016《食品安全国家标准 食品微生物学检验 总则》[27]中的采样方案进行三级采样。参照GB 2726—2016《食品安全国家标准 熟肉制品》[28]中的微生物限量进行分析。同一批次采集样品数n=5,最大允许超出微生物指标可接受水平限量值的样品数(c)为2,微生物指标可接受水平限量为104,微生物指标的最高安全限量M=105。
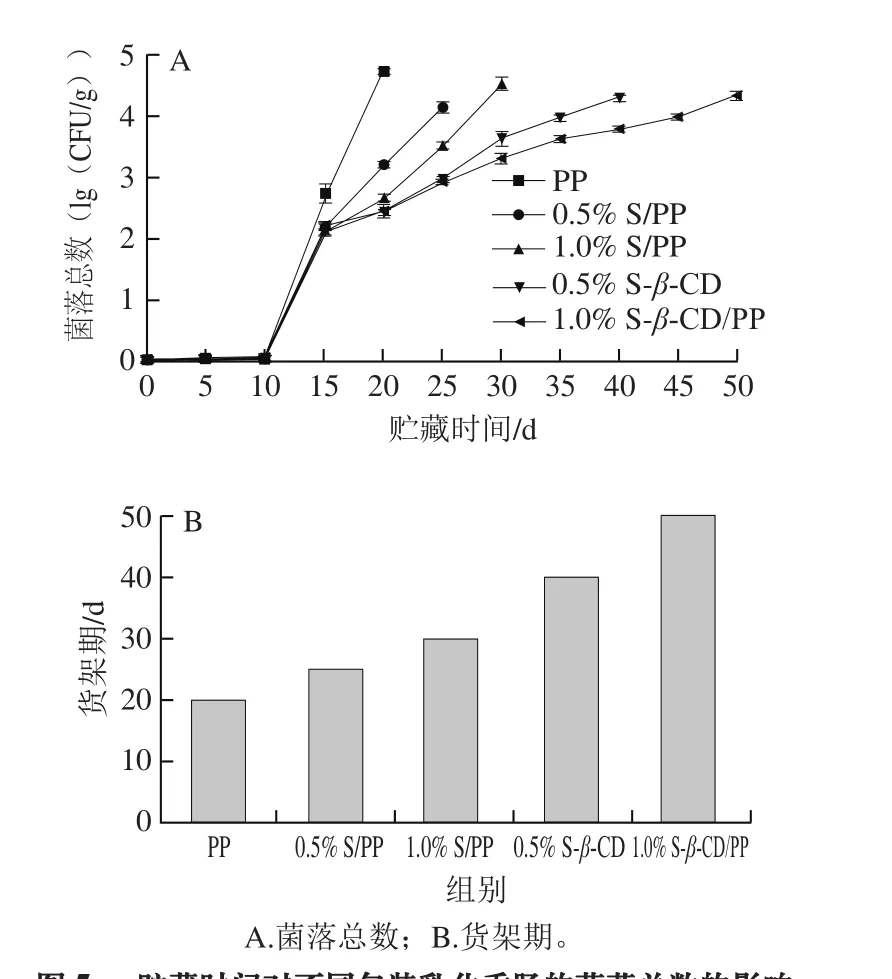
图5 贮藏时间对不同包装乳化香肠的菌落总数的影响Fig. 5 Changes in total bacterial count of sausage samples packaged with different films during storage
由图5A可知,在贮藏期间,乳化香肠的菌落总数随着贮藏时间延长不断增加,相同贮藏时间时,PP组的菌落总数高于另外4 组。第20天,未经处理的PP组乳化香肠菌落总数为(4.73±0.02)(lg(CFU/g)),c=5,菌落总数超标;第25天,0.5% S/PP组乳化香肠菌落总数为(4.15±0.09)(lg(CFU/g)),c=5,菌落总数超标;第30天,1.0% S/PP组乳化香肠菌落总数为(4.53±0.11)(lg(CFU/g)),c=5,菌落总数超标;第40天,0.5% S-β-CD/PP组乳化香肠菌落总数为(4.31±0.03)(lg(CFU/g)),c=5,菌落总数超标;第50天,1.0% S-β-CD/PP组乳化香肠菌落总数为(4.53±0.11)(lg(CFU/g)),c=5,菌落总数超标。
由图5B可知,随着留兰香添加量的增加,乳化香肠的货架期延长,0.5% S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP可分别延长货架期至25、30、40、50 d,说明这4 种抗菌膜可以在一定程度上抑制香肠表面微生物的繁殖。留兰香的抑菌机理是有效成分利用其疏水性与细菌的细胞膜结合,使得微生物菌体溶胀裂解,从而抑制微生物的繁殖[29-30]。对该指标进一步分析得到,β-CD包埋留兰香后,留兰香的持续抑菌能力更久。这是因为β-CD具有很好的热稳定性,β-CD的分子结构在280 ℃被破坏,开始热重损失发生降解,适合200 ℃以下的热加工处理;而本研究吹塑的模头温度是200 ℃,采用β-CD作为包埋介质可以极大地保护在薄膜加工过程中温度对留兰香物质有效成分的破坏,可以很大程度上解决肉制品货架期短的问题。
3 结 论
本研究利用β-CD包埋留兰香提取物制备抑菌缓释聚丙烯基薄膜,留兰香的有效成分因其疏水性可与细菌细胞膜结合,使得微生物菌体溶胀裂解,从而抑制微生物的繁殖。本实验采用挤出吹塑法制备了PP、0.5%S/PP、1.0% S/PP、0.5% S-β-CD/PP、1.0% S-β-CD/PP,比较分析了不同种功能性缓释膜厚度、力学性能、透光率、水蒸气透过率、抑菌性能和乳化香肠的色泽、pH值、TBA含量、菌落总数等指标;结果表明:在贮藏期间,1.0% S-β-CD/PP薄膜包装可以显著减少乳化香肠TBA的产生,降低菌落总数,使得乳化香肠保持良好的品质从而延长货架期。综合考虑,1.0% S-β-CD/PP薄膜包装的乳化香肠的货架期最长,可以延长至50 d,微生物繁殖是影响中温肉制品货架期的关键因素。本研究为中温乳化香肠的生产及贮藏提供了解决方法,可以很大程度解决肉制品货架期的问题,可进一步应用在肉制品的包装上,具有实际应用价值。
[1] MARTÍNEZ-ABAD A, LAGARÓN J M, OCIO M J. Characterization of transparent silver loaded poly (L-lactide) films produced by melt-compounding for the sustained release of antimicrobial silver ions in food applications[J]. Food Control, 2014, 43(5): 238-244.DOI:10.1016/j.foodcont.2014.03.011.
[2] WU J L, LIU H, GE S Y, et al. The preparation, characterization,antimicrobial stability and in vitro, release evaluation of fish gelatin films incorporated with cinnamon essential oil nanoliposomes[J].Food Hydrocolloids, 2015, 43: 427-435. DOI:10.1016/j.foodhyd.2014.06.017.
[3] LEE J, LEE Y H, JONES K, et al. Antimicrobial packaging of raw beef, pork and turkey using silver-zeolite incorporated into the material[J]. International Journal of Food Science and Technology,2011, 46(11): 2382-2386. DOI:10.1111/j.1365-2621.2011.02760.x.
[4] KREPKER M, SHEMESH R, POLEG Y D, et al. Active food packaging films with synergistic antimicrobial activity[J]. Food Control, 2017, 76: 117-126. DOI:10.1016/j.foodcont.2017.01.014.
[5] MEI L, TENG Z, ZHU G, et al. Silver nanocluster-embedded zein films as antimicrobial coating materials for food packaging[J]. ACS Applied Materials and Interfaces, 2017, 9: 35297-35304. DOI:10.1021/acsami.7b08152.
[6] FASIHNIA S H, PEIGHAMBARDOUST S H, PEIGHAMBARDOUST S J. Nanocomposite films containing organoclay nanoparticles as an antimicrobial (active) packaging for potential food application[J].Journal of Food Processing and Preservation, 2018, 42(2): e13488.DOI:10.1111/jfpp.13488.
[7] LIU Y W, WANG S Y, LAN W T. Fabrication of antibacterial chitosan-PVA blended film using electrospray technique for food packaging applications[J]. International Journal of Biological Macromolecules,2018, 107: 848-854. DOI:10.1016/j.ijbiomac.2017.09.044.
[8] WU Z J, WU J J, PENG T T, et al. Preparation and application of starch/polyvinyl alcohol/citric acid ternary blend antimicrobial functional food packaging films[J]. Polymers, 2017, 9(3): 2-19.DOI:10.3390/polym9030102.
[9] YANG F X, HU S F, LU Y, et al. Eあects of coatings of polyethyleneimine and thyme essential oil combined with chitosan on sliced fresh Channa argus during refrigerated storage[J]. Journal of Food Process Engineering,2015, 38(3): 225-233. DOI:10.1111/jfpe.12155.
[10] 金征宇. 环糊精化学: 制备与应用: Cyclodextrin chemistry:preparation and application[M]. 北京: 化学工业出版社, 2009: 8-10.
[11] 翟秀超. 挤压法制备抗菌包装膜及其性质研究[D]. 无锡: 江南大学,2013: 17-18.
[12] 国家质量监督检验检疫总局. 塑料薄膜与薄片厚度的测定 机械测量法: GB/T 6672—2001[S]. 北京: 中国标准出版社, 2001: 1-2.
[13] 国家质量监督检验检疫总局, 国家标准化管理委员会. 塑料 拉伸性能的测定 第1部分: 总则: GB/T 1040.1—2006[S]. 北京: 中国标准出版社, 2006: 1-2.
[14] 国家质量监督检验检疫总局, 家标准化管理委员会. 透明塑料透光率和雾度的测定: GB 2410—2008[S]. 北京: 中国标准出版社,2006:1-4.
[15] 户帅锋, 于洁, 赵碧洁, 等. 负载山梨酸的壳聚糖微囊-EVOH抗菌薄膜对黑鱼鱼肉保鲜的影响[J]. 食品科学, 2017, 38(15): 237-243.DOI:10.7506/spkx1002-6630-201715038.
[16] 方梦琳. 羊肉对羊肉香肠加工适宜性的品质评价技术研究[D]. 北京: 北京林业大学, 2008: 29-30.
[17] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 肉与肉制品 pH测定: GB/T 9695.5—2008[S]. 北京: 中国标准出版社,2008: 1-2.
[18] 国家卫生和计划生育委员会. 食品安全国家标准 食品中丙二醛的测定: GB 5009.181—2016[S]. 北京: 中国标准出版社, 2016: 3-6.
[19] 国家卫生和计划生育委员会. 食品安全国家标准 食品中微生物学检验 菌落总数的测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016: 1-5.
[20] 孙淼. 基于丁香精油/β-环糊精包合物的聚乙烯醇抗菌膜的制备及性能研究[D]. 株洲: 湖南工业大学, 2012: 24-25.
[21] 潘旭迟, 许剑锋, 傅昱晟, 等. 3 种植物挥发油抑制食源性细菌生长活性成分及机理[J]. 食品科学, 2017, 38(13): 143-149. DOI:10.7506/spkxl1002-6630-201713024.
[22] 段艳, 杨扬, 翟钰佳, 等. 燕麦粉及低聚果糖对发酵香肠品质特性的影响[J]. 食品研究与开发, 2017, 38(18): 92-98.
[23] 贾晓云, 张顺亮, 刘文营, 等. 乳酸链球菌素-普鲁兰多糖-海藻酸钠可食用抗菌共混膜的制备及其在生鲜肉保鲜中的应用[J]. 肉类研究, 2017, 31(4): 17-22. DOI:10.7506/rlyj1001-8123-201704004.
[24] 潘晓倩, 赵燕, 张顺亮, 等. 中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J]. 食品科学, 2016, 37(7): 93-98. DOI:10.7506/spkx1002-6630-201607018.
[25] 王正勇, 盛益东. 肉制品中的脂肪氧化[J]. 江苏食品与发酵, 1999(1):16-19.
[26] KĘSKA P, LIBERA J, STADNIK J. Comparison of antioxidant activity of protein isolates derived from selected dry-cured meat products[J].Journal of Food Processing and Preservation, 2017, 41(3): e12933.DOI:10.1111/jfpp.12933.
[27] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 总则: GB 4789.1—2016[S]. 北京:中国标准出版社, 2016: 1-5.
[28] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 食品安全国家标准 熟肉制品: GB 2726—2016[S]. 北京: 中国标准出版社,2016: 1-2.
[29] AHMAD A, KHAN A, AKHTAR F, et al. Fungicidal activity of thymol and carvacrol by disrupting ergosterol biosynthesis and membrane integrity against Candida[J]. European Journal of Clinical Microbiology and Infectious Diseases, 2011, 30(1): 41-50.DOI:10.1007/s10096-010-1050-8.
[30] AL-TAWAHA A M, AL-KARAKI G, MASSADEH A. Comparative response of essential oil composition, antioxidant activity and phenolic contents spearmint (Mentha spicata L.) under protected soilless vs.open field conditions[J]. Advances in Environmental Biology, 2013,7(5): 902-910.
