降香内生真菌代谢产物对H2O2诱导的HepG2细胞氧化损伤保护作用
2018-06-19王福玲周艳岩张晓萌咸玥桐
高 原,王福玲,贾 琦,刘 微,周艳岩,张晓萌,咸玥桐
(哈尔滨商业大学药学院,细胞与分子生物学研究所,黑龙江 哈尔滨 150076)
降香檀(Dalbergia odorifera T. Chen)为豆科檀属植物,别名降香、花梨木,是国家二级保护植物[1-3]。降香檀(简称降香)的树干和根的干燥心材降香为我国传统中药,多用于脘腹疼痛,跌扑损伤,外伤出血的治疗,常与其他活血化瘀药配伍用于心血管疾病的治疗[4-6]。降香的主要化学成分为挥发油类和黄酮类化合物。现代药理学研究表明其成分具有抗氧化、抗肿瘤、抗炎、抗凝血、抗高血脂、舒张血管、抑制中枢神经系统以及抑制白细胞三烯生物合成等作用[7-10]。降香资源日益紧缺,生长周期长,分布受到地域限制并在一定程度上受环境的影响。如果直接以降香为研究对象,从降香中提取分离活性成分,会面临着破坏植物资源、采集困难、耗时耗力等诸多难题。为了解决这些问题,本研究将目光转向降香内生真菌。内生真菌作为丰富的次生代谢产物的天然药库,有着巨大的开发潜能。如果利用植物内生真菌发酵生产活性次生代谢产物,能够降低成本、节约资源,对保护环境亦有重大贡献。
自由基是生物体内生命活动的一种正常代谢产物,当机体处于正常情况下,体内自由基的产生和消除处于一种动态的平衡状态[11-12],然而当某种原因打破这种动态的平衡后,自由基就会导致组织细胞的氧化损伤并引发多种疾病[13-14]。这种过氧化反应在某些化合物的作用下,是可以逆转的,抗氧化剂即能防止这一现象的产生。由于人工合成抗氧化剂在生物体内沉降积累,不易分解,容易对机体造成损伤,所以天然抗氧化剂的开发和应用越来越受到人们的关注。丙二醛(malonic dialdehyde,MDA)是肝细胞脂质过氧化反应的终产物,MDA的测定可以用于评价氧自由基介导的细胞损伤。超氧化物歧化酶(superoxide dismutase,SOD)能清除超氧阴离子自由基,保护细胞免受损伤,其活力反应机体清除氧自由基的能力。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)能够有效清除脂质和其他的有机氢过氧化物,是氧化应激中发挥保护作用的重要酶[15-17]。以上酶及相关产物的检测往往是抗氧化活性评价的重要指标。
本研究通过从降香中分离内生真菌,并初步筛选获得一株抗氧化活性较好的菌株,并对其进行分类鉴定。拟通过构建HepG2细胞氧化损伤模型,观察降香内生真菌代谢产物对HepG2细胞氧化损伤的保护作用,为探讨其抗氧化损伤机理提供理论依据。
1 材料与方法
1.1 材料与试剂
降香新鲜植株,购自广东省广州市老果农实验基地;HepG2细胞,哈尔滨商业大学细胞与分子生物学研究所保存。
染料木素标准品(纯度≥98%) 上海伊卡生物技术有限公司;白藜芦醇(纯度≥98%) 西安玉泉生物科技有限公司;氨苄青霉素 美国Sigma公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 北京中生瑞泰科技有限公司;MDA、SOD和GSH-Px试剂盒 南京建成生物工程研究所;次氯酸钠 西陇化工股份有限公司;RPMI 1640培养基、胎牛血清 杭州四季青生物工程材料有限公司;马铃薯葡萄糖琼脂培养基、琼脂粉 北京奥博星生物技术有限责任公司;酵母浸粉 安琪酵母股份有限公司;葡萄糖 天津市天力化学试剂有限公司;氯化钠国药集团化学试剂有限公司。
1.2 仪器与设备
RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HH-2型恒温水浴箱 江苏省金坛市荣华仪器制造有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;电热鼓风干燥箱、生化培养箱、BP-9082型精密恒温培养箱 上海一恒科学仪器有限公司;BSA6202S-CW电子分析天平、PB-10 pH计 赛多利斯科学仪器有限公司;ZHWY-2102恒温培养振荡器 上海智城分析仪器制造有限公司;XSP-12CD型光学显微镜上海沪杏光学仪器有限公司;1100高效液相色谱(high performance liquid chromatography,HPLC)仪美国Agilent公司;AB Sciex API3000质谱(mass spectrometry,MS)仪(三重四极杆串联MS检测器)美国SCIEX公司;ELx800酶标仪 美国BioTek公司;CO2培养箱 德国Memmert公司。
1.3 方法
1.3.1 降香内生真菌的分离与培养
新鲜降香树皮,洗涤剂洗净表面污垢,清水冲洗。无菌条件下进行组织表面消毒:75%的乙醇100 mL浸泡1 min,无菌水漂洗2~3 次,10%的NaClO 100 mL溶液分别浸泡5 min,无菌水100 mL漂洗2~3 次,每次1 min,最后用无菌滤纸吸干表面水分,备用[18-19]。将降香树皮用镊子撕下并剪成适宜大小的组织块,放置于氨苄青霉素终质量浓度为100 µg/mL的PDA培养基上,30 ℃培养3~10 d,以最后一次无菌水涂抹印记作为阴性对照。待长出真菌后,挑去尖端菌丝,反复纯化,保存备用。
将已纯化的降香内生真菌菌种活化后,接种于200 mL马铃薯葡萄糖液体培养基中,30 ℃摇床培养2 周后,菌种4 层纱布过滤后烘干,乙酸乙酯浸提,发酵培养液乙酸乙酯萃取后,二者合并后浓缩得浸膏,溶于1 mL甲醇备用。
1.3.2 降香内生真菌的抗氧化活性筛选
通过DPPH清除自由基实验对降香内生真菌代谢产物的抗氧化活性进行筛选。按下式计算DPPH自由基清除率。用无水乙醇做空白对照[20]。
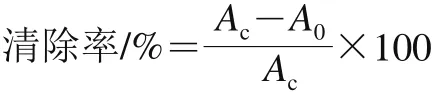
式中:Ac为无水乙醇+DPPH的吸光度;A0为样品+无水乙醇+DPPH的吸光度。
1.3.3 降香内生真菌的鉴定
真菌总DNA提取采用CTAB法[21],以ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)为引物,通过聚合酶链式反应(polymerase chain reaction,PCR)获得ITS-rDNA扩增片段[22-23]。PCR体系(50 μL):5 μL 10×PCR buffer、4 μL 25 mmol/L MgCl2、4 μL 2.5 mmol/L dNTP、5 μL 0.5 μmol/L上游引物、5 μL 0.5 μmol/L下游引物、0.2 μL 5 U/μL Taq酶、26.8 μL无菌去离子水。PCR扩增程序:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30 个循环。DNA片段回收纯化后送往上海生物工程有限公司测序,所得结果在GenBank上进行同源性比对,并利用软件MEGA 5.0构建系统发育树,确定菌株分类地位[24]。
1.3.4 降香内生真菌代谢产物检测
精确称量内生真菌乙酸乙酯萃取物溶于色谱甲醇,质量浓度为10 µg/mL,0.22 µm滤膜过滤。采用HPLCMS/MS法检测[25]。色谱条件:色谱柱:HiQ SiL C18柱,250 mm×4.6 mm;流动相:甲醇-水(含1%的甲酸),梯度洗脱:91%甲醇0~10 min,91%~57%甲醇10~25 min,57%~91%甲醇25~40 min;流速1.0 mL/min;进样量10 µL,用染料木素标准品做对照。质谱条件:离子源为ESI源,多反应监测负离子扫描,离子喷雾电压-4 500 V,去簇电压、碰撞电压、入口电压和出口电压分别为-60、-25、-10、-5 V。用于分析的染料木素离子质荷比(m/z)为269.1~133.0。
1.3.5 内生真菌产物对H2O2诱导肝细胞抗氧化酶活力等指标的影响
取处于对数生长期的HepG2细胞接种于6 孔培养板,每孔1×104细胞,培养约12 h后,分为阴性对照组、阳性对照组和不同质量浓度的内生真菌代谢产物组。阴性对照组不加受试物;阳性对照组只加入200 µmol/L H2O2干预6 h,内生真菌代谢产物组分别加入的质量浓度为0、1、5、10、20、40 µg/mL预处理12 h,各代谢产物组再加入200 µmol/L H2O2作用6 h,置于37℃、5% CO2培养箱中培养。干预结束后用0.01 mol/L磷酸盐缓冲液清洗2 次,然后每孔加入1% Triton100的磷酸盐缓冲液0.5 mL,细胞裂解液裂解细胞后2 000 r/min离心10min取得上清液,参照试剂盒要求,测定细胞中MDA水平、SOD、GSH-Px活力等相关氧化损伤的指标[26-28]。阳性对照药选取白藜芦醇(0~40 µg/mL)。
1.4 数据统计分析
应用SPSS统计软件包进行数据统计学处理。采用方差分析并行方差齐性检验;结果以表示。
2 结果与分析
2.1 降香内生真菌的分离及抗氧化活性筛选
通过组织表面消毒法初步从降香树皮部分离获得内生真菌83 株,通过DPPH自由基清除率实验,对稀释不同倍数(0.031×、0.063×、0.13×、0.25×、0.50×和1.00×)的内生真菌发酵浓缩液进行了检测,初步筛选获得了一系列抗氧化活性较好的内生真菌,其中内生真菌JXP21抗氧化活性最佳,计算得其半数抑制浓度为0.052×内生真菌浓缩液。
2.2 降香内生真菌的鉴定
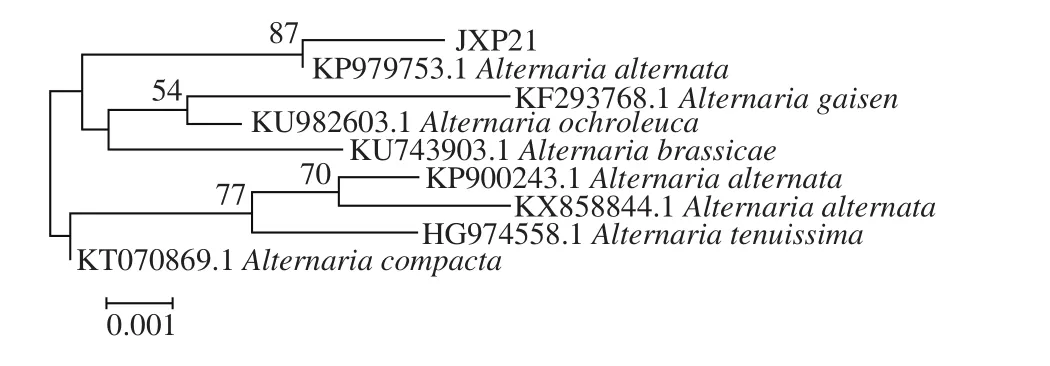
图1 降香内生真菌JXP21 ITS序列系统进化树发育分析Fig. 1 Phylogenetic tree analysis of endophyte JXP21 based on ITS sequence
通过对菌株JXP21进行DNA的提取及PCR扩增回收,测序获得菌株JXP21的ITS-rDNA序列,用BLAST与GenBank数据库中的序列比较,从中获得与该菌株序列相近种属的ITS-rDNA序列,构建系统发育树。结合真菌形态学及分子生物学比对结果(图1),菌株JXP21鉴定为链格孢菌(Alternaria alternata),与Alternaria alternata(KP979753.1)具有100%的相似性。
2.3 降香内生真菌代谢产物的检测
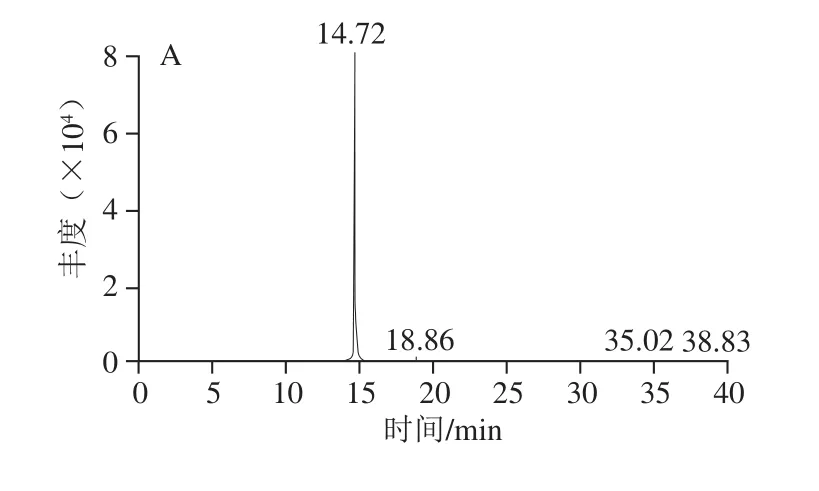
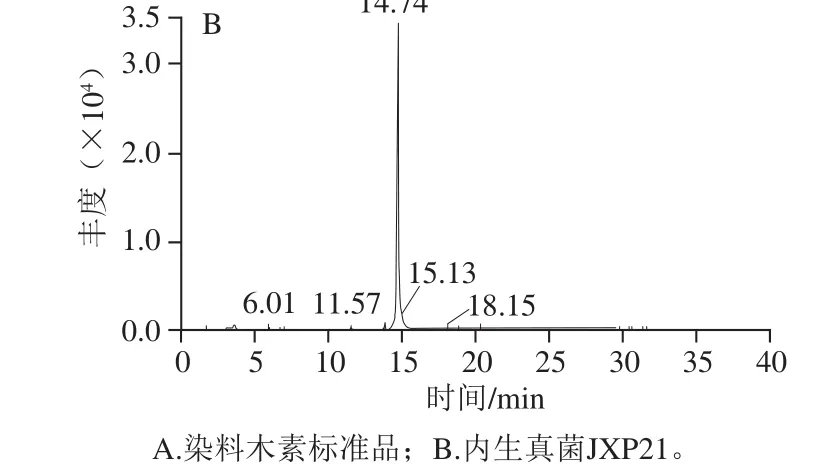
图2 降香内生真菌JXP21次生代谢产物的HPLC-MS/MS检测Fig. 2 HPLC-MS/MS analysis of secondary metabolites from JXP21
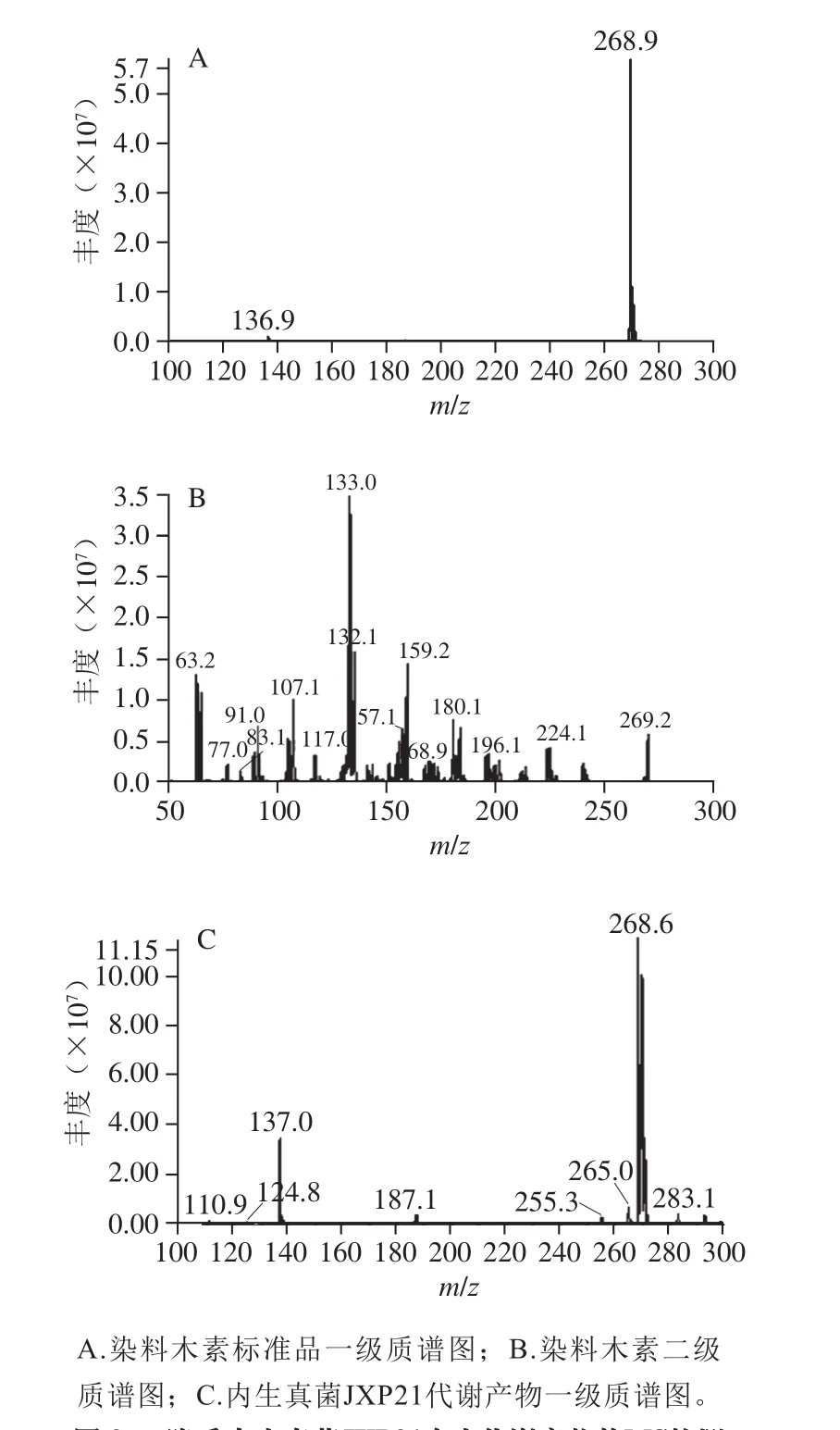
图3 降香内生真菌JXP21次生代谢产物的MS检测Fig. 3 Mass spectra of secondary metabolites from JXP21
采用HPLC-MS/MS成对捕捉检测结果显示,在内生真菌JXP21的乙酸乙酯层中,检测出了染料木素,出峰时间为14.74 min,m/z 269.1~133.0(图2),一级、二级质谱图如图3所示。染料木素(genistein)为异黄酮的一种,它具有弱雌激素活性、抗癌、预防心血管疾病等功能,此外,还具有抗氧化、抗衰老、抗真菌、抑制真菌活性及酪氨酸蛋白激酶活性的功能[29-30],通常存在豆科植物中,也在降香中存在。在内生真菌代谢产物中检测得到染料木素可能与其宿主环境的影响有关,内生真菌JXP21的抗氧化活性也可能受到染料木素的影响。
2.4 降香内生真菌萃取物对H2O2诱导HepG2细胞抗氧化酶活力的影响
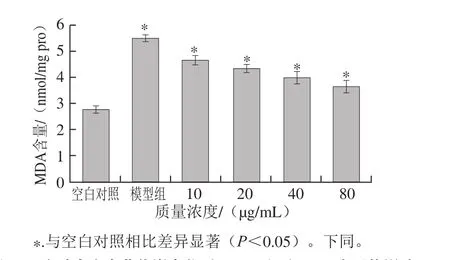
图4 降香内生真菌代谢产物对HepG2细胞MDA水平的影响Fig. 4 Effect of metabolites from JXP21 on MDA level in HepG2 cells
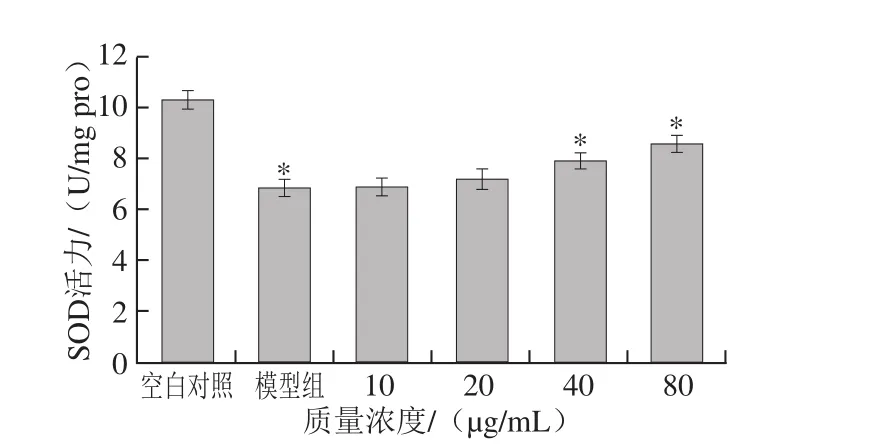
图5 降香内生真菌代谢产物对HepG2细胞SOD活力的影响Fig. 5 Effect of metabolites from JXP21 on SOD activity in HepG2 cells
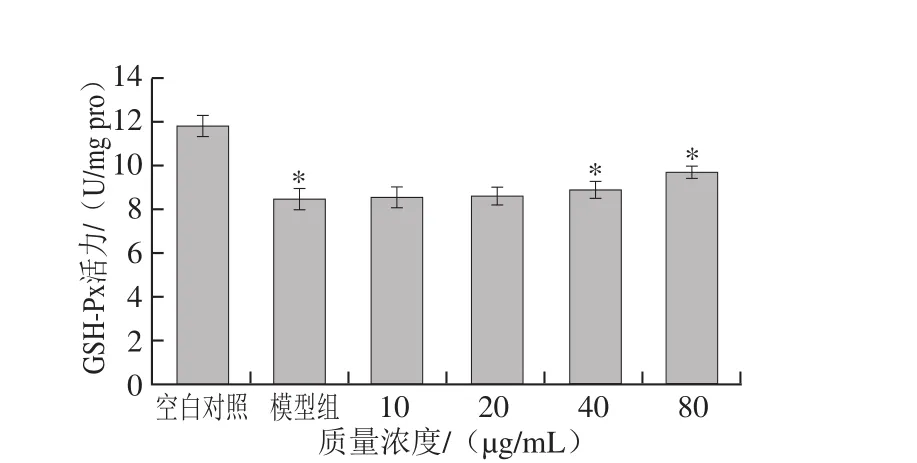
图6 降香内生真菌代谢产物对HepG2细胞GSH-Px活力的影响Fig. 6 Effect of metabolites from JXP21 on GSH-Px activity in HepG2 cells
与空白对照组比较,H2O2诱导模型组细胞悬液中SOD活力明显降低,GSH-Px活力明显下降,MDA水平明显升高。内生真菌代谢产物作用于HepG2细胞后,与模型组相比,能够降低H2O2诱导损伤引起的MDA含量的升高,MDA含量由4.65 nmol/mg pro下降为3.68 nmol/mg pro。提高SOD和GSH-Px活力,SOD活力由6.88 U/mg pro升高至8.64 U/mg pro,GSH-Px活力由8.45 U/mg pro升高至9.68 U/mg pro。且变化趋势均呈明显的剂量依赖性(图4~6)。与阳性对照白藜芦醇(0~40 µg/mL)结果呈现一致性,白藜芦醇作用HepG2细胞后,MDA含量下降1.82 nmol/mg pro,SOD活力上升1.53 U/mg pro,GSH-Px活力上升2.13 U/mg pro。
3 结 论
本实验通过组织表面消毒法,从降香树皮中分离出大量内生真菌,初步筛选获得一株具有良好抗氧化活性的降香内生真菌JXP21。通过分子生物学方法,对内生真菌JXP21进行了鉴定,系统发育分析初步判定JXP21为链格孢菌。进一步对JXP21扩大培养,富集纯化代谢产物,通过HPLC-MS/MS检测,初步检测出一种活性成分——染料木素,推测该菌株活性与该化合物有一定的关系。在内生真菌JXP21代谢产物对H2O2诱导的HepG2细胞氧化损伤的保护作用研究中表明,适当质量浓度的降香内生真菌JXP21代谢产物能抑制H2O2所诱导的细胞氧化应激损伤,JXP21代谢产物对H2O2所致的肝细胞损伤有明显的抗氧化作用,能够提高HepG2细胞的SOD和GSH-Px的活力,降低MDA含量,表明内生真菌JXP21代谢产物对肝细胞具有一定的保护作用。关于内生真菌及其次生代谢产物的研究目前已经较为成熟,但是关于降香内生真菌及其代谢产物的研究目前报道较少,对降香这种国家二级保护植物的内生真菌的分离培养,不仅为降香资源的开发和利用提供了新途径,也为该药用植物及其其内生真菌之间的关系提供了一定的理论依据。本课题组也将继续对降香内生真菌的次级代谢产物进行研究与探讨,对次生代谢产物的抗氧化机制进一步深入的研究。
[1] 国家药典委员会. 中华人民共和国药典[S]. 一部, 北京: 中国医药科技出版社, 2015: 229.
[2] 赵夏博, 梅文莉, 龚明福, 等. 降香挥发油的化学成分及抗菌活性研究[J]. 广东农业科学, 2012, 39(3): 95. DOI:10.16768/j.issn.1004-874x.2012.03.020.
[3] 王文燕, 王靖, 张铁军. 降香挥发油的指纹图谱研究[J]. 中草药,2007, 38(1): 66-68.
[4] 郑联合, 黄星, 王莉, 等. 降香黄檀籽油的理化性质及化学成分分析[J].中国油脂, 2011, 36(11): 73-76.
[5] 刘洪玲. GC-MS法分析降香挥发油化学成分[J]. 中成药, 2009,31(6): 915-917.
[6] 章碎凡, 季叶静. 不同提取方法对降香中挥发油有效成分及含量的影响[J]. 中国基层医药, 2013, 20(5): 743.
[7] 潘有智. 降香叶中四种主要黄酮类成分的提取和富集分离工艺研究[D]. 哈尔滨: 东北林业大学, 2014: 1-5.
[8] WANG H, MEI W L, ZENG Y B, et al. Phenolic compounds from Dalbergia odorifera[J]. Phytochemistry Letters, 2014, 9: 168-173.DOI:10.1016/j.phytol.2014.06.008.
[9] YANG Z H, MEI C, HE X H, et al. Advance in studies on chemical constitutions, pharmacological mechanism and pharmacokinetic profile of Dalbergiae Odoriferae Lignum[J]. China Journal of Chinese Materia Medica, 2013, 38 (11): 1679-1683.
[10] ZHENG L H, HUANG X, WANG L, et al. Physicochemical properties, chemical composition and antioxidant activity of Dalbergia odorifera T. Chen seed oil[J]. Journal of the American Oil Chemists Society, 2012, 89: 883-890. DOI:10.1016/j.foodres.2015.04.018.
[11] LIU R H, WEN X C, SHAO F, et al. Flavonoids from heartwood of Dalbergia cochinchinensis[J]. Chinese Herbal Medicines, 2016, 8(1):89-93. DOI:10.1016/S1674-6384(16)60014-X.
[12] LEPETSOS P, PAPAVASSILIOU A G. ROS/oxidative stress signalling in osteoarthritis[J]. BBA-Molecular Basis of Disease, 2016,1862(4): 576-591. DOI:10.1016/j.bbadis.2016.01.003.
[13] KANG M X, QIN W J, BUYA M, et al. VNN1, a potential biomarker for pancreatic cancer-associated newonset diabetes,aggravates paraneoplastic islet dysfunction by increasing oxidative stress[J]. Cancer Letters, 2016, 373(2): 241-250. DOI:10.1016/j.canlet.2015.12.031.
[14] 付余, 赵新淮. 鲑鱼皮明胶水解物的抗氧化活性及其对细胞氧化损伤的保护作用[J]. 食品工业科技, 2013, 34(5): 113-117.DOI:10.13386/j.issn1002-0306.2013.05.004.
[15] 李丽月. 檀香挥发油质控及其对PC12细胞氧化损伤的保护作用研究[D]. 广州: 广州中医药大学, 2013: 2-4.
[16] 赵旭, 刘寿荣, 冯仙菊, 等. 从氧化应激谈白藜芦醇对高尿酸介导的非酒精性脂肪肝大鼠的影响[J]. 中华中医药学刊, 2016, 34(5):1193-1195. DOI:10.13193/j.issn.1673-7717.2016.05.049.
[17] 徐俊杰, 吕士杰, 魏景艳. 含硒抗体模拟谷胱甘肽过氧化物酶的研究进展[J]. 吉林医药学院学报, 2010, 31(4): 220-223.
[18] 冉火苗, 孔望君, 蒋会芳, 等. 盐生海芦笋抗菌内生细菌的筛选与鉴定[J]. 食品与发酵工业, 2016, 42(3): 79-86. DOI:10.13995/j.cnki.11-1802/ts.201603014.
[19] 王艳红, 朱艳萍, 杨信东, 等. 温郁金抗炎抗氧化活性内生真菌的筛选[J]. 药物评价研究, 2013, 36(2): 90-94.
[20] SOKMEN M, ANGELOVA M, KRUMOVA E, et al. In vitro antioxidant activity of polyphenol extracts with antiviral properties from Geranium sanguineum L.[J]. Life Science, 2005, 76: 2981-2993.DOI:10.1016/j.lfs.2004.11.020.
[21] 吴发红, 黄东益, 黄小龙, 等. 几种真菌DNA提取方法的比较[J]. 中国农学通报, 2009, 25(8): 62-64.
[22] 黄芳, 韩婷, 秦路平. 等. 牡荆内生真菌的分离与鉴定[J]. 中国中药杂志, 2011, 36(14): 1945-1950.
[23] CHEN K H, J MIADLIKOWSKA, MOLNÁR K, et al. Phylogenetic analyses of eurotiomycetous endophytes reveal their close affinities to Chaetothyriales, Eurotiales, and a new order-Phaeomoniellales[J].Molecular Phylogenetics and Evolution, 2015, 85: 117-130.DOI:10.1016/j.ympev.2015.01.008.
[24] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: a guide to methods and applications[M]. San Diego:Academic Press,1990: 315-322. DOI:10.1016/B978-0-12-372180-8.50042-1.
[25] GAO Y, ZHAO J T, ZU Y G, et al. Antioxidant properties, superoxide dismutase and glutathione reductase activities in HepG2 cells with a fungal endophyte producing apigenin from pigeon pea[Cajanus cajan(L.) Millsp.][J]. Food Research International, 2012, 49(1): 147-152.DOI:10.1016/j.foodres.2012.08.001.
[26] 张培丽, 张帅, 陈雪香, 等. 桑葚多糖对H2O2诱导PC-12细胞氧化损伤的保护作用[J]. 现代食品科技, 2015, 31(11): 20-25. DOI:10.13982/j.mfst.1673-9078.2015.11.004.
[27] 黄娜娜. 柑橘精油抗氧化特性及对皮肤细胞氧化损伤的保护作用研究[D]. 武汉: 华中农业大学, 2016: 37.
[28] 陈亚蓝, 王雪青, 王怡雯, 等. 基于HepG2细胞模型研究普洱茶茶色素的抗氧化作用[J]. 食品科学, 2017, 38(1): 226-231. DOI:10.7506/spkx1002-6630-201701038.
[29] 王凤芹, 蒋可志, 李祖光. 银杏叶提取物中染料木素的分离纯化及结构鉴定[J]. 色谱, 2007, 25(4): 509-513.
[30] 邢江浩, 孙晓莉, 周军. HPLC同时测定鹰嘴豆中染料木素、刺芒柄花素和鹰嘴豆芽素A的含量[J]. 药物分析杂志, 2009, 29(1): 73-75.DOI:10.16155/j.0254-1793.2009.01.019.
