北极海洋红球菌B7740(Rhodococcus sp.)产类胡萝卜素和类异戊二烯醌的抗氧化、抗增殖活性
2018-06-19陈亚淑谢笔钧杨季芳陈吉刚孙智达
穆 青,陈亚淑,谢笔钧,杨季芳,陈吉刚,孙智达,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.浙江万里学院生物与环境学院,浙江 宁波 315100)
类胡萝卜素具有独特的多支链段和共轭双键,是天然色素中最重要的化合物之一。目前自然界发现的天然类胡萝卜素已有700多种,在生物圈如植物、动物和微生物中都具有广泛的分布[1]。由于类胡萝卜素在光化学反应中起到重要的作用,被认定是光保护色素。同时,类胡萝卜素也是重要的VA前体,而VA是人体必需的微量营养素且不能被人体自身合成,只能靠从外界摄入获得[2]。因为类胡萝卜素特殊的富含电子的长多烯碳链结构,其具有淬灭单线态氧、清除自由基的重要生理活性[3],在抗氧化、抗癌、预防白内障、保护视网膜细胞等方面有较广阔的应用前景,越来越多的被应用于食品和药物[4-6]。此外,一些微生物在特定的条件下能够合成类异戊二烯化合物作为次级代谢产物[7-8],通过微生物生产复杂的类胡萝卜素和类异戊二烯醌这种经济环保的方式,使其代谢产物在医学和食品化学领域得到进一步研究[9-13]。
细菌中的类异戊二烯醌类主要是甲基萘醌和泛醌[14]。其中,甲基萘醌又称VK2,其结构是由一个2-甲基-1,4-萘醌母环和母环C3位置连结不同数目的异戊二烯侧链组成。VK2属于凝血类维生素,因其在食品中微量存在,所以又有“铂金维生素”之称[15]。研究发现,VK2不仅有易于被人体吸收利用、生物活性强、安全性高等优点,而且能够增加骨密度,预防骨质疏松[16]、血管钙化[17]、肝癌及肝硬化[18]、老年痴呆等。传统的VK2一般采用化学法合成,具有产率低、产物活性低、副产物多等许多不足,而活性高的VK2仅能通过微生物发酵法制得[19-21]。因此,细菌产生的类异戊二烯醌类化合物具有广阔的应用前景。
根据本课题组研究成果显示,在优化从北极海洋红球菌B7740中提取类胡萝卜素的同时,发现并鉴定出其能产生大量的甲基萘醌-8(menaquinone-8,MK-8)[22]。研究表明,植物源的类胡萝卜素具有优异的抗氧化、抗增殖活性,但微生物红球菌B7740产类胡萝卜素和类异戊二烯醌的抗氧化活性目前还鲜见报道。因此,在本研究中,通过抗漂白能力、脂质氧化抑制能力和抗生物大分子(DNA、蛋白质)过氧化等方法测定红球菌产物B7CIQE(含类胡萝卜素、MK-8)的抗氧化活性。研究结果将有助于进一步探索其对癌症、心血管疾病的预防作用。
1 材料与方法
1.1 材料与试剂
北极海洋红球菌(Rhodococcus sp. B7740)冻干菌粉由浙江万里学院提供;花生油 山东鲁花集团有限公司;醋酸锌、甲醇、二氯甲烷、氢氧化钾、过硫酸钾、铁氰化钾、2,4-二硝基苯肼(2,4-dinitrophenyl hydrazine,DNPH)、无水硫酸钠、三氯乙酸、牛血清白蛋白、偶氮二异丁基脒盐酸盐、2,2’-偶氮(2-甲基丙基脒)(2,2’-azobis(isobutyronitrile),ABAP)、磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)、琼脂糖、四氢呋喃、硫酸亚铁、溴化乙锭、双氧水、盐酸、pBR322质粒、2,6-二叔丁基-4-甲基苯酚(2,6-di-tertbutyl-4-methylphenol,BHT) 国药集团化学试剂有限公司;溶菌酶(20 000 U/mg)、β-胡萝卜素、叶黄素、番茄红素(lycopene,Lyc)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG) 上海源叶有限公司;甲醇(色谱纯) 赛默飞世尔科技(中国)有限公司;甲基叔丁基醚(色谱纯) 上海阿拉丁生化科技有限公司。
1.2 仪器与设备
WH-3微型涡漩混合仪 上海沪西分析仪器有限公司;EL-104电子天平 梅勒特-托利多仪器(上海)有限公司;DK-98-II A型电热恒温水浴锅 天津市泰斯特仪器有限公司;UV-1800紫外-可见分光光度计 日本Shimadzu公司;5810R台式低温离心机德国Eppendorf公司;RE-3000旋转蒸发仪 上海亚荣生化仪器厂;DSC204F1型差示扫描量热(differential scanning calorimetry,DSC)仪 耐驰仪器上海有限公司;Multiskan™ GO 全波长酶标仪 赛默飞世尔科技(中国)有限公司;DYY6C型电泳仪 北京市六一仪器厂;0.22 μm有机滤膜、进样瓶 国药集团化学试剂有限公司。
1.3 方法
1.3.1 类胡萝卜素及类异戊二烯醌的提取
提取方法参考陈亚淑等[22]所作的描述。北极海洋红球菌B7740经由酶法破壁,甲醇和二氯甲烷混合溶剂提取得到B7CIQE,测定其提取量,再将提取液经减压旋转蒸发后,充入氮气封口保存。其在450 nm波长处有3 个吸收峰,确定B7CIQE为类胡萝卜素,其中经液相色谱-质谱联用鉴定出2 种甲基萘醌类类胡萝卜素,MK-8(H2)和MK-8(H4)。B7CIQE的质量(m)根据公式(1)计算。
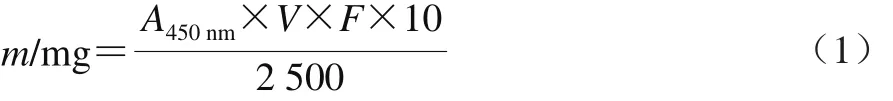
式中:A450nm代表提取液在450 nm波长处的吸光度;V代表提取液的体积/mL;F代表测定时稀释的倍数。
1.3.2 β-胡萝卜素抗漂白能力
本实验参照Kuzina等[23]的方法。具体步骤如下,β-胡萝卜素以0.2 mg/mL的质量浓度溶解于二氯甲烷中,取该溶液2 mL,与20 μL亚油酸、20 μL吐温20混合后转移至平底烧瓶中,并于40 ℃负压悬蒸10 min。随后向平底烧瓶中加入100 mL的去离子水。平均取5 mL溶液分装于试管中,分别加入溶解于二氯甲烷的0.2 mL不同质量浓度的B7CIQE和阳性对照(BHT、Lyc、EGCG)溶液,并设空白(不加样品,其余条件相同)对照,放置于50 ℃水浴,每隔15 min测一次470 nm波长处的吸光度,直到β-胡萝卜素溶液颜色褪去。实验重复3 次,取平均值。β-胡萝卜素抗氧化抑制率根据公式(2)计算。

式中:AA代表氧化抑制率/%;A0代表样品组初始吸光度;At代表时间t时样品组的吸光度;A00代表空白组初始吸光度;A0
教师A在反思日志中提到了自己反思内容的困惑,教师A想要解决这些问题,但是由于各方面原因影响整体解决效果。
t代表空白组时间t时的吸光度。
1.3.3 脂质氧化稳定性
本实验采用DSC进行脂质氧化稳定性的测定[24]。实验在氮气(60 mL/min)与氧气(20 mL/min)的条件下进行,温度范围308.2~573.2 K(35~300 ℃),升温速率为10.0 K/min。B7CIQE和植物来源类胡萝卜素用花生油配成58 μg/mL的溶液。将分散好的溶液进行压片,然后进行DSC测定。
1.3.4 类胡萝卜素对蛋白质氧化的抑制作用
本实验参照Cao[25]、Tian[26]等的方法。具体步骤如下,将100 μL类胡萝卜素(分散在四氢呋喃中的不同浓度B7CIQE和植物来源类胡萝卜素)与500 μL牛血清白蛋白(1 mg/mL)、200 μL FeSO4(5 mmol/L)、200 μL H2O2(80 mmol/L)在37 ℃下孵育0.5 h。反应结束后加入100 μL过氧化氢酶(0.5 mg/mL、3 000 U)终止反应。之后加入3 mL DNPH溶液,并在室温下于暗室孵育1 h,且每10 min进行一次涡漩。反应结束后加入800 μL 10%(质量分数,下同)的三氯乙酸溶液来沉淀蛋白质,并将溶液在12 000 r/min、4 ℃条件下离心15 min。沉淀用体积比1∶1的乙醇和乙酸乙酯洗涤3 次,最后将沉淀物充分溶解在1 mL的盐酸胍中。溶液的吸光度在370 nm波长处测定。蛋白质氧化抑制率根据公式(3)计算。式中:A对照代表对照组的吸光度;A空白代表空白组的吸光度;A样品代表样品组的吸光度。
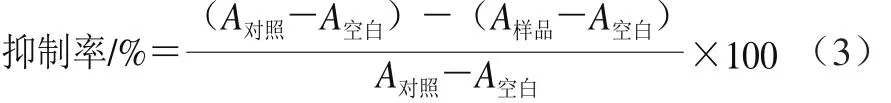
1.3.5 DNA链断裂保护实验
本实验参照Jung等[27]的方法。取10 μL pBR322(10 ng/μL)与10 μL 2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis-2-methyl-propanimidamide,dihydrochloride,AAPH)(10 mmol/L)溶解在PBS中,在37 ℃条件下孵育1 h。取5 μL B7CIQE与植物来源的类胡萝卜素在二甲基亚砜(dimethyl sulfoxide,DMSO)中进行孵育。孵育结束后,取9 μL混合液,加入1 μL 10 倍十二烷基硫酸钠DNA上样液,然后进行琼脂糖凝胶电泳。各泳道加样情况为:泳道1只添加pBR322溶液;泳道2添加pBR322和AAPH溶液;泳道3~8全部添加pBR322和AAPH溶液,并分别添加50~100 μg/mL B7CIQE溶液;泳道9~17全部添加pBR322和AAPH溶液,并分别添加50、75、100 μg/mL番茄红素、β-胡萝卜素、叶黄素溶液。凝胶最后用溴化乙锭染色,并在透射条件下进行观察。
1.3.6 细胞培养
人肝癌细胞HepG2培养所用完全培养基为90%高糖培养基、10%的小牛血清、约1%的青霉素-链霉素,人口腔癌细胞KB所用完全培养基为90%高糖培养基、10%的胎牛血清、约1%的青霉素-链霉素。样品和阳性对照全部溶解在含有0.1% DMSO的培养基中。
1.3.7 细胞内抗氧化实验
红球菌所产B7CIQE的细胞内抗氧化实验根据文献[28]所作描述,并略作一些调整。取处于对数生长期的HepG2细胞,用培养其所用的完全培养基稀释至6×105个/mL,每孔100 μL,转移至96 孔板;经过37 ℃、5% CO2、24 h培养,细胞贴壁以后,去掉培养基,并用100 μL的PBS洗每孔的细胞。接下来每孔加入不同质量浓度的样品处理液和对照组,其中均含有25 μmol/L的2’,7’-二氯荧光黄双乙酸盐,同样培养条件,继续培养1 h,吸去全部液体,用100 μL的PBS分为清洗或者不清洗2 种处理方式,加入100 μL的含600 μmol/L ABAP的PBS以及对照组100 μL空白PBS,随后将96 孔板放入荧光酶标仪,对其在37 ℃下进行扫描,测定条件为激发波长538 nm,发射波长485 nm,每5 min测试一次,持续1 h。细胞抗氧化活性根据公式(4)计算。抗氧化活性强弱通过半最大效应浓度(half maximal effective concentration,EC50)进行比较。

式中:∫SA表示不同质量浓度的样品处理液时间-光密度曲线下的积分面积;∫CA表示时间-对照光密度曲线下的积分面积。
1.3.8 细胞毒性与抗癌细胞增殖活性测定
该实验方法参照文献[29-30]并略微调整。人口腔癌细胞KB和人肝癌细胞HepG2分别用完全培养基稀释至0.6×105个/mL和 1×105个/mL,每孔100 μL,转移至96 孔板。经过37 ℃、5% CO2、12 h培养,细胞贴壁以后,去掉上层培养基,每孔加入100 μL不同质量浓度的样品处理液,对照组为完全培养基。同样培养条件下,继续培养24 h,使用PBS清洗每孔,使用噻唑蓝法测其剩余活细胞数量,计算得其细胞毒性。光密度在490 nm波长处测定,每组做5 个复孔,实验重复3 次。
1.4 统计分析
实验结果使用SPSS软件进行t检验和方差分析,并用Origin 8软件绘图。
2 结果与分析
2.1 抗漂白能力

图1 β-胡萝卜素氧化抑制率Fig. 1 Inhibition rates of β-carotene by B7CIQE and positive controls
从图1可以看出,B7CIQE的抗漂白能力在实验的4 种抗氧化剂中最强,相同质量浓度30 μg/mL下,抗氧化能力的顺序为B7CIQE(70.20%)>BHT(66.70%)>EGCG(17.80%)>番茄红素(1.90%)。在2、5、12、15、30 μg/mL的不同质量浓度条件下,B7CIQE抗漂白能力随着质量浓度的增大而增强。在30 μg/mL时,B7CIQE抗漂白能力要远高于天然的β-胡萝卜素。这可能是由于B7CIQE是由稀有的类胡萝卜素和甲基萘醌组成,不饱和双键含量较高,所以在抗氧化性上优于普通类胡萝卜素和多酚类物质。
2.2 抗脂质氧化能力
DSC是一种常用于评价抗氧化剂抗油脂氧化的方法,油脂开始氧化温度越高,说明抗氧化剂的抗氧化能力越强。从图2可以看出,添加了B7CIQE的花生油开始氧化的温度为175 ℃,后面依次为β-胡萝卜素(165 ℃)、叶黄素(162 ℃)和番茄红素(160 ℃)。从组成结构上推断,B7CIQE具有较多数目的不饱和双键,且其中萘醌母核具有较强的稳定性,所以相比其他3 种类胡萝卜素具有最强的抗脂质氧化能力。

图2 B7CIQE与植物源类胡萝卜素抗脂质氧化的DSC热流曲线Fig. 2 Non-isothermal DSC thermograms for peanut oils added with B7CIQE, lycopene, lutein or β-carotene
2.3 抑制蛋白氧化的能力
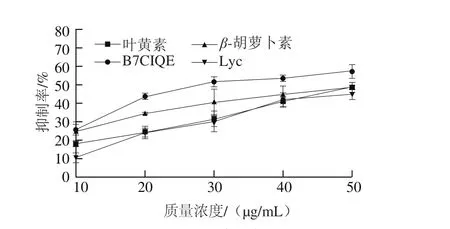
图3 蛋白质体外氧化抑制率Fig. 3 Inhibitory effect in vitro of antioxidants on protein oxidation
为了分析B7CIQE对于蛋白质氧化抑制的效应,本实验测定了添加B7CIQE和植物源性类胡萝卜素的牛血清白蛋白的氧化损伤。图3表明,蛋白质的氧化抑制率呈现出一致的质量浓度依赖性。在10 μg/mL的质量浓度下,B7CIQE对蛋白质氧化的抑制率(25.75%)比类胡萝卜素(24.97%)、叶黄素(17.94%)、番茄红素(10.40%)略高。随着质量浓度的增加,B7CIQE的抑制率逐渐增加。在50 μg/mL的质量浓度下,与类胡萝卜素(48.44%)、叶黄素(48.64%)、番茄红素(44.80%)的抑制率相比,B7CIQE表现出最大的抑制率(57.20%)。
2.4 对DNA解链的保护作用
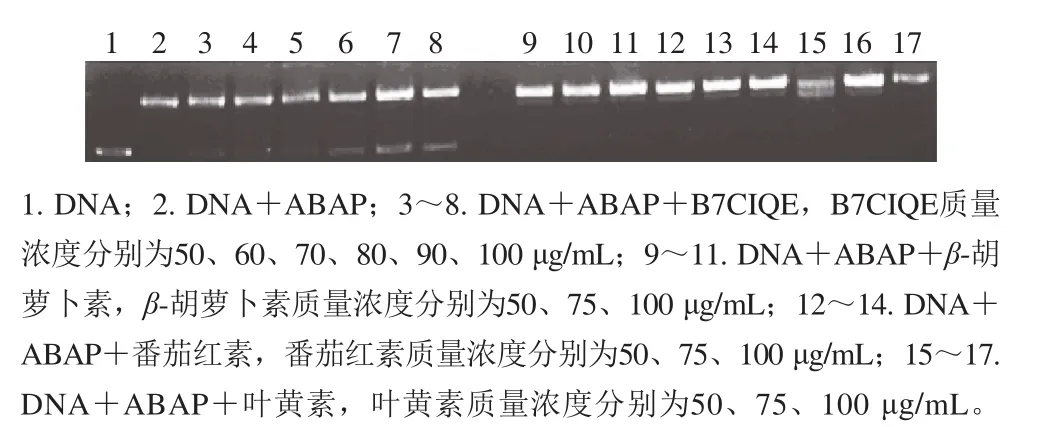
图4 DNA链氧化断裂图Fig. 4 Agarose gel electrophoretogram showing the protection of B7CIQE against DNA damage
ABAP能造成超螺旋DNA解链甚至破碎。为了研究B7CIQE对于ABAP所致的DNA损伤的缓解效应,本实验使用pBR322的DNA。在琼脂糖凝胶中,超螺旋DNA的移动速率大于碎片化DNA。如图4所示,上面亮带表示解链或者破碎的DNA,下面暗带表示超螺旋或者没有受损的DNA。比较条带1和2,ABAP孵化1 h后的超螺旋DNA完全解链或者破碎。条带3~8显示B7CIQE对于DNA损伤的抑制率有质量浓度依赖性。然而条带9~17显示,无论是50 μg/mL的低质量浓度,还是100 μg/mL的高质量浓度,植物内源物都不能防止DNA损伤。在本实验中,B7CIQE显示出对于DNA损伤保护的能力,为B7CIQE生物活性的研究提供参考。
2.5 细胞内抗氧化能力
鉴于单独的蛋白质、脂质等抗氧化实验结果受到细胞内部生化特性以及生物利用率等问题的影响,本实验采用细胞内抗氧化的方法对红球菌B7740所产B7CIQE的抗氧化活性进行测定。所得结果由EC50表示。为了探明B7CIQE与细胞膜的相互作用及细胞的摄入量,实验设计了清洗和未清洗2 组。如图5所示:未清洗时,EC50顺序为B7CIQE(96.14 μg/mL)<番茄红素(155.98 μg/mL)<叶黄素(186.47 μg/mL)<β-胡萝卜素(199.81 μg/mL);清洗时,EC50顺序为B7CIQE(182.86 μg/mL)<β-胡萝卜素(260.25 μg/mL)<叶黄素(287.57 μg/mL)<番茄红素(295.09 μg/mL)。B7CIQE与常见高等植物来源类胡萝卜素相比,其EC50均较小。该结果显示,B7CIQE因含有甲基萘醌类稀有类胡萝卜素,具有比高等植物来源类胡萝卜素更高的细胞膜渗透性,所以B7CIQE在细胞中具有较高的摄入量以及抗氧化活性。
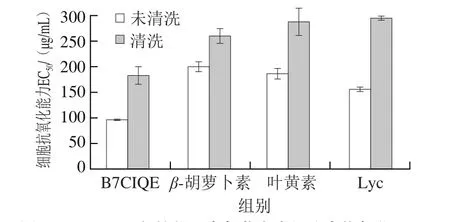
图5 B7CIQE与植物源类胡萝卜素细胞内抗氧化EC50Fig. 5 Cellular antioxidant activity of B7CIQE and plant-derived carotenoids
2.6 细胞毒性与抗增殖活性
如图6所示,实验结果用EC50表示,较低的EC50表示其较高的抗增殖能力。B7CIQE与常见植物来源类胡萝卜素都表现了抗增殖活性与质量浓度的相关性。人肝癌细胞HepG2抗增殖实验结果表明,叶黄素具有最低的EC50(20.86 μg/mL),其次为β-胡萝卜素(124.88 μg/mL)、B7CIQE(126.34 μg/mL)、番茄红素(139.24 μg/mL)。人口腔癌细胞KB抗增殖实验结果表明,B7CIQE具有最强的抗KB细胞增殖活性,其EC50最低(25.14 μg/mL),其次为叶黄素(64.29 μg/mL)、番茄红素(69.87 μg/mL)、β-胡萝卜素(149.16 μg/mL)。在实验质量浓度下,B7CIQE对HepG2和KB细胞均未有明显的细胞毒性(HepG2细胞的半抑制浓度(half maximal inhibitory concentration,IC50)为(311.92±36.01)μg/mL,KB细胞的IC50为(163.95±17.34)μg/mL),表明B7CIQE抑制HepG2和KB细胞增殖活性不是由其细胞毒性引起。

图6 B7CIQE与植物源类胡萝卜素抗HepG2与KB细胞增殖能力Fig. 6 Antiprolitferative activities of B7CIQE and plant-derived carotenoids against HepG2 human liver cancer and KB human oral cancer cells
自由基主要通过损伤脂质、蛋白质、DNA以及改变细胞间信号通路等作用对机体造成损害。脂质与蛋白质氧化与许多疾病相关,如糖尿病、子痫、慢性肾功能衰竭、自身免疫性疾病等。DNA是氧化应激的模态损伤靶点,最终导致癌症的发生。根据实验结果,初步判断了B7CIQE的抗氧化活性。在氧化反应特别是生物大分子的氧化反应中,B7CIQE显示出了优良的抗氧化活性。除此之外,B7CIQE在细胞内的抗氧化活性以及细胞利用率都较高,对于HepG2和KB细胞都表现了良好的抗增殖活性。
3 结 论
β-胡萝卜素漂白实验结果显示,B7CIQE具有抗漂白能力,且随着质量浓度的增大其抗漂白能力逐渐增强,在30 μg/mL时,B7CIQE抗漂白能力要远大于天然的β-胡萝卜素。脂质氧化稳定性实验结果显示,B7CIQE相比β-胡萝卜素、叶黄素和番茄红素具有最强的抗脂质氧化能力。对蛋白质氧化的抑制实验结果显示,与β-胡萝卜素、叶黄素、番茄红素相比,B7CIQE对蛋白质氧化有很强的抑制作用,且随着质量浓度增加抑制作用增大。DNA链断裂保护实验结果显示,B7CIQE对DNA损伤具有保护的作用。细胞内抗氧化实验结果显示,B7CIQE在细胞中具有较高的摄入量以及抗氧化活性,与常见高等植物来源类胡萝卜素相比,其EC50均较小。细胞毒性与抗增殖活性实验结果显示,B7CIQE与常见植物来源类胡萝卜素对人肝癌细胞HepG2和人口腔癌细胞KB都表现了抗增殖活性与质量浓度的相关性,且B7CIQE具有最强的抗KB细胞增殖活性。
综合实验结果表明,北极海洋红球菌B7740所产B7CIQE与常见高等植物来源类胡萝卜素相比,具有较高的抗氧化活性和抗增殖活性。同时,红球菌B7740所产B7CIQE的分离纯化、工业化生产、应用等也需要深入研究。
[1] ZHU Y H, GRAHAM J E, LUDWIG M, et al. Roles of xanthophyll carotenoids in protection against photoinhibition and oxidative stress in the cyanobacterium Synechococcus sp. strain PCC 7002[J].Carotenoids, Archives of Biochemistry and Biophysics, 2010, 504(1):86-99. DOI:10.1016/j.abb.2010.07.007.
[2] 李福枝, 刘飞, 曾晓希, 等. 天然类胡萝卜素的研究进展[J]. 食品工业科技, 2007, 28(9): 227-232. DOI:10.13386/j.issn1002-0306.2007.09.029.
[3] 刘晓庚, 袁磊, 高梅, 等. 类胡萝卜素清除自由基的动力学及体外模拟消化对清除率的影响[J]. 食品科学, 2016, 37(11): 65-73.DOI:10.7506/spkx1002-6630-201611012.
[4] 孙玉敬, 乔丽萍, 钟烈洲, 等. 类胡萝卜素生物活性的研究进展[J]. 中国食品学报, 2012, 12(1): 160-166. DOI:10.16429/j.1009-7848.2012.01.004.
[5] RAO A V, RAO L G. Carotenoids and human health[J].Pharmacological Research, 2007, 55(3): 207-216. DOI:10.1016/j.phrs.2007.01.012.
[6] HANDELMAN G J. The evolving role of carotenoids in human biochemistry[J]. Nutrition, 2001, 17(10): 818-822. DOI:10.1016/S0899-9007(01)00640-2.
[7] MEHTA B J, CERDÁ-OLMEDO E. Mutants of carotene production in Blakeslea trispora[J]. Applied Microbiology & Biotechnology,1995, 42(6): 836-838. DOI:10.1007/BF00191178.
[8] NSIMBA R Y, KIKUZAKI H, KONISHI Y. Antioxidant activity of various extracts and fractions of Chenopodium quinoa and Amaranthus spp. seeds[J]. Food Chemistry, 2008, 106(2): 760-766. DOI:10.1016/j.foodchem.2007.06.004.
[9] KAISER P, GEYER R, SURMANN P, et al. LC-MS method for screening unknown microbial carotenoids and isoprenoid quinones[J].Journal of Microbiological Methods, 2011, 88(1): 28-34. DOI:10.1016/j.mimet.2011.10.001.
[10] CHANDI G K, GILL B S. Production and characterization of microbial carotenoids as an alternative to synthetic colors: a review[J].International Journal of Food Properties, 2011, 14(3): 503-513.DOI:10.1080/10942910903256956.
[11] BULE M V, SINGHAL R S. Use of carrot juice and tomato juice as natural precursors for enhanced production of ubiquinone-10 by Pseudomonas diminuta NCIM 2865[J]. Food Chemistry, 2009, 116(1):302-305. DOI:10.1016/j.foodchem.2009.02.050.
[12] KLEIN-MARCUSCHAMER D, AJIKUMAR P K, STHANOPOULOS G. Engineering microbial cell factories for biosynthesis of isoprenoid molecules: beyond lycopene[J]. Trends Biotechnology, 2007, 25(9):417-424. DOI:10.1016/j.tibtech.2007.07.006.
[13] SANDMANN G. Molecular evolution of carotenoid biosynthesis from bacteria to plants[J]. Physiologia Plantarum, 2002, 116(4): 431-440.DOI:10.1034/j.1399-3054.2002.1160401.x.
[14] 陈梅雪, 王菊思. 细菌细胞中类异戊二烯醌的分析[J]. 环境化学,1996, 15(5): 467-475.
[15] 陶轶, 焦淑清, 杨明波, 等. 维生素K2类化合物合成研究进展[J]. 化学通报, 2013, 76(3): 238-243. DOI:10.14159/j.cnki.0441-3776.2013.03.009.
[16] 张月雷, 丁浩, 高悠水, 等. 维生素K参与骨代谢研究进展[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 8(3): 251-255. DOI:10.3969/j.issn.1674-2591.2015.03.012.
[17] 陈雪英, 杨雅, 游志刚, 等. 维生素K2对老年去卵巢大鼠血管钙化的影响[J]. 中国动脉硬化杂志, 2012, 20(3): 197-202.
[18] 林青山, 刘育华, 吴俊伟, 等. 维生素K2预防乙型肝炎病毒相关性肝细胞癌术后复发的应用[J]. 汕头大学医学院学报, 2015, 28(2):99-101. DOI:10.13401/j.cnki.jsumc.2015.02.018.
[19] 罗苗苗, 胡学超, 邱宏伟, 等. 微生物发酵法制备维生素K2研究进展[J]. 食品与发酵工业, 2015, 41(10): 221-225. DOI:10.13995/j.cnki.11-1802/ts.201510040.
[20] 张晓蓉, 赵春贵, 杨素萍. 产氢红杆菌类胡萝卜素含量和组分分析[J]. 微生物学通报, 2007, 34(5): 863-866. DOI:10.3969/j.issn.0253-2654.2007.05.009.
[21] 徐建中, 王颖妤, 严为留, 等. 维生素K2合成途径中主要酶对MK-7产量的影响[J]. 生物技术通报, 2016, 32(11): 248-254.DOI:10.13560/j.cnki.biotech.bull.1985.2016.11.032.
[22] 陈亚淑, 汪荣, 谢笔钧, 等. 北极海洋红球菌(Rhodococcus sp.)B7740产类胡萝卜素的提取条件优化及甲基萘醌类类胡萝卜素鉴定[J]. 食品科学, 2016, 37(2): 25-30. DOI:10.7506/spkx1002-6630-201602005.
[23] KUZINA V, CERDÁ-OLMEDO E. Ubiquinone and carotene production in the Mucorales Blakeslea and Phycomyces[J]. Applied Microbiology and Biotechnology, 2007, 76(5): 991-999. DOI:10.1007/s00253-007-1069-7.
[24] MAGDALENA G, ANNA P, KATARZYNA K, et al. Characteristics of rose hip (Rosa canina L.) cold-pressed oil and its oxidative stability studied by the differential scanning calorimetry method[J]. Food Chemistry, 2015, 188: 459-466. DOI:10.1016/j.foodchem.2015.05.034.
[25] CAO G, CUTLER R G. Protein oxidation and aging 1. difficulties in measuring reactive protein carbonyls in tissues using 2,4-dinitrophenylhydrazine[J]. Archives of Biochemistry and Biophysics, 1995, 320(1): 106-114. DOI:10.1006/abbi.1995.1347.
[26] TIAN B, SUN Z, SHEN S, et al. Effects of carotenoids from Deinococcus radioduranson protein oxidation[J]. Letters in Applied Microbiology, 2009, 49(6): 689-694. DOI:10.1111/j.1472-765X.2009.02727.x.
[27] JUNG Y, SURH Y. Oxidative DNA damage and cytotoxicity induced by copper-stimulated redox cycling of salsolinol, a neurotoxic tetrahydroisoquinoline alkaloid[J]. Free Radical Biology & Medicine,2001, 30(12): 1407-1417. DOI:10.1016/S0891-5849(01)00548-2.
[28] KELLYL W, RUI H L. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907.DOI:10.1021/jf0715166.
[29] ZHANG L Z, LIU R H. Phenolic and carotenoid profiles and antiproliferative activity of foxtail millet[J]. Food Chemistry, 2015,174: 495-501. DOI:10.1016/j.foodchem.2014.09.089.
[30] ZHANG L Z, LIU R H, NIU W. Phytochemical and antiproliferative activity of proso millet[J]. PLoS ONE, 2014, 9(8): e104058.DOI:10.1371/journal.pone.0104058.
