熊果酸对酒精性肝损伤大鼠肠道菌群的影响
2018-06-19马浩然贾海莲张文龙张男男李可欣邰大鹏
马浩然,贾海莲,张文龙,王 晶,张男男,李可欣,邰大鹏,戈 娜,*
(1.包头医学院 营养与食品健康研究所,内蒙古 包头 014040;2.包头医学院第一附属医院骨外科,内蒙古 包头 014010;3.包头医学院第二附属医院消化科,内蒙古 包头 014030)
酒精性肝损伤又称酒精性肝病,是指长期大量饮酒所致的肝损伤,也是导致肝癌甚至急性肝衰竭最常见的诱因之一[1]。在临床上常见酒精性肝病患者会伴有内毒素血症的出现,而越来越多的研究也显示,酒精能够引起肝细胞损伤、肠道菌群改变、肠道上皮细胞屏障功能障碍、肠道细菌代谢产物易位和内毒素血症的发生,揭示出肠道菌群在酒精诱导的肝损伤中扮演着重要的角色[2-4]。熊果酸(ursolic acid,UA)又名乌索酸、乌苏酸、香树脂醇,是一种弱酸性五环三萜类化合物,分子式为C30H48O3,在自然界分布广范,多以游离或与糖结合成苷的形式存在于沙棘、女贞子、山楂、蔓越莓、枇杷叶等植物中,是多种植物的主要功能成分[5]。目前研究已发现UA不仅具有抗炎、抑菌、抗氧化、免疫调节等多种生物学效应,而且具有活性强、安全性高、毒性低(口服半数致死量为8 330 mg/kg)等特性[6-8]。Saravanan等[9]的研究还发现,UA对酒精性肝损伤有保护作用,但机制不明。已有文献报道酒精性肝损伤常伴有肠道菌群失调症状[10-11],且该类患者常出现内毒素血症。本研究以肠道菌群为着眼点,探讨UA对酒精性肝损伤的保护机制。调节肠道菌群可以防止革兰氏阴性菌的过量繁殖,进而避免内毒素水平过高对肝脏进行的“二次伤害”[5]。本研究应用基因间重复共有序列(enterobacterial repetitive intergenic consensus,ERIC)-聚合酶链式反应(polymerase chain reaction,PCR)和PCR-变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)指纹图谱分析以及实时荧光PCR技术等方法,探讨UA对酒精性肝损伤大鼠肠道菌群的影响,以期为后续UA对酒精性肝损伤的保护作用机制研究提供可参考的依据,同时也为酒精性肝损伤的防治提供新思路。
1 材料与方法
1.1 动物、材料与试剂
2 月龄雄性Wistar大鼠,SPF级,30 只,体质量180~200 g,由山东鲁抗医药股份有限公司提供,动物合格证号:SCXK(鲁)20140001。
UA(纯度98%) 长沙麓园生物科技有限公司;血清谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)试剂盒南京建成生物工程研究所;内毒素检测显色基质鲎试剂盒厦门市鲎试剂实验厂有限公司;D-乳酸(D-lactic acid,D-LA)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海迪奥生物科技有限公司;粪便总DNA提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒、普通PCR试剂盒 天根生化科技(北京)有限公司;PCR引物 上海英俊公司;标准菌株 广东省食品微生物安全工程技术研究开发中心;定量PCR试剂盒 大连TaKaRa公司。
1.2 仪器与设备
ELx808型酶标仪 美国BioTek公司;PCR仪、凝胶成像仪 美国Bio-Rad公司;实时荧光定量PCR扩增仪、微量紫外分光光度计 美国Thermo公司。
1.3 方法
1.3.1 动物分组及样本采集
大鼠适应性喂养7 d之后,按体质量随机分成3 组,每组10 只,分别为正常对照组、酒精模型组、UA干预组。正常对照组每日给予生理盐水灌胃1 次,持续8 周;酒精模型组给予体积分数50%酒精8 mL/(kg·d)灌胃2 周,第3周把酒精剂量提高至12 mL/(kg·d),持续灌胃6 周;UA干预组每日给予150 mg/(kg·d) UA,1 h后再给予酒精灌胃,剂量同模型组。各组大鼠自由进食和饮水,实验持续8 周。末次灌胃12 h后,10%水合氯醛按0.3 mL/100 g腹腔麻醉,腹主动脉取血。剥离肝脏组织,一部分用于病理学分析,剩余部分肝脏-80 ℃冻存备用。此外,用无菌棉签从结肠留取新鲜粪便3~5 g充满无菌标本盒,-20 ℃冻存备用。
1.3.2 检测指标
1.3.2.1 肝脏组织HE染色观察
新鲜大叶肝相同部位组织1 块(约0.9 cm×0.9 cm×0.5 cm),体积分数10%中性甲醛缓冲液固定过夜,常规石蜡包埋,切片,脱蜡,苏木精-伊红(hematoxylin-eosin,HE)染色,中性树胶封片,光学显微镜下观察肝组织形态学变化。
1.3.2.2 血清转氨酶活力检测
采用赖氏法检测各组大鼠血清ALT和AST活力,操作步骤严格按试剂盒说明书进行。
1.3.2.3 大鼠血浆中D-LA浓度和内毒素水平检测
采用ELISA法检测血浆D-LA浓度,显色基质鲎试剂盒检测血浆内毒素水平,实验步骤严格按照试剂盒说明书进行。
1.3.2.4 粪便肠道菌群基因组总DNA提取
称取180 mg粪便样品,采用粪便基因组DNA提取试剂盒提取肠道菌群基因组总DNA,提取过程严格按照说明书操作。使用微量分光光度计和质量分数1%琼脂糖凝胶电泳法检测DNA质量浓度和纯度。
1.3.2.5 ERIC-PCR检测
以肠道菌群基因组DNA为模板进行ERIC-PCR扩增。采用的通用引物序列为:上游引物:5’-ATG TAA GCT CCT GGG GAT TCA C-3’;下游引物:5’-AAG TAA GTG ACT GGG GTG AGC G-3’。采用5×TBE缓冲液制备1%的琼脂糖凝胶进行电泳,90 V电泳40 min。通过凝胶成像分析系统对DNA条带进行拍照并分析结果,寻找各组样品间的规律性变化,做出对肠道菌群结构变化的分析。
1.3.2.6 PCR-DGGE检测
对肠道菌群总DNA 16S rDNA V3可变区扩增,采用的通用引物序列为:V3F+GC:5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA C-3’,V3R+GC:3’-GGG GGC CTA CGG GAG GCA GCA G-5’,目的基因片段长度220 bp。使用DGGE凝胶制备装置,40%~50%变性梯度胶,60 ℃恒温点样,100 V电泳300 min。应用Quantity One进行非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析。
1.3.2.7 实时荧光定量PCR检测
按照细菌DNA提取试剂盒提取4 种细菌DNA,并进行普通PCR扩增,按照普通琼脂糖凝胶DNA回收试剂盒说明书进行割胶回收,使用微量紫外分光光度计测定质量浓度计算拷贝数,制成102~109拷贝/μL的标准品,与样品(100 ng/μL)一同使用96 孔板上样。利用标准曲线(R2>0.999)生成的公式以及机器测量的Ct值计算样品拷贝数,各组之间进行比较。各菌目的片段长度以及退火温度见表1。

表1 PCR引物信息和预期产物长度Table 1 Information on primers used in PCR and expected product length
1.4 统计分析
应用SPSS 19.0软件对实验数据进行整理和分析。对符合正态分布且方差齐的计量资料多组间比较,采用单因素方差分析,以表示,不同组间两两比较采用最小显著性差异法-t检验;非正态或方差不齐的计量资料多组间比较采用Kruskal-Wallis H检验,以M(P25,P75)表示,不同组间两两比较采用Mann-Whitney U检验。以P<0.05表示差异显著。
2 结果与分析
2.1 UA干预对酒精暴露大鼠肝脏组织病理学改变的影响

图1 HE染色观察大鼠肝脏组织的病理学改变(400×)Fig. 1 Pathological observation of liver tissue by HE staining in rats (400 ×)
如图1所示,正常对照组大鼠肝小叶结构清晰,肝板排列整齐,肝细胞索以中央静脉为中心呈放射状排列(图1A);酒精模型组大鼠肝小叶结构模糊,肝细胞大片性坏死,胞质中可见大小不等、数量不一的圆形脂肪空泡,坏死区可见炎性细胞浸润(图1B)。而UA干预组肝小叶结构虽有不同程度破坏,但与酒精模型组相比较,肝索排列逐渐恢复整齐(图1C)。
2.2 UA干预对酒精诱导肝损伤大鼠血清转氨酶活力的影响

表2 UA对酒精性肝损伤大鼠血清转氨酶活力的影响Table 2 Effects of UA on serum aminotransferase level in alcohol-treated rats
如表2所示,酒精模型组血清转氨酶水平明显高于正常对照组(P<0.05),而UA干预组较酒精模型组ALT和AST活力均显著降低(P<0.05)。
2.3 UA对酒精性肝损伤大鼠血浆中D-LA浓度和内毒素水平的影响

表3 UA对酒精性肝损伤大鼠血浆D-LA浓度和内毒素水平的影响Table 3 Changes in plasma D-LA and endotoxin in rats from different groups
由表3可知,大鼠给予50%酒精连续灌胃8 周后,酒精模型组大鼠血浆D-LA浓度和内毒素水平显著高于正常对照组(P<0.05),分别为正常对照组的1.6、1.5 倍;而UA干预后可明显抑制酒精所致的血浆D-LA浓度和内毒素水平的升高(P<0.05)。
2.4 大鼠肠道菌群ERIC-PCR指纹图谱分析

图2 大鼠粪便肠道菌群ERIC-PCR指纹图谱分析Fig. 2 ERIC-PCR fingerprint of gut microbes in rats from different groups
如图2所示,酒精模型组大鼠肠道菌群明显区别于空白对照组大鼠,在1 000 bp左右有清晰明亮的条带1,而UA干预组该条带则较暗,接近正常水平;约在250 bp处空白组较酒精模型组有较亮的条带2,UA干预组该条带亮度介于二者之间。
2.5 大鼠粪便总DNA PCR-DGGE指纹图谱分析
图3 粪便微生物总DNA 16S rDNA V3可变区PCR产物琼脂糖凝胶电泳图Fig. 3 Gel electrophoresis of PCR products of V3 variable region of 16S rDNA gene sequence from total genomic DNA in gut microbes

图4 DGGE图谱中肠道菌群的变化(A)以及UPGMA聚类分析(B)Fig. 4 Changes in gut microbes by DGGE (A) and UPGMA cluster analysis (B) in two groups
如图3所示,对各组大鼠粪便微生物总DNA 16S rDNA V3可变区进行PCR扩增及1%的琼脂糖凝胶电泳,产物长度为220 bp。将扩增产物进行DGGE得到指纹图谱,进行UPGMA聚类分析(图4),可见酒精模型组与其他两组相似系数仅为0.21,UA干预组与正常对照组相似系数为0.46。酒精模型组大鼠肠道菌群多样性明显下降且与正常组的相似性较低,而UA干预组大鼠肠道菌群结构与正常组大鼠更相似。
2.6 粪便中特定菌株的定量分析
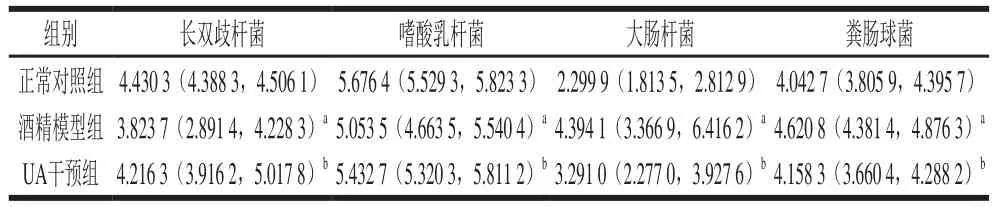
表4 UA对酒精暴露大鼠肠道菌群特定菌株的定量分析(M(P25,P75),n=10)Table 4 Quantities of gut microbes in rats from different groups(M(P25, P75), n= 10)拷贝/μL
如表4所示,与正常对照组比较,酒精模型组大鼠粪便中大肠杆菌和粪肠球菌数量均明显增多(P<0.05);而UA干预组大肠杆菌和粪肠球菌数量较酒精模型组显著减少(P<0.05),且与正常对照组大鼠间无统计学差异(P>0.05)。此外,酒精模型组大鼠粪便中长双歧杆菌和嗜酸乳杆菌数量与正常对照组相比均显著降低(P<0.05),而UA干预后可以明显抑制这种变化,使两种肠道菌群更趋近于正常对照组。
3 讨 论
肠道菌群指肠道正常微生物群,它们按照一定规律分布在肠道内,与肠黏膜共同形成防御屏障[12]。现有研究表明,长期过量饮酒可使肠道微生物群组成和分布发生紊乱,肠道内有益菌数量减少,有害菌繁殖增多,进而引起内毒素大量分泌,破坏肠黏膜渗透入血,诱发内毒素血症,最终导致肝脏损伤[4,11]。
肝脏病理学检查是反映肝损伤程度最直观的证据,也是临床常用的金标准。ALT与AST活力是检测肝脏损伤的最敏感指标,可以在一定的范围内反映生物体内肝细胞的损伤程度大小。各种急性病毒性肝炎、药物或酒精引起急性肝细胞损伤时,血清ALT活力最敏感,在临床症状如黄疸出现之前ALT活力就急剧升高,同时AST活力也升高[13]。本研究结果显示,UA干预能够改善肝脏组织病理学改变,同时有效抑制大鼠血清转氨酶的释放,从而对酒精诱导的肝损伤起到保护作用,这与Caignin等[6]的报道一致。D-LA是肠道多种细菌发酵的终代谢产物。正常情况下血清D-LA在人体内含量很低,但当肠道通透性的增加时,可导致D-LA涌入血液循环[14]。因此,D-LA常被认为是肠道通透性增加的敏感性指标之一[15-16]。内毒素是革兰氏阴性细菌细胞壁外膜上的一种脂多糖和微量蛋白质的复合物。酒精除了能够直接激活toll样受体(toll-like receptor,TLR)信号通路引起肝损伤,还能够增加变形菌及革兰氏阴性菌的数量,进而导致内毒素产量增高。过量的内毒素破坏肠黏膜入血,通过门静脉进入肝脏,与肝细胞上的TLR4结合,启动一系列信号转导,造成肝损伤[17]。临床上发现重症的酒精性肝炎会常常伴有内毒素血症,Parlesak等[18]发现酒精肝病患者血液中内毒素水平是正常人的5 倍。本实验通过对D-LA和内毒素检测结果的分析可知:酒精模型组大鼠血中D-LA浓度和内毒素水平均显著升高,经过8 周UA干预后,这种升高明显得到抑制,提示长期大剂量酒精摄入可能导致大鼠肠道内微生态失衡,肠黏膜受损,肠通透性增加,进而诱发肠源性内毒素血症的发生,最终导致肝损伤的发生或加重;而UA的补充可改善肠黏膜屏障,减少内毒素的产生和释放,从而有效缓解肝脏损伤。
近年来的研究已发现酒精可引起肠道菌群的失衡,因此越来越多的人开始关注酒精性肝损伤的发生与肠道菌群失衡的关系[19-21]。本研究通过3 组间的对比进行酒精性肝损伤大鼠肠道菌群结构分析,以往对肠道菌群结构的认识常采用传统生物培养技术,但因肠道内约90%的微生物不能在体外培养,因此不能客观评价肠道微生物群落的变化规律[22]。ERIC-PCR和PCR-DGGE技术是目前被广泛用于肠道结构及种群变化的分子生物学方法,其灵敏度和可靠性较好,且能克服传统培养技术费时、费力及培养过程中菌种比例发生变化等缺点[23-25]。本实验通过对3 组大鼠肠道菌群基因ERIC-PCR指纹图谱观察可见酒精性肝损伤大鼠的肠道菌群明显区别于健康大鼠,而UA干预后的大鼠肠道菌群结构更加接近于正常对照组。PCR-DGGE结果显示酒精使肠道菌群种类及数量发生明显变化,多样性降低,且与其他两组相似度较低;而UA干预组与空白对照组相似度较高,更加直观的表明UA补充对肠道菌群的调节作用。16S rDNA为编码16S rRNA的基因,存在于所有细菌染色体基因组中,是细菌分类学研究中最常用、最有用的“分子钟”,其种类少、含量大(约占细菌DNA含量的80%)、分子大小适中,可变区因细菌而异,变异程度与细菌的系统发育密切相关。因此,16S rDNA是细菌菌落结构分析最常用的系统进化标记分子[22,26-28]。本研究采用16S rDNA实时荧光定量PCR技术,检测酒精暴露大鼠粪便中4 种具有代表性的细菌,包括大肠杆菌、粪肠球菌、嗜酸乳杆菌与长双歧杆菌[29]。结果显示:酒精摄入后隶属革兰氏阴性杆菌的大肠杆菌与粪肠球菌数量显著升高,放线菌门的长双歧杆菌和厚壁菌门的嗜酸乳酸杆菌数量显著下降,这一结果与Bull-Otterson等[30]的研究结果相似,说明酒精可以引起肠道菌群的失衡;但UA干预后可见大鼠粪便中大肠杆菌数量明显下降(P<0.05),而长双歧杆菌与嗜酸乳酸杆菌数量显著回升(P<0.05),与酒精模型组形成鲜明对比。上述结果均提示UA可调节肠道菌群,防止肠道内菌群失衡,进而发挥改善酒精性肝损伤的作用。
综上所述,长期大剂量酒精摄入可能导致肠道黏膜通透性增大,大鼠肠道内微生态失衡,加速内毒素释放,最终加重肝细胞损伤;补充UA可能通过调节酒精性肝损伤大鼠肠道菌群结构和数量,修复肠黏膜细胞屏障,减少内毒素的产生和释放,改善肠道微生态,从而达到有效缓解肝细胞损伤的功效。
[1] TORRUELLAS C, FRENCH S W, MEDICI V. Diagnosis of alcoholic liver disease[J]. World Journal of Gastroenterology, 2014, 20(33):11684-11699. DOI:10.3748/wjy.v20.i33.11684.
[2] MALAGUAMERA G, GIORDANO M, NUNNARI G, et al. Gut microbiota in alcoholic liver disease: pathogenetic role and therapeutic perspectives[J]. World Journal of Gastroenterology, 2014, 20(44):16639-16648. DOI:10.3748/wjg.v20.i44.16639.Review.
[3] VASSALLO G, MIRIJELLO A, FERRULLII A, et al. Review article:alcohol and gut microbiota the possible role of gut microbiota modulation in the treatment of alcoholic liver disease[J]. Alimentary Pharmacology &Therapeutics, 2015, 41(10): 917-927. DOI:10.1111/apt.13164.
[4] MUTLU E, KESHAVARZIAN A, ENGEN P, et al. Intestinal dysbiosis: a possible mechanism of alcohol-induced endotoxemia and alcoholic steatohepatitis in rats[J]. Alcoholism-Clinical and Experimental Research, 2009, 33(10): 1836-1846. DOI:10.1111/j.1530-0277.2009.01022.x.
[5] 武岩峰, 张晓磊, 张予心, 等. 益生菌通过调整正常菌群缓解酒精性肝损伤的研究进展[J]. 微生物学通报, 2015, 42(10): 1988-1993.DOI:10.13344/j.microbiol.china.141021.
[6] CAIGNIN S T, GNOATTO S B. Ursolic acid from apple pomace and traditional plants: a valuable triterpenoid with functional properties[J]. Food Chemistry, 2017, 220: 477-489. DOI:10.1016/j.foodchem.2016.10.029.
[7] TIAN S, SHI Y, YU Q, et al. Determination of oleanolic acid and ursolic acid contents in Ziziphora clinopodioides Lam. by HPLC method[J]. Pharmacogn Magazine, 2010, 6(22): 116-119.DOI:10.4103/0973-1296.62898.
[8] YU Y X, GU Z L, YIN J L, et al. Ursolic acid induces human hepatoma cell line SMMC-7721 apoptosis via p53-dependent pathway[J]. Chinese Medical Journal, 2010, 123(14): 1915-1923.DOI:10.3760/cma.j.issn.0366-6999.2010.14.016.
[9] SARAVANAN R, VISWANATHAN P, PUGALENDI K V. Protective effect of ursolic acid on ethanol-mediated experimental liver damage in rats[J].Life Science, 2006, 78(7): 713-718. DOI:10.1016/j.lfs.2005.05.060.
[10] 蔡夏夏, 鲍雷, 王楠, 等. 膳食5'-核苷酸对酒精性肝损伤大鼠肠道菌群的影响[J]. 食品科学, 2015, 36(15): 212-216. DOI:10.7506/spkx1002-6630-201515039.
[11] MUTLU E A, GILLEVET P M, RANGWALA H, et al. Colonic microbiome is altered in alcoholism[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2012, 302(9):G966-G978. DOI:10.1152/ajpgi.00380.2011.
[12] 梁惠, 吕锐, 傅泳, 等. 益生菌对大鼠酒精性肝损伤的保护作用及机制研究[J]. 中国药理学通报, 2016, 32(7): 991-997. DOI:10.3969/j.issn.1001-1978.2016.07.021.
[13] 彭文锋, 钟政永. ADA与ALT、AST、GGT联合检测在肝脏疾病诊断中的意义[J]. 当代医学, 2011, 17(9): 4-6. DOI:10.3969/j.issn.1009-4393.2011.9.003.
[14] 彭韶, 杜天华, 张曼. 反复肺炎患儿的肠道菌群与血清D-乳酸变化及相关性研究[J]. 中国当代儿科杂志, 2016, 18(2): 113-116.DOI:10.7499/j.issn.1008-8830.2016.02.004.
[15] CHEN Z Q, WANG Y M, ZENG A, et al. The clinical diagnostic significance of cerebrospinal fluid D-lactate for bacterial meningitis[J].Clinica Chimica Acta, 2012, 413(19/20): 1512-1515. DOI:10.1016/j.cca.2012.06.018.
[16] SZALAY L, UMAR F, KHADEM A, et al. Increased plasma D-lactate is associated with the severity of hemorrhagic/traumatic shock in rats[J]. Shock, 2003, 20(3): 245-250. DOI:10.1097/00024382-200309000-00008.
[17] DAPITO D H, MENCIN A, GWAK G Y, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J].Cancer Cell, 2012, 21(4): 504-516. DOI:10.1016/j.ccr.2012.02.007.
[18] PARLESAK A, SCHÄFER C, SCHÜTZ T, et al. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease[J]. Journal of Hepatology, 2000, 32(5): 742-747. DOI:10.1016/S1068-8278(00)80242-1.
[19] 邱萍, 李相, 孔德松, 等. 酒精性肝病发病机制研究的新进展[J].中国药理学通报, 2014, 30(2): 160-163. DOI:10.3969/j.issn.1001-1978.2014.02.004.
[20] NEUMAN M G, FRENCH S W, ZAKHARI S, et al. Alcohol,microbiome, life style influence alcohol and non-alcoholic organ damage[J]. Experimental and Molecular Pathology, 2017, 102(1): 162-180. DOI:10.1016/j.yexmp.2017.01.003.
[21] CASSARD A M, GERARD P, PERLEMUTER G. Microbiota, liver diseases, and alcohol[J]. Microbiology Spectrum, 2017, 5(4): 187-212.DOI:10.1128/microbiolspec.BAD-0007-2016.
[22] CLARRIDGE J E. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J]. Clinical Microbiology Reviews, 2004, 17(4): 840-862.DOI:10.1128/CMR.17.4.840-862.2004.
[23] 潘康成, 陈正礼, 崔恒敏, 等. 利用ERIC-PCR和PCR-DGGE技术分析喂服枯草芽孢杆菌肉鸡肠道菌群的多样性[J]. 动物营养学报,2010, 22(4): 985-991. DOI:10.3969/j.issn.1006-267x.2010.04.026.
[24] 林朝洪, 倪学勤, 曾东, 等. 重复序列ERIC(IRU)研究进展[J]. 微生物学报, 2007, 47(2): 370-373. DOI:10.3321/j.issn:0001-6209.2007.02.037.
[25] 黄俊文, 冯定远, 林映才. PCR-DGGE技术及其在动物肠道微生态学研究中的应用[J]. 中国畜牧杂志, 2006, 42(17): 47-50.DOI:10.3969/j.issn.0258-7033.2006.17.016.
[26] 郑将臣, 万全, 程起群, 等. 基于16S rRNA序列探讨龟鳖类的遗传分化和系统发生[J]. 湖南农业大学学报(自然科学版), 2011, 37(2):199-205. DOI:10.3724/SP.J.1238.2011.00199.
[27] 刘志国, 崔步云, 王妙, 等. 布氏菌分离株16S rDNA基因遗传进化分析[J]. 中国人兽共患病学报, 2015, 31(8): 700-703. DOI:10.3969/cjz.j.issn.1002-2694.2015.08.003.
[28] 陈荣, 刘利林, 格明古丽·木哈台, 等. 16S rDNA克隆文库法分析拜城油鸡盲肠细菌多样性研究[J]. 家畜生态学报, 2017, 38(2): 18-21.DOI:10.3969/j.issn.1673-1182.2017.02.004.
[29] SGHIR A, GRAMET G, SUAU A, et al. Quantification of bacterial groups within human fecal flora by oligonucleotide probe hybridization[J]. Applied and Environmental Microbiology, 2000,66(5): 2263-2266. DOI:10.1128/AEM.66.5.2263-2266.2000.
[30] BULL-OTTERSON L, FENG W, KIRPITH I, et al. Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment[J]. PLoS ONE, 2013, 8: 53028. DOI:10.1371/journal.pone.0053028.
