鱼油对KKAy糖尿病小鼠糖代谢及PI3K/Akt信号通路的影响
2018-06-19胡名媛马永建孙桂菊
胡名媛,王 锋,马永建,2,孙桂菊,*
(1.东南大学公共卫生学院营养与食品卫生学系,环境医学工程教育部重点实验室,江苏 南京 210009;2.江苏省疾病预防控制中心,江苏 南京 210009)
糖尿病已成为当前威胁全球人类健康最重要的慢性非传染性疾病之一,并在世界范围内呈流行趋势[1]。据国际糖尿病联盟统计,至2016年12月,全球糖尿病患者人数已达4.25亿 人[2]。我国糖尿病患病率近几年增长迅速。从1994年的2.5%[3]、2002年的2.7%[4],增加至2013年的10.9%[5],其中2型糖尿病(type 2 diabetes mellitus,T2DM)患者人数约占糖尿病患者总人数的90%~95%[6]。日益增长的糖尿病患病率给社会带来沉重的经济负担[7],因此积极控制和治疗T2DM具有极其重要的意义。
1978年Dyerberg等[8]发表流行病学调查,发现生活在格陵兰岛的爱斯基摩人摄入大量的海洋脂类物质,但冠心病、心肌梗塞、血栓病等疾病发病率却很低,自此关于ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3 PUFA)的研究迅速发展,并成为目前T2DM营养干预研究的热点。ω-3 PUFA主要包括α-亚麻酸(α-linolenic acid,ALA)、二十碳五烯酸(eicosapentaenoicacid,EPA)和二十二碳六烯酸(docosahexaenoic,DHA)。ALA在植物种子中含量丰富,EPA和DHA在鱼类和贝壳类动物中含量丰富。T2DM的病理生理机制主要包括胰岛素分泌不足与胰岛素抵抗(insulin resistance,IR),其中IR被认为可能是T2DM发生的始动因素[9]。而胰岛素信号通路(磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路)在T2DM的发病过程中发挥着重要作用,与胰岛素信号转导及IR有着密切的联系[10]。本研究旨在对EPA、DHA含量丰富的鱼油对糖代谢和PI3K/Akt胰岛素信号通路的影响进行探索。
1 材料与方法
1.1 动物、材料与试剂
40 只KKAy雄性小鼠,SPF级,8 周龄;10 只C57BL/6雄性小鼠,SPF级,8 周龄,购自北京华阜康生物科技股份有限公司动物实验中心(实验动物使用许可证:SYXK(苏)2013-0037)。
实验用鱼油由汤臣倍健公司按课题组要求生产(深海鱼油胶囊,每粒1 g,含25.8%(质量分数,下同)EPA和36.4% DHA)。
胰岛素试剂盒、脂联素试剂盒、瘦素试剂盒南京建成生物工程研究所;TRIzol试剂 美国Thermo Fisher Scientific公司;Revertra Ace qPCR逆转录反应试剂盒、SYBR Green实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)Master Mix试剂盒TOYOBO生物工程有限公司;胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)、PI3K、Akt、葡萄糖转运蛋白-4(glucose transporter-4,GLUT-4)及内参β-actin引物上海捷瑞生物工程有限公司。
1.2 仪器与设备
DxC800型全自动生化分析仪 美国Beckman公司;ME203E型天平 上海梅特勒-托利多有限公司;酶标仪美国BioTek Epoch公司;电热恒温培养箱 上海精宏实验设备有限公司;5424R型台式高速冷冻离心机、基因扩增仪 德国Eppendorf 公司;全自动样品快速研磨仪 上海净信实业发展有限公司;Step One Plus型荧光定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 造模及分组处理
设10 只C57BL/6小鼠为正常对照组,给予普通饲料喂养。KKAy小鼠适应性喂养1 周后给予高脂饲料喂养,4 周后断尾采血,空腹血糖(fasting blood glucose,FBG)不低于13.9 mmol/L者为T2DM合格模型小鼠。根据体质量和血糖随机分为4 组,分别为模型组和鱼油低、中、高剂量组,每组10 只,入组时测定的血糖值如表1所示。KKAy小鼠给予高脂饲料并自由摄食和饮水,分别按照鱼油低(0.67 g/kg)、中(1.33 g/kg)、高(2.00 g/kg)剂量给予灌胃。正常对照组和模型组给予5‰羧甲基纤维素钠溶液灌胃。连续灌胃12 周,对小鼠的体质量进行监测。观察小鼠的精神状态、饮食量以及反应状态。12 周结束后禁食不禁水8 h,摘眼球取血,分离血清,于-20 ℃保存备用。取小鼠的骨骼肌于-80 ℃保存,以备检测基因表达水平。

表1 入组时各组小鼠的血糖值Table 1 Blood glucose levels of mice in all groups before experiment
1.3.2 指标检测
禁食8 h后用全自动生化分析仪测定血糖值,用酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)法检测血清胰岛素(fasting insulin,FINS)浓度。应用脂联素、瘦素ELISA试剂盒测定小鼠血清中脂联素和瘦素的表达,按照试剂盒说明书步骤进行操作。根据公式(1)计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)。
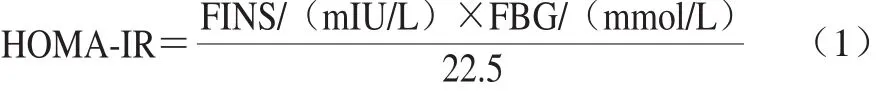
1.3.3 实时荧光定量PCR法检测肝脏中IRS-1、PI3K、Akt、GLUT-4 mRNA表达水平
采用实时荧光定量PCR法,使用TRIzol试剂提取骨骼肌组织中的RNA,利用Revertra Ace qPCR逆转录试剂盒对RNA进行逆转录,体系为20 µL,反应条件为37 ℃ 15 min,98 ℃ 5 min,-20 ℃保存备用。应用SYBR Green实时荧光定量PCR Master Mix试剂盒对cDNA进行扩增,体系为10 μL,反应条件为:95 ℃ 1 min,95 ℃ 5 s,55 ℃ 10 s,72 ℃ 15 s,45 个循环,以β-actin基因为内参。分析IRS-1、PI3K、Akt、GLUT-4 mRNA的表达水平,各基因的引物序列见表2。ΔΔCt=(实验组目的基因Ct值-实验组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值),2–ΔΔCt可反映实验组与对照组基因表达的差异(倍数)。

表2 PCR引物序列及产物长度Table 2 PCR Primer sequences and product lengths
1.4 数据统计分析
采用SPSS 19.0软件进行统计学分析,结果用¯x表示,结果进行正态性与方差齐性检验,组间差异采用单因素方差分析,组间两两比较用最小显著性差异法-t检验,非正态分布时采用非参数检验,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2 结果与分析
2.1 KKAy小鼠的状态

表3 各组小鼠的体质量Table 3 Body mass of mice in all groupsg
实验期间,正常对照组小鼠一般状态良好,毛色有光泽,饮食进水量正常,对外界反应灵敏,无死亡。模型组小鼠出现多食、多饮、多尿等现象,对外界刺激不灵敏。鱼油灌胃组小鼠的精神状态有所改善。如表3所示,对实验期小鼠的体质量进行监测,与正常对照组相比,模型组和鱼油各剂量组的小鼠体质量明显增加(P<0.01)。与模型组相比,实验期鱼油低、中、高剂量组的小鼠体质量均没有统计学差异(P>0.05)。
2.2 鱼油对KKAy小鼠血糖、胰岛素、胰岛素抵抗指数的影响

表4 各组小鼠的血糖、胰岛素和胰岛素抵抗指数水平Table 4 Blood glucose, insulin and HOMA-IR levels of mice in all groups
如表4所示,与正常对照组相比,模型组和鱼油低、中、高剂量组的血糖值明显升高(P<0.01)。与模型组相比,鱼油低剂量组血糖值极显著降低(P<0.01);鱼油中、高剂量组血糖值下降不明显(P>0.05)。与模型组相比,鱼油低、中剂量组胰岛素水平提高(P<0.05,P<0.01),鱼油高剂量组胰岛素水平升高不明显。与正常对照组相比,模型组和鱼油各剂量组的胰岛素抵抗指数上升(P<0.01),与模型组相比,鱼油低剂量组的胰岛素抵抗指数下降的趋势较明显,但无统计学差异。
2.3 鱼油对KKAy小鼠脂肪细胞因子的影响
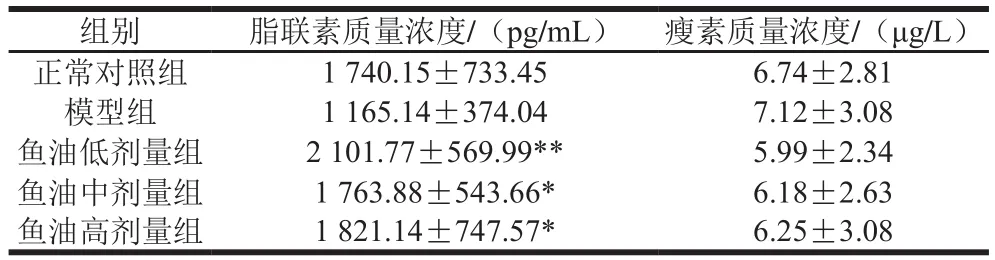
表5 各组小鼠的脂联素和瘦素质量浓度Table 5 Adiponection and leptin levels of mice in all groups
如表5所示,与正常对照组相比,模型组脂联素质量浓度有降低的趋势,但无统计学差异。与模型组相比,鱼油低剂量组的脂联素质量浓度极显著升高(P<0.01),鱼油中、高剂量组的脂联素质量浓度也有升高但差异不显著(P<0.05)。与正常对照组和模型组相比,鱼油低、中、高剂量组的瘦素质量浓度均无显著性差异。与模型组相比,鱼油低、中、高剂量组均可提高小鼠的脂联素质量浓度,其中鱼油低剂量组提高脂联素质量浓度的作用更加明显。
2.4 鱼油对KKAy小鼠骨骼肌组织PI3K/Akt通路中相关基因mRNA表达的影响

表6 各组小鼠骨骼肌相关基因mRNA表达水平Table 6IRS-1, PI3K, Akt,GLUT-4 mRNA expression levels in skeletal muscle of mice in all groups
如表6所示,与正常对照组相比,模型组的IRS-1、PI3K、Akt基因表达显著降低(P<0.05),GLUT-4基因表达有下降的趋势但无显著性差异。与模型组相比:鱼油低、中剂量组IRS-1 mRNA表达水平显著提高(P<0.05);鱼油高剂量组IRS-1 mRNA表达水平极显著提高(P<0.01);鱼油低、中、高剂量组的PI3K mRNA表达水平均极显著提高(P<0.01);鱼油低、中、高剂量组的Akt mRNA表达有上升的趋势,但是差异无统计意义,其中鱼油低剂量组的Akt mRNA表达上升趋势更加明显;鱼油低剂量组GLUT-4 mRNA表达水平极显著提高(P<0.01);鱼油中、高剂量组GLUT-4 mRNA表达水平显著提高(P<0.05)。
3 讨 论
本研究选用KKAy小鼠模型,KKAy小鼠是在KK小鼠的基础上转入突变毛色基因(Ay)而形成的,其Ay基因不仅影响小鼠毛色,而且还可引起代谢紊乱,并出现肥胖、高血糖、脂质代谢紊乱和高胰岛素血症等代谢异常综合征,故其发病是在遗传易感的基础上加上环境因素而诱发的[11-12],因此这种动物模型是广泛应用于研究IR及与IR相关的抗糖尿病药物的较好模型。C57BL/6J小鼠呈黑色,因与KK小鼠具有基因同源性而作为正常对照组[13]。
鱼油富含ω-3 PUFA[14],是EPA和DHA的主要来源。Arai等[15]发现鱼油能降低小鼠的血糖,减少脂肪滴,改善肝肥大和IR。中华医学会糖尿病学分会也指出,要强化包括饮食干预在内的生活方式干预来预防T2DM的发生和发展,并建议T2DM患者适当提高多不饱和脂肪酸的摄入,特别是ω-3 PUFA[6]。本研究发现,与模型组相比,鱼油低剂量组能够显著降低KKAy糖尿病小鼠的血糖值,其胰岛素抵抗指数也有下降的趋势。
IR是T2DM的主要发病机制,表现为糖、脂代谢的紊乱[16-17]。脂肪组织是一个重要的内分泌器官,它所分泌的多种脂肪细胞因子与IR相关,如脂联素、瘦素[18-19]。脂联素被认为是最重要的脂肪细胞因子,具有抗动脉粥样硬化、抗炎症、保护内皮细胞、调节糖脂代谢及改善IR等作用[20-22]。生理条件下瘦素与胰岛素存在着一种双向的反馈环,一旦平衡被破坏,胰岛素对瘦素的敏感性降低,即可导致IR[23]。本研究结果显示,鱼油灌胃组与模型组相比,脂联素质量浓度明显升高(P<0.05),其中鱼油低剂量组脂联素质量浓度极显著提高(P<0.01)。各组之间的瘦素质量浓度无显著差异,可能与瘦素本身对IR的作用机制复杂有关。鱼油低剂量组脂联素质量浓度的显著提高可能和鱼油低剂量组胰岛素抵抗水平降低有关,但本研究未能深入探讨这两者之间的关系,实验结果可能存在偏差,具体机制仍需进一步研究。
骨骼肌是胰岛素作用的主要靶器官,是糖代谢发生的重要场所,更是IR形成的主要部位。目前的研究证实,胰岛素受体活性及其下游信号转导能力的变化是影响胰岛素敏感性最重要的因素,这种变化可发生于所有的胰岛素敏感组织如肌肉、脂肪和肝脏。胰岛素刺激的葡萄糖摄取约有80%发生在骨骼肌组织中,因此骨骼肌在机体葡萄糖的摄取中占有重要地位[24]。胰岛素受体后的信号转导机制相当复杂,目前尚不十分清楚。IRS是胰岛素信号传递的重要介质,是胰岛素信号转导通路中受体后蛋白水平的重要信号,其中IRS-1广泛分布于骨骼肌,在胰岛素信号转导通路中发挥重要作用,促进骨骼肌对葡萄糖的利用[25]。有研究表明,胰岛素的信号到达细胞膜后,通过胰岛素受体基因编码,促使IRS蛋白磷酸化,将信号转导至下游PI3K/Akt信号系统,PI3K诱导的Akt磷酸化能够促进葡萄糖的吸收(通过GLUT-4转导)以及糖原的合成,进而影响血糖的吸收与代谢,升高胰岛素敏感性水平[26-27]。Akt是是PI3K信号转导通路中的重要因子[28],在糖代谢等方面起着调节作用。GLUT-4是葡萄糖转运的关键蛋白,主要在骨骼肌中表达,是在胰岛素作用下葡萄糖通过细胞膜所必需的载体。Hu Shiwei等[29]研究发现从海参中提取的富含EPA的磷脂酰胆碱可以降低大鼠的血糖并显著提高腓肠肌中IRS-1、PI3K、Akt和GLUT-4的基因表达。本研究对KKAy小鼠胰岛素信号通路中的关键靶点(IRS-1、PI3K、Akt、GLUT-4)实施检测,探讨鱼油对骨骼肌胰岛素信号通路的影响。实验结果表明,正常对照组与鱼油各剂量组相比IRS-1、PI3K、Akt、GLUT-4 mRNA表达水平无明显差异。与模型组相比,鱼油各剂量组IRS-1、PI3K、Akt、GLUT-4 mRNA表达水平均升高,其中鱼油低剂量组Akt mRNA表达水平上升趋势明显、GLUT-4 mRNA表达水平显著升高。结合血糖和胰岛素抵抗指数的测定结果,与模型组相比,鱼油低剂量组降低血糖的作用明显、胰岛素抵抗指数下降趋势也较明显。因此,鱼油低剂量组可能是通过调节胰岛素受体信号转导通路PI3K/Akt途径,改善IRS-1、PI3K及Akt的mRNA表达,从而提高GLUT-4 mRNA的表达和跨膜转运,促进了小鼠肌肉组织对葡萄糖的吸收和利用,从而促进肌糖原的合成,调节血糖平衡。
在早期的人群研究中,有研究发现ω-3 PUFA对T2DM患者有升糖作用,也有少部分研究发现ω-3 PUFA对糖代谢没有作用[30-31]。出现这样结果可能是由于早期的实验剂量都比较大,多数集中于4~10 g/d。随着研究者对实验干预剂量的合理化调整,绝大多数干预剂量低于4 g/d,干预剂量的中位数大约在2.4 g/d[32]。Sarbolouki等[33]的研究结果表明,每天服用2 g EPA可降低研究对象的血糖和胰岛素抵抗指数。有关鱼油干预的动物实验发现鱼油0.5 g/kg和1.0 g/kg剂量组可降低T2DM大鼠的血糖[34],其干预剂量和本研究鱼油低剂量组干预剂量接近。Yamazaki等[35]的实验结果也表明低剂量膳食补充鱼油(1 g/(kg·d))能够改善糖脂代谢以及胰岛素敏感性。Andersen等[36]的实验结果显示,补充EPA和DHA(0.5 g/(kg·d))8 周后,Wistar大鼠的胰岛素敏感性提高。本研究和上述实验结果基本一致,发现低剂量鱼油(0.67 g/kg)对于KKAy糖尿病小鼠的血糖调节作用更好,对于IR的改善作用也明显优于鱼油中、高剂量组。本实验设置的鱼油低剂量组和上述动物实验设置的研究剂量更加接近,研究结果也较一致,鱼油中、高剂量组设置的干预剂量可能过高,导致实验结果不太理想。因此,综合以上实验结果,低剂量鱼油对于糖代谢和IR的改善作用更加显著,干预剂量过高对于T2DM的作用效果不明显,甚至可能产生不利的影响,但仍需更多的人群和动物实验进行验证。
综上所述,经鱼油干预后,不同剂量鱼油灌胃的作用效果不同。鱼油低剂量组降低血糖、提高脂联素质量浓度、提高骨骼肌PI3K/Akt胰岛素转导系统中的基因表达效果更加显著。因此,综合考虑所有的实验结果,提示低剂量鱼油能显著改善T2DM小鼠糖代谢,其机制可能与改善胰岛素信号通路转导和调节脂肪细胞因子水平有关,但仍需对通路机制进行更深入的研究。
[1] 胡照娟, 张先慧, 张艳红, 等. 辛开苦降方对初发2型糖尿病KKAy小鼠胰岛素敏感性及糖脂代谢的影响[J]. 世界中医药, 2014, 9(6):774-777. DOI:10.3969/j.issn.1673-7202.2014.06.027.
[2] International Diabetes Federation. IDF diabetes atlas eighth edition 2017[R]. Brussels: IDF, 2017.
[3] PAN X R, YANG W Y, LI G W, et al. Prevalence of diabetes and its risk factors in China, 1994[J]. Diabetes Care, 1997, 20(11): 1664-1669. DOI:10.2337/diacare.20.11.1664.
[4] LIU S, WANG W, ZHANG J, et al. Prevalence of diabetes and impaired fasting glucose in Chinese adults, China national nutrition and health survey, 2002[J]. Preventing Chronic Disease, 2011, 8(1): 1-9.
[5] WANG L M, GAO P, ZHANG M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. JAMA, 2017, 317(24):2515-2523. DOI:10.1001/jama.2017.7596.
[6] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志, 2014, 6(7): 447-498. DOI:10.3760/cma.j.issn.1674-5809.2014.07.004.
[7] 徐瑜, 毕宇芳, 王卫庆, 等. 中国成人糖尿病流行与控制现状:2010年中国慢病监测暨糖尿病专题调查报告解读[J]. 中华内分泌代谢杂志, 2014, 30(3): 184-186. DOI:10.3760/cma.j.issn.1000-6699.2014.03.002.
[8] DYERBERG J, BANG H O, STOFFERSEN E, et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis?[J]. The Lancet,1978, 2: 117-119. DOI:10.1016/S0140-6736(78)91505-2.
[9] 郑钜圣, 袁继红, 李铎. 膳食中n-3多不饱和脂肪酸对2型糖尿病患者血糖和胰岛素敏感性的影响[J]. 食品安全质量检测学报, 2012, 3(5):379-382.
[10] 王笑, 王甄真, 陈雁. PI3K/Akt信号通路在维持血糖平衡中的作用[J]. 生命科学, 2013, 25(2): 133-139. DOI:10.13376/j.cbls/2013.02.001.
[11] MITA T, GOTO H, AZUMA K, et al. Impact of insulin resistance on enhanced monocyte adhesion to endothelial cells and atherosclerogenesis independent of LDL cholesterol level[J].Biochemical and Biophysical Research Communications, 2010,395(4): 477-483. DOI:10.1016/j.bbrc.2010.04.031.
[12] CHEN R, LIANG F X, MORIMOTO S, et al. The effects of a PPAR α agonist on myocardial damage in obese diabetic mice with heart failure[J]. International Heart Journal, 2010, 51(3): 199-206.DOI:10.1536/ihj.51.199.
[13] KHAN A H, CAPILLA E, HOU J C, et al. Entry of newly synthesized GLUT4 into the insulin-responsive storage compartment is dependent upon both the amino terminus and the large cytoplasmic loop[J].Journal of Biological Chemistry, 2004, 279(36): 37505-37511.DOI:10.1074/jbc.M405694200.
[14] POTTEL L, LYCKE M, BOTERBERG T, et al. Omega-3 fatty acids:physiology, biological sources and potential applications in supportive cancer care[J]. Phytochemistry Reviews, 2014, 13(1): 223-244.DOI:10.1007/s11101-013-9309-1.
[15] ARAI T, KIM H, HIRAKO S, et al. Effects of dietary fat energy restriction and fish oil feeding on hepatic metabolic abnormalities and insulin resistance in KK mice with high-fat diet-induced obesity[J]. Journal of Nutritional Biochemistry, 2013, 24(1): 267-273.DOI:10.1016/j.jnutbio.2012.06.002.
[16] HAGBERG C E, MEHLEM A, FALKEVALL A, et al. Targeting VEGF-B as a novel treatment for insulin resistance and type 2 diabetes[J]. Nature, 2012, 490: 426-430. DOI:10.1038/nature11464.
[17] PISTROSCH F, PASSAUER J, FISCHER S, et al. In type 2 diabetes,rosiglitazone therapy for insulin resistance ameliorates endothelial dysfunction independent of glucose control[J]. Diabetes Care, 2004,27(2): 484-490. DOI:10.2337/diacare.27.2.484.
[18] 戴金颖, 张军, 袁洁, 等. 脂肪组织与2型糖尿病胰岛素抵抗的研究进展[J]. 湖南中医杂志, 2017, 33(5): 186-188. DOI:10.16808/j.cnki.issn1003-7705.2017.05.083.
[19] 葛丹, 任建功. 脂肪细胞因子对2型糖尿病胰岛素抵抗的影响[J]. 医学综述, 2013, 19(9): 1635-1638. DOI:10.3969/j.issn.1006-2084.2013.09.035.
[20] CINAR N, GURLEK A. Association between novel adipocytokines adiponectin, vaspin, visfatin, and thyroid: an experimental and clinical update[J]. Endocrine Connections, 2013, 2(4): 30-38. DOI:10.1530/EC-13-0061.
[21] MANGGE H, ALMER G, TRUSCHNIG-WILDERS M, et al.Inflammation, adiponectin, obesity and cardiovascular risk[J].Current Medicinal Chemistry, 2010, 17(36): 4511-4520.DOI:10.2174/092986710794183006.
[22] ANDO R, SUZUKI S, NAGAYA T, et al. Impact of insulin resistance,insulin and adiponectin on kidney stones in the Japanese population[J].International Journal of Urology, 2011, 18(2): 131-138. DOI:10.1111/j.1442-2042.2010.02690.x.
[23] 王晓健. 肥胖与糖尿病的关系及发病机制的研究进展[J]. 中国疗养医学, 2011, 20(8): 723-725. DOI:10.13517/j.cnki.ccm.2011.08.056.
[24] SYLOW L, KLEINERT M, PEHMOLLER C, et al. Akt and Rac1 signaling are jointly required for insulin-stimulated glucose uptake in skeletal muscle and downregulated in insulin resistance[J]. Cellular Signalling, 2014, 26(2): 323-331. DOI:10.1016/j.cellsig.2013.11.007.
[25] GORGISEN G, BALCI M K, CELIK F C, et al. Differential activation and expression of insulin receptor substrate 1 (IRS1) in mononuclear cells of type 2 diabetes patients after insulin stimulation[J]. Cellular and Molecular Biology, 2016, 62(2): 25-30.
[26] TIAN R. Another role for the celebrity: Akt and insulin resistance[J].Circulation Research, 2005, 96(2): 139-140. DOI:10.1161/01.RES.0000156076.17807.1F.
[27] SIDDLE K. Signalling by insulin and IGF receptors: supporting acts and new players[J]. Journal of Molecular Endocrinology, 2011, 47(1):1-10. DOI:10.1530/JME-11-0022.
[28] NIE X Q, CHEN H H, ZHANG J Y, et al. Rutaecarpine ameliorates hyperlipidemia and hyperglycemia in fat-fed, streptozotocin-treated rats via regulating the IRS-1/PI3K/Akt and AMPK/ACC2 signaling pathways[J]. Acta Pharmacologica Sinica, 2016, 37(4): 483-496.DOI:10.1038/aps.2015.16.
[29] HU Shiwei, XU Leilei, SHI Di, et al. Eicosapentaenoic acid-enriched phosphatidylcholine isolated from Cucumaria frondosa exhibits antihyperglycemic eあects via activating phosphoinositide 3-kinase/protein kinase B signal pathway[J]. Journal of Bioscience and Bioengineering,2014, 117(4): 457-463. DOI:10.1016/j.jbiosc.2013.09.005.
[30] MONTORI V M, FARMER A, WOLLAN P C, et al. Fish oil supplementation in type 2 diabetes: a quantitative systematic review[J].Diabetes Care, 2000, 23(9): 1407-1415. DOI:10.2337/diacare.23.9.1407.
[31] MOSTAD I L, BJERVE K S, BJORGAAS M R, et al. Eあects of n-3 fatty acids in subjects with type 2 diabetes: reduction of insulin sensitivity and time-dependent alteration from carbohydrate to fat oxidation[J].American Journal of Clinical Nutrition, 2006, 84(3): 540-550.
[32] 王炎炎. 深海鱼油对老年2型糖尿病患者糖脂代谢影响的双盲随机对照研究[D]. 南京: 东南大学, 2016: 2-3.
[33] SARBOLOUKI S, JAVANBAKHT MH, DERAKHSHANIAN H,et al. Eicosapentaenoic acid improves insulin sensitivity and blood sugar in overweight type 2 diabetes mellitus patients: a double-blind randomised clinical trial[J]. Singapore Medical Journal, 2013, 54(7):387-390. DOI:10.11622/smedj.2013139.
[34] KEAPAI W, APICHAI S, AMORNLERDPISON D, et al. Evaluation of fish oil-rich in MUFAs for anti-diabetic and anti-inflammation potential in experimental type 2 diabetic rats[J]. Korean Journal of Physiology & Pharmacology, 2016, 20(6): 581-593. DOI:10.4196/kjpp.2016.20.6.581.
[35] YAMAZAKI R K, BRITO G A P, COELHO I, et al. Low fish oil intake improves insulin sensitivity, lipid profile and muscle metabolism on insulin resistant MSG-obese rats[J]. Lipids in Health and Disease,2011, 10(1): 66. DOI:10.1186/1476-511X-10-66.
[36] ANDERSEN G, HARNACK K, ERBERSDOBLER H F, et al.Dietary eicosapentaenoic acid and docosahexaenoic acid are more effective than α-linolenic acid in improving insulin sensitivity in rats[J]. Annals of Nutrition and Metabolism, 2008, 52(3): 250-256.DOI:10.1159/000140518.
